 > Техника, страница 12 > Аммония соединения
> Техника, страница 12 > Аммония соединения
Аммония соединения
Аммония соединения, соединения, в которых встречается одновалентный радикал аммоний NH4, отличающийся свойствами, весьма сближающими его с щелочными металлами первой группы периодической системы. Существование NH4 в свободном виде доказано Шульбахом и Бал-лауфом, которым удалось обесцветить синий раствор Na в жидком аммиаке, смешивая его с раствором йодистого аммония в жидком аммиаке при t° —70°; это можно объяснить реакцией NH4J-f-Na=NH4+NaJ, то есть образованием свободного NH4. Присутствие свободного NH4 вероятно также и в амальгаме аммония, получаемой при электролизе аммонийных солей при помощи ртутного катода или при взаимодействии амальгамы натрия с раствором NH4Ci (смотрите возражения против такой точки зрения Moissan, CR, 133, р. 715, 1901). В растворе А. с. обнаруживается присутствие одновалентного положительного иона NH4‘. Окись
1S
аммония (ΝΗ4)20 неизвестна, зато известны перекиси аммония NH40 · ОН (Гпл. 14°) и ΝΗ4·0·0·ΝΗ4 (1°разл. 10°). Хорошо известен раствор гидрата окиси аммония—нашатырный (смотрите Аммиак). А. с. получаются путем непосредственного присоединения воды или кислоты к аммиаку: NH3-|-H20==NH4OH, NH3+HCl=NH4Cl. Строение А. с и теория химическ. сил, их образующих, более подробно выясняются теорией Вернера (смотрите Комплексные соединения). Согласно этой теории, NH3 как нейтральная часть вторгается в комплекс, вытесняя электроотрицательную составную часть комплекса и этим повышая его электроположительный характер; например HC1 + NH3=[H(NH3)]C1 или H2S04+2NH3=[H(NH3)]2S04 (наоборот, можно и азот принимать за центральный атом с координационным числом 4; тогда водородный ион к-ты, поляризуясь отрицательными зарядами азота, образует с NH3 комплексный ион NH4). Присоединение нейтральной части комплекса NH3, по теории Вернера, не изменяет валентности центрального атома: водородный атом, а равно и весь радикал аммоний, остается одновалентным. В радикале H(NH3) после внедрения атома водорода, вероятно, происхо-
дит перегруппировка: jjN g, и т. о. получается группа NH4. Молекула кислоты может присоединять к себе не только одну молекулу ХН3, но при низкой t° и несколько (полиаммиакаты кислот, например H[NH3]4C1, H[NH3]4N03, — соединения весьма нестойкие). Но даже продукты присоединения к к-там одной только молекулы аммиака— т. н. аммонийные соединен и я— являются весьма нестойкими соединениями и диссоциируют при нагревании. Весьма слабые кислоты (борная, кремневая и вода) не могут удерживать при себе NН3 уже при комнатной t°. Более прочными при обыкновенной t° являются аммонийные соли угольной к-ты, сероводорода и других слабых кислот; они легко диссоциируют при нагревании до сравнительно невысокой t° (следует отметить тот факт, что эта диссоциация солей аммония идет особенно легко в присутствии хотя бы следов влаги; как (NH4)2C03, так и первичный продукт его разложения NH4HC03 разлагаются гораздо труднее в совершенно сухом состоянии). Значительно более устойчивыми А. с. являются соли аммония с сильными к-тами: NH4C1, (NH4)2S04, но и они при нагревании диссоциируют с образованием свободного аммиака и к-ты. И здесь приходится отметить тот факт, что в отсутствии влаги совершенно сухая соль, например NH4C1, может возгоняться без разложения, и, наоборот, встреча совершенно сухих NH3 и НС1 не приводит к образованию NH4C1. Это обстоятельство свидетельствует о значении гидролиза в процессах соединения и разложения А. с. При взаимодействии NH3 и С02 в отсутствии Н20 вместо углекислых солей образуются соли карбаминовой кислоты по ур-ию
С
О
О
NH, _ р Н““ U
NH,=0 ОН
По растворимости, кристаллической форме и электропроводности А. с. сильно приближаются к соединениям тяжелых щелочных металлов. Повидимому, радикал NH4 имеет объём, близкий к объёму рубидия. Аналитически А. с. обнаруживаются по реакциям на аммиак (смотрите), выделяющийся при их диссоциации (посинение лакмусовой бумажки, реактив Несслера, и т. д.). Но А. с. можно обнаружить и осадить количественно реактивами на К и тяжелые, щелочи: винной к-той, H2PtCle, Na3Co(N02)6 и т. д. (Об аммиакатах см. Комплексные соединения.)
Получение А. с. в технике. Технически большинство А. с. получаются в качестве побочных продуктов при газификации и коксовании каменного угля и битуминозных сланцев после нейтрализации или «сатурации» газообразными продуктами, выделяющимися при этих процессах кислых поглотителей. (В последнее время А. с. получаются при нейтрализации разных кислот синтетическим аммиаком, полученным по методу Габера—Боша или по цианамидному методу из азота воздуха).
Обычно при указанных процессах получается жидкость, имеющая цвет от желтого до темиокоричневого и представляющая собою раствор многих А. с. и аммиака различной крепости. Все эти соединения можно распределить на две группы: л е-тучие и нелетучие с парами воды. К первым принадлежат свободный, или, вернее, водный аммиак NH4OH, углекислый аммоний, сернистый аммоний, гидросернистый аммоний и цианистый аммоний; ко вторым — сернокислый аммоний, сернистокислый аммоний, хлористый аммоний, тиосульфат аммония, тиокарбонат аммония, сульфоциаиид аммония и ферроцианид аммония.
После вытеснения аммиака из газовой воды кипячением и после разложения известковым молоком содержащихся в ней аммиачных солей весь аммиак освобождается и пропускается для поглощения в раствор серной к-ты. При этом известь прибавляют уже после того, как растворенный аммиак и летучие с паром соединения вытеснены из газовой воды и когда в ней остались лишь нелетучие соли аммония. Образование (NH4)2S04 при этом протекает в водном растворе, после чего для получения твердой соли необходимо выпаривание этого раствора, связанное с расходом тощгива. Нек-рые методы дают возможность получения твердого (NH4)2S04, причем отделение воды от твердой соли протекает за счет самой теплоты нейтрализации аммиака серной к-той. При производстве в большом масштабе А. с. встретились неожиданные трудности, с к-рыми не приходится иметь дела в незначительных по размерам установках. Улавливание аммиака из коксовальных печей с небольшой продукцией аммиачных солей шло почти нацело и без особых затруднений. Когда яге пришлось конструировать установки для сатурации кислоты синтетическим аммиаком с производством 100—120 тонн в сутки, то оказалось, что свинец, из которого были построены колокола сатураторов, разъедался избыточ. аммиаком, не успевавшим равномерно распределяться по всему раствору. Пришлось устанавливать сильные механические пе-ремешиватели. Кроме того, благодаря высокой t° раствора, металл, из которого изготовляются насосы (фосфористая брон-
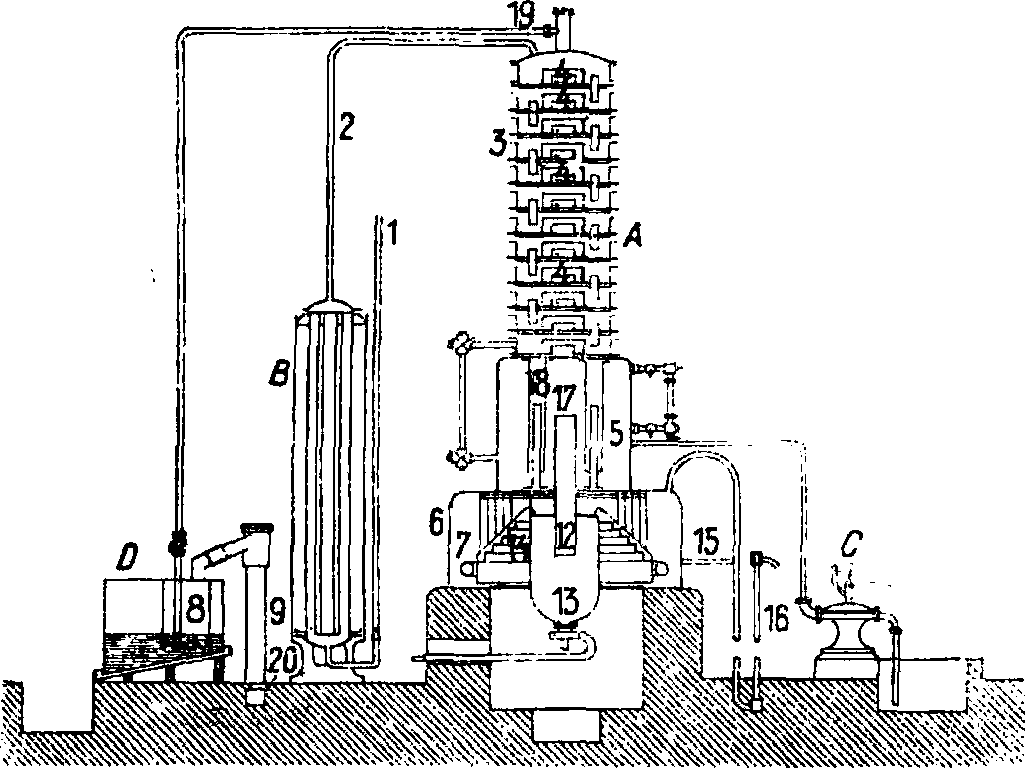
Фигура 1. Установка Грюнберга и Блюма. за), также подвергался изменению; пришлось позаботиться о регулировании t°.
В качестве примера современной установки производства сернокислого аммония приведем установку Грюнберга и Блюма для отгонки из газовой воды NH3 и для получения (NH4)2S04, изображенную на фигуре 1 (Partington and Parker, The Nitrogen Industry).
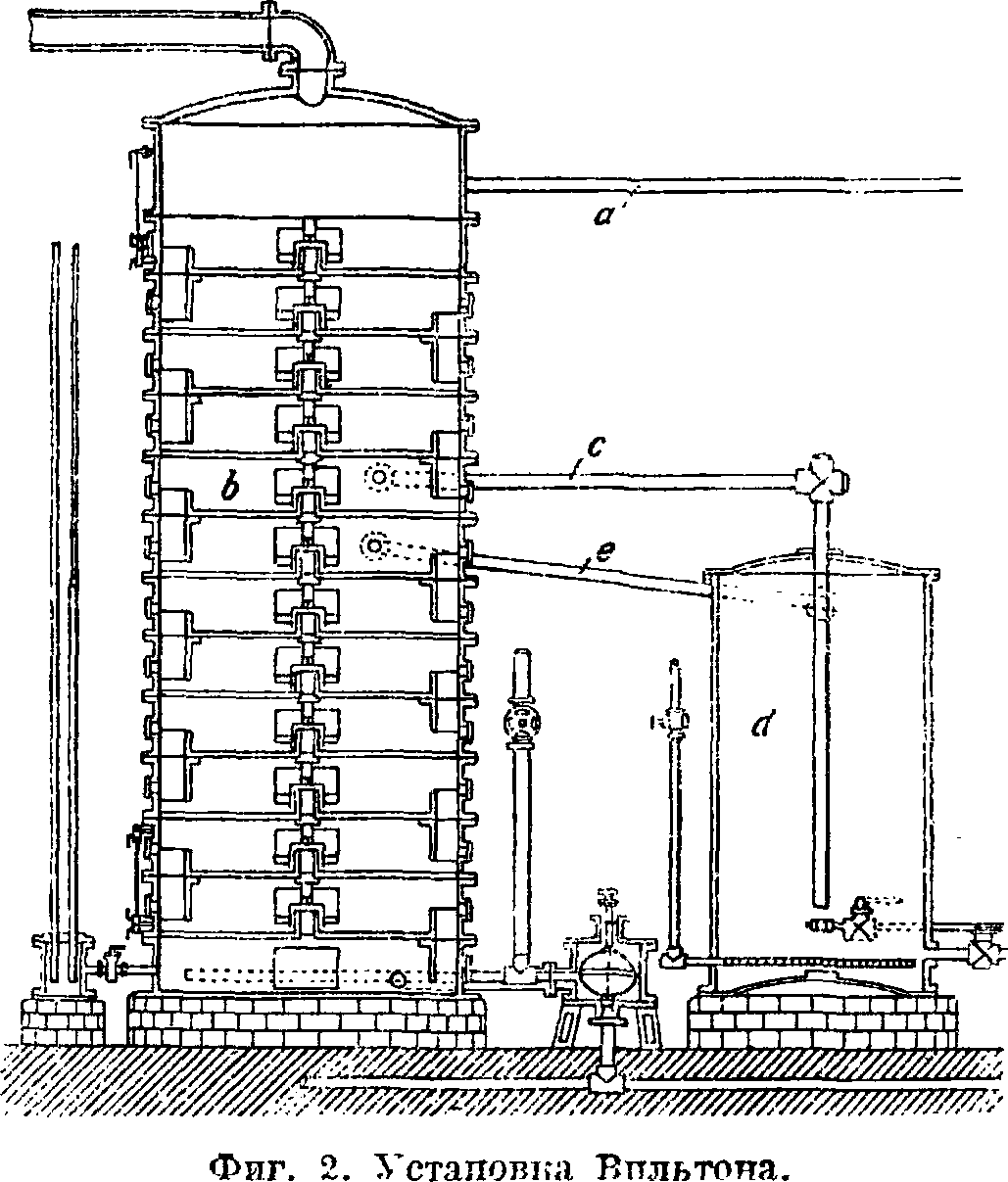
В — экономайзер, в к-ром газовая вода нагревается горячими отработанными газами или нарами из котла. В колонне А газовая жидкость нагревается паром, в результате чего летучие А. с. диссоциируют и отгоняются. Кроме того, здесь же при действии извести разлагаются с выделением NH„ ташке и стойкие А. с., растворенные в газовой воде. Весь NH3 поступает затем в сатуратор В, в к-ром нейтрализуется серной к-той и образует (NH4)2S04. Для нагревания газовой воды отходящими из сатуратора нагретыми теплотой нейтрализации газами применяется особый перегреватель. Аммиачная вода поступает в его нижнюю камеру, затем идет по трубам в среднюю камеру, далее она проходит через систему труб в верхнюю камеру, откуда вытекает при t° 93°. Отходящие газы от сатуратора сначала проходят через особый сепаратор, в к-ром, ударяясь о перфорированные свинцовые диски, газы освобождаются от брызг кислой жидкости, механически увлеченных из сатуратора. После этого рни направляются в перегреватель. В нем они поступают сначала в одну камеру, затем через боковую трубу в другую камеру, из которой, наконец, они выходят в конденсационный аппарат. В колонном аппарате, состоящем из сообщающихся при помощи коротких переливных труб этажей, жидкость переходит последовательно через все эти этажи снизу вверх, причем все летучие А. с. разлагаются и отгоняются от нее, а именно: NH„ С02, H2S и HCN. После этого жидкость стекает наконец во второй отдел (фпг. 1, 5), в к-рый через ка ждые 10 мин. накачивается известковое молоко. Здесь также имеется паровой котел с внутренним паровым соплом 14, благодаря к-рому жидкость в небольших слоях доводится до кипения при помощи пара. При этом окончательно разлагаются все А. с., и продукты их разложения вместе с парами воды через трубу 19 из колонного аппарата поступают в сатуратор (фигура 1, В), наполненный серной к-той. Отходящие от сатуратора газы служат для нагревания аммиачной жидкости в экономайзере. Существенным недостатком описанного колонного аппарата является частое засаривание низших камер продуктами взаимодействия извести с H2S, СОг и т. д., требующее разборки аппарата для его очистки. Значительным усовершенствованием поэтому является англ, установка Вильтона (фигура 2). В этой установке аммиачная жидкость поступает через трубу а в колонный аппарат, спускается в нем лишь до камеры Ь, откуда, уже лишенная А. с., стекает через с в изве-стковальную камеру d, после чего через трубу е вновь попадает в колонный аппарат и движется обычным порядком вниз до выпускного крана. Сатуратор (фигура 1, В) построен из листового железа и внутри облицован свинцом. Первоначально NHS попадает через тРУбу 19 в свинцовый колокол 8, из которого газ распределяется в сатураторе на большое расстояние. Непоглощенная часть газов поступает через трубу 9 в конденсатор 20, где конденсируется и задерживается увлеченная газами жидкость. В сатураторе все время возобновляется 77%-ная H2S04. Образующиеся кристаллы (NH4)2S04 от вре
мени до времешi извлекаются. Отходящая через 16 жидкость не должна содержать более 5 частей NH3 на 100 000. В зависимости от способа выборки (NH4)2S04 из сатураторов, последние молено разделить на: а) сатураторы с ручным выгребанием готовой соли (XH4)2S04: б) сатураторы с выбрасыванием (NH4)2S04 помощью пара; в этом случае, вместо выстланного свинцом чана для ручного выгребания соли, под сатуратором имеется колодец, куда поступает (NH^SO* для дальнейшего выбрасывания паром; так. обр. разгрузка происходит автоматически, и весь процесс сатурации изолирован от внешнего воздуха. Такой закрытый тип сатуратора с паровым эжектором весьма совершенен с точки зрения экономии труда; кроме того, при такой конструкции зловонные отходящие газы совсем не проникают в помещение. Извлеченные из сатуратора кристаллы (NH4)2S04 раскладываются на 4—5 дней для стекания с них маточного раствора, и для сушки на покрытых свинцом дренажных столах. Маточный раствор стекает по желобам в особые чаны, откуда перекачивается обратно в сатуратор. Сушка кристаллов м. б. значительно ускорена центрифугированием, к-рое в несколько минут дает продукт уже почти годный для упаковки. Готовый продукт обычно имеет сероватый цвет и содержит от 24,25 до 24,75% NHS, от 2 до 4% влаги, от 0,15 до 0,40% свободной H2S04. При большем обезвоживании можно получить белый продукт с содержанием до 25,25% NH3, HQ он уже обойдется несколько дороже.
В Германии во время войны, в виду связанного с последней недостатка серного колчедана, значительно развилось применение гипса для производства (NH4)2S04. 200 килограмм мелко перемолотого гипса (77% CaS04) смешивают с 201 л газовой воды (19,2% NH3) и с 200 л воды в автоклаве и пропускают при избыточном давлении до 2 atm углекислый газ при t° 50°. Через пять часов выпускают образовавшийся H2S, фильтруют и выкристаллизовывают (NH4)2S04. Реакция, которая протекает по ур-ию (NH4)2C03+ + CaS04-2H20=СаС03 + (NH4)2S04 + 2H20, ускоряется, если прибавить некоторое количество СаС12 (Margueritte). При производстве (NH4)2S04 из газовой воды и гипса целесообразно используются также и дымовые газы. При взаимодействии NH3 и дымовых газов с суспензированным гипсом последний переходит в раствор, к-рый остается только отфильтровать от СаС03и выпарить, чтобы получить кристаллы (NH4)2S04. Этим путем используются дымовые газы и устраняется их вред для сел. хозяйства окружающей местности. Предложено также использовать весь H2S газов, переводя его в SOs и Н20 путем пропускания через трубы с прокаленной железной рудой или путем пропускания над FeS04. Реакция идет по уравнениям:
FeS04+2NH3-|-H2S=FeS+(NH4)2S04,
2FeS+3SO,=2FeSaO,+S,
FeS-(-3S02=FeS40e.
При пропускании S02 над полученными серноватистокислой и тетратионовой солями все сернистые соединения переходят в (NH4)2S04:
2(NH4)2S2Os + 3S02=(NH4)2S30e+ (NH4)2S406, (NH4)2S306+(NH4)2S40e-2(NH4)2S04+ -f-2S02+3S.
По другому методу аммиак заставляют взаимодействовать с S02, и образующийся бисульфит аммония превращается в сернокислый аммоний. Последняя реакция связана с возможностью ов. Путем прибавления в качестве катализатора серы или селена эту реакцию можно проводить спокойно. Продукт, применяемый для сел.-хоз. целей, получается при взаимодействии NH3 с суперфосфатом, связывающим аммоний с образованием аммонийно-кальциевой соли фосфорной кислоты. BASF запатентовала метод использования MgS04для получения (NH4)2S04. Смесь измельченного кокса с гидратом MgS04 постепенно обезвоживается, после чего нагревается до 600—700°. При этом выделяется S02, идущий в дальнейшую переработку. Полученный (NH4)2S04 м. б. далее переработан с выходом 80—90% в бисульфат аммония, путем нагревания его во вращающейся трубчатой печи, через которую пропускают отходящие газы от пламени светильного или генераторного газа. Кислый сернокислый аммоний, в свою очередь, м. б. далее применен для переработки фосфоритов с образованием растворимого комбинированного азотно-фосфорного удобрительного тука. В С.-А. С. Ш. фирма «Аммофос» вырабатывает большое количество комбинированного азотно-фосфорного удобрения действием H2S04 на фосфориты и последующим насыщением раствора аммиаком.
Вырабатывая из гипса сернокислые соли и даже серную кислоту, Германия эмансипировала себя во время войны от импорта колчедана для серной к-ты, столь необходимой для выработки суперфосфатов и для многих других целей. Однако производство (NH4)2S04 "из гипса связано с необходимостью отфильтровывания растворов сульфата от илистого осадка СаС03. Это отфильтро-вывание создает значительные затруднения вследствие засорения аппаратуры и больших потерь (NH4)2S04, остающегося в жидкости ила. Для отфильтровывания раствора (NH4)2S04 пришлось воспользоваться отсасывающими фильтрами, погружаемыми в суспензию СаС03 в растворе (NH4)2S04, наподобие тех, которые применяются для извлечения растворов золота. При этом CaCOsобволакивает фильтры тонким и вполне проницаемым слоем, не препятствующим дальнейшему отсасывательному фильтрованию. Гипс предварительно должен быть подвергнут обжигу во вращающейся барабанной печи. Такой обжиг вдвое и даже больше уменьшает в дальнейшем продолжительность фильтрования. Англ, заводы стремятся получить абсолютно нейтральный (NH4)2S04, ибо содержание кислоты оказывает значительное влияние на разложение соли при ее хранении. Соль приходится высушивать горячим воздухом, ибо при содержании менее 0,25% влаги она в течение долгого времени сохраняет консистенцию, удобную для рассеивания в качестве удобрения. Небольшие примеси сернокислого пиридина также вызывают спекание, комковатость и гигроскопичность соли. Интересный метод получения сульфата аммония состоит в окислении сульфита аммония. Этот метод, с одной стороны, дает возможность утилизировать S02 дымовых газов,
а с другой стороны — в качестве побочного продукта дает азот, к-рый можно применить для синтетического аммиака.
Аммонийная селитра NH4N03представляет собой весьма ценный удобрительный тук, в к-ром нитратный азот усваивается немедленно, а аммонийный — постепенно. Существенным недостатком является то, что она легко расплывается на воздухе и потому неудобна для хранения. Поэтому ее выпускают на рынок в смеси с костяной мукой, гипсом и известковой селитрой. уменьшающими ее гигроскопичность. Уменьшения гигроскопичности аммонийной селитры можно добиться также прибавлением к маточному раствору селитры белков, желатина, декстрина и г. д. Смешанные калиево-аммонийная селитра и аммонийно-сульфатная селитра не отличаются такой гигроскопичностью. Поэтому аммонийную селитру смешивают также (в Оппау) с хлористым калием и сернокислым аммонием. Образующуюся от смешения пасту высушивают во вращающихся сушильных печах. Технич. аммонийно-сульфатная селитра содержит (NH4)2S04 несколько больше того количества, к-рое соответствовало бы формуле 2NH4N03-(NH4)2S04. В калиево-аммонийной селитре на 60 ч. (NH4)2S04 приходится 40 ч. хлорида. При содержании в аммонийно-сульфатной селитре менее 60% NH4N03 смесь уже не является чатой. Однако в 1921 году на ф-ке в Оппау произошел громадный около 4 500 тонн аммонийно-сульфатной селитры, сопровождавшийся гибелью 600 чел. и разрушением имущества на много км в окружности. Причина а осталась невыясненной.—Чистая аммонийная селитра идет на изготовление чатых веществ. Английские снаряды (T.N.T.) выполнены смесью из 80% NH4N03 и 20% тринитроа. Получение чистого NH4N03связано с нейтрализацией HNOs (разбавленной) водным аммиаком, к-рый во избежание ов должен быть хорошо очищен от пиридиновых оснований и серы. Процесс весьма прост, но наталкивается па затруднение, заключающееся в том, что выпариваемый для кристаллизации раствор NH4N03 действует разрушительным образом на большинство металлов и делает, например, железо резервуаров и выпаривательных котлов весьма хрупким. Поэтому приходится действовать газообразным аммиаком на концентрированную HNOs. При этом выделяется при реакции нейтрализации так много тепла, что его достаточно для удаления всей воды из раствора и для плавления образовавшейся твердой аммонийной селитры. Существуют еще методы получения чистого ΝΗ4Ν03 из кальциевой селитры и углекислого аммония по уравнению
Ca(N 03)2+(N Н4)аС03=СаС08+2N H4N03.
Аммоний хлористый, нашатырь, NH4CI. Уд. в 1,522; кристаллизуется в октаэдрах или кубах; без запаха, остросоленого вкуса; теплота растворения 3,88 cal. При внесении 3 ч. NH4C1 в 10 ч. воды (13°,3) смесь охлаждается до —5°,1. Растворимость HN4C1 дана в следующей табл., показывающей %-ное содержание NH4C1.
Процентное содержание насыщенных водных растворов.
| NH.C1 в % | Г | NH4C1 в % | t° | NH4C1 в % | |
| -1,6 | 19,4 | 40 | 31,4 | 80 | 39,6 |
| 0 | 23,0 | 50 | 33,5 | 90 | 41,6 |
| 20 | 27,1 | 60 | 35,6 | 100 | 43,6 |
| 30 | 29,3 | 70 | 37,6 | 110 | 45,6 |
При кипячении растворы NH4C1 выделяют NH3 и становятся кислыми. Они действуют разрушающим образом на железные и свинцовые сосуды.
NH4C1 имеет применение в качестве удобрения, для пайки металлов, полуды и оцинкования меди, для гальванических элементов, при производстве красок, при крашении, ситцепечатании и т. д.
NH4C1 получается при насыщении НС1 газовой концентрированной водой. Полученный раствор соли выпаривают при помощи парового змеевика при t° 100° до насыщения. После охлаждения в течение 4—5 дней на деревянных шестах выкристаллизовывается NH4C1. После центрифугирования и сушки соль готова для упаковки. В других "случаях NH4C1 получается при непосредственном насыщении НС1 аммиаком, отогнанным из газовой воды. NH4C1 получается также при нагревании цианамида кальция с раствором NaCl или КС1 до 100°, при одновременном действии постоянного электрич. тока через реакционную смесь. Образующийся при этом NH4C1 возгоняется. NH4C1 получается также в качестве побочного продукта при несколько измененном сольвеевском содовом процессе, если вводимый N Н8 не используется для кругового процесса, а выделяется в виде нашатыря.
Интересный метод получения NH4C1 (Salzwerke Heilbronn, A. G.) заключается в действии NH, в присутствии паров воды на нагретые до 150° или на сплавленные хлориды (в качестве катализаторов в этом процессе служат: Со, мелко раздробленное железо, окислы железа, глинозем и т. д.). BASF запатентовала метод получения NH4C1 путем насыщения аммиаком при помешивании смеси из 843 ч. H2S04(36,2%-пой) и 368 ч. NaCl. В настоящее время имеет большое применение метод, являющийся модификацией сольвеевского процесса, а именно:
NaCl+NH3+C02+H20=NH4Cl+NaHC03.
Аммоний углекислый, карбонат аммония (NH4)2C03, получается при постепенном нагревании 1 ч. (NH4)2S04 с 2 ч. свежеосажденного мела с прибавкой угольного порошка (х/8 по общему весу) в чугунных ретортах. Отгоняющиеся при этом пары конденсируются в свинцовых камерах в виде (NH4)2C03, к-рый еще сублимируется из железных котлов со свинцовым шлемом.—К ислый углекислый аммоний (бикарбонат аммония) NH4HC03 получается при взаимодействии С02 и NH3 в определенном соотношении и в присутствии паров воды. Из раствора трудно растворимый бикарбонат осаждается углекислым газом. Другой метод состоит в пропускании смеси С02, NHa и паров Н20
через трубу, нагреваемую снаружи до 200°, после чего пары сгущаются в камере, охлаждаемой до 60°. Готовый, еще влажный продукт обрабатывают под давлением углекислым газом. Обычно продажный карбонат аммония представляет собою смесь карбоната с карбаминовокислым аммонием: 2NH4HC03-C0(NH2).(0NH4) (с 28,81 %NH3) hNH4HC03·CO(NН2) ·(ONHJ (с 32,48%NH3). Углекислые аммонийные соли легко разлагаются при нагревании, а при кипячении водного раствора разлагаются нацело. Применяется углекислый аммоний в качестве твердых дрожжей (пекарного порошка), при производстве красок, при отмывке шерсти, для очистки жиров, в горном деле. Бикарбонат аммония, в виду меньшего содержания NH3 и низкой t° полного разложения (60°), имеет широкое применение в качестве пекарного порошка.
Аммоний молибденовокис-л ы и имеет состав (ΝΗ4)βΜο7024.4Η20. Получается при действии ΝΗ3 на молибденовую к-ту и выпаривании раствора при низкой t°. При нагревании выделяет NH3и Н20 и переходит в (NH4)2Mo04. Применяется в качестве чрезвычайно распространенного реактива на фосфорную к-ту при анализах железа, почв и фосфоритов, а также для расцветки керамических изделий и металлов.
Аммоний сернистый, сульфид аммония (NH4)2S, получается при насыщении растворов NH4OH сероводородом на холоду; на воздухе выделяет NH3 и переходит в гидросульфид, или в сульфогидрат, аммония NH4HS. В водных растворах сернистый аммоний, окисляясь на воздухе, переходит в полисульфиды, окрашенные в желтый цвет; одновременно выделяется сера и образуется тиосульфат, аммония. NH4HS получается перегонкой NH4C03 с K2S или нагреванием при помощи пара сернокислого аммония с остатками содового процесса или с насыщенной отходящими газами (при получении сернокислого аммония) известью. Пентасульфид аммония (NH4)2S5 получается в виде оранжево-красных игол при обработке ом насыщенного серой раствора сернистого аммония. Сульфиды аммония применяются для денитрации нитроцеллулозного искусственного шелка, для аналитических работ, для растворения свинцовых руд, для получения на электрич. проводах налета, устойчивого против щелочей.
Аммоний роданистый, NH4CNS, получается из отбросов газового производства при очистке светильного газа, к-рый содержит роданистоводородную кислоту. Свойства и методы получения щавелевокислого, фосфорнокислого, сернистокислого, виннокислого, серноватистокислого аммония приведены в Blticher’s Auskunftbuch 1. d. ehem. Industrie, В., 1926.
Лит.: см. Азот, Аммиак, Азотная кислота, Азотные удобрения. Б. Б.