 > Техника, страница 31 > Вода
> Техника, страница 31 > Вода
Вода
Вода, простейшее химическое соединение водорода с кислородом; химическая формула Н20; молекулярный вес 18,016; при обыкновенной температуре—жидкость без запаха и цвета, но в толстых слоях имеет голубой цвет. Чистая дистиллированная вода имеет, благодаря осмотическим процессам в клетках слизистой оболочки, неприятный вкус и вредна для здоровья; вода, содержащая ие-значит. количество солей, не только не вредна, но необходима для питания организма.
I. Физич. и химии, свойства воды.
Физические свойства воды сопоставлены в таблице 2. Увеличение объёма жидкой воды при повышении температуры выражается следующими (смотрите табл. 1) цифрами (объём при 0° принимается за 10 000):
Таблица 1,—У в е л и ч е н и е объёма воды в зависимости от £°.
| t° | 10° | 20° | 30° | 40° | 50° |
| Увеличение объёма | 1,2 | 16,0 | 41,5 | 75,8 | 117,0 |
| ί° | 60° | 70° | 80° | 90° | 100° |
| Увеличение объёма | 163,0 | 225,5 | 291,0 | 385,5 | 427,0 |
Т. Э. m. III.
26
| г | Плотность жидкой воды | Вязкость жидкой воды | Поверхностное натяжение по сравн. с влажным воздухом (дин на см“) | Упругость насыщенных паров в миллиметров над | Концентрация водяных паров в воздухе, насыщенном парами воды ПрИ 760 ММ (в г на 1 килограмм воздуха) | Удельная теплота жидк. воды (для 15°=* 1,0000) | |
| льдом | водой | ||||||
| - 10° | 0,99815 | 1,947 | 2,144 | 1,76 | |||
| - 5° | 0,99980 | — | — | 3,009 | 3,158 | 2,59 | 1,0155 |
| + 0° | 0,999868 | 0,0178 | 75,49 | 4,579 | 4,579 | 3,75 | 1,0091 |
| + 4° | 1,000000 | 0.0156 | 74,90 | — | 6,101 | 4,98 | (5°) 1,0050 |
| + 10° | 0,999727 | 0,0131 | 74,01 | — | 9,210 | 7,51 | 1,0020 |
| + 20° | 0,998230 | 0,0101 | 72,53 | — | 17,539 | 14,33 | 0,9987 |
| + 40° | 0,99224 | 0,0065 | 69,54 | — | 55,340 | (30°) 26,18 | 0,9971 |
| + 70° | 0,97781 | — | — | — | 233,790 | — | — |
| + 100° | 0,95838 | 760,000 | ~ | ||||
Жидкая вода: сжимаемость 491Л0“7 при 20°; абсолютная теплопроводность 0,00154 при 10° идо 18°; показатель преломления для На 1,3311; Να 1,3330; Щ 1,3371 при 20°; скорость звука в В. при 13,7° равна 1 437 м/ск. Лед: плотность при 0° 0,9176. Водяной пар: плотность при 0° и 760 миллиметров 0,0008045; уд. объём при 0° и 760 миллиметров 1 243 сж3. Изменение точки замерзания воды от давления равно —0,0073° на 1 Atm; ί°ηΛ. 0°; t°Kun- при 423 миллиметров 84,4°, при 680 миллиметров 96,1°, при
1 Atm 100°, при 2 Atm 120,5°, при 3 Atm 134°, при 10 Atm 180°; t°KpUm. 374°; давление критическое 217,5 Atm; тройная точка t== + 0,0073°, р=ок. 4,6 миллиметров; скрытая теплота плавления равна 79,7 cal; скрытая теплота испарения равна 538,9 cal; теплота образования жидкой воды на 1 моль при 18° из
2 Н +О равна 68 200 cal; теплота образования из H+ ОНравна 14 900 cal; молекулярное понижение плавления 1,85; молекулярное повышение кипения 0,52. При увеличении давления t° замерзания В. претерпевает весьма интересные изменения: так, при давлении 8,1 Atm точка перехода вода—лед лежит при —0,06°; при давлении
16,8 Atm она равна —0,13о; при давлении в одну Atm (то есть в 1,03 килограмма/см2) точка перехода В. в лед равна 0°; при давлении 615 килограмм/см2 она равна —5°; при давлении 1 625 килограмм/см2 она равна —15°; при давлении 2200 килограмм/см2 она равна —22°; при дальнейшем увеличении давления точка перехода неожиданно повышается, и при давлении в 3 530 килограмм/см2 она равна —17°, при давлении в 6 380 килограмм/см2 она равна +0,16°; при давлении 20 670кг/сж2 лед может существовать при t° ок. +76° ί1·*].
В твердом виде В. (лед) может образовывать целый ряд (не менее шести) модификаций. При обыкновенном давлении единственной устойчивой модификацией является обыкновенный лед. При изменении давления в границах до 20 000 Atm Таман превратил обыкновенный лед (гексагональной системы) в другие модификации. Бриджмен описывает следующие модификации льда:
I на 10—13,6% легче воды
| II | » | 22% | плотнее | воды | |
| III | » | 3% | < ">> | » | |
| IV | » | 4% | плотнее | , чем | V |
| V | » | ву.% | » | » | III |
| VI | » | 4% | » | » | V |
Модификация I (обыкновенный лед) имеет больший объём по сравнению с жидкой В.
при той же t°, и сжимаемость этой модификации весьма невелика. Поэтому при замерзании в замкнутом пространстве В. развивает значительные давления, разрывая, например, чугунные гильзы с толщиной стенок более 1 см. Это свойство воды имеет большое значение в геологии, процессах (коррозионные процессы). При своем плавлении В. (лед) выделяет значит, скрытую теплоту (79,7 cal), высокое значение которой объясняется одновременной частичной деполимеризацией воды. Из рентгенограммы (по Лауе) можно заключить, что в льде молекула Н20—бимолекулярная при плавлении льда часть молекул деполимеризуется, и при этом процессе выделяется теплота. Твердость льда при 0° по шкале Моса равна 1,5. В спокойном состоянии В. может находиться в переохлажденном неустойчивом состоянии, но при сотрясении или внесении кристалликов льда В. быстро замерзает. Как и многие другие жидкости, вода обнаруживает явления ассоциации (смотрите). При каждой t° существует подвижное равновесие, выражаемое ур-ием: (Н,0)х + хН,0.
В органич. растворителях фактор ассоциации В. в точности равен 2. В газообразном состоянии для мол. в воды при 4 Atm было найдено значение 19,06 вместо 18,01; это свидетельствует о том, что и в газообразном состоянии В. несколько ассоциирована. В. обнаруживает аномалию в отношении зависимости своей плотности от темп-ры. За единицу для сравнения плотности других тел с водой принимается ее максимальная плотность, которую она имеет при 4°; при 0° плотность воды=0,9170. При соединении 2Н2 с О г с образованием 2Н20 достигается темп-pa около 3100°. Однако она должна была бы быть значительно выше, если бы газы соединялись полностью. На самом же деле при указанной темп-ре реакция идет лишь на 73, образуя подвижное равновесие: 2 Η,Ο ίί 2 н, + о.
Уже при более низких t° наблюдается диссоциация В., а именно:
Температура. 1 397° 1 661° 2 267°
% диссоциации.. 0,0073 0,036 1,77
Поэтому при погружении раскаленного металла в воду образуется гремучий газ.
В. кристаллизуется в гексагональной системе, обнаруживая 6 полиморфн. разностей.
Чрезвычайно важным характерным свойством В., определяющим ее громадное значение в химизме всех процессов на поверхности земного шара, в том числе и процессов, протекающих в организмах животных и растений, является ее значительная способность ионизировать растворенные в ней соединения; эта способность связана с исключительно высокой диэлектрической постоянной воды (около 80 по сравнению с диэлектрической постоянной пустоты). Только весьма немногие химические соединения по величине своей диэлектрической постоянной приближаются к воде.
В природе В. никогда и нигде не встречается в совершенно чистом состоянии; даже после перегонки из платинового сосуда при помощи платинового холодильника она все же содержит в себе в растворенном состоянии вещества, влияющие на ее физич. свойства, например углекислоту и другие газы. Кольраушу и Гейдвейлеру удалось получить на весьма короткое время почти абсолютно чистую воду и измерить ее электропроводность; оказалось, что при 18° электропроводность воды равна 0,040 х10_6; исследуя 1°-ный коэфф. электропроводности В., Коль-рауш определил, что чистая В. должна иметь при 18° электропроводность *=0,038х 10~6, при 25° электропроводность * воды равна 0,054 х10-6. Зная скорость движения водородных ионов, можно вывести, что при 25° в одной т чистой воды содержится всего только 1,8 мг ионизированной В. Следовательно в чистой В. концентрация водородных ионов равна одной десятимиллионной (1×10-7) части Vi N концентрации.
Очистка В. производится фильтрованием (от нерастворимых примесей), п е-регонкой и вымораживанием. Перегонку предпринимают для особенно тщательной очистки при помощи оловянных, серебряных или даже платиновых холодильников, т. к. при высокой t° В. выщелачивает нек-рые соли из стекла. Для окисления орга-нич. примесей и для связывания С02 к В. при тщательной дистилляции прибавляют КМпО, и NaOH. После этого воду подвергают кипячению в вакууме и пропускают через нее инертный газ (водород) для удаления растворенной углекислоты и кислорода.
В природе вода находится в громадном количестве в гидросфере, покрывающей */s земного шара, а также в парообразном состоянии и в виде мельчайших капель в атмосфере земли. Значительные количества В. содержатся и под поверхностью земли (в литосфере) в виде почвенных вод, а также образуют т. н. конституционную В., входящую в состав многих химич. соединений. Часто одна или несколько молекул воды образуют комплексные соединения— гидраты с другими соединениями или с молекулами элементов. Такие гидраты В. образует не только с твердыми, но и с жидкими и газообразными телами; в водных растворах многих химич. соединений образуются их моно- или полигидраты. Все виды природной В. содержат растворенные примеси: дождевая В.—окислы азота, углекислоту и аммиак; грунтовая, речная и морская В.— целый ряд растворенных солей, содержание которых в морской В. доходит до 372% (в Красном море даже до 4 %), а в нек-рых соленых озерах и до значительно большего процентного содержания (вода Мертвого моря с уд. в 1,2 содержит около 22% солей). Образуя комплексные соединения с молекулами др. химич. соединений, В. присутствует в них в строго определенном количестве в виде так называемым кристаллизационной В. В некоторых же случаях (цеолиты и тому подобное.) В. связывается с другими химическ. соединениями в неопределенном количестве (смотрите Цеолиты).
II. Исследование воды.
Для оценки пригодности питьевой воды необходимо произвести полный анализ правильно отобранных ее проб в разное время года. Отбор пробы должен производиться с соблюдением условий: а) исключающих случайность в составе воды, б) гарантирующих соответствие пробы общей массе воды данного источника и в) гарантирующих неизменность воды в зависимости от маниций отбора пробы. Для этого проба воды отбирается: из водопроводного крана или колодезного насоса—через 10 метров после предварительного спуска; из колодцев или родников—два раза в день, утром до начала. расхода и вечером по прекращении расхода воды; из открытых естественных водоемов—при помощи батометра (смотрите). В теплое время пробы воды консервируются: проба для определения окисляемости, азота и аммиака—прибавлением 2 см3 25 %-ной H2S04, проба для определения плотного остатка взвешенных веществ, HN03 и HN02— прибавлением 2 см3 хлороформа на 1 л воды. Интервал между взятием пробы и производством анализа допускается: для незагрязненных вод—72 часа, для довольно чистых вод—48 ч., для загрязненных—12 ч. Определение растворенных в воде газов: 02, H2S и С02 должно производиться на месте.
Исследование В. на месте производится по стандартным методам исследования питьевых вод, выработанным Бюро водопроводных и санитарно-технич. съездов при НТУ ВСНХ СССР, по следующему плану и методам, описываемым ниже согласно опубликованным инструкциям [·]: 1) Температура источника определяется термометром с делениями в 1/5° в течение 15 метров (перевертывающимся термометром Негретти-Замбо—ок. 3—5 м.). 2) Прозрачность определяется диском Секки, окрашенным в белый цвет (глубина в сантиметров при исчеза-нии видимости). 3) Цвет определяется путем сравнения цвета диска Секки в воде с цветом сравнительных растворов по шкалам Фореля и Уле. Первая состоит из запаянных пробирок, в которые налиты растворы: I.—CuSOj.5 Н20—1 з, NH3 (25%)—5 см3, И20—до 200 см3 и II.—К2СЮ4—1 г, Н20— до 200 см3. Шкала Уле готовится смешением последнего номера шкалы Фореля с раствором CoS04.7H20 (1 : 200) с добавлением NH3до растворения осадка (смотрите табл. 3 на столбце 807). 4) Запах испытывается при подогревании до 45°. 5) Вкус испытывается при 15—20°. 6) Цвет (в бутыли), опалесценция, муть и случайные включения определяются по внешнему виду.
Таблица З.-Шкалы Ф о р е л я и Уле.
| Шкала Фореля | Шкала Уле | ||||
| № | Синий | Желтый | № | Раств.
XI |
Кобальт. раствор |
| I | 100 | 0 | XI | 100 | 0 |
| II | 98 | 2 | XII | 98 | 2 |
| III | 95 | 5 | XIII | 95 | 5 |
| IV | 91 | 9 | XIV | 91 | 9 |
| V | 86 | 14 | XV | 86 | 14 |
| VI | 80 | 20 | XVI | 80 | 20 |
| VII | 73 | 27 | XVII | 73 | 27 |
| VIII | 65 | 35 | XVIII | 65 | 35 |
| IX | 56 | 44 | XIX* | 56 | 44 |
| X | 46 | 54 | XX | 46 | 54 |
| XI | 35 | 65 | XXI | 35 | 65 |
* В последние три раствора добавляется несколько капель NH3 до полной прозрачности.
Непосредственно на месте также определяются: 1) Реакция на лакмус и Рн индикаторами (смотрите Водородные ионы, Индикаторы]); 2) Содержание азотистой к-ты, для чего 10 см3 воды с 0,5 ел3 реактива Гриса нагревают в течение 5 минут до 70—80° на свечке и затем наблюдают полученное
ТаОл. 4. — Результаты исследования реактивом Гриса.
| Окрашивание при рассматривании сбоку | Окрашивание при рассматривании сверху вниз | Окрашивание при рассматривании сверху вниз под углом 45° | Содержание азотистой кислоты (мг на 1 л) |
| Нет | Нет | Нет | < 0,00.1 |
| » | » | Едва замет- | |
| ное розовое | » 0,001 | ||
| » | » | Очень слабо | |
| розовое | » 0,002 | ||
| Едва замет- | Чрезвычайно | Слабо розо- | |
| ное розовое | слабо розо- | вое | » 0,005 |
| вое | |||
| Очень слабо | Слабо розо- | ||
| розовое | вое | * | » 0,01 |
| Слабо розо- | Светлорозо- | ||
| вое | вое | » | » 0,05 |
| Светлорозо- | |||
| вое | Розовое | » | » 0,10 |
| Розовое | Сильно розо- | ||
| вое | » 0,20 | ||
| Сильно розо- | |||
| вое | Красное | » | » 0,50 |
| Красное | Яркокрасное | * | » 1,00 |
окрашивание (табл. 4); 3) Содержание азотной к-ты, для чего смесь из 0,5 см3 В. и 1,5 см3 крепкой H2S04 охлаждается до 20— 25°, и в смесь всыпается несколько крупинок бруцина (около 2 мг). Наблюдаемые окраски приведены в таблице 5. 4) Аммиак, смотрите ниже.
5) Сероводород определяется при помощи потемнения свинцовой бумажки (грубое определение). 6) Содержание окиси и закиси железа: к 1—2 кристалликам КС103прибавляют 1—2 капли крепкой H2S04, после чего приливают 10 см3 испытуемой воды. Затем прибавляют 0,2 см3 50%-ного раствора роданистого аммония (КСЮ3 можно заменить щепоткой персульфата или 1—2 каплями 3 %-ной
Таблица 5. —Определение содержания азотной кислоты в воде.
| Окрашивание (в фарфоровой чашечке) | Содержание азотной кислоты (мг на 1 л) | |
| Нет окрашивания..
Через одну м. едва уловимое розовое окрашивание, сохраняющееся в тече- | Меньше 0,5 | |
| ние нескольких м..
Через одну м. незначительное розоватое окрашивание; через 10 метров окра- |
» | 0,5 |
| шивание едва заметно.
Через одну м. слабо розовое окрашивание; через 5 метров окрашивание ста- |
» | 1,0 |
| новится незначительным.
Через одну м. светлорозовое окрашивание; через 4 метров незначительное ро- |
* | 2,5 |
| зовато-желтое окрашивание.
Раствор быстро розовеет; через 1 метров розовое окрашивание; через 21/* м. слабо розовое; через Юм. слабо жел- |
5,0 | |
| тое с розоватым оттенком.
Раствор быстро розовеет; через а/< м. желто-розовое окрашивание; через I1/, м. розовато-желтое; через 8 метров. |
» | 10,0 |
| светложелтое..
Раствор быстро розовеет; через 7* м. красновато-оранжевое окрашивание; через 1 метров сильное розовато-желтое |
25,0 | |
| окрашивание; через 5 метров желтое. Раствор очень быстро розовеет; через 7а м. оранжево-красное окрашивание, быстро желтеющее; через *Jt м. яркооранжевое окрашивание; через | * | 50,0 |
| 5 метров интенсивно желтое. | » | 100,0 |
Н202). Диаметр пробирок—13—14 миллиметров; высота столба раствора—ок. 7 сантиметров при 10 см3 жидкости (табл. 6). 7) Окисляемость (смотрите ниже). 8) Содержание свободной С02—определяется на месте или же берут пробу в 400 см3 в склянке, так чтобы вода доходила до самой пробки. Содержание С02м. б. выведено также и из Рн по содержа-ншо гидрокарбоиатной С02. В теплое время и при жесткости воды выше 20° гидрокарбонатная С02 также определяется на месте. 9) Проба для последующего определения кислорода, по Винклеру, должна быть фиксирована на месте.
При необходимости более тщательного исследования питьевой воды производится полныйколичественныйанализ ее в лаборатории. При этом производятся следующие определения: 1) Цвет устанавливается по американок. платино-кобальтовой шкале цветности [смесь раствора 1,245 з хлороплатината и 1,009 з кристаллич. хлористого кобальта (СоС12. 6Н20) в 100 см3
Таблица 6.— Определение содержания железа в воде.
| Окрашивание при рассматривании сбоку | Окрашивание при рассматривании сверху вниз | Содержание железа (мг на 1 л) |
| Нет окрашивания Едва заметное желто- | Нет окрашивания Чрезвычайно слабое | Меньше 0,05 |
| вато-розоватое Очень слабое желтова- | желтовато-розоватое Слабое желтовато-ро- | » 0,10 |
| то-розоватое Слабое желтовато-ро- | зовое
Слабое желтовато-ро- |
* 0,25 |
| зовое | зовое | * 0,50 |
| Светлое желтовато-ро- | ||
| зовое | Желтовато-розовое | * 1,00 |
| Сильное желтовато-ро- | ||
| зовое | Желтовато-красное | » 2,50 |
| Светлое желтовато- | ||
| красное | Яркокрасное | » 5,00. |
воды и 100 см3 НС1, уд. в 1,19, доводят до 1 л]; цветность этого раствора принимается равной 500 градусам L1]. 2) Запах: «холодный» запах определяется при 20°; для определения «горячего» запаха 150 см3 воды нагревают почти до кипения и дают остывать в течение 5 метров Различают запахи: ароматный, свободного хлора, неприятный, землистый, рыбный, травяной, затхлый, плесени, болотный, сладковатый, сероводородный; интенсивность запаха оценивается по пятибальной системе. 3) Вкус определяется описательно и также оценивается по пятибальной системе. 4) Прозрачность определяется в цилиндре Генера высотой в 50— 60 сантиметров по чтению шрифта Снеллена № ; прозрачность выражается максимальной высотой воды в тот момент, когда чтение еще возможно. 5) Муть и осадки: муть характеризуется словами: слабая опалесценция, сильная опалесценция, тонкая взвешенная муть, устойчивая муть и т. д. Осадок характеризуется словами: ничтожный, незначительный, значительный, большой; по качеству: глинистый, песчаный, хлопьевидный, кристаллический, серый, желтый и т. д. 6) Изменение при стоянии определяется через сутки, словами: оседание осадка,появление мути, исчезновение запаха и т, д. 7) Реакция: а) на лакмусовую бумажку, которая сравнивается с лакмусовой бумажкой, смоченной дистиллированной В.;
б) на метилоранж; в) на фенолфталеин.
8) Активная кислотность—см. Водородные ионы. 9) Содержание углекислоты, причем различаются свободная, гидрокарбонатная, карбонатная, недостающая и общая. 10) Содержание агрессивной углекислоты. Часть свободной С02 в воде, находящаяся в равновесии с диссоциирующимся гидрокарбонатом кальция, не обладает способностью растворять новое количество среднего карбоната кальция.
Таблица 7.—Т аблица Тильманса и Гейбл е и н а для определения агрессивной С02·
| Связанная СО, (мг на 1 л) | Свободная С08(Λ13 на 1 л) | Связанная С02(мг на 1 л) | Свободная С02(мг на 1 л) | Связанная С08(мг на 1 л-) | Свободная С08(мг на 1 л) |
| 5,06 | 0 | 75 | 9,25 | 137,5 | 72,3 |
| 16 | 0,25 | 77,5 | 10,4 | 140 | 76,4 |
| 17,5 | 0,4 | 80 | 11,5 | 142,5 | 80,5 |
| 20 | 0,5 | 82,5 | 12,8 | 145 | 85 |
| 22,5 | 0,6 | 85 | 14,1 | 147,5 | 89,1 |
| 25 | 0,75 | 87,5 | 15,6 | 150 | 93,5 |
| 27,5 | 0,9 | 90 | 17,2 | 152,5 | 93 |
| 30,0 | 1,0 | 92,5 | 19 | 155 | 103 |
| 32,5 | 1,2 | 95 | 20,75 | 157,5 | 107,5 |
| 35 | 1,4 | 97,5 | 22,75 | 160 | 112,5 |
| 37,5 | 1,6 | 100 | 25 | 162,5 | 117,5 |
| 40 | 1,75 | 102,5 | 27,3 | 165 | 122,5 |
| 42,5 | 2,1 | 105 | 29,5 | 167,5 | 127,6 |
| 45 | 2,4 | 107,5 | 32,3 | 170 | 132,9 |
| 47,5 | 2,7 | 110 | 35 | 172,5 | 138 |
| 50,0 | 3,0 | 112,5 | 37,8 | 175 | 143,8 |
| 52,5 | 3,5 | 115 | 40,75 | 177,5 | 149,1 |
| 55 | 3,9 | 117,5 | 43,8 | 180 | 154,5 |
| 57,5 | 4,25 | 120 | 47 | 182,5 | 160 |
| 60,0 | 4,8 | 122,5 | 50,2 | 185 | 165,5 |
| 62,5 | 5,25 | 125 | 54 | 187,5 | 171 |
| 65 | 6,0 | 127,5 | 57,4 | 190 | 176,6 |
| 67,5 | 6,75 | 130 | 61 | 192,5 | 182,3 |
| 70 | 7,5 | 132,5 | 64,7 | 195 | 188 |
| 72,5 | 8,3 | 135 | 68,5 | 200 | 199,5 |
Избыток против этой части С02 называется агрессивной углекислотой. Если содержа-ние свободной углекислоты больше того количества, которое находится в равновесии, то избыточная С02 будет-растворять карбонат кальция (бетонные водопроводные трубы, хранилища). Вычисление агрессивной СО 2 производится по таблицам Тильманса и Гейблейна (табл. 7), если содержание связанной СО 2 не сильно отличается от ее количества, эквивалентного присутствующему Са; в противном случае (присутствие Mg и Na) агрессивная С02 определяется непосредственным экспериментом—по Гейеру: в склянку в 400—500 см3 всыпают 3—5 г порошка мрамора и часто взбалтывают с исследуемой водой в течение 3—4 дней, после чего вновь определяют связанную С02. Разница покажет содержание агрессивной С02. 11) Щелочность титрационная: 100 см3 воды (3 капли 1%-ного метилоранжа) титруют V10 N раствором НС1 до очень слабого розового окрашивания. 12) Кислотность титрационная определяется γ10 N раствором NaOH с метилоранжем или фенолфталеином. 13) Ж е с т-кость (смотрите ниже). 14) Взвешенные вещества определяются фильтрованием при 105° через высушенный при 105° тигель Гуча. 15) Плотный остаток фильтрованной воды при 110° определяется упариванием в платиновой чашке 500 см3 воды и сушкой остатка в течение 3 час. при 110°. Если в воде содержится сульфатов более 50 мг на л, то к В. прибавляют при выпаривании 100 мг чистой углекислой соды, растворенной в 10 см3 В. 16) Окиси кальция и магния, обусловливающие о б-щую жесткость В., определяются осаждением, причем сначала отделяют их от А1(ОН)3 и Fe(OH)3 (смотрите Анализ химический), затем осаждают Са щавелевокислым аммонием в присутствии NH4C1; осадок прокаливают и СаО взвешивают. После осаждения Са осаждают из фильтрата окись магния в виде фосфорноаммонийномагниевой соли; последнюю прокаливают и пирофосфат магния взвешивают: вес Mg2P207 х 0,3621=весу MgO; вес Mg2P207×0,2184=весу металлического Mg. 17) Окись натрия и окись калия определяют в прокаленной (для удаления аммонийных солей) навеске путем осаждения хлорной платиной. Из обоих образовавшихся хлороплатинатов Na2PtCleи K2PtCl6 первый растворяется в 80%-ном винном е, второй — не растворяется. K2PtCI6×0,1937=К20; K2PtCl6 х 0,1609==К; K2PtCl6x 0,3067 =КС1. 18) Железо присутствует в артезианских и грунтовых водах почти исключительно в виде бикарбоната Fe(HC03)2; на воздухе же протекают следующие реакции:
Fe(HCO,),-* FeCO, + Η,Ο + СО,;
FeCO, + Η,Ο ->· Fe(OH), + СО,;
2 Fe(OH), + Η,Ο + О -»· 2 Fe(OH), -► Fe,0,. 3 Η,Ο.
Органические вещества (гуминовые) оказывают защитное действие (смотрите Коллоиды) на коллоидальные гидроокиси железа. Метода, позволяющего детализировать определение железа по разным формам его соединений, не выработано. Определение железа в В. чаще всего производится колориметрически.
Стандартный раствор железа [0,8633 г железноаммонийных квасцов FeNH4(S04)2.12H20+ + 10 см3 крепкой H2S04] разбавляют до 1л; 1см3 содержит ОД мг Fe. Общее содержание железа определяется след, образом: к 50 см3 воды прибавляют 2 см3 НС1 уд. в 1,12 и 1см3 насыщенного раствора КС103(или 5 капель 3%-ной Н202) и кипятят в течение 15 мин. на водяной бане. После этого прибавляют 1 см3 крепкого раствора KCNS или NH4CNS (225 з соли+ 125 см3 В.) и исследуют колориметрически, сравнивая со стандартным раствором (смотрите Колориметрия). Окись железа определяется без прибавления КС103 или Н202. Содержание закиси железа вычисляется по разнице между общим содержанием железа и содержанием окиси железа. 19) Окись алюминия А1203 —.см. Анализ химический. 20) Марганец определяется колориметрически, путем окисления солей Мп в растворе надсерной кислоты H2S208 в присутствии ионов AgB качестве катализатора доНМп04, окрашенной в розовый цвет. 21) Свинец, цинк, медь и олово определяются колориметрически и электролитически (смотрите Анализ химический). Грубую оценку содержания свинца можно сделать, осаждая РЬ сероводородом в присутствии СН3-СООН и сравнивая полученную окраску с окраской стандартного раствора свинцовой соли, обработанной таким же образом сероводородом (если вода бесцветна и не содержит больших количеств железа). 22) Серная кислота (сульфаты) определяется либо весовым способом (осаждением в виде BaS04) либо объёмным методом по Эндрьюс-Кома-ровскому: действием ВаСг04 и KJ в присутствии НС1 по уравнениям:
BaCrOi + К,SO.=BaSO. + K.CrO.,
K,CrO,+ 8 НС1 + 3 KJ=5 KC1 + CrCl, + 4H,0 + 3 J, причем иод оттитровывается иодометриче-ски. 23) Хлористоводородная к-та (хлориды) определяется, после обесцвечивания пробы действием А1(ОН)3 и нейтрализации ее содой или слабой H2S04,—путем титрования в 50 см3 пробы раствором AgN03(в присутствии 1 см3 раствора К2Сг04 в качестве индикатора) до появления слабого красного окрашивания. 24) Азотная кислота (нитраты) определяется по методу Гранвиля и Лажу, по у-рию:
С.Н.ОН + 3 HNO,=ΟβΗ,(ΝΟ,),ΟΗ + 3 Η,Ο.
Образовавшуюся пикриновую к-ту переводят в пикрат аммония, к-рый определяют колориметрически. 25) Азотистая кислота (нитриты) определяется по Грису путем диазотирования азотистой к-той аро-матич. аминов (раствор 0,2 г к-нафтилами-на в 150 см3 12%-ной уксусной кислоты, охлажденной на льду, смешанный с раствором 0,52 г сульфаниловой кислоты в 150 см3 12%-ной уксусной кислоты, также охлажденным на льду); смесь растворов в присутствии нитритов окрашивается в розовый цвет, который сравнивается колориметрически со стандартным раствором азотистокислой соли. 26) Аммонийные соли (солевой аммиак) определяются колориметрически с помощью Неслера реактива (смотрите) (щелочный раствор двойной соли HgJ2 · 2 К J),
к-рый с NH3 дает желтое окрашивание от образования йодистого меркураммония по уравнению:
NH, + 2 (HgJ, · 2 К J) + 3 КОН =
= NH,-Hg,0 J + 7 KJ + 2 Η,Ο.
27) Альбуминоидный азот. После отгонки ΝΗ3 из аммонийных солей окисляют воду при помощи 25 см3 щелочного раствора КМп04 (400 г КОН и 16 г КМп04в 2 л Н20). Азотистые соединения разрушаются до ΝΗ3, который определяется, как указано выше. 28) Органический азот определяется по методу Кьельдаля. 29) Общий азот определяется по методу Кьельдаля-Иодлбауера. 30) С е р о в о д о-род (сульфиды) определяется качественно, как при исследовании на месте; количество Н2в определяется по Винклеру: 100 см3 исследуемой В. смешивают с 5 см3 сегнетовой соли; в другую склянку наливают 100 см3 дистиллированной воды и 5 см3 сегнетовой соли. Затем во вторую склянку посредством бюретки приливается эмпирический раствор As2S3, пока окраски не сравняются. Число прилитых см3 раствора As2S3 указывает на число см3 H2S в 1 л исследуемой В. Можно также титровать H2S 7100 N раствором иода по методу Дюпаскье-Фрезениуса. 31) К ремне к и с л о т у определяют обработкой (З раза) сухого остатка от 7s л воды 20—30 см3 дистиллированной воды и 5—10 см3 крепкой НС1; после выпаривания отфильтровывают нерастворимый гидрат кремневой к-ты, прокаливают и взвешивают. 32) Фосфаты определяются колориметрически по молибденово-оловянному методу Дениже (Deniges), который позволяет открывать в натуральной воде 0,001 мг Р306 в 1 л. 33) Окисляемость определяется прибавлением избытка Vioo-ZV раствора КМп04, обработкой 10 см31/1MN щавелевой кислоты и, в заключение, обратным титрованием Vioo-iV хамелеоном; 1 см3 1l100N раствора КМп04соответствует 0,08 мг 02 (метод Кубеля). В загрязненных водах окисляемость фильтрованной и нефильтрованной В. определяется отдельно. 34) Потребление кислорода выражается разностью содержания О2 в двух пробах после насыщения В. воздухом путем взбалтывания. В первой пробе 02 определяется сейчас же, во второй— через 5 дней стояния в термостате при 18,3°. 35) Растворенный кислород определяют в пробе в 250 см3, взятой в колбу с притертой пробкой, причем необходимо следить, чтобы в пробу не попали пузырьки воздуха (трубка, присоединенная к крану, доходит до дна колбы, 2—3 объёма воды переливаются через верх склянки, после чего колбу закрывают притертой пробкой; те же предосторожности соблюдаются и при взятии пробы из водоемов). К пробе приливают 0,7 см3 крепкой H2S04 и 1 см3 раствора КМп04. Если через 20 метров проба обесцветится, прибавляют еще 1 см3 КМп04; через 20 минут прибавляют 1 см3 раствора оксалата калия. После осветления прибавляют 1 см3 сернокислого марганца и 3 см3 щелочного раствора KJ и 1 сои3 крепкой H2S04. Из пробы отбирают 200 см3 и титруют 7100 N раствором серноватистокислого натрия в присутствии 1 ом3 крахмального клейстера (прибавлять к концу реакции) до получения синего окрашивания; 1 см3 Viqo N раствора гипосульфита эквивалентен 0,08 мг 02. Для определения содержания 02 в мг на л нужно число см3 7ю5 N раствора гипосульфита, израсходованного на титрование 200 см3 воды, умножить на 0,4. Умножая число мг на вес 1 см3 02, то есть на 1,429, получим содержание 02, выраженное в см3 на 1 л (объёмный %). Растворимость 02 при 0° и 760 миллиметров приведена в таблице 8.
Таблица 8. —Растворимость кислорода в воде.
| t° | О, мг | О а °/оо | t° | О* мг | О» °/оо |
| 0° | 14,62 | 10,21 | 16° | 9,95 | 6,95 |
| 1° | 14,23 | 9,93
9,66 |
17° | 9,74 | 6,80 |
| 2° | 13,84 | 18° | 9,54 | 6,66 | |
| 3° | 13,48 | 9,41 | 19° | 9,35 | 6,53 |
| 4° | 13,13 | 9,17 | 20° | 9,17 | 6,40 |
| 5° | 12,80 | 8,94 | 21° | 8,89 | 6,28 |
| 6° | 12,48 | 8,71 | 22° | 8,83 | 6,16 |
| 7° | 12,17 | 8,50 | 23° | 8,68 | 6,06 |
| 8° | 11,87 | 8,29 | 24° | 8,53 | 5,95 |
| 9° | 11,59 | 8,09 | 25° | 8,38 | 5,85 |
| 10° | 11,33 | 7,91 | 26° | 8,22 | 5,74 |
| 11° | 11,08 | 7,73 | 27° | 8,07 | 5,63 |
| 12° | 10,83 | 7,56 | 28° | 7,92 | 5,53 |
| 13° | 10,60 | 7,40 | 29° | 7,77 | 5,42 |
| 14°
15° |
10,37
10,15 |
7,24
7,09 |
30° | 7,63 | 5,33 |
Жесткость В. Под жесткостью воды подразумевается содержание в воде солей кальция и магния. Обыкновенно различают временную, или устранимую, жесткость (также называемую щелочной, или карбонатной, жесткостью) от п о-стоянной жесткости (некарбонат-н а я—о статочная). Первая обусловливается присутствием в воде двууглекислых солей кальция и магния, вторая—присутствием других кальциевых и магниевых солей (гипса, хлористого магния и др.). Общая жесткость Жобщ.=Жустр. + ЖПост
Жесткость оценивается: в немецких градусах, причем 1 градус=1 з СаО в 100 000 г воды или 10 мг СаО в 1 л воды; французск. градусы показывают число частей СаС03 в 100 000 ч. воды. При оценке жесткости воды применяется следующая шкала: менее 8°— мягкая, от 8 до 16°—средняя, выше 16=— жесткая. Содержание MgO перечисляется на СаО, для чего количество MgO надлежит помножать на 1,4. Определение временной жесткости В. производится путем титрования 500 см3 у10 N соляной к-той с метилоранжем или ализарином. Помножив число потраченных сл3 кислоты на 2,8, получаем времен. жесткость водывнемецк. градусах. (Из этого титрования определяется и содержание связанной С02: 1 см3 у10 N НС1=2,2 мг полусвязанной С02.) Общая жесткость определяется путем осаждения углекислых солей Са и Mg. Для этого 200 см3 воды нейтрализуют при помощи НС1 и выпаривают до объёма в 50 см3. После этого нейтрализованную воду сливают в колбу объёмом в 100 см3; к ней прибавляют 20 см3 смеси уб N соды и у6 N NaOH, и вся смесь доводится до метки (Ϊ00 см3). Затем жидкость фильтруется через сухой фильтр, и 50 см3 фильтрата (первые капли выливаются) оттитро-вываются у5 N НС1 с метилоранжем. Пусть для обратного титрования пошло а см3 У5 N НС1. Тогда для осаждения щелочи земельных металлов, которые содержатся в 200 см3 В., потребовалось бы (20 — 2а) см3 раствора щелочи. Умножая на 2,8, мы получим общую жесткость в нем. градусах. Обыкновенно общая щелочность определяется, по Бляхеру, при помощи раствора калийного мыла. Для этого 25,6 г пальмитиновой кислоты растворяют в 400 см3 а и 250 см3 глицерина. К смеси прибавляют фенолфталеин и смесь точно нейтрализуют гольным раствором едкого кали, после чего доводят ом общий объём до 1 л. Затем необходимо установить титр полученного ового раствора мыла; для этого полученным мыльным раствором титруют
Таблица 9.—Н ормы литьевых вод (количество мг в 1 л).
| Название норм | Сухой остаток | Жесткость | Органические вещества | Хлор | Серная кислота | Азотная кислота | Азотистая кислота | Аммиак солевой | Аммиак альбуминоид. |
| Рейхгарта .. | 00—500 | 18° | 0,5—2,5 | 2—8 | 2—63 | 4 | |||
| Брюссельского конгресса. | 500 | 20° | 2,5 | 8 | 60 | 2 | _ | 0,5 | _ |
| Фишера | — | 17—20° | 2—4 | 36 | 80 | 27 | 0 | 0 | _ |
| Comite consullatif de France. | — | 8,4—11,2° | 2 | 40 | 5—30 | ||||
| Швейцарских химиков.. | 500 | 2,5 | 20 | _ | 0 | 0,02 | _ | ||
| Тимана и Гертнера.. | 500 | 18—20° | 1,5—4,5 | 20—30 | 80—100 | 5—15 | 0 | 6 | — |
| Паркса | 858 | — | 1Д | 87 | 111,5 | —. | 0 | 0 | _ |
| Швейцарского союзного совета 1909 г. | 500 | — | 1,5 | 20 | _ | 20 | 0 | 0 | _ |
| Клюта 1911 г.. | 500 | 18° | 3,0 | 30 | 60 | 30 | 0 | 1,0 | _ |
| Флюгге 1912 г.. | 500 | 19° | 2 | 30 | 100 | 15 | Следы | Следы | _ |
| Французск. земледельч. об-ва 1912 г. | 500 | — | 2 | 40 | — | — | — | 0 | _ |
| Эриемана .. | 5С 0—600 | 18—20° | 2—3 | 20—30 | 80 | 30—40 | Следы | Следы | _ |
| Буткевича для Днепропетровска. | 2 000 | 60° | 6—7 | 2С 0—300 | — | — | — | — | — |
|
Артезианские воды Москвы по данным И. Р. Хецрова и Л. А. Михайловской (среднее из 203 анализов)— Труды Московского санитарного института, 1926 г., вып. 1. | |||||||||
| Верхнекаменноугольный горизонт. | 231 | 10,7° | 1,6 | 9.4 | 14,9 | 0,04 | Следы | От 0,2 | От |
| Среднекаменноугольный горизонт. | 319 | 14,8° | 1.2 | 7,3 | 32,7 | 0,5 | » | ДО 0,5 | еле- |
| Нижнекаменноугольный горизонт. | 457 | 17,2° | 0,67 | 9,0 | 145,8 | 0—1,0 | * | в среднем | лов
ДО0.2 |
с фенолфталеином до явственно красного окрашивания точно отмеренное количество известковой воды установленной крепости. Определив титр мыльного раствора, можно им пользоваться для исследования общей щелочности В. Для этого сначала определяют временную жесткость титрованием воды Vio N раствором НС1 (с метилоранжем). Вытеснив из раствора сильным током воздуха углекислоту, его точно нейтрализуют и прибавляют к нему мыльного раствора до появления красного цвета. Число потраченных см3 мыльного раствора, умноженное на поправку мыльного раствора, выразит общую жесткость В. От временной жесткости вода м. б. освобождена путем кипячения; при этом бикарбонаты разлагаются с выделением газообразной С02 и осадка СаС03 (накипь). Но и после кипячения в растворе останутся соли, обусловливающие постоянную жесткость: CaS04, СаС12, MgS04 и MgCl2. Чтобы освободить воду от этих солей, а равно чтобы освободить В. без нагревания от временной жесткости, ее подвергают очистке (смотрите ниже).
В табл. 9 приведены нормы питьевой В. и сравнит, характеристика артезианских вод Москвы. Относительно методов бактериологии. и биологич. исследования питьевой В. см. Микробиология техническая.
Лит.: ) Landolt-Bornschtein, Physik.-chemi-sche Tabellen, В. t, p. 362, В., 1923; !) Bridgman, «Ztseh. f. anorgan. Chemie», B. 77, p. 377, 1 912. 3) Стандартные методы исследования питьевых и сточных вод, НТО ВСНХ, М., 1927 (весьма полная методика исследования, сокращенно излагаемая в настоящей статье, и принципы оценки вод; приведена обширная лит.); Хлопин Г. В., Химические и микробиологическ. методы санитарного исследования питьевых и сточных вод, П., 1918; В о л н< и н В. А., Анализ воды, СПБ, 1912; Д о с т К. и Г и л п е р-м ан Р., Практическое руководство к исследованию питьевых и сточных вод, М.—П., 1922; Бруевич С. В., Коршун С. В., О з e р о в С. А. и×е προ в И. Р., Исследование питьевых вод, М., 1925; Ephraim F., Anorganische Chemie, Dresden u. В., 1926; В i e d e r m a η n К. u. Roth W. A., Che-miker-Kalender, В., 1928; Ab egg R. und Auerbach F., Handbuch d. organischen Chemie, B. 2, Abt. 1, p. 55, I,pz., 1908. Б. Беркенгейм.
III. Веда в природе.
Существуют две теории образования подземных вод: инфильтрационная и конденсационная. По первой теории они происходят от выпавших на землю атмосферных осадков, которые и проникают на разные глубины. По второй теории, существование В. в земной коре обусловлено осаждением водяных паров из воздуха, проникающего в землю. По глубине залегания В. различают: почвенные, глуби н.н ы е и артезианские. Почвенными В. называются атмосферные воды, задерживающиеся в пустотах верхних слоев почвы. Такие В,- почти не минерализуются, но в значительной степени растворяют гумусовые составные части почв, содержат много органических веществ и поэтому мало пригодны в качестве питьевой В. Если атмосферные воды, не задерживаясь в верхних слоях почвы, опускаются по грунтам ниже зимнего промерзания почвы до водонепроницаемого пласта, вдоль которого они затем направляются, то такие воды называются грунтовыми. Эти воды при своем опускании часто проходят через дренирующие породы—
пески, песчаники, известняки, продолжают движение по этим пластам, получающим тогда название водоносных пластов, и, фильтруясь в этих последних от органических и других загрязнений, превращаются в хорошие питьевые В. Очень чаото грунтовые воды при своем передвижении попадают в такие условия, что легко минерализуются, и тогда получаются грунтовые минеральные воды. Когда грунтовые В. не ограничиваются движением по первому водонепроницаемому пласту, или когда этот последний имеет большой уклон и входит под толстые наносы, или же, наконец, когда вследствие разрыва пласта воды попадают в другие пласты и по ним опускаются ниже горизонта постоянной t° почвы данного района на большие глубины, то в этих случаях В. называются глубинными. Глубинные В. еще более способны минерализоваться и насыщаться газами (С02, H2S, N, О и др.), и при известном расположении пород получают свободный напор, а при больших глубинах и высокую t°. Глубинные воды с напором, выводимые на поверхность земли буровыми скважинами, называются артезианскими.
Почвенные воды в земной коре не остаются в покое, а, наоборот, пребывают в постоянном движении, причем это движение редко соответствует поверхностному рельефу местности, а зависит от расположения пород и всех дислокационных явлений. Движение В. по пластам можно уподобить широким потокам (пластовые воды), а по трещинам пород—движению воды в трубах (трещинные воды); как и в трубах, в трещинах могут возникать временные задержки от скопления газов.
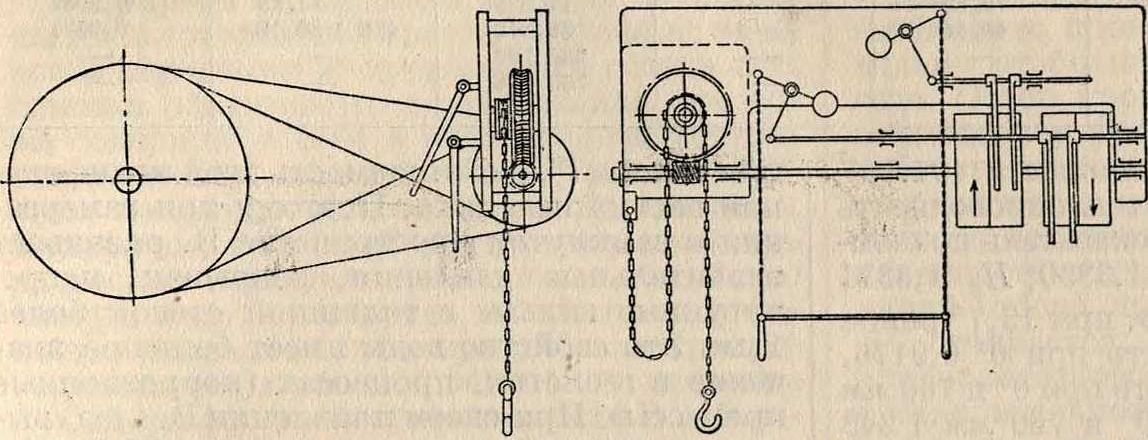
В практике часто необходимо знать количество подземных вод в данном районе, но теоретическое исследование, например, пластового движения подземных вод возможно только при некоторых предположениях относительно свойств водопроницаемого пласта. Если предположить, что он состоит из однородного вещества, например из гравия с зернами одинакового и небольшого размера, то можно принять для движения подземных вод зависимость: v=ka, где υ—скорость течения, а—уклон и к—некоторый коэффициент, определяемый опытом и зависящий от величины отдельных зерен гравия. В действительности же такая однородность зерен встречается редко; поэтому величину к установить трудно. Тем не мепее для практических целей применяют разные приемы определения скорости потока, его формы, уклона и прочие Так, с помощью буровых скважин определяют поверхность (скатерть) подземных вод и изображают ее для известного момента на плане в горизонталях. Форма поверхности позволяет сделать заключение о направлении течения и уклона потока; если известно значение к (например его величина определена тем же бурением, выясняющим свойства горизонта), то при известной высоте и ширине поперечного сечения потока можно вычислить и расход подземных вод. В практике определение мощности потока поверхностных В. производится иногда путем выкачивания
постоянного объёма В. из пробного колодца в течение продолжительного времени и наблюдения происходящей при этом депрессии. Среднюю скорость движения подземных В. можно определить, если в одной буровой скважине опустить в поток поваренную соль или флуоресцеин, а в другой, удаленной от первой по уклону на расстояние а, определить появление наибольшего содержания поваренной соли или же с помощью флуороскопа констатировать наибольшее окрашивание вод. Тогда, зная число секунд Т, прошедшее между моментами впуска соли или флуоресцеина и появлением HX.j можно вычислить скорость движения воды ν=ψ. Умножая V на площадь поперечн. сечения потока, можно получить непосредственно и расход подземных вод (в предположении, конечно, однородности вещества водоносного слоя). При водоснабжении городов глубинными или грунтовыми водами важно знать точно количество используемой воды, для чего необходимо с возможно большей точностью определить скорость движения подземных вод; кроме того, необходимо изучить колебание уровня подземных вод в зависимости от переменных соотношений между атмосферными осадками и испарением.
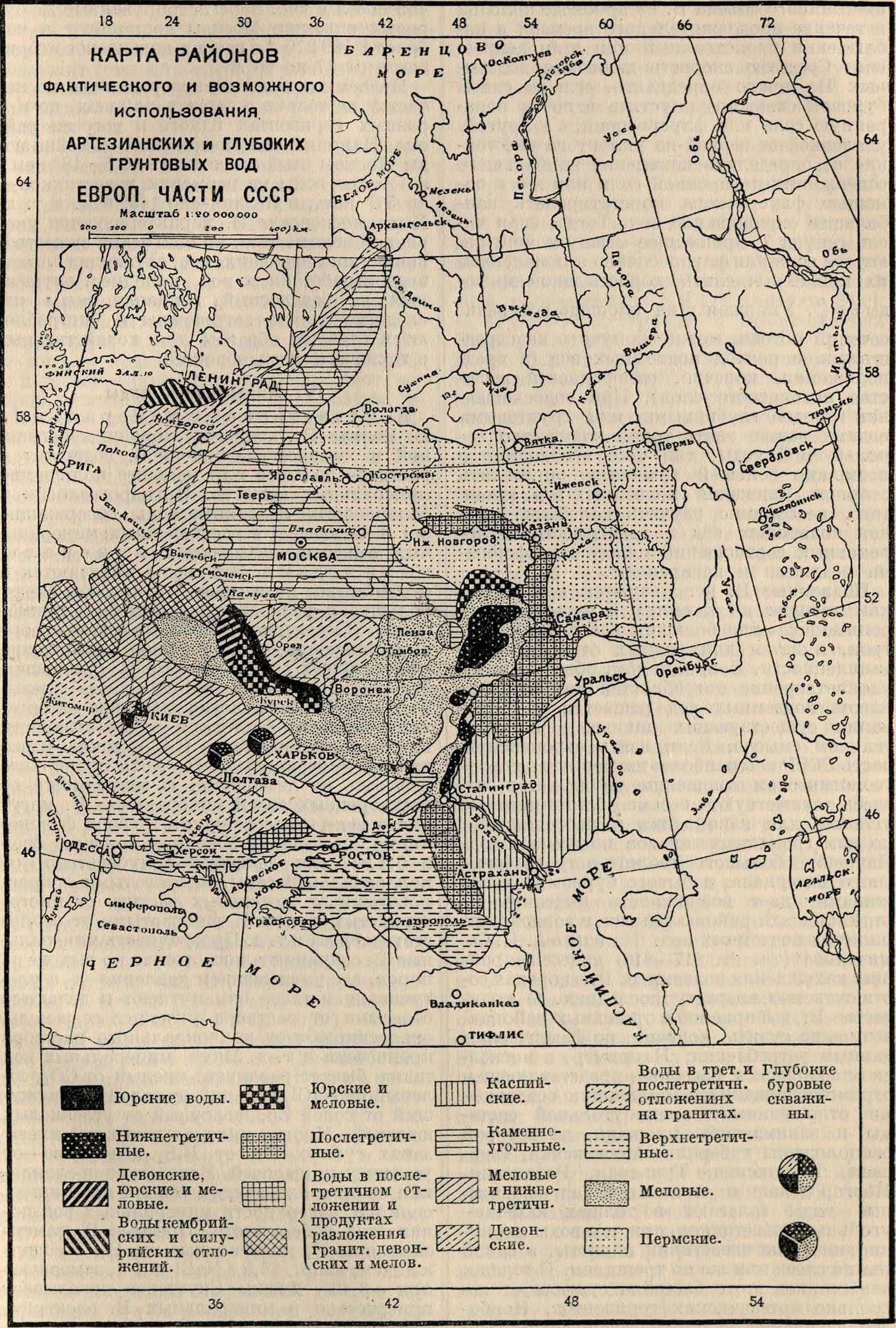
Подземные В. используются для питья как лучшие по качеству и часто единственные воды для больших населенных центров, а затем для разных отраслей промышленности. Вопрос о том, обеспечено ли удовлетворение потребностей человека запасом подземных вод решается на основании существующих данных в положительном смысле. Если взять европейскую часть СССР как наиболее изученную в гидрогеологическом отношении, то окажется, что здесь существуют весьма благоприятные условия для накопления и передвижения по ним громадных запасов подземных вод. Изучение большого геолого-петрографического материала, добытого буровыми скважинами, дает возможность выделить на этой площади районы фактич. и возможного наличия подземных вод. На карте А. Н. Се-михатова (смотрите ст. 817—818) нанесены районы нахождения подземных В. в породах соответственно возрасту последних. О количестве В., выбираемой в отдельных районах, возможно судить, конечно, по фактическим данным потребления. Например, в московском водоносном бассейне, представляющем огромную впадину, заполненную осадочными отложениями каменноугольной системы и занимающую площадь, на которой расположены губернии: Московская, Тверская, Калужская, Тульская, Рязанская, Новгородская и Архангельская,—подземные воды залегают в толщах каменноугольных известняков, причем воды циркулируют, если известняки пористы, в самой толще слоев или же по трещинам. В толщах известняков этого бассейна существует несколько артезианских горизонтов. Наиболее изученной является водоносность Москвы и ее окрестностей, где имеется несколько десятков глубоких скважин с притоком самоизливающейся воды от 6 150 до
455 000 л в час. Зарегистрированные 27 буровых скважин Москвы доставляют в час более 2 189 270 л с глубин водоносного горизонта от 37 до 65 метров.
Подземные воды весьма различны по качеству не только в разных районах, но и в разных горизонтах одного и того же района. Наприм., для Московского бассейна воды Москвы имеют жесткость 15,5—18° нем., в Самаре воды из пермских известняков— до 57° нем., в Казани—до 145° нем. и т. д. Хотя московские В. характеризуются умеренной жесткостью, но благодаря существованию поглощающих, то есть служащих для отвода отработанных вод, колодцев, опущенных на водоносный горизонт, воды последнего сильно загрязнены и употребляются главным образом для хозяйственных и технических надобностей.
IV. Минеральные воды.
А. Естественные минеральные В. Всякая В., исключая хорошо перегнанной и химически очищенной, содержит в растворе большее или меньшее количество минеральных веществ. В гидрогеологии и бальнеологии подземные воды, содержащие в 1 л не менее 1 з растворенных минеральных веществ, называются минеральными водами. Эти воды выделяются в особый отдел подземных вод, так как имеют большое и разнообразное лечебное применение. В практике, правда, не всегда строго выдерживается установленное определение минеральных вод, и нек-рые В. с меньшим содержанием солей, но способные оказывать лечебно-физиологич. действие на организм человека благодаря радиоактивности или присутствию газов (С02), также называются минеральными В., хотя правильнее называть их лечебными. В зависимости от растворенных солей минеральные В. могут иметь нек-рые особенности в своих физико-химич. свойствах. Уже при толщине слоя в 0,2 миллиметров они делаются голубоватыми от коллоидальной серы, желтоватыми и красноватыми от гуминовых частиц, от многосернистых щелочей, черноватыми от сернистого железа и т. д. Прозрачность минеральные В. сохраняют лишь тотчас по выходе из пород, а с уменьшением давления и с улетучиванием газов они мутнеют и делаются белесыми от раствора углекислых земель, опалесцируют от коллоидального раствора кремнезема и т. д. Вкус минеральных вод также бывает различен: кислый от С02, соленый от NaCl, горький от солей Mg, вяжущий от солей Zn, щелочный от углекислых щелочей. Многие минеральные воды имеют запах тухлых яиц от H2S, йодоформа—от углекислых щелочей. Вследствие преломления света в плавающих тонких пластинках соли на поверхности минеральных вод появляется побежалость. Пресные В. замерзают при 0°, минеральные же В., с содержанием, например, 58,5 з NaCl в 1 л, замерзают при —3,42°. Физик Скуттенен доказывает присутствие в минеральных В. электрич. напряжения, то есть возникновение электрич. тока при соединении минеральной В. в сосуде с землей посредством проводника, причем В. заряжается отрицательно, а земля положительно; силу возникающего тока, по его мнению, можно определить чувствительным гальванометром. Кроме того, не подлежит сомнению электропроводность минеральных вод, причем Кольрауш установил даже ее величину для разных минеральных вод.
Все элементы, встречающиеся в растворе в минеральных В., могут быть разделены на 3 группы: 1) встречающиеся очень редко и в малых дозах: золото, платина, цинк, хром, никель, уран, барий и тому подобное., 2) встречающиеся часто, но в небольших количествах: железо, стронций, марганец, иод, бром, фтор, и тому подобное. и 3) элементы, встречающиеся часто и в больших количествах: кальций, магний, натрий, калий, алюминий, сера, хлор, кремний и тому подобное. Кроме того, в воде часто находятся в растворе и газообразные тела: кислород, азот, водород, углекислота, сероводород, воздух, гелий, аргон и др. Пока из 77 химич. элементов в составе минеральных В. не встречено только 16. Как бы глубоко в земле ни находились подземные В., получая возможность минерализоваться и приобретать высокую t°, все же подземное движение минеральных вод заканчивается выходом их на поверхность. Эти выходы бывают естественные (источники, ключи) и искусственные (колодцы, буровые скважины). Утилизация минеральных вод, конечно, производится у устья источников; поэтому местоположение устья очень важно для гидротехника, так как его надо обеспечить в смысле прочности, постоянства и удобства охраны, что достигается закреплением выхода источника («каптаж»). Разумеется, выходы источников в болотах, озерах и тальвегах долин являются наиболее затруднительными для каптажа и использования.
Воды минеральных источников классифицируют: 1) по ί° и 2) по химич. составу. По ^разделяют воды так: если движение минеральных вод происходит в слоях, где t° не ниже средней годовой, колеблющейся между 10 и 20°, то источники называются нормальными по ί°. Источники с t° ниже нормальной называются холодны-ми, или гипотермами (например В. ледниковых потоков или В., циркулирующие в почвах с вечной мерзлотой, как Пиаровские, Дарасунские с t° 1,2—0,5°). Источники с t° выше среди, годовой называются теплыми, или термами (20—50°). Выше 50°источники называются горячими. Геолог Э. Зюсс подразделяет горячие источники, кроме того, на г е и з е р ы, то есть периодически бурно действующие кремнекислые источники, и спрудели, то есть спокойные и постоянно действующие. Темп-ра минеральных источников колеблется в широких пределах, от 0,5° (Дарасунский) до 100° (Бананинский на Камчатке).
По химическ. составу имеется несколько группировок минеральных В. Русские бальнеологи и химики основывают деление минеральных вод на физиологич. действии их главных составных частей на организм человека. По этим признакам различают следующие группы минеральных вод: 1) щелочные, 2) В. поваренной соли, 3) железные,
4) овистые, 5) горькие, 6) сернистые, 7) известковые и землистые и 8) химически безразличные, или акратотер-м ы. Каждая из этих групп характеризуется какой-либо преобладающей составной частью, но в деталях каждая группа разделяется на классы.
1) Щелочные воды, характеризуясь преобладанием углекислого натра и С02, подразделяются, в зависимости от других солей, на следующие классы: а) углекислые с преобладанием С02 (Нарзан, Мариен-бад); б) щелочно-углекислые с преобладанием Na2C03 и С02 (Боржом, Виши); в) щелочно-соляные, в к-рых, кроме предыдущей соли, содержится и NaCl (Ессентуки, Эмс);
г) щелочно-глауберовые с преобладанием Na2S04 (Карлсбад, Слепцовские). 2) Группа В. поваренной соли, в зависимости от содержания NaCl, подразделяется на классы: а) слабые В., с содержанием соли не более 1,5% сухого остатка (Старая Русса, Соден); б) крепкие воды, с содержанием соли не менее 1,5% (Дакс, Наугейм). Выше
2,5—3% получается уже рассол, или рапа (Баскунчак). 3) Железными В. принято называть лишь такие, в которых содержится на л не менее 0,03 г железа в виде двууглекислой закиси. Эти воды подразделяются по преобладанию той или другой второстепенной соли на: а) чистые железные воды (Липецк, Спа), б) железно-щелочные, содержащие, кроме Fe, также и щелочи (Мзымтинские, Франценсбад), в) железносоляные (Столыпинские, Ноденталь), г) железно-известковые (Железноводск, Яма-ровск), д) железные с сернокислою закисью железа (Левико, Змеевские). 4) овистыми В. называют такие, которые содержат As в количестве, достаточном для врачебного действия, и лучшими считаются сочетающие As со щелочами (Ронченьо, Ви-Сюр-Цер, Хасиевский). 5) Горькие В., главная составная часть которых MgS04 с примесью также и NaCl (Баталинский, Гуния-ди-Янос). 6) Сернистые В. характеризуются содержанием H2S и сернистых металлов Na, Са, Mg, К и др. Эти В. подразделяются по t° на: а) горячие (Горячеводские 90°, Экс 77°), б) теплые (Пятигорск, Бареж) и в) холодные (Сергиевские 8°, Буйские).
7) Известковые В. с преобладанием в их составе CaS03, CaS04, а также с содержанием солей Mg (Джелал-Абад, Контрексвиль).
8) В. с незначительным содержанием солей имеют обычно менее 1 г солей на л, и лечебное значение таких вод обусловливается: темп-рой, присутствием С02 и, часто, радиоактивными свойствами (Абас-Ту-манские, Туркинские, Теплиц). Кроме упомянутых групп, следует отметить еще: кремнекислые источники, содержащие Si02 (гейзеры Исландии и Новой Земли), борные источники, с содержанием борной кислоты (Тосканские фумаролы), и радиоактивные источники, содержащие в растворе радиоактивные вещества. Минеральные воды приобретают эту радиоактивность от радиоактивных горных пород—гранитов, известняков, трахитов и др. Радиоактивность В. определяют особыми приборами (электроскопы, фонтак-тоскопы) и выражают у нас в единицах Махе.
Радиоактивность В. измеряется по величине тока насыщения в фонтактоскопе (смотрите) в результате ионизирующего действия эманации из одного л В. Если силатока=1 000 эл,-ст. ед., то радиоактивность такой В. равна 1 единице Махе (1 ME). Во Франции радиоактивность измеряется единицей Кюри, представляющей такое количество RaEm, которое находится в равновесии с 1 г чистого металлического Ra. Единица Кюри равна 2,75-109 единиц Махе. Минеральные воды обычно содержат чрезвычайно мало RaEm, поэтому для воды пользуются единицей Махе (ME). Установлено, что: а) холодные воды содержат более RaEm, чем теплые и горячие; б) менее насыщенные солями В. более радиоактивны, поэтому химически безразличные В. содержат много RaEm; в) сернистые В. чаще содержат RaEm, чем В. друг, соединений; г) источники с малым притоком более радиоактивны, чем с большим. В виду малой изученности физиологии, действия радиоактивных В., а с другой стороны, в виду многих редких особенностей этих свойств, источники даже с минимальным содержа-нием RaEm часто считают уже радиоактивными. Норден предлагает классифицировать источники по содержанию RaEm так: 1) сильно радиоактивные, с содержанием 100 и более ME (единиц Махе); 2) умеренно радиоактивные—от 50 до 100 ME и 3) слабо радиоактивные—от 20 до 50 ME. При содержании ниже 20 ME источники уже не считаются радиоактивными. Наиболее известные радиоактивные источники: 1) Брам-бах—содержит до 2 270 ME, 2) Иоахимс-таль—содержит от 115 до 2 884, а в среднем—600 ME, и 3) теплосерные в Пятигорске—в отдельных пунктах до 560 ME, а в среднем 60 ME.
Число минеральных источников с самыми ценными качествами в лечебном отношении в СССР очень велико и по отдельным районам они исчисляются не десятками, а сотнями; например, в районе ского хребта зарегистрировано их до 400, в Уральской области—более 300.
Выделения минеральных источников как твердые, так и газообразные эксплоатиру-ются также и в промышленных целях. Твердые выделения минеральных источников весьма разнообразны по качеству и достигают громадных размеров. Гипсовый источник Лоренц выносит в год до 6 700 тонн твердых солей, Карлсбад—до 5 500 т, Нарзан— 25 тонн Твердые накопления источников образуют иногда целые горы, как, например, пятигорские известковые отложения (траверти-ны). Отложения соленых источников дают большие накопления NaCl; железные источники выделяют и накопляют железные руды в виде болотных и озерных; гейзеры дают колоссальные накопления кремнекислых отложений. Газообразные выделения минеральных В. также имеют практическое применение: свободная углекислота больших источников идет для газирования разных минеральных В. Кроме того, угольная кислота, сжиженная под большим давлением, вывозится также для разных целей в особых баллонах. Наконец, многие ценные в лечебном отношении минеральные во ды, кроме применения на месте, экспортируются после искусственного газирования.
В СССР как минеральные источники, так и местности, где эти источники находятся, если НКЗдрав признает их имеющими общегосударственное значение, ограждаются от порчи и истощения, для чего устанавливаются округа горной охраны. Границы горной охраны намечаются после геологических исследований и устанавливаются законодательным порядком. Принято устанавливать три зоны охраны: горной, санитарной и охраны лесов. В округах охраны проводится целый ряд закрепительных мероприятий.
Таблица 10 содержит некоторые данные для оценки значения минеральных В. в СССР.
Таблица 10. —Количество отпущенных лечебных процедур на курортах СССР.
| Годы | Общее число отпущ. процедур | Из них—грязевых ванн |
| 1921.. | 1 641 619 | 183 438 |
| 1922 .. | 1 021 370 | 257 600 |
| 1923 .. | 1 984 208 | 308 272 |
| 1924 .. | 2 643 315 | 430195 |
| 1925 .. | 4 266 523 | 520 827 |
| Итого. | 11 557 035 | 1 700 332 |
Не менее показательны в этом отношении цифры экспорта ских минеральн. В.
Разлив и вывоз ских минеральных В. в бутылках возник еще с 80-х гг., и в 1899 г. было отправлено 700 000 бутылок. Но быстрый рост экспорта начался с 1900 г., когда была перестроена разливная в Кисловодске согласно требованиям техники того времени: был устроен завод жидкой С02 из естественного газа источника «Нарзан», и все минеральные В. газировались ею. Развитие экспорта характеризуется табл. 11,
Таблица И.—Э к с п о р т ских минеральных вод.
| Годы | Продано | Валов. | |
| в бутылках | доход
(рублей) |
(рублей) | |
| 1909. | 7 959 257 | 776 353 | 241 173 |
| 1910. | 12 103 173 | 1 209 056 | 378779 |
| 1911. | 14 845 721 | 1 481 861 | 435 350 |
| 1912. | 16 169 297 | 1 652 491 | 447 741 |
| 1913. | 17 779 835 | 1 817 531 | 554 900 |
| 1922 (лет. сезон) * | 1 240 000 | — | — |
| 1922/3. | 2 998 000 | — | — |
| 1923/4. | 5 066 000 | — | — |
| 1924/5. | 12 456 000 | — | — |
| 1925/6. | 17 863 000 | — | — |
| 1926/7. | 22 000 000 | - | - |
| * В революционное время раздив и продажа прекратились; и только в 1922 году они были снова | |||
| организованы. | |||
из которой видно, что экспорт ских минеральных В. уже в 1925/26 годах достиг довоенного размера и продолжает быстро возрастать. На 1927/28 г. было намечено к продаже 27 000 000 бут. Среди экспортируемых вод собственно лечебные составляли в дореволюционное время 12%, а в настоящее время до 35%; остальное количество приходится на № 20 и Нарзан. Считая на каждого пользующегося экспортной минеральной водой 30 бут., можно принять, что в 1927 г. более 700 000 чел. могли пользоваться натуральной лечебной В.
Б. Искусственные минеральные В. Кроме естественных минеральных В., население, особенно в южных жарких местах, потребляет в значит, количествах искусственные минеральные В.: лечебные воды, шипучие напитки, фруктовые воды, лимонады, квасы и прочие Мысль приготовлять искусственные минеральные воды, в подражание натуральным, появилась у разных химиков еще в 16 в., но только в начале 19 в., благодаря целому ряду строго научных анализов натуральных вод (Фрезениус, Либих, Берцелиус и др.), приготовление искусственных минеральных В. значительно усовершенствовалось. В 1821 году химик Ф. Струве приготовил карлсбадскую воду, которую Фарадей не мог отличить от натуральной. Искусств, минеральные В. по своему составу более или менее подходят к В. тех естественных минеральных источников, названия которых они носят. При фабрикации газовых В. главными факторами являются СО г и вода. Степень растворимости С02 в В. зависит от £° и давления. При обычных условиях, то есть при t°, равной 19°, и 760 миллиметров давления, один объём воды растворяет равный себе объём С02, а при более низкой t° и большем давлении В. может растворить гораздо больше газа. Этим и пользуются для приготовления шипучих напитков: С02поглощается водой под усиленным давлением, и в этом виде В. сохраняется в плотно закупоренных бутылках. Для приготовления шипучих, а главное—минеральных вод следует брать стерилизованную воду, но так как стерилизация обходится дорого и требует много времени, то для приготовления шипучих В. обыкновенно употребляют лишь фильтрованную В., но при этом, конечно, должен быть производима и бактериологии. очистка для удаления микроорганизмов. Образцовое приготовление искусственных минеральных В., а равно и шипучих напитков, слагается из нескольких операций, но в общем все производство представляет одну непрерывную цепь таких аппаратов (фигура 1): 1) производитель или выделитель А, где готовится СО г из разных материалов (мрамор, известняк, доломит, мел, магнезит); 2) про-мывательД, через который пропускают С02для освобождения ее от примесей органических веществ, H2S, сернистой кислоты и окиси азота [про-мывателей должен быть не менее трех, но еще лучше иметь их шесть, заполненных: а) водой для охлаждения и очистки, б) 5%-ным раствором соды NaHC03для нейтрализации случайной кислоты, в) 5 %-ным раствором железного купороса PeSO, для удержания H2S, г) 1 %-ным раствором марганцевокислого калия КМп04, д) углем для удержания органических примесей и е) дистиллированной
В. для промывки]; 3) приемник, или газометр D, куда СО а переходит после очищения; 4) сатуратор С, к-рый служит для насыщения В. углекислотой под давлением более 6 Atm и потому должен быть снабжен предохранительным клапаном. Насыщенная в сатураторе минеральная или шипучая В. переходит по оловянным трубкам в разливочные станки К. Кроме того при аппаратах имеется насос Е для накачивания в цилиндры воды, пропускаемой иногда через угольный
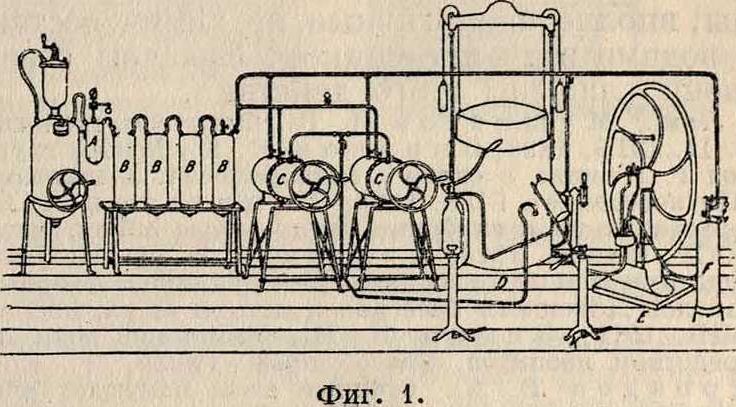
цилиндр F. Кроме описанного аппарата (Струве), существуют и другие конструкции, иапр. Германа Лашапеля с нагнетательным насосом или система Карбонатик, в которой насыщаемая В. превращается в пыль, причем из нее сначала выделяется воздух, а затем она насыщается углекислотой.
Из искусственных минеральных В. наибольшее распространение имеют сельтерская и содовая. Химич. состав этих вод непостоянен, что видно из анализов В. московских заводов (табл. 12). Из анализов видно, что сельтерская В. по составу солей крепче содовых. Но отсутствие определенных норм для состава искусственных минеральных В. отражается на качестве изготовляемых В. Разновременно проведенные в Москве, Петербурге и Одессе санитарные осмотры заведений искусственных минеральных-и шипучих В. обнаружили очень много недочетов как в способах приготовления, так и в качестве материалов. Причины недоброкачественности этих напитков, в особенности на небольших предприятиях, бывают следующие: 1) неудовлетворительность аппаратов для приготовления С02, обусловливающая примесь к последней атмосферного воздуха и понижающая вкусовые свойства; 2) плохое содержание и редкая очистка фильтров; 3) недоброкачественность материалов для получения С02; 4) грязное содержание промывных приборов и употребление недистиллированной воды, применение нелуженых
Таблица 12,—Анализы шипучих вод московских з-дов (в г на 1 л воды).
| Содовая | Сельтерская | |||||
| Составные части | среди. | макс. | мин. | среди. | макс. | МИН. |
| Сухой прокалзпный остаток. | 2,773 | 4,083 | 1 ,515 | 3,622 | 4,472 | 2,473 |
| Известь. | 0.0908 | 0.2752 | 0.0140 | 0,1490 | 0,4165 | 0,0524 |
| 0,0437 | 0.1653 | Следы | 0,0663 | 0,2362 | 0.0175 | |
| Серная кислота. | 0.0327 | 0,2274 | 0,0050 | 0,0709 | 0,2404 | 0,0040 |
| Хлор.. | 0.8071 | 1,0155 | 0,3330 | 1,2645 | 1,4253 | 0.8700 |
| Натрий. | 1,4107 | 2,06S0 | 0,7369 | 1,7235 | 2,2410 | 1,0606 |
| Кислород на окисл. органич. веществ. | 0,0024 | 0.0048 | 0,0009 | 0,0027 | 0.0)44 | 0,0016 |
| Углекислота. | 0,5795 | 1,0450 | 0,2340 | 0,4933 | 0,8530 | 0,2067 |
газометров и сатураторов; 5) недостаточная промывка бутылок, сифонов и прочие.
Вообще говоря, искусственные лечебные В. не могут заменить собою естественных, т. к. сложные составы последних нет возможности воспроизводить искусственно. Не раз случалось, что с успехами науки действие многих минеральных В. получает новое освещение и новое применение. Наир., до открытия радиоактивности могучее действие теплосерных источников (Пятигорск) не имело объяснения, искусственные же воды, вполне аналогичные по химич. составу с водами этих источников, были бы совершенно лишены этого действия.
Лит.: Мушкетов И. В., Физическ. геология, ч. II, СПБ, 1888; О п и о к о в Е. В., Режим грунт, вод г. Нежина в связи с метеорология, элементами, «Почвоведение», СПБ, 1900; С ем и хат о в А. Н., Артезианские и глубокие грунт, воды европ. части СССР, Москва, 1925; Аверкиев Н. Д., Питьевая вода в местностях расположения рудников, фабрик и заводов Донецкого бассейна и методы ее улучшения, СПБ, 1911; Зимин Η. Н., Умягчение воды посредством цеолитов. Способ проф. Ганса, М., 1911; Дроздов В. А., Сточные воды мануфактурпои промышленности и их очистка, «Вестник инженеров», П., 1915; Бертенсон Л., Лечебные воды, грязи и морские купанья в России и за границей, СПБ, 1901; II о л я к о в Р. И., Каковы наши искусствен, минеральные шипучие воды и сиропы, Одесса, 1900; Sliclater С. S., The Motions oi Underground Waters, U. S. Geolog. Survey, Water Supply and Irrigation, Paper 67, Wsh., 1902; Thiem G., Hydrolo-gische Metlioden, Leipzig, 1906; Krebs W., Grund-wasserbeobachtungen im Unterelbischen Geblete, Berlin, 1892; Frank L., Beziehungen zwischen Regen-fall und Quellenergiebigkeit usw., «Mitteil. d. Geolog. Gesellschaft zu Miinchen», Milnchen, 1911. В. Сергее?.
V. Очищение воды.
А. Питьевая вода. Для очищения питьевой личными реактивами (хлором, хлорной известью, перекисью водорода и прочие), ультрафиолетовыми лучами или озоном.
1) Отстаивание—см. Водоснабжение.
2) Фильтрование питьевой В. Различают медленное (английское) и быстрое (американское).
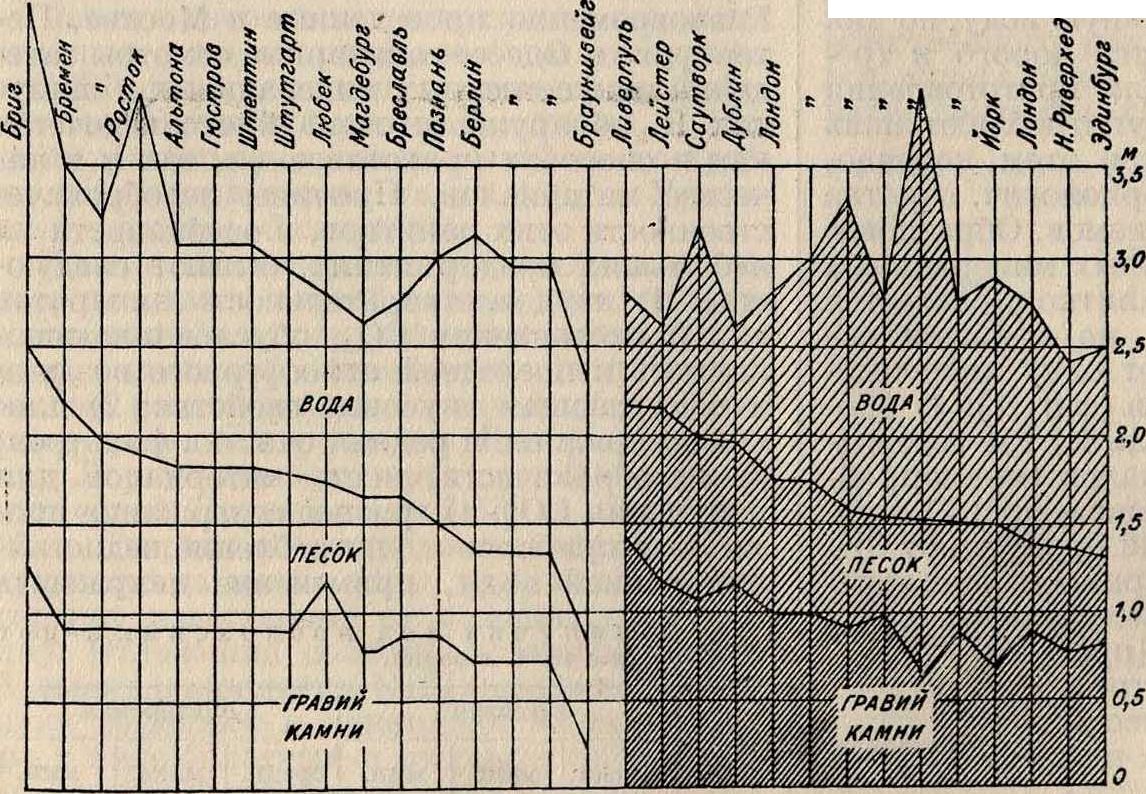
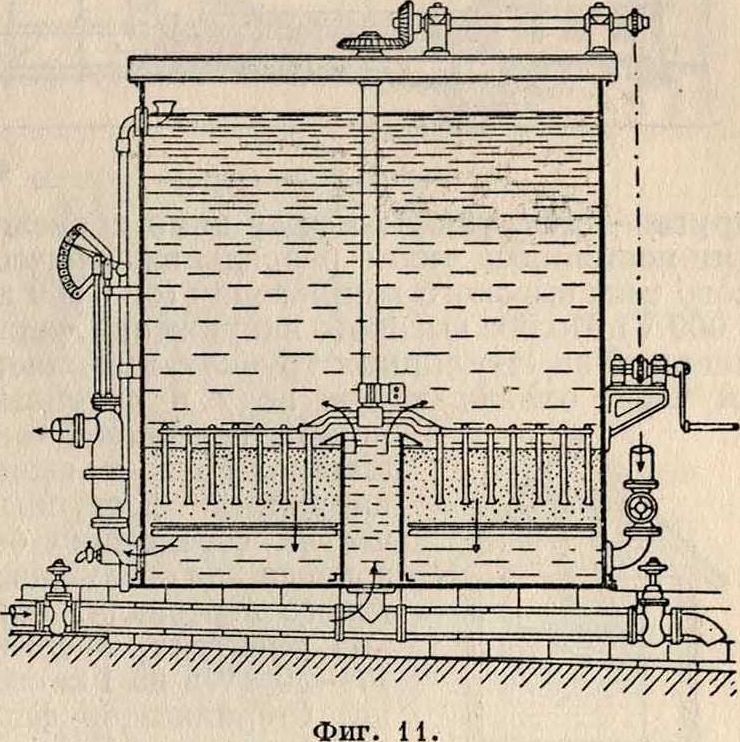
Английское медленное фильтрование. Более крупные установки англ, песочных фильтров имеют отстойные бассейны, рассчитанные на 12—24-часовое пребывание в них осветляемой воды. Сущность процесса фильтрования заключается в том, что сырая В. после той или иной ее подготовки пропускается через промытый речной песок, состоящий из крупинок, размеры которых постепенно увеличиваются сверху вниз. На фигуре 2 приведены высоты напора и мощности слоев фильтрующего песка, кварца и подпорного камня, применяемые в водоснабжеииях различных городов. Фильтр удерживает не только механические примеси, но и до 99% всех содержащихся в сырой воде бактерий; из воды удаляется при фильтровании также часть растворенных органических веществ.После правильно поставленного фильтрования получается прозрачная вода, и если она имела какую-либо окраску, то нередко теряет ее и обесцвечивается. Как показали опыты Пифке, этими ценными свойствами фильтр обязан в значительной мере бактериям и другим низшим животным и растительным организмам, содержащимся как в сырой воде, так и в особенности в илистой пленке, образующейся на поверхности фильтрую
В. применяются следующие способы: 1) отстаивание в специальных отстойных бассейнах, играющих также роль сборников воды,
Фигура 2.
2) фильтрование с предварительным отстаиванием или с предварительным коагулированием и отстаиванием и 3) обезжелезива-ние воды; последнее производится в случа,-ях заметного содержания железа в питьевой воде. Кроме того в целях полной дезинфекции В. нередко подвергается обработке раз щего песка, а также в иле самого песчаного слоя. Эти бактерии и низшие организмы играют существенную роль в процессах окисления органических веществ и вообще в химических реакциях, которые сопровождают фильтрацию В. и сводятся в своей основе преимущественно к процессам брожения. Работа фильтра ухудшается от размножения водорослей (альг), многочисленные виды которых (до 160) обнаружены в иле фильтров. Т. н. зеленые водоросли, сообщающие воде неприятный рыбный запах, удаляются из воды прибавлением очень слабого раствора (1 : 4 000 000) сернокислой меди. Из других видов водорослей особенно быстро закупоривают фильтр диатомовые, или кремневые водоросли, образующие плотную пленку. Противодействием против них служат: обильный свет, энергичная жизнедеятельность низших организмов и обильное выделение кислорода. Песочные фильтры работают главн. обр. своей поверхностью, где. образуемая фильтрую-ща.я пленка служит местопребыванием для полезных бактерий и других микроорганизмов. Раньше ей придавали исключительное значение при фильтровании воды, однако позднее признали, что действие фильтрующей пленки не имеет столь решающего значения. На фигуре 3 схематически открыт, фильтрах; кроме того, их устройство обходится значительно дороже. Различают мнимую и действительную скорость фильтрования. Первая представляет отношение часовой производительности фильтра (в м3) Q к площади поперечного сечения фильтра
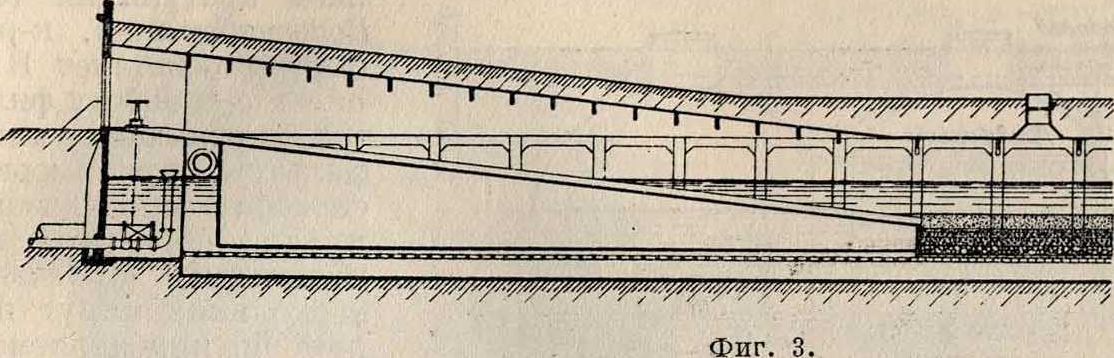
изображен англ, песочный фильтр. Песочные фильтры имеют обыкновенно форму прямоугольника, ограниченного кирпичными или каменными стенками и наполненного гравием или песком (фигура 4). В нижней части фильтра находится несколько слоев гравия: нижний слой—размером ореха (30—60 миллиметров), следующие—размером боба (20—30 миллиметров), гороха (10—20 миллиметров) и т. д., уменьшаясь под конец до размера крупы (3 — 5 миллиметров). Над слоем гравия находится слой песка, а над последним— определенный слой фильтруемой воды, необходимый для создания гидравлического напора. Слои гравия и песка могут иметь различные высоты. Средняя мощность слоев водяного столба, песка и гравия— 600 миллиметров каждый. Профильтрованная вода спускается вниз и собирается в бассейне для чистой воды.
Городские водопроводы снабжены обыкновенно многими подобными фильтрами. По Газену, наивыгоднейшая площадь одного отделения фильтра прямоугольной формы: 2100 — 2 400 ж2 для закрытых и 3 300— 4 250 м2 для открытых фильтров, а по Кенигу, в среднем, 2 000—3 000 ж2. Устройство английских фильтров должно позволять самостоятельное наполнение, опорожнение и чистку каждого отделения. Для правильной работы фильтра необходим песок однородный по размерам и форме.
С увеличением размеров зерен и песка скорость фильтрования воды увеличивается, но грубый песок не дает прозрачной воды, свободной от зародышей, а при более мелком песке быстрее образуется фильтрующая пленка. Боковые стенки англ, фильтров снабжены вытяжными трубопроводами для отвода воздуха, накопление которого могло быразорватьфильтрующуюплен-ку. Англ, фильтры бывают двух типов: от-крытые.и закрытые; последние не замерзают зимой, но в них фильтрующая пленка образуется медленнее и менее совершенно, чем в
(в ж2) F над поверхностью фильтрующего песка: г>=~. Т. к. площадь пор, образуемых фильтрующим песком, составляет примерно около одной трети поперечника фильтра, то действительная скорость фильтрования соответственно больше мнимой скорости (пределы последней 50—100 миллиметров/ч). Работа фильтра признается удовлетворительной, если в 1 ж3 профильтрованной В. содержится не больше 100 бактерий.
Очистка и промывка фильтров производится периодически. Применяемые для этого аппараты основаны на принципе бесконечного винта или эжектора. После промывки фильтр работает не совсем удовлетворительно до восстановления разрушенной при промывке пленки и достаточного заиливания фильтрующего песка. Для восстановления надежной работы фильтра (для его созревания) требуется продолжительное время.
Недостатки англ, фильтров следующие: громоздкость и дороговизна зданий для фильтров, огромный расход песка, большие потери его (равно как и промывных вод) при чистках и промывках и трудность самих чисток. Кроме того, существенным недостатком является ненадежность работы, особенно в половодье, когда сырая вода сильно загрязнена илом и бактериями; эти примеси либо прямо проходят через фильтр, либо остаются в фильтре и затем постепенно извлекаются оттуда водой. При мутной или жесткой воде англйск. фильтры также дают неудовлетворительные результаты. Созревание фильтра часто связано с большими потерями времени и большим расходом воды.
Англ, система получила в последние десятилетия значительное усовершенствование. Так, вместо естественного отстаивания В. в

Фигура 4.

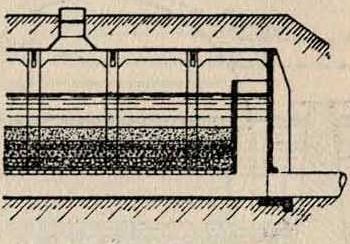
кратному фильтрованию, при котором прежде всего, с применением коагуляции (смотрите || Водоснабжение), которая : быстро осветляет В. и
: облегчает работу филь тра. В отличие от англ. |L· фильтров, при америк. способе фильтрующая ip пленка образуется ис-щ кусственно в течение Щ, нескольких минут при
Рр помощи прибавляемого к очищаемой > воде реактива. Отличительные особенности американ-з: 1) скорость фильтрации (4—5 м/ч), 2) малая фильтрующая поверхность (в 40—50 раз меньше, чем в обыкновенных английских фильтрах), 3) легкая очистка всего фильтрующего материала в самом фильтре при помощи механич. мешалки или сжатого воздуха и 4) применение коагулянта. Условиями правильной работы америк. фильтров являются: правильная дозировка коагулянта и надлежащие конструкция и размеры отстойного резервуара и фильтра. Фильтрующий материал—по преимуществу дробленный кварц. Толщина фильтрующего слоя не менее 30 см. Фильтр снабжен манометром, поддам? фильтр называющим гидравлич. напор слоя В. над пес-
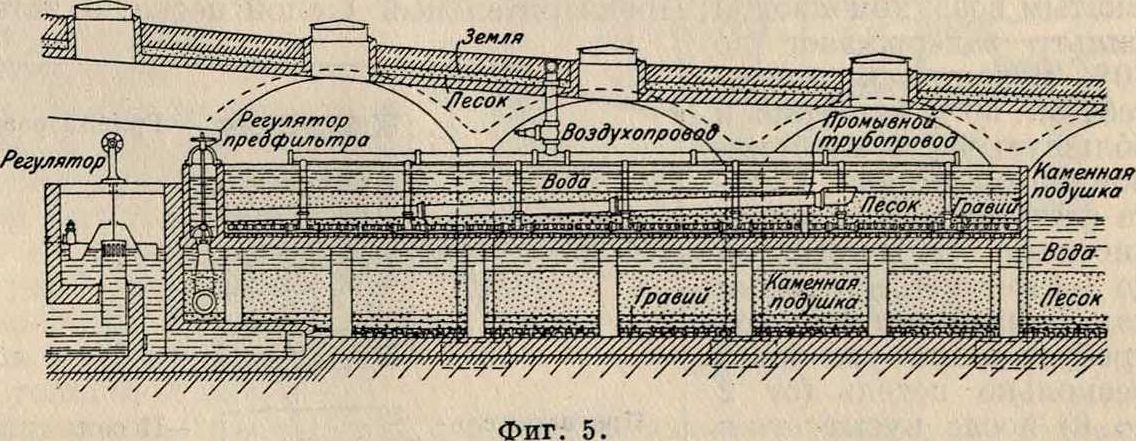
Предфильтр
Песок. стало возможно значительно увеличить еко-рость фильтрования. Принцип многократн. фильтрования, предложенный Гальбертсма, был вскоре видоизменен в способ д в о и н о-г о фильтрования, которое получило быстрое распространение в Европе и даже
Предварительный фильтр
- Резервуар -для очищенной ". i воды i I
Гравий размер, зерна 15—20 миллиметров.
10—15 »
Предварительный фильтр Пюша
Предварительный фильтр
—Песок »
—Гравий »
.Полые камни
Главный фильтр
Песок размер, зерна Песок » »
^Гравий » »
Гравий » »
полые камни
| μ | |
| ДОИ | |
| дои | |
| ^ ^ μ» | μ. ^ μ. | |
| воздухопровод | —t ff | |||||
| ·— | —ШУШУШУЖг | |||||
осветлительных бассейнах стали прибегать к предварительному искусственному осветлению сырой В. путем обработки ее коагулянтом (смотрите Водоснабжение). Существенным успехом явился также переход к много-
Английские фильтры, снабженные предварительными фильтрами и применяющие (в паводки) коагулирование, установлены на московской рублевской водокачке.
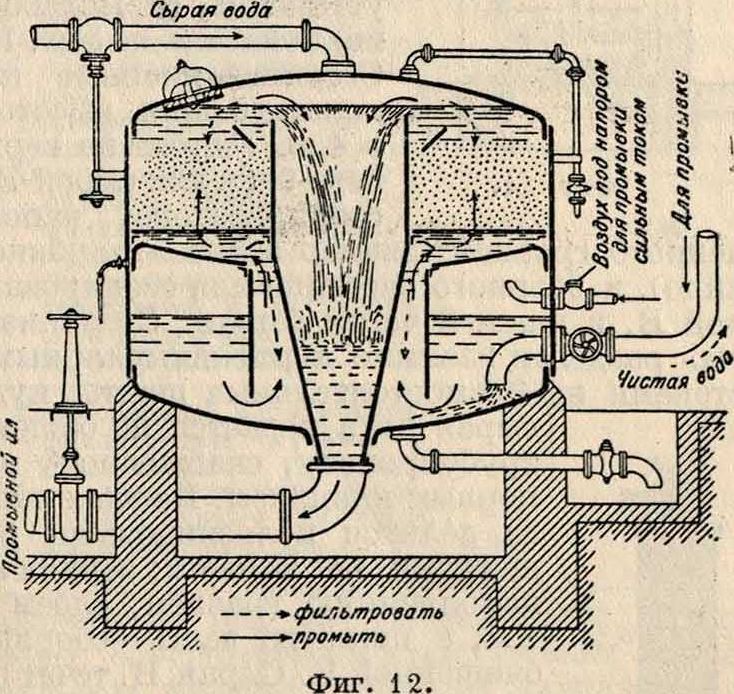
Америк, быстрое фильтров а-
дренажных трубок Е—в сборную трубу G и отсюда через особый регулятор—в резервуар для очищенной воды. На фигуре 10 показана деталь дренажных трубок. Другие системы быстрых фильтров изображены: на фигуре 11—фильтр Бреда, на фигуре 12—фильтр
Фигура 9.
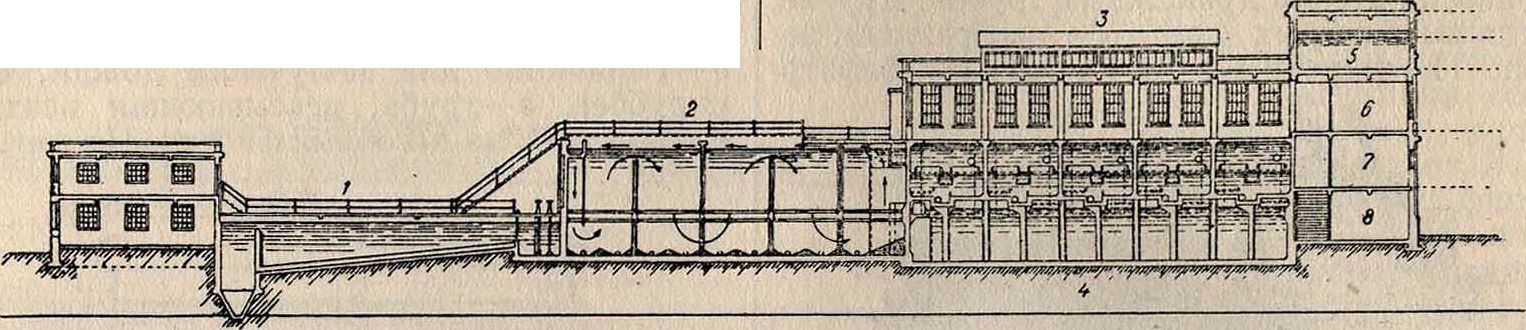
Рейзерта. На фигуре 13 представлен быстродействующий фильтр Сандфильда, близ Лондона, который состоит из 10 фильтров с общей фильтрующей поверхностью в 300 м2; емкость отстойника—1 600 л3 на 2,5 часа отстоя; резервуар чистой воды — 950 л3; скорость фильтрации 2,5 м/ч. На фигуре показаны: 1—отстойник, 2— резервуар для коагулирования и отстойник, 3—здание фильтра, 4— резервуар для чистой воды, 5—бак с водой для промывки фильтра, 6— лаборатория, 7 — помещение хлораторов, 8 — помещение для хранения хлора.
3) Обезжелезивание В. Искусственное удаление железа из В. в крупных водокачках производится обыкновенно при содержании железа более 2 лз на л. О процессе выделения железа из воды дает представление следующее химическое уравнение:
4 Fe(HCO„),+2 Н,0 + 0г=4 Fe(OH),+ 8 СО-.* Бунте и Шмит предложили следующие ф-лы осаждения железа:
6 FeCOj+З Η,Ο+3 0=Fe,(OH),+2 Fe,(CO,)„
2 Fe,(CO,),+e НгО=2 Fet(OH),+6 СО,.
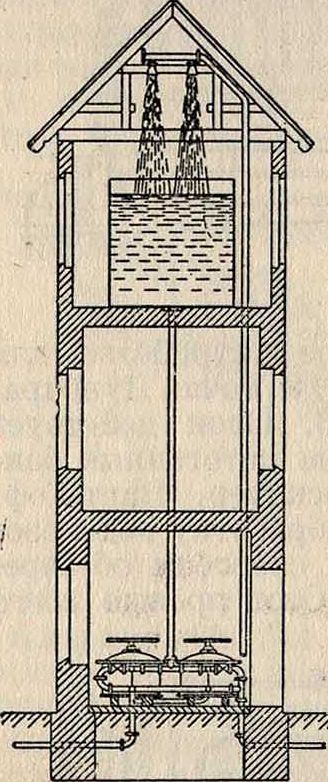
Большинство применяемых способов обез-железивания воды основано на аэрации воды с последующим ее фильтрованием. На фигуре 14 показана установка системы Эстепа в Фрейенвальде: В. падает с высоты 2л в виде мелкого дождя из 18 душей на зеркало В. фильтра; при этом она приходит в тесное соприкосновение с воздухом и затем фильтруется через слой гравия, толщиной 30 см, лежащий на перфорированных пластинах, покрытых латунной сетчатой тканью и покоящихся на свободно лежащих бетонных балках. Фильтр промывается обратным током воды и при этом механически разрыхляется граблями. Часовая производительность фильтра—1 л3 В. на 1 л2 поверхности фильтра. Другой известный конструктор
* В этой формуле и в дальнейшем тексте соединения, выпадающие в виде осадка, подчеркнуты сплошной линией (нерастворимые осадки) или пунктирной (частично растворимые).
Т. Э. т. III.
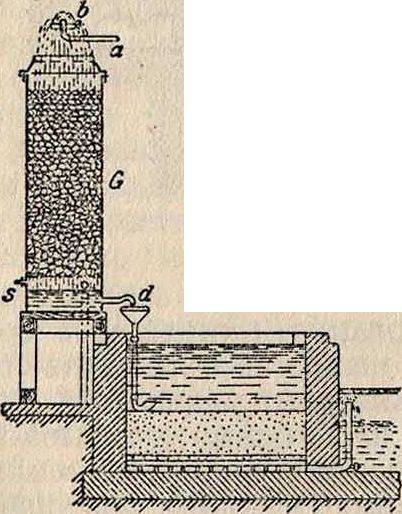
Пифке скомбинировал устройство для получения дождя с градирней, или воздушной камерой, наполненной кулачным коксом (фигура 15), особенно хорошо способствующим перемешиванию воды с воздухом; здесь: а, b—устройство для получения дождя, G— скруббер, s—труба, всасывающая воздух, d—выход В. на песочный фильтр. На фигуре 16
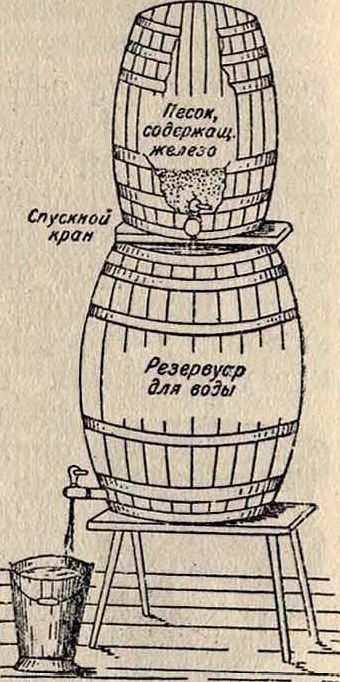
показано весьма простое устройство для обезжелезивания воды, т. н. бочка Дунбара.
Озонирование В. Озон действует разрушающим образом на патогенные бактерии. Ольмюллер, Проскауер, Вант-Гоф, Шрейбер и др. считают обработку воды озоном наиболее надежным способом обезвреживания питьевой воды. Озон прежде всего
реагирует окисляющим образом на содержащиеся в воде неорганич. окисляемые соединения и органич. вещества и лишь после того действует на бактерии, уничтожая их. Это обстоятельство необходимо учитывать при выборе источника для водоснабжения и обработки В. озоном. Осадки и взвешенные вещества должен быть удалены из В. быстрым фильтрованием до озонирования, тем более, что заключенные в твердых частицах бактерии менее доступны для воздействия озона. В Германии первые опыты озонирования
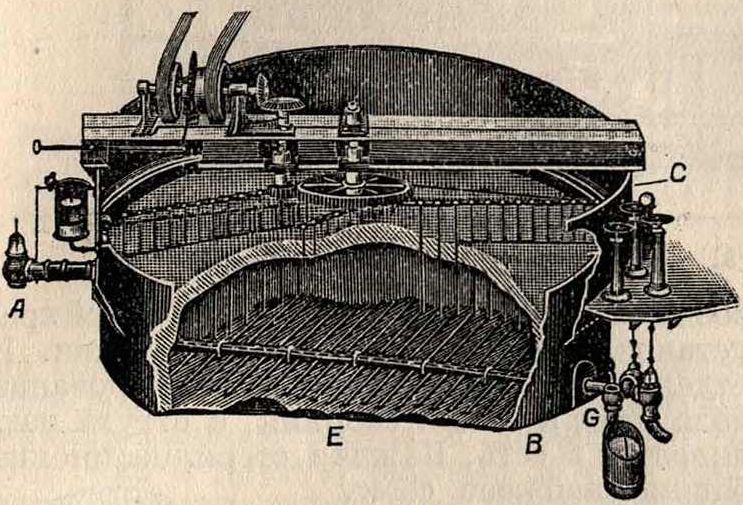
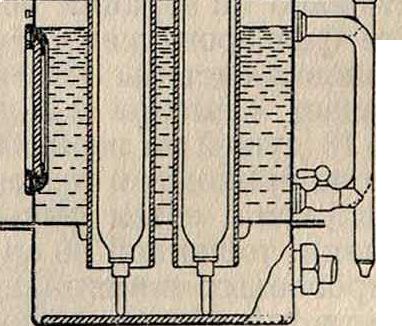
27
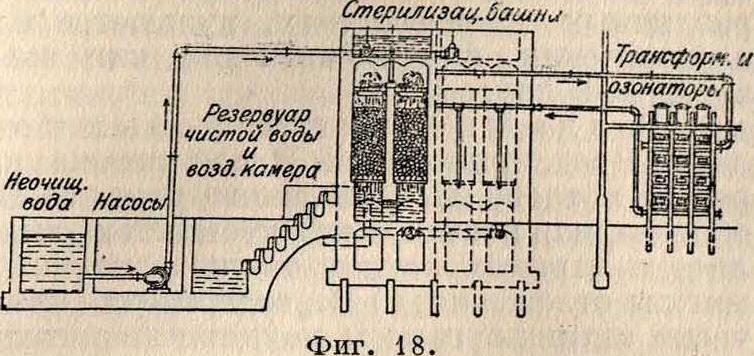
воды были произведены фирмой Сименс и Гальске. Сконструированный ей озонатор показан на фигуре 17. Проникающий в нижнюю часть аппарата воздух проходит через трубки, из которых одна—алюминиевая, а озона. Озонированный воздух движется по замкнутому кругу через озонаторы и стерилизаторы. Израсходованный кислород
Фигура 13.
другая—стеклянная; между ними происходят постоянные тихие разряды электрического тока высокого напряжения (от 6 000 до 8 000 V). Полюс высокого напряжения, укрепленный на стеклянных трубках, заземляется через охлаждающую воду и чугунный ящик, вследствие чего аппарат во всех своих наружных доступных частях совершенно безопасен для обслуживающего персонала. Расход электрич. энергии 17—20 kWh на 1 килограмм озона. Стерилизатор фирмы Сименс и Гальске представляет собой градирню или скрубберную башню, наполненную слоем камня, через который текут навстречу друг другу В. (сверху) и озонированный воздух (снизу). Такая установка (в Падебор-не) показана на фигуре 18. Стерилизационные каменные башни, высотою в 4 м, состоят из верхнего бака для сырой В., стерилизатора, наполненного гравием (размер зерна—гблубиное яйцо), и сборного бассейна для озонированной В. в нижней части башни. Стерилизатор разделен взаимно перпендикулярными стенами на 4 самостоятельных шахты, куда сырая вода подается по общему трубопроводу, снабженному запорным клапаном. Каждая шахта делится колосниковыми решетками на 2 части: верхнюю, наполненную гравием, слоем в 1 м, и нижнюю часть—сборник очищенной В. Сырая В. течет по общей линии через четырехплечий распределитель в отдельные колонны или шахты, проходит через частые сита и затем, в виде мельчайшего дождя, падает на слой гравия. Через каждую шахту, поперечным сечением в 1 м3, пропускается в час 15—20 ж3 воды и 30—40 м3 озонированного воздуха с определенным содержанием
Фигура 14.
Фигура 15.
Фигура 16.
воздуха восполняется через воздушный кран, установленный на всасывающей линии. Из отдельных нижних камер озонированная вода течет в общий сборник, а оттуда накачивается в сеть. Каждая стерилизационная башня снабжена сбоку каскадами, где очищенная вода, подвергаясь аэрации, теряет последние следы озона. Стоимость очистки 1 ж3 В., включая и фильтрацию через быстрый фильтр, ок. 3 пф. Для домашнего употребления применяют небольшие аппараты, получающие разряды от осветительной сети. При употреблении эмульсаторов для смешивания воды с озоном (фигура 19) стерилизация происходит почти мгновенно. Озонирование В., при относительно невысоких эксплуатон-ных расходах, требует крупных первоначальных затрат на оборудование, в виду чего этот чрезвычайно ценный способ борьбы с патогенными бактериями применяется преимущественно на крупных водокачках.
Стерилизация В. ультрафиолетовыми лучами. Ультрафиолетовые
-г—. лучи быстро и на
V п, дежно стерилизуют ."‘jitaRfpfci Ον—7 только совершенно ---ш Ли ш—!== прозрачную и притом бесцветную В., не содержащую осадков и взвешен, веществ. Мутная вода должна быть осветлена, обесцвечена и освобождена от железа до воздействия ультрафиолетов, лучей. Другим условием успеха стерилизации является соприкосновение воды с лу-чеиспускающим прибором, мимо которого она должна циркулировать медленной и тонкой струей так, чтобы каждая молекула воды могла освещаться ультрафиолетовым светом в активной лучистой зоне не меньше 7 ск., по Шварцу, и ок. 1 мин., по Валле; для этого приемник должен быть надлежащей емкости. Сгери-
Фигура 17.
лизационный аппарат Westinghouse-Cooper-Hewitt С° показан на фигуре 20; ртутная лампа с кварцевой оболочкой и светящейся кварцевой трубкой хотя и не погружена в В.,
Вода
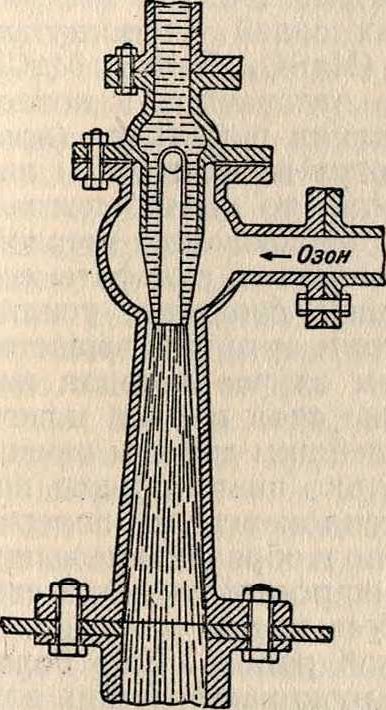
но находится на очень близком расстоянии от ее поверхности. Внутри цилиндрического эмалированного сосуда А помещаются вдетые одна в другую воронки В к С, благодаря которым сырая вода, поступающая в стерилизатор через Е, течет зигзагообразно по удлиненному пути, показанному стрелками, протекая повторно мимо самой лампы. Прибор строится на часовую производительность от 600 до 122 л В. В аппарате с про-изводительн.в 600 л лампа работает при 110 V и 3,5 А постоянного тока, что дает расход энергии 0,6 Wh на 1 л. Для озонирования 1 м3 воды расходуется от 60 до 100 Wh, в зависимости от загрязнения сырой В.; стерилизация же ультрафиолетовыми лучами требует от 100 до 300 и даже до 600 Wh. Поэтому последний способ пока применяется лишь в небольших установках, для домашних потребностей и тому подобное. установок, где расходы на очистку играют второстепенную роль.
Дезинфекция хлором $ и другими реактивами. Применениехлор-ной извести, предложенное Траубе в 90-х гг. прошлого в., нашло быстрое распространение в Америке. Но этот метод недостаточно надежен в смысле уничтожения болезнетворных бактерий, т. к. споры бактерий при хлорировании водой не погибают; бактерии, содержащиеся во взвешенных твердых частицах, также не уничтожаются при обработке воды хлорной известью. Кроме того, при хлорировании питьевая вода не становится прозрачнее; содержание осадков и взвешенных
Фигура 19.
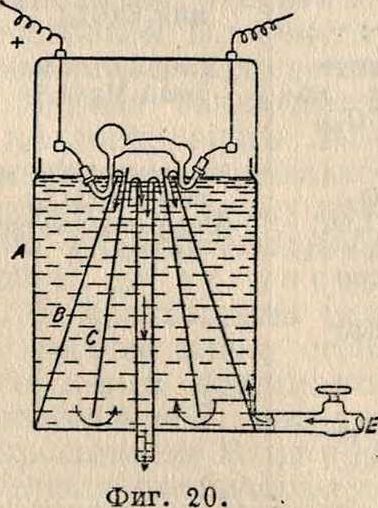
Таблица 13. — Стоимость очистки питьевой воды (в марках).
| Род установки | Стоим, всей установки, отнес, к 100 м“ су точи, производительности | Эксплоатац. расходы, отнес, к 100 м’ суточн. производительности |
| Медлен, фильтрование озерной воды через песок в г. Цюрихе без предварительного фильтра. | 2400 | 0,65 |
| Предварительн. фильтр для озерной воды в г. Цюрихе | 280 | 0,088 |
| Медленное фильтрование с предварительным фильтром в г. Цюрихе. | 2680 | 0,488 |
| Ступенчатый фильтр Пюш-Шабаля со скорым песочным фильтром, υ=10 м/ч. | 2000 | 0,55 |
| То же с медленным песочным фильтром, υ=3 м/ч. | 4 400 | 0,95 |
| Коагулирование с расходом коагулянта (сульфата алюминия) около 30 г на 1 λι3 воды; сюда же включе- | ||
| ны отстойники, общей емкостью равной 8-часовой производительности установки. К. | 350 | со са о |
| Предварительная очистка при помощи марганцево- | ||
| кислого калия (2 г на 1 мя): отстойники—на 2-часовую | ||
| производительность. | 80 | 0,206 |
| Американ, быстродействующий фильтр Джуела; коагулирование сульфатом алюминия—30 г на 1 λι3. | 1500 | 0,81 |
| Фильтр Миссонга в качестве предварительн. фильтра; простое фильтрование, v=2i м/ч. | 1667 | 0,91 |
| Обработка воды хлором без осветления и фильтрования .. | 0,01—0,03 | |
| Озонирование воды без осветления и фильтрования | 1500 | 0,60 |
| Озонирование воды с коагулирован. сульфатом алю- миния, фильтр Джуела. Стерилизация воды ультрафиолетовыми лучами без осветления и фильтрования; расход электрической энергии 370 Wh на 1 мг воды.. | 4000 | 1,48 |
| 800 | 0,51 | |
| Стерилизация воды ультрафиолетовыми лучами в комбинации с предварительным ступенчат, фильтром и скорым песочным фильтром, V =>Ю м/ч. | 3000 | 1,08 |
веществ в ней не уменьшается; окраска воды, обусловленная присутствием коллоидальных веществ, также не изменяется, и, наконец, не исчезают ни тухлый запах, ни неприятный вкус. Расход хлорной извести колеблется от 2 до 10 г (иногда и больше) на 1 м3 воды в зависимости от загрязнения последней. При предварительном осветлении В. коагулированием и фильтрованием расход хлорной извести значительно уменьшается, и действие реактива становится более надежным. Названный способ дезинфекции В. должен рассматриваться как временная мера, пригодная там, где отсутствуют более совершенные способы стерилизации и где последняя повелительно диктуется угрозой эпидемий тифа, холеры и других инфекционных заболеваний и отсутствием удовлетворительной питьевой В.
Из других реактивов, применяемых для дезинфекции питьевой В., следует упомянуть: четырехокись хлора С1204, бром, гипохлорит натрия, перекись водорода, перекись натрия, марганцевокислый калий. Они имеют при стерилизации питьевой В. лишь весьма ограниченное применение.
Стоимость очистки питьевой воды. По статистическ. данным Циглера, стоимость устройства 7 самых больших установок англ, фильтров, отнесенная к суточной производительности в 1 000 ж3 профильтрованной В., составляет 34 560 мар.; для 6 больших и 2 средних установок америк. фильтров·—12 800 мар. Эксплоатационные расходы, не считая процентов на затраченный капитал, составляют для америк. фильтров 4,26 мар., а для англ.—2,92 мар. Но если считать хотя бы 5 % на затраченный капитал (отнесенный к суточной производительности в 1 000 ж3), то картина получается совершенно иная, а именно в пользу скорых фильтров: суточная производительность в 1 000 ж3 в английских фильтрах обходится в 2,92+4,80=7,72 мар., тогда как в америк. фильтрах 4,26 + 1,77=6,03 марки. Т. о. в большинстве случаев скорые фильтры, хотя и требуют расходов на реактивы и обученный персонал, в конечном итоге обходятся дешевле медлен, фильтров. В иных случаях, наоборот, более дешевыми являются английские фильтры, комбинируемые с предварительным фильтрованием воды. В табл. 13 приведены сравнительные данные стоимости очистки и стерилизации воды в более или менее крупных установках.
Б. Вода в технике и промышленности. Технически чистую В. можно встретить только в редких случаях. Сюда относятся: дождет вая вода, поскольку ее удается собирать чистой; вода, которая берет начало в горных хребтах и протекает через трудно растворимые горные породы (гранит, гнейс и др.), и, наконец, родниковая, или ключевая, вода песчаных местностей. Подобного рода В. отличается б. ч. прозрачностью, малой жесткостью и малым плотным остатком. Состав В., вообще говоря, зависит от местных геологических условий. В меловых районах она всегда содержит более или менее значительные количества солей кальция и магния (накипеобра-зователи). Грунтовая В. низменностей имеет самый разнообразный состав в зависимости от почвенных, клима-тическ. и других усло вий, в числе которых близость населенных пунктов, наличие промышленных предприятий и тому подобное. играют значительную роль. Вещества, обыкновенно встречающиеся в В., приведены в таблице 14. Вода, применяемая в различных производствах, нуждается или в осветлении, или в умягчении, или же и в том и в другом.
1. В. для питания паровых котлов. Вред, приносимый В. для питания паровых котлов, м. б. двоякого рода: а) В., обладающая повышенной жесткостью, выделяет в паровых котлах твердую накипь и мягкие отложения; б) В., содержащая химически активные газы и неудовлетворительная по химическ. составу, может действовать на материал котла разъедающим образом, производя протравление его стенок и арматуры. Чаще всего неудовлетворительная В. причиняет вред в обоих отношениях.
Накипеобразующие соединения показаны в вертикальной графе II табл. 14. Однако, при известных обстоятельствах, и нек-рые из легко растворимых солей, упомянутых в графе III табл. 14 (MgS04, FeS04, MgCl2и другие), могут дать отложения в котле. Если бикарбонаты магния и кальция (временная жесткость) могут выделиться в паровом котле в виде ила, то некарбонатная жесткость приводит к образованию твердой накипи. Особенно силикаты и сульфаты сообщают накипи вредные свойства, усиливающиеся в присутствии органич. веществ. Получающаяся в этом случае твердая накипь уже при толщине слоя в 1 жж может вызвать, согласно новейшим данным немецкой практики, не только значительное понижение коэфф-та теплопередачи поверхности нагрева котла, но и образование выпу-чин в кипятильных и жаровых трубах и стенок цилиндрич. корпуса котла, в особенности при форсированной работе. Еще более вредное действие обнаруживают накипь или
Таблица 14. —Растворимые в воде вещества.
| I
Растворенные газы |
II
Трудно растворимые вещества |
III
Легко растворимые соли |
IV
Продукты местных загрязнений почвы и воды |
| со“ | Соли кальция, в виде двууглекислого кальция Са(НС08)г | Хлористый натрий NaCl
[Хлористый кальции Cad,] |
Аммиак ТШа
Азотистая кислота N*Oa |
| О, | Магнезия, в виде дву углекисл, магния Mg(HC03)2 | [Хлористый магний MgCl2] | Азотная кислота NaO* (в виде солей) |
| Ni и прочие. | Гипс CaS04[Силикаты SiOi, глинозем А12Оя] [Двууглекислое записное железо Fe(HCOs)2] [Двууглекислый марганец Мп(НСО,)2] | [Сернокислый магний MgS04] [Сернокислое железо FeS04] | Хлор (хлористый натрий)
Органические вещества Сероводород HtS и др. |
| Органические вещества и прочие. | |||
| Взятые в кв. скобки соединения обыкновенно встречаются в небольших количествах и не во всех пресных водах. Кроме хлористого натрия иногда встречаются в пресных водах сернокислый натрий Na*SOt п редко-двууглекислый натрий NaHCO,. | |||
мягкие отложения, пропитанные маслом или жирами. Присутствие масла в питательной В., хотя бы в незначительном количестве, абсолютно недопустимо. Масло должно быть удалено предварительным очищением воды.
К вредным газам, растворенным в В., относятся кислород и угольная к-та, которые отличаются сильными протравительными свойствами, в особенности когда оба газа присутствуют одновременно. Угольная к-та освобождается также в работающем паровом котле из бикарбонатов, причем из послед, образуются карбонаты,и, частью, из карбонатов, которые превращаются при этом в гидрат окиси соответствующего металла, например
Na2C03+H,0=2 NaOH+CO,.
Кроме газов, сильным разъедающим действием отличаются свободные минеральные кислоты (например свободная серная к-та, которая нередко встречается в шахтных В.), далее хлориды, особенно хлористый магний, сульфаты (сернокислый магний и серножелезные соли) и продукты местного загрязнения почвы — соли азотистой и азотной к-т, сероводород и сульфиды, органич. вещества (особенно гуминовые к-ты). Разъедающее действие средних солей (например хлоридов или нитратов магния, кальция и др.) вначале, при малом нарастании их концентрации в воде несколько даже ослабевает, но затем оно увеличивается и достигает максимального значения при так называемым критич. концентрации; перейдя последнюю, оно быстро падает, но не исчезает полностью. В этом отношении упомянутые соли отличаются от другой группы солей (уксус-нонатриевая соль, хроматы, хлораты и вообще соли кислородсодержащих к-т) или же от щелочных растворов (соды, едкого натра, фосфорнокислого натрия и тому подобное.). Протравляющее действие этой группы веществ также достигает максимального значения при критич. концентрации, но вслед за ней чрезвычайно быстро падает и совершенно прекращается при достижении т. н. предельной концентрации этих соединений. Поэтому они (особенно натровая щелочь) находят большое применение в качестве защитного средства против протравляющего действия вредных составных частей питательной воды.
В наиболее промышленных странах 3. Европы почти все котельные оборудованы водоочистительными установками. Различают два рода очистки питательной В.: очистку в самом паровом котле и очистку до ее поступления в котел. Первая заключается в применении либо коллоидального либо элекролитического способа; но она оказалась на практике нерациональной, и потому применение ее определенно не рекомендуется.
Очистка питательной В. до ее поступления в котел м. б. производима разными способами. На первом плане стоит химич. очищение, которым достигается как умягчение, так и осветление В.; попутно же происходит и обезвреживание В. от протравляющих свойств. Бикарбонаты кальция и магния, гипс, силикаты щелочноземельных металлов и вообще все соли, показанные в графе II и частью в III табл. 14, а также органич. вещества удаляются из В., полностью или б. ч., в процессе химич. водоочи-
щения. Реактивами для этого служат: едкая известь Са(ОН)2, едкий натр NaOH, углекислый натрий Na2C03, в редких случаях— углекислый или едкий барит, фосфорнокислый натрий и др., причем они применяются или порознь или в известных группировках, в зависимости от состава В. В табл. 15 приведены химич. реакции водоочищения.
Таблица 15.—X и м и ч е с к и е реакции в о до-очищения.
I. Содово-известковый способ; реактивы: едкая известь Са(ОН), и с о д a Na,СО,.
СО, + Са(ОН), =. СаСО, + Η,Ο (1)
44 74 100 18
Са(НСО,), + Са(ОН),=2 СаСО, + 2 Н,0 (2)
162 74 200 S6
I Mg(HCO,), + Са(ОН),=СаСО, + MgCO,+2 Η,Ο (3)
] 146 74 100 .84"" 36
I MgCO, + Ca(OI-I),=Mg(OH), + CaCO, (4)
81 74 " 58 100
MgSO, + Ca(OH),=Mg(OH), + CaSO, (5)
120 74 58 "lie
MgCl, + Ca(OH), - Mg(OH), + CaCl, (6)
94,9 74 68 110,9
CaSO. + Na,CO,^CaCO, + Na,SO. (7)
136 103 100 142
CaCl, Na,CO, *= CaCO, -f- 2 NaCl (8)
111 106 Поо 117
MgSO, + Na,CO, it MgCO, + Na.SO, (9)
120 106 .84 142
MgCl, + Na,CO, — MgCO, + 2 NaCl (10)
95 106 .84 117
MgCO, + Ca(OH),=CaCO, + Mg(OH), (11)
84 74 100 58
И. Реактивы: сода Na,СО, и едкий натр NaOH.
СО, + 2 NaOH=Na,СО, + Η,Ο (12)
44 80 106 18
Са(НСО,), + 2 NaOH - СаСО, + Na,СО, + 2 Η,Ο (13) 162 80 100 106 36
Mg(HCO,), + 2 NaOH=MgCO, + Na,СО, + 2 Η,Ο (14) 146 80 84 106 36
MgCO, + 2 NaOH=Mg(OII), + Na,СО, (15)
84 80 58 106
CaSO, + Na,CO, ^ CaCO, + Na,SO, (16)
136 106 100 142
MgSO, + Na,СО, MgCO, + Na,SO, (17)
120 106 84 142
CaCl, + Na,СО,=CaCO, + 2 NaCl (18)
111 106 100 117
MgCl, + Na,СО,=MgCO, + 2 NaCl (19)
95 106 84 117
MgCO, + 2 NaOH=Mg(OH). + Na,СО, (20)
84 80 58 106
MgCl, + 2 NaOH=Mg(OH), + 2 NaCl (21)
95 80 58 117
MgSO, + 2 NaOH =. Mg(OH), + Na,SO, (22)
120 80 58 142
III. Реактив: сода Na,СО,.
СО, + Na,СО, + Η,Ο=2 NaHCO, (23)
44 106 18 168
Са(НСО,), + Na,СО, ц“ СаСО, + 2 NaHCO, (24,
162 106 1 00 168
Mg(HCO.) + Na,СО, MgCO, + 2 NaHCO, (25)
146 106 84 168
CaSO, + Na,CO,^CaCO,+ Na,SO, (26)
136 106 100 142
CaCl, + Na,СО,=CaCO, + 2 NaCl (27)
111 106 100 117
MgSO, + Na,CO, MgCO, + Na,SO, (28)
120 106 84 142
MgCI, + Na2C08 - MgCO, + 2NaCl (29)
95 106 .84. 117
Реакции в паровом котле:
2 NaHCO,=Na2CO, 4-Н20 4-СО, (30)
168 106 18 44
Na,CO, + Η,Ο=2 NaOH + СО, (31)
106 18 80 44
MgCO, + 2 NaOH=Mg(OH), + Na.CO, (32)
84 80 58 106
Реакции при непрерывной продувке и отводе котловой воды в о д о-умягчитель:
Са(НСОа), + 2 NaOH=СаСО, + Na,CO, + 2 Н,0 (33)
162 80 100 106 36
Mg(HCO,)2 +1 NaOH=Mg(OH), + 2 Na,СО, + 2 Η,О (34) 146 160 58 212 36
IV. Реактивы: едкая известь Са(ОН), и едкий натр NaOH.
Са(НСО,)2 + Са(ОН),=2 СаСО, + 2 Н,0 (35)
162 74 200 36
Mg(HCO,)2 + Са(ОН),=MgCO, + СаСО, + 2Н,0 (36) 146 74 84 100 36
MgCO, + 2 NaOH=Mg(OH), + Na,СО, (37)
84 80 58 106
Образовавшаяся сода реагирует вышеуказанным образом с солями небикарбонатной жесткости.
V. Реактивы: соли бария ВаСО„ ВаС1„ Ва(ОН)2 и алюминат бария ВаА1,0,.
CaSO, + ВаСО,=BaSO, + СаСО, (38)
136 196 232 100
MgSO, + ВаСО, + Са(ОН), -120 196 74
= Mg(OH), + СаСО, + BaSOi (39)
58 100 232
CaSO, + BaCl,=BaSO, + CaCl, (40)
136 206,9 232 110,9
CaSO, + Ba(OH),=BaSO, + Ca(OII), (41)
136 170 232 74
Ca(HCO,), + Ba(OH),=СаСО, + BaCO, + 2 H,0 (42) 162 170 100 190 36
MgSO, 4- Ba(OII),=Mg(OH), + BaSO, (43)
120 170 58 232
CaSO, 4- BaAl,0,=BaSO, 4- CaAI.O, (44)
Алюминат кальция, с водой дает Са(ОН),
CaSO, 4- Са(НСОз), 4- ВаА],0, 4- 2Н,0 =
= BaSO, 4- 2 СаСО, 4- 2: А1(ОЫ), (45)
VI. Способ иартрицидны й»; реактив:
фосфорнонатр. соль Na,PO, или Na.HPO,. CaSO, 4- Na,HPO,=СаНРО, 4- Na,SO, (46)
Са(НСО,),4-2 СаНРО,=Ca,(PQ,),4-2 СО,4- 2 Н,0 (47) Са(НСОз), 4- Na,HPO,=СаНРО, 4- 2 NaHCO, (48)
Образовавшаяся сода реагирует, как указано выше, с солями небикарбонатной жесткости.
Соли магния реагируют с Na,HPO, подобно солям кальция.
3 Fe(HCO,), 4- 2 Na,HPO, =
= Ге,(РО,), 4- 4 NaHCO,4-2 00, 4- 2 Η,О (49)
VII. Пермутитовый способ в о д о-
умягчения.
P-Na, 4- Са(НСО,)д=Р-Са 4- 2 NaHCO, (50)
162 168
P-Na, 4- Mg(HCOa),=P-Mg 4- 2 NaHCO, (51)
146 168
P-Na, 4- CaSO,=P-Ca 4- Na2SO, (52)
136 142
P-Na, 4- MgSO,=P-Mg 4- Na,SO, (53)
120 142
P-Na. 4- CaCl, - P-Ca 4- 2 NaCI (54)
111 117
P-Na, 4- MgCI, - P-Mg 4- 2 NaCI (55)
95 117
В ур-иях, выражающих эти реакции, числа, поставленные под химич. формулами, означают соответственные молекулярные веса или кратные их. Чтобы получить возможно больше нерастворимых осадков, то есть чтобы возможно полнее удалить накипе-образователи из исправляемой воды, нужно прибавлять реактивы с некоторым избытком против теоретических количеств, приведенных в таблице. Это нужно иметь в виду при определении расходов реактивов. Из таблицы видно, что все соли кальция, в результате реакции водоочищения, переводятся в нерастворимые соли кальция, дающие осадок; в растворе остается его 12—20 до 36 мг в 1 л, в зависимости от избытка реактива и от ί°, при которой происходит умягчение В. Магнезиальные соли должен быть превращены в гидрат окиси магния Mg(OH)2, чтобы выделиться из воды в виде нерастворимого осадка. При правильной постановке водоочищения следует стремиться, чтобы в растворе оставалось от 4 до 10 и не свыше 12 мг гидрата окиси магния в 1 л очищенной В. При выборе растворов необходимо учитывать состав очищаемой В. Если в последней содержится гипс CaS04, то необходимо применить соду или барит. Углебариевая соль еще более пригодна, чем сода, т. к. она, согласно ур-ию (38), полностью удаляет гипс, тогда как при воздействии соды в В. образуется растворимая сернонатриевая соль, поступающая в паровой котел. Барит является также превосходным реактивом при удалении из воды сернокислого магния, как видно из ур-ий (39) и (43) [ср. с уравнениями (5), (9) и (22)]. Согласно ур-ию (39), кроме уг-лебариевой соли, прибавляется к воде также гидроокись кальция. Другим преимуществом названного реактива является то обстоятельство, что вследствие его нерастворимости не требуется его точно дозировать. Но барит мало еще доступен по цене; кроме того, реакции с баритом идут медленно и потому требуют больших отстойных баков. Как видно из таблицы, одной известью удаляется из В. бикарбонатная жесткость и свободная углекислота [уравнения (1)—(4)]; для удаления же постоянной кальциевой жесткости [CaS04, СаС12, Ca(N03)2] требуется сода. Для удаления постоянной магнезиальной жесткости требуются два реактива: едкая известь и сода [ур-ия (9)—(11)] или же один едкий натр. При воздействии едкого натра на бикарбонатнуго жесткость в очищенной воде образуется сода, реагирующая с гипсом или вообще с постоянной жесткостью [ур-ия(13)—(17)и др.]. Если,однако, последней не содержится или содержится очень мало, то сода остается в очищенной В. и переходит с ней целиком в котел. Но т. к. слишком большое накопление соды в котле может повлечь нежелательное вспенивание и кидание воды и вызвать разъедание бронзовой арматуры, то способ очистки воды одним едким натром пригоден лишь для таких В., в которых, наряду с бикарбонатной жесткостью, имеется и значительная некарбонатная жесткость. Кроме того, едкий натр может быть с успехом заменен более дешевыми едкой известью и содой, при взаимодействии которых и образуется едкий натр,—согласно следующей формуле: Ca(OH),+Na,CO,=2 NaOH+CaCO,.
Применение едкой извести и соды (т. и. содово-известковый способ) является универсальным и в то же время наиболее дешевым способом химии, очистки В. В случае применения подогрева в водоумягчите-ле расход извести уменьшается против показанного в таблице, т. к. при t° очищаемой В. в 60—70° происходит частичное разложение бикарбонатов кальция и магния с выделением в осадок углекальциевой соли и, реже (при значительной магнезиальной жесткости),—углемагниевой соли, с выделением освободившейся угольной кислоты: Са(НСО,),=CaCOjH-CO,+HtO, Mg(HCO,),^MgCO;+CO,+H,Q·
Содержащаяся в В. свободная углекислота при высоком подогреве также б. ч. удаляется, соответственно уменьшая потребный для ее связывания расход едкой извести. Выше было упомянуто, что для полноты реакции реактивы должны прибавляться к В. с небольшим избытком. Но если избыток будет слишком велик, то ясно, что в очищенной воде будет избыток едкой извести или большой избыток соды. О нежелательности большого избытка соды уже упоминалось выше; избыток же едкой извести недопустим даже и в самом ничтожном количестве, т. к. гидроокись кальция легко выкристаллизовывается в котле, способствуя образованию твердой, трудно удалимой накипи. Если же одновременно с избытком извести к В. прибавлено достаточно соды, то образуется гидрат окиси натрия; последний допустим в очищенной В. не больше 0,5 нем. градуса. Если, наоборот, извести подано меньше соответствующего содерясания в В. бикарбонатов, магнезии и свободной углекислоты, то в воде остаются бикарбонаты, дающие в котле углекислый газ, разъедающий котельное железо, особенно энергично в момент своего образования. Кроме углекислоты из бикарбоната кальция выделяется карбонат кальция, сильнее пристающий к котельным стенкам в виде твердой накипи также в момент своего образования. Если, наконец, подано соды меньше потребного количества, то вода—недоочищена, и в ней остается соответственная часть небикарбо-натных накипеобразователей, что так же вредно, как и избыток едкой извести. Отсюда ясно, что водоочиститель должен обеспечивать постоянство и правильность подачи реактивных растворов в тех весовых взаимоотношениях, которые показаны в таблице 15. Это является одним из основных требований правильной постановки водоочищения. При целесообразном применении перечисленных выше реактивов можно в подавляющем большинстве случаев получить безукоризненную питательную В.
Едкий натр редко комбинируется с известью; чаще он применяется в комбинации с содой. В последнем случае едкий натр реагирует со свободной углекислотой и с бикарбонатами, причем в осадке выделяются СаС03 и Mg(OH)2 и образуется сода [ур-ия (12)—(15)]. При взаимодействии же едкого натра с минеральными соединениями ма гния также переходит в осадок Mg(OH)2, а в растворе остается соответствующая минеральная соль натрия NaCl, Na2S04 или, в редких случаях, NaN03 [ур-ия (21) и (22)]. Что же касается минеральных солей кальция, то они требуют для своего осаждения соды: прежде всего с ними реагируют те количества соды, которые вновь образовались, согласно ур-иям (13)—(15); эта сода должна приниматься в расчет при вычислении необходимых прибавок соды для умягчения В. Различие между последним способом и содово-известковым практически заключается в том, что при применении соды и едкого натра в водоочистителе получается меньше осадков. Поэтому в случаях очень жестких вод, с большой магнезиальной жесткостью, этот способ является пригодным, но он дороже содово-известкового.
При применении одной соды получают, как уже сказано, хорошие результаты с гипсом или же с хлористым кальцием,— вообще с минеральными соединениями кальция. Химич. реакции соды с солями магния [ур-ия (17) и (19)] не протекают количественно полностью, и в питательной В. может остаться, например, хлористый или сернокислый магний, чрезвычайно опасные для парового котла. По Мразеку, сернокислый магний разъедает железо. Получающийся в результате этих реакций углекислый магний [см. также ур-ия (28), (29)] тоже остается в большинстве случаев в растворе и поступает в котел, где он, гл. обр. под действием едкого натра, получающегося вследствие гидролиза соды, дает обильные осадки: Что касается реакций соды со свободной углекислотой и бикарбонатами кальция и магния [ур-ия (23)—(25)], то при них образуется бикарбонат натрия, разлагающийся в котле с выделением вредного углекислого газа: 2 NaHC0,=Na,C0s+C0,+H,0.
Кроме того, реакции (24) и (25) протекают удовлетворительно при высоком подогреве В. и большом избытке соды. Отсюда ясно, что применение одной соды для водоумягче-ния вне котла, можно рекомендовать только в редких случаях,—гл. обр. тогда, когда в очищаемой воде сильно преобладает гипс, мала бикарбонатная жесткость и ничтожно содержание магния. В практике этот способ комбинируется с постоянными продувками котла, причем котловая В. полностью или частью отводится в водоумягчитель (аппараты Неккар и др.); при этом частью утилизируются содержащиеся в котловой В. в избытке реактивы (едкий натр, сода) и тепло. За последние годы, вследствие многих присущих указанному способу недостатков, преимущество стали отдавать содово-известковому способу в комбинации с постоянными продувками котлов.
Необходимо упомянуть еще о т а р т р и-цидном способе умягчения воды, заключающемся в прибавлении к ней фосфорнонатриевой соли Na2HP04 или Na3P04 [ур-ия (46)—(49)]. Названный способ привлек к себе в последние годы, гл. обр. в С.-А. С. Ш., большое внимание, и ему с распространением высокомощных котельных установок, повидимому, предстоит значительная роль. Из различных соединений фосфорной к-ты наибольшее применение получил фосфорнокислый натрий Na3P04 как наиболее дешевый реактив; в последнем отношении он, правда, уступает кальцинированной углекислой соде, будучи у нас значительно дороже последней. Впрочем оба названных реактива могут рационально дополнять друг друга, когда химической очистке подлежат значительные количества воды; в таких случаях в качестве основных реактивов можно употреблять, как наиболее дешевые, известь и соду или (при малой бикарбо-натной жесткости воды) едкий натр, а фосфорнонатриевую соль прибавлять к воде вслед за ними. При этом рекомендуется работать без избытка соды. Преимущества фосфорнокислого натрия перед углекислой содой заключаются прежде всего в том, что сода, как было упомянуто выше, в работающем паровом котле гидролизуется на едкий натр и углекислоту, причем уже при 15 atm избыточного давления получается около 65 % едкого натра. Т. к. при содово-известковом способе избыток необходим также и в котловой В. (например во избежание регенерации гипса за счет извести и ионов серной к-ты), то, чем выше рабочее давление и чем фор-сированнее работает котел, тем больше требуемый избыток. Но при этом быстро нарастает и концентрация едкого натра, как продукта гидролитическ. разложения соды, так что требуются более частые и продолжитель-ные продувки котлов, чтобы избежать вредного или даже угрожающего накопления гидроокиси натрия. Фосфорнокислый натрий значительно устойчивее против высоких темп-p, и его требуется меньше для воспрепятствования образованию в котле гипса, дающего твердую накипь.
Для определения количества потребных реактивов наиболее надежным является производство опытной лабораторной очистки В. При теоретич. подсчете кладут в основание следующие числовые отношения. Для умягчения 1 м3 В. на 1 нем. градус карбонатной жесткости требуется 10 г 100%-ной окиси кальция. Кроме того, прибавляют по 1,4 г того же реактива на каждый г окиси магния, содержащейся в 1 м3 очищаемой В. Для связывания каждого мг свободной углекислоты, содержащейся в 1 м3 той же В., прибавляют 1,27 г 100%-ной окиси кальция. Наконец, для удаления из 1 м3 В. одного нем. градуса некарбонатной жесткости прибавляют 18,9 г химически чистой кальцинированной соды Na2C03 (100%-ной) или 51 г кристаллическ. соды (Na2CO3.10H2O). Вместо 10 г СаО берут 14,29 г NaOH. Образующиеся при реакциях с бикарбонатной жесткостью количества соды принимают в расчет при вычислении необходимых добавок последней для удаления некарбонатной жесткости.
Выше было упомянуто, что сода подается к очищаемой В. с нек-рым избытком. Часть последнего идет на осаждение силикатов (кремнезема) и органич. веществ. По исследованиям Гольдберга, силикаты накипеоб-разователей либо совсем не удаляются либо удаляются в очень ничтожной степени при прибавлении едкого кальция. Кохенгау-зен рекомендует делать прибавки реактивов Лфейфера по следующим ф-лам (в г на л):
окись кальция — а.+„1„1 Ь>
U, ίΟΌ
сод a= 18, ЭЛ — 2,41«,
где а—число мг связанной углекислоты в 1 л, b—число мг MgO в 1 л и Н—общая жесткость в нем. градусах. Шплитгербер предлагает для расчета немного видоизмененные ф-лы Гундесгагена (в г на м3):
едкая известь=10,0(К+Мд+С), содα= 18,91V,
где обозначают в нем. градусах: К—карбонатную жесткость, Мд—магнезиальную жесткость, N—некарбонатную (постоянную) жесткость и С—т. н. эквивалент жесткости для свободной углекислоты (то есть содержание свободной С02 в мг на л, умноженное на коэфф. 0,127). При применении для водо-умягчения едкого натра и соды Шплитгербер предлагает следующие видоизмененные ф-лы Гундесгагена (в г на м3):
NaOH=—,-0(g+fg+C)=14,3 (К+Мд + С),
Na2C03=18,9(1V -К- Мд - С), или, т. к. N=Ca + Мд — К,
Na2C03=(7a — 2К — С
(Са здесь обозначает известковую жесткость, остальные обозначения — прежние). При умягчении воды одной содой прибавляют по 18,9 г на каждый нем. градус удаляемой жесткости, считая на 1 м3 умягчаемой В.
При применении постоянных продувок количество прибавок реактива проще всего определять на основании анализа очищаемой В. из водоочистителя после ее смешения в аппарате с продувочной котловой В. Такие анализы В. должны периодически производиться в заводской лаборатории и служить основой для всех мероприятий по очистке В. При этом для вычисления прибавок могут служить упомянутые формулы, или же прибавки устанавливаются на основании опытной очистки. Для определения количества едкого натра, попадающего в водоочиститель вместе с продувочной котловой В. и образующегося в последней вследствие гидролитич. разложения углекислого натрия, могут служить средние значения, приведенные в таблице 16.
Таблица 16.—С одержание NaOH в % к содер-жанию NaaC03 в котловой воде.
|
Давление пара в котле в atm | |||||
| 3 | 12 | 15—16 | 20 | 30 | 50 |
| Начало гидролитического разложения Na,C03 | 50% | 65% | 78% | 85% | 100% |
Для упрощения расчетов все содержащиеся в В. соединения, а равно и требующиеся для водоумягчения реактивы м. б. вычислены в одних и тех же единицах, например в нем. градусах жесткости, причем одному нем. градусу жесткости соответствуют, или эквивалентны (в мг на 1 л воды):
7,14 Са; 10 СаО; 13,21 Са(ОН),; 17,86 СаСО„;
28,93 Ca(HCOs),; 24,29 CaSO,; 19,82 СаС1„;
4,28 Mg: 7,14 MgO; 10,36 Mg(OH)«; 15,00 MgCO>;
26,07 Mg(HCO,)2; 21,43 MgSO,; 16,96 MgCl,;
14.29 NaOH;
18,93 NasCOs; 30.00 NaHCOs; 19,65 Na2P04;
35,18 BaCO>.
Что касается кислотных ангидридов С02, S03, Cl и др., то одному нем. градусу соответствует, или эквивалентно, такое количество их, которое связывается с 10 мг СаО. Так, одному немецкому градусу карбоната эквивалентно содержание 7,86 мг С02 или
10,7 мг С03 на 1 л; 1 нем. градусу сульфата эквивалентно содержание 14,29 мг S03 или
17,1 мг S04; 1 немецкому градусу хлорида— 12,68 мг С1.
Вместо того чтобы найденные анализом числа мг оснований и кислотных ангидридов делить на вышеприведенные коэфф-ты с целью выражения их в единицах жесткости (в нем. градусах), еще проще, для достижения той же цели, умножать их на коэфф-ты, приведенные в таблице 17.
Таблица 17.—К оэфф-ты для перевода веса оснований и кислотных ангидридов в единицы жесткости.
| Название основания или ангидрида | Коэфф-т |
| Окись кальция СаО.. | 0,10 |
| Кальций Са.. | 0,14 |
| Окись магния MgO.. | 0,14 |
| Магний Mg.. | 0,23 |
| Сернокислый ангидрид S03. | 0,07 |
| Сульфат SO.. | 0.059 |
| Углекислый газ С02.. | 0.127 |
| Карбонат СО,.. | 0,093 |
| Хлор С1 | 0,079 |
| Карбонат кальцин СаСО,. | 0.056 |
| Сульфат » CaSO,. | 0.041 |
| Хлористый кальций СаС1г. | 0,050 |
| Углемагпиевая соль MgCO,. | 0.067 |
| Серномагниевая » MgSO*. | 0,047 |
| Хлористый магний MgCls. | 0.059 |
Пользуясь этими коэфф-тами, можно с достаточным для практич. целей приближением судить о правильности произведенного полного анализа воды. Дальнейшим упрощением является пересчет данных химического анализа на миллиграмм-эквиваленты, так как последними пользуются и при изготовлении титрованных растворов для объёмных анализов В. Приведенные числовые значения для различных химическ. соединений, выраженные в нем. градусах, были получены делением соответствующих миллиграмм-эквивалентов на децимиллиграмм-эквива-лент СаО (28 мг : 10=2,8 мг СаО). Миллиграмм-эквиваленты некоторых наиболее часто встречающихся в водоочищении соединений приведены в таблице 18.
Таблица 18. — Миллиграмм-эквиваленты главнейших соединений.
| Соединения | сЗ
η а Sa о £ ά £ 4 4 |
Соединения | 1
ri a a S a Λ fc «» 5 ч « |
| СаО. | 28 | MgSO,. | 60 |
| СаС03. | 50 | MgCl,. | 47,5 |
| СаСНСО,),. | 81 | NaOH. | 40 |
| Са(ОН)2. | 37 | Na,CO,. | 53 |
| CaSO, ". | 68 | Na*S04. | 71 |
| MgO. | 20 | NaCl. | 58,5 |
| MgCO,. | 42 | CO,. | 22 |
| Mg(HCO,)t. | 73 |
Химические водоочистители. Для русских техников небезынтересны будут некоторые сведения о работе водоочистителей в СССР. На фигуре 21 показан водоочистительный аппарат системы автора. Водоочиститель м. б. снабжен специальным водо-подогревателем. Сырая В. поступает в бак 1, имеющий водосливное устройство, разделяющее при помощи передвижных дисков всю
В., соответственно ее составу, на отдельные струи, направляемые трубой 7 в сатуратор, трубой 5 на малое гидравлич. колесо раздатчика реактивных растворов 20 и трубой 6 на большое гидравлич. колесо, а при отсутствии последнего—непосредственно в смеситель 19 (гидравлич. привод м. б. заменен электрическим, для чего достаточно 74 №). Сатуратор 8 служит для приготовления насыщенного профильтрованного известкового раствора. Сатуратор имеет внутри одну или несколько коническ. перегородок, разделяющих его на отдельные камеры. В верхней части его помещен фильтр. Из воронки 10 через полый вал 9 и его ответвления 14 вода вытекает вблизи днища сатуратора, где тщательно перемешивается с известью, подаваемой в верхнюю его камеру в виде известкового молока. Перемешивание производится мешй 13, ответвлениями 14, а также действием струй, вытекающих через ответвления. Известковый раствор, заполнив нижнюю камеру сатуратора, попадает в нижнюю часть средней камеры, где он встречается со свежей загрузкой реактива, с которым раствор тщательно перемешивается мешалками 11 и 12. Насыщенный реактивом раствор проходит затем снизу вверх через фильтр и по трубе 18 попадает в воронку смесителя. Из смесителя В. течет вниз по центрально расположенной в отстойнике и книзу уширяющейся трубе; скорость В. постепенно убывает, и потому наиболее значительное выделение осадков происходит уже в нижней части отстойного резервуара. Осадки сползают по конусному днищу 27 и отсюда периодически удаляются продувкой. Умягченная вода поднимается вверх по отстойнику опять со все уменьшающеюся скоростью и уже в совершенно спокойном состоянии доходит до фильтра 28, выше которого расположен открытый сверху кольцевой жо-лоб 29, куда и сливается совершенно прозрачная и мягкая вода, удаляющаяся через трубу 30. Раздатчик реактивов 20 состоит из небольшого сосуда, разделенного на отделения вертикальными перегородками. В одном отделении вращается маленькое гидравлическое колесо, а в других помещаются реактивные растворы. Малая струя из водослива по трубе 5 направляется на водяное колесо, с которым связаны маленькие черпачки 21, забирающие реактивный раствор из одного отделения и выливающие его через воронку 23 в другое отделение сосуда, в котором реактив разбавляется неочищенной водой, стекающей с гидравлич. колеса. Количества подаваемой сырой В., а следовательно и числа оборотов малого гидравлич. колеса и самые подачи реактивных растворов, регулируются передвижением диска.
Пуску в действие водоочистительной установки предшествует приготовление реактивных растворов. Прежде всего производится зарядка сатуратора, для чего предварительно приготовляется известковое молоко. Отвешенное количество негашеной извести (примерно от 15 до 200 килограмм в зависимости от состава В. и производительности установки) подается в известковый бак 16 и заливается В. По окончании гашения известь перемешивается с В. в густое молоко, и к последнему доливают В. до наполнения бака. Содержимое бака по трубе 15 пропускают в верхнее отделение сатуратора, а оттуда—в нижнюю камеру, для чего открывают клапан 17. Когда сатуратор загружен известью, пускают в него В., причем приводят в действие мешалки. Тем временем в запасных бачках 25 заготовляют растворы соды и других реактивов. Концентрацию соды выбирают от 1 до 10% в зависимости от состава воды и производительности аппарата. При отсутствии паропровода для нагревания баков растворение соды облегчается примешиванием к ней горячей В. Когда растворы приготовлены, то часть их переводят в соответствующие рабочие отделения раздатчика, для чего открывают вентили соединительной линии 24. Если требуется коагулирование В., то кроме обыкновенных реактивов применяют также сернокислый глинозем в комбинации с известью и содой, чаще всего для осветления речных или прудовых вод во время весенних или осенних паводков. Прибавка коагулянта определяется в каждом случае опытным путем в зависимости от свойств и состава очищаемой воды. Когда прибавки реактивов точно установлены и все растворы их приготовлены, можно приступить к предварительной установке водораспределительного прибора и к пуску аппарата. Эта установка состоит в соответственном расположении вертикальных дисков 3 и 4 в жолобе 2 по длине водосливного порога, снабженного миллиметровой шкалой. Деление шкалы, на к-ром ставится указатель диска 4, отделяющего воду в сатуратор, определяется простым арифметическим расчетом: найденное теоретически или опытной очисткой потребное количество извести, выраженное в нем. градусах, умножается на общую длину водосливного порога в миллиметров, и произведение делится на число, обозначающее в нем. градусах крепость известкового раствора над фильтром сатуратора. Если, например, прибавка извести определена в 25 нем. градусов, общая длина водосливного порога 500 миллиметров, а крепость известкового раствора 125 немецких градусов,
то получается - 125 -=100 миллиметров, то есть диск 4
должен быть поставлен на расстоянии 100 миллиметров от начальной точки водослива со стороны сатуратора. Эта установка диска является предварительной; более точная дозировка производится после пуска водоочистителя и контрольного анализа очищенной воды и известкового раствора. Предварительная установка раздатчика легко растворимых реактивов заключается в закреплении ковшиков в таком числе и при таком уклоне, чтобы общая подача ими раствора соответствовала требующимся на основании лабораторного опыта или расчета количествам прибавок. Когда подачи всех реактивных растворов отрегулированы и произведена набивка фильтров отстойника и сатуратора древесной шерстью, водоочиститель пускают в ход открытием крана в приточном трубопроводе 31 для неочищенной воды, устанавливая кран в соответствии с расходом очищенной В., однако в пределах допускаемой производительности водоочистителя. При этом одновременно и автоматически приводятся в действие все распределительные органы аппарата: водораспределитель, сатуратор, раздатчик легко растворимых реактивов, гидравлический привод.
Колебания состава сырой воды вызывают необходимость периодич. регулировки аппарата, которая сводится к изменению подач извести или легко растворимых реактивов. Изменение подач извести достигается передвижением диска 4; изменение подачи соды и тому подобное. реактивов достигается изменением скорости вращения колеса раздатчика, для чего переставляется диск 3. Для предварительного, грубого регулирования подач можно пользоваться также способом, заключающимся в изменении числа ковшиков и уклона их.
Обслуживание описанного водоочистителя заключается в следующем: а) пуск и остановка его достигаются открытием и закрытием приточного крана для очищаемой воды (при применении подогрева очищаемой В.
перед пуском водоочистителя открывают соответственный паровой вентиль); б) приготовление растворов легко растворимых реактивов производится периодически—один раз в сутки или в двое суток; в) зарядка сатуратора известковым молоком производится раз или два раза в сутки или еще реже. Зарядка сатуратора производится следующим образом: за несколько минут до продувки сатуратора останавливают мешалку, затем открывают продувной кран на
5—10 ск. и удаляют таким обр. из нижней камеры сатуратора отработанную известь вместе с образовавшимися в ней осадками; после этого открытием задвижки 17 переводят полуиспользованный реактив из средней камеры в нижнюю для его окончательного использования; наконец, отводят из известкового бака в верхнее отделение сатуратора свежую загрузку известкового молока. Все эти операции требуют от 10 до 15 м., после чего аппарат снова готов к работе. Продувка отстойника по накоплении осадков производится открытием продувного крана. Эта операция, к-рую следует производить не реже одного раза в сутки, продолжается 1—2 минуты.
Пермутитовый способ умягчения В. Этот способ заключается в том, что неочищенная В. после предварительной ее подготовки фильтруется через определенный слой цеолитного или пермутитового песка со скоростью от 2 до 8—10 м/ч (в среднем—3—4 м/ч) в зависимости от ее состава и жесткости. Процесс очистки протекает на холоду, т. к. при подогреве фильтруемой В. цеолит разрушается. Различают цеолит натуральный и искусственный. Последний, под названием пермутита, получается сплавлением каолина, кварца и соды в примерном отношении 3:6: 12. После плавления получают стекло, слабозеленоватого цвета, состава А1203Н-Ю SiO2 + 10 Na20; сплав измельчается до размера зерен 0,5—1 миллиметров, после чего обрабатывается В., поглощаемой при этом пермутитовой массой. Приблизительный состав получающегося пермутитового песка следующий: 46%Si02, 22% А1203, 13,6% Na30 и 18,4% Н20 (натрий-алюми-ний-силикат). Рыночный продукт промывкой и центрифугированием очищается от щелочных растворов. Сокращенная формула натриевого пермутита P-Na2. Как и натуральные цеолиты, пермутиты легко вступают в обменные реакции [ур-ия (50)—(55)]. Умягченная вода имеет т. о. больший плотный остаток, чем неочищенная В., т. к. в ней кальций и магний замещены натрием, связанным с соответствующими анионами (S04" НС03, C1 и др.). В этом отношении пермутитовый способ далеко уступает другим химия. способам водоумягчения, при которых (особенно при содово-известковом) бикарбо-натная жесткость удаляется из воды в виде осадков и плотный остаток очищенной В. соответственно уменьшается, а свободная углекислота удаляется полностью без того, чтобы в очищенной В. появилось равное ей количество двууглекислого натрия. К недостаткам пермутитового способа кроме того относятся: 1) необходимость предварительной подготовки В. до пуска ее на пермутит;
2) быстрая засариваемость пермутита, если в умягчаемой В. содержатся железо, марганец или механич. примеси (последние должен быть удалены предварительным фильтрованием);
3) быстрое разрушение пермутита свободной углекислотой (для связывания последней пермутитовый фильтр снабжают предфиль-тром из мрамора); 4) сильное загрязнение умягченной В. двууглекислым натрием, образующимся в результате обменных реакций P-Na2 с бикарбонатной жесткостью и свободной С02; 5) сильное загрязнение котла содой, едким натром и свободной углекислотой, влекущее за собой затрудненное парообразование, вспенивание и кидание воды и образование протравливаний; 6) возможность образования тонкой твердой силикатной накипи или же, наоборот, геля кремневой кислоты, что сильно понижает коэфф. теплопередачи поверхности нагрева котла и создает опасность протравления котельных стенок. Положительная сторона пермутитового способа заключается в сравнительной простоте устройства и в том, что для умягчения В. не требуется реактивов.
Обменная способность пермутита определяется формулой:
вес СаО, поглощенный пермутитом, х 100 вес всего пермутита и колеблется от 1,8 до 2%. Обменная способность не одинакова для кальция и магния. Для магниевых солей она в 2,8 раза меньше, чем для кальциевых соединений, то есть для поглощения магния требуется в 2,8 раза больше пермутита, чем для поглощения такого же количества извести. Во столько же раз меньшей является и скорость обменной реакции магния на натрий. Реакции пермутитов обратимы. На обратимости этих реакций основан применяемый на практике способ их регенерации поваренной солью, согласно следующим формулам:
Р-Са+2 NaCl=.P-Na,+CaCl,,
Ρ·Mg+2 NaCl=P-Na,+MgCI,. Поваренная соль берется при этом в очень большом избытке, а именно в 8—10-кратном размере против теоретич. количества, в виде 10%-ного подогретого раствора. Регенерация пермутитового фильтрующего песка производится еще до того, как весь натрий пермутита замещен кальцием и магнием. Период работы пермутитового фильтра между двумя регенерациями продолжается обыкновенно от 10 до 16 часов. Поэтому при непрерывной работе котлов в течение круглых суток необходима установка двух комплектов пермутитовых фильтров.
На фигуре 22 изображен открытый пермути-товый фильтр. Пермутит помещается между слоями гравия для предохранения его от уноса током В.; верхний слой гравия служит вместе с тем фильтром для взвешенных веществ. Сырая В. поступает сверху по трубе 2; напор В. регулируется шаровым клапаном 2. Мягкая В. выпускается через трубу 4 и кран 5. Во время работы фильтра краны 2 и 5 открыты, а краны 3, 6, 7 и 5 закрыты. Когда пермутит сработался, закрывают кран 5 и проточный кран для умягчаемой В. Пермутит разрыхляют сильным током В. через кран 3. Затем выпускают В.
над пермутитом через кран 8 и пускают определенное количество 10 %-ного раствора поваренной соли в течение 2—4 ч. Скорость пропускания раствора должен быть в 2—4 раза меньше против скорости фильтрования В.
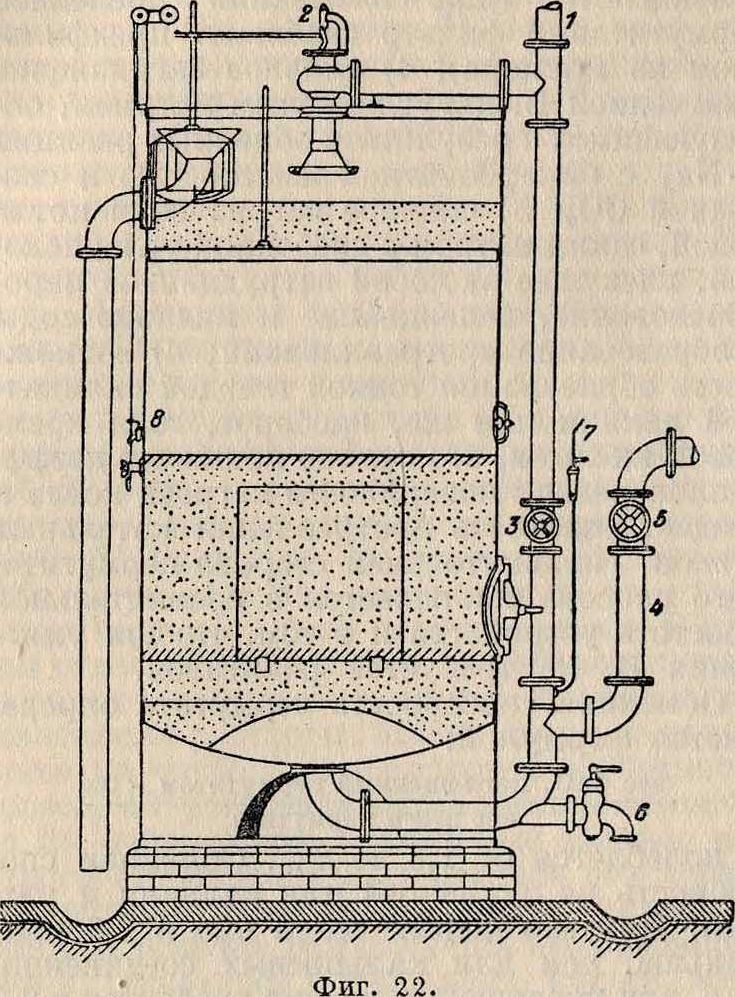
По прекращении притока соли пермутит остается под раствором еще 4—8 ч. После этого кран 7, к-рый служит для спуска раствора поваренной соли при регенерации, закрывают и открывают кран 6. Током воды вытесняют поваренную соль из пермутита (лучше всего употреблять не жестк., а умягченную В.) и после промывки, продолжающейся 5—10 м., кран 6 закрывают, предварительно убедившись, титрованием Vio N раствором азотнокислого серебра пробы В., взятой ниже пермутитового фильтра, что поваренная соль полностью удалена. После этого фильтр снова готов к работе.
Удаление вредных газов. Агрессивное действие вредных газов—кислорода и свободной угольной кислоты—на котельный материал особенно возрастает, если питательной В. служит поверхностный конденсат паровой турбины, не содержащий солей.
Конденсат и дистиллят могут получаться свободными и от газов, но при соприкосновении с воздухом они жадно поглощают кислород и свободную угольную кислоту, становясь нередко еще более опасными, чем неочищенная В. Поэтому необходимо особенно тщательно за-резервуары, где хранится чистый конденсат, были надежны. Удаление газов из В. может производить ся химич., механич. или термин, путем или же комбинацией механич. и термического способов. Для последних способов применяются специальные аппараты—дегазеры или деаэраторы разных систем. Дегазер завода Бальке схематически показан на фигуре 23. Здесь обозначают: а—всасывающая труба для сырой В., b—паровая турбина, г—бак газоочиститель, d—предохранительные клапаны, f—выхлопная к последним труба, h—регулятор уровня воды, и—окислительный фильтр, поглощающий 02 и С02 из воздуха, проникающего в корпус р при конденсации в нем паровой подушки; к—труба для отсасывания выделившихся из воды газов.
Очистка В. путем испарения. Полное удаление из питательной В. растворенных в ней веществ возможно путем ее испарения и последующей конденсации образовавшихся паров. Практически, однако, конденсат, получаемый в испарительных установках, всегда содержит незначительные количества щелочей и некоторую жесткость, величина которых колеблется в зависимости от типа установки и от того, подвергается ли вода предварительной обработке или нет. Необходимыми предпосылками правильно работающей установки являются достаточные размеры испарителя и тщательный уход за ним. Практика показала, что, за исключением тех случаев, когда в распоряжении имеется совсем мягкая питательная В., требуется предварительная химич. очистка последней. В противном случае, при загрязнении поверхности нагрева испарителей накипью и осадками, паропроизводительность их сильно падает. От старых опреснителей незамкнутого цикла, обладавших весьма низким кпд, в последнее десятилетие стали переходить к более совершенным испарителям замкнутого цикла. Значительный успех был достигнут применением работающего на остром паре пароструйного насоса, к-рый отсасывает вторичный пар, образующийся в фИГ. 24.
первом корпусе, и направляет его в последующие корпуса испарителя уже в виде рабочего пара для подогрева испаряемой воды.
Такой замкнутый тепловой процесс наглядно показан на фигуре 24. Притекающий острый пар расширяется в компрессоре приблизительно до 0,5 atm избыт, и засасывает вторичный пар низкого давления из испарителя, приобретающий при этом то же давление. Скомбинированный с подобным тепловым компрессором испаритель называют испарителем низкого давления. Его кпд значительно выше, чем у опреснителей незамкнутого цикла, но самый цикл, с термин, точки зрения, имеет лишь теоретич. значение, т. к. на практике: 1) часть тепла теряется через лучеиспускание, особенно вследствие значительных удельных объёмов испарителей; 2) часть тепла теряется при очень частых продувках испарителей; 3) значительная часть тепла теряется также при частых
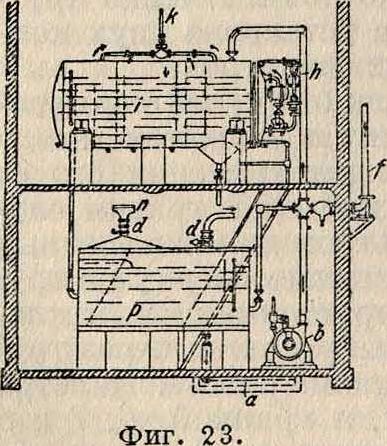
ботиться о том, чтобы дестиллат 100 кал
=540кйл.:
остановках испарителей для чистки, причем из них выпускается вся горячая вода.
Новейшие конструкции завода Вальке дают от 3,5 до 4 кз дистиллята за счет 1 килограмм острого пара, при условии предварительной очистки воды от механическ. примесей и бикарбонатов. Обыкновенно соединяют последовательно несколько испарителей, и только первый испаритель обогревается острым паром или даже мятым паром из турбин и паровых машин; образующийся в нем испарением В. вторичный пар подогревает В. во втором испарителе и т. д. Из последнего испарителя пар (в отличие от опреснителя незамкнутого цикла) отсасывается пароструйным насосом в первый испаритель. Расход пара на 1 килограмм дистиллята при трехкорпусном испарителе достигает 0,35 кз, при двухкорпусном— 0,6—0,7 килограмм, а при однокорпусном — 0,9—·
1,1 килограмм. Испарители мало доступны по цене, отличаются сложной контрукцией, требуют сложного ухода и контроля и, вследствие своей громоздкости, нуждаются в обширных помещениях. При таких условиях конденсат обходится очень дорого, и потому испарители находят ограниченное распространение; они устанавливаются преимущественно на крупных электрических станциях, где для питания паровых котлов имеется чистый турбинный конденсат в количестве 95— 97% всей потребности и где, следовательно, очистке подлежит лишь незначительное количество добавочной В.
На фигуре 25 показан схематически испаритель завода Вальке с устройством для предварительной обработки испаряемой воды соляной к-той; обозначения: а—испаритель, δ—пароструйный насос (термокомпрессор), с—выход щелока, образующегося при сгущении воды испарением, d—выход дистиллята, f—отвод дистиллированной воды, д— дегазер, h—трубчатый подогреватель, работающий паром из испарителя, к—насос для соляной к-ты, I—раздатчик соляной к-ты, т—выход сырой воды, п—резервуар для соляной к-ты, о—ороситель.
2. В. в производстве. Кроме основных требований чистоты, прозрачности, бесцветности, отсутствия запаха и тому подобное., к В., применяемой в производствах, предъявляются специальные требования в зависимости от того назначения, к-рое В. имеет в данном деле. Для многих производств требуется, чтобы употребляемая В. не содержала органических веществ и соединений железа.
На шерстомойнях требуется мягкая В., т. к. при жестких В. образуется известковое и магнезиальное мыло, плотно отлагающееся на волокнах и затрудняющее дальнейшую обработку шерсти, особенно при крашении. При мойке жесткой В. выделяются с мылом обильные жирные осадки, шерсть при сушке теряет свою мягкость и нередко плохо пахнет; при этом естественно теряется много мыла: один немецкий градус жесткости обусловливает потерю 120 мг хорошего ядрового мыла; на 1 м3 В., имеющей 25 нем. градусов жесткости, теряется 3 килограмма мыла. На шелкоткацких и шелкокрасильных фабриках также требуется мягкая В., не оставляющая извести в волокнах, т. к. известь затрудняет крашение и трудно поддается удалению. Особенно опасно загрязнение В. солями железа, а также красящими органическими веществами, вызывающими образование пятен на готовом фабрикате. Загрязнение В. железом вредно также и в писчебумажном производстве вследствие образования на товаре пя тен. Загнивающие органические вещества в
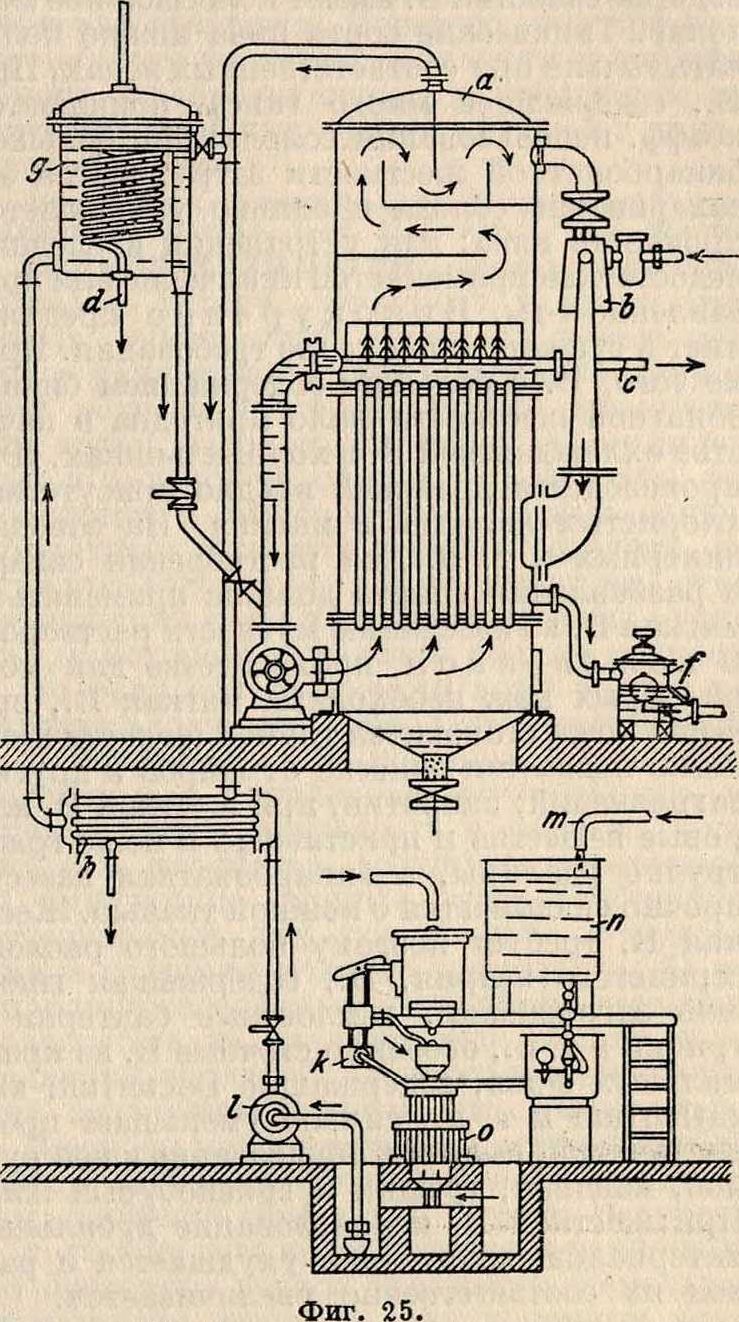
В. могут повлечь за собой образование грибков в бумаге. При проклейке бумажной массы на 1 нем. градус бикарбонатной жесткости непроизводительно теряется 50 г сернокислого алюминия на 1 м3 В. Для крахмального производства требуется В., совершенно свободная от частиц травы, листьев, водорослей (диатомей), т. к. все эти растительные остатки вызывают побурение крахмала при сушке. Недопустимо также присутствие в В. различных грибков, как Crenotrix, Cladotrix, а равно и солей железа, к-рое восстановительным действием грибков отлагается на их поверхности и вызывает желтоватое окрашивание крахмала. В. должна быть также свободна от дрожжевых и споровых грибков, возбудителей брожения, не содержать аммиака и азотной кислоты и значительных количеств окисляющихся органических веществ (требующих для окисления больше 10 мг на л кислорода). Наконец, вода не должна содержать много извести и магнезии, во избежание увеличения зольности крахмала. В сахарном производстве предъявляются к воде приблизительно аналогичные требования. Гниющие вещества В. могут вызывать разложение в диффузорах, а солевой состав—затруднить варку и кристаллизацию и увеличить зольность фабриката; последняя, как известно, при анализе продукта на содержание сахара вычитается в пятикратном размере из показаний поляриметра. Для варенного производства свойства В. имеют колоссальное значение. Типические сорта пива можно получать только при соответственных водах. При
B., содержащей много гипса, понижается коэфф. использования солода; при большой бикар бонатной жесткости затрудняется засахаривание солода и сильно уменьшается прочность пива; для устранения последних недостатков применяется кипячение или прибавление к-ты. предъявляет в существенном те же требования. Кроме того, В. с большим содержанием бикар-бонатной жесткости мало пригодна в качестве охлаждающей В. в холодильниках. Для производства дрожжей вредно присутствие хлористых кальция и магния. На заводах ликерных и тому подобное. для растворения сахара и разбавления а должна применяться мягкая В. во избежание мутности растворов. В кожевенном производстве для мочки сырых кож необходима мягкая В., при которой кожа становится тонкой и эластичной, легко поддается очистке от жиров и других загрязнений; напротив, при жесткой В. жировые вещества и приставшая к коже грязь трудно удалимы, а бикарбонатная известь прочно связывается с кожной тканью. Жесткая В. требует поэтому большого расхода сернистого натрия. В., содержащая гниющие загрязнения, гнилостные бактерии и грибки и тому подобное., особенно сточные В. из крахмальных з-дов, содержащие Bacterium megatherium и т. д., сильно уменьшает прочность кожи, вызывая образование в ней рубцов, канавок, трещин и грязнобурых жил. При жесткой В. использование дубильных материалов значительно ухудшается и расход их соответственно увеличивается.
Лит.: Тимонов В. Е., Водоснабжение и водостоки, СПБ, 1904—06; Черепашинский М., Водоснабжение, СПБ, 1905; Сурин А., Курс водоснабжения, Л., 1926; его же, Улучшение качеств воды, употребляемой в промышленности и для питья, СПБ, 1910; Г е и д е.п р и м С., Очистка воды для питания паровых котлов, М., 1900; Г о р д о н И. Л., Вода и ее очистка для питания паровых котлов, и т. д., М., 1927; Гордон В. Л. и Гордон
И. Л., Обслуживание паровых котлов и очистка питат. вод паровых котлов, М., 1928; Гордон И. Л., Очистка воды для питья, «Техн. и окон. пут. сообщ.», М., 1923, т. 2, 6; его же, Питательная вода паровых котлов, «Тепло и сила», М., 1924, 7—12, 1925, 2—3,-«Вестник Моек. об-ва тех. надз.», М., 1925, 8—11, 1926, 2—4; его же, Очистка воды на Владиской ж. д., «Техника и экономика путей сообщения», М., 1922, т. 1, 6; Юшкевич С. Ф., Смягчение жестких вод, М., 1925; Кашнаров Н. А., Современные способы очистки воды, Томск, 1912; Блахер и Рейшле, Труды 43 Съезда инженеров Международного союза об-в надзора за паровыми котлами, пер. И. Л. Гордона, М., 1913; Потресов М. И., Цеолитовый способ исправления жестких вод, М., 1912; Изгарышев Н. А., Пассивность металлов, «Технико-экономический вестник», М., 1925, 8—9; Труды II Всеросс. теплотехнического съезда, т. 4, вып. 1, Доклады проф. Вологдина
C. П. и инж. Гордона И. Л., М., 1925; «Тепло и сила», М., 1924; «Журнал Русского физич. об-ва», 1914; «Известия Моек, об-ва для надзора за пар. котлами», М., 1911—17; Lunge и. В е г 1, Handbuch d. che-raisch-technischen Untersuchungsmethoden, В. 4, В., 1924; Fischer F., Chem. Technologie. Das Wasser,
Lpz., 1914; Ziegler P., Schnellfilter, ihr Bau u. Betrieb, Lpz., 1919; Heyn E. u. Bauer O., Dber d. Angriff d. Eisens durch Wasser u. wasserige Losun-gen, Mitteilungen des Materialpriifungsamtes und d. K. Wilhelm Inst. f. Metallforschung, Η. I—II, B., 1908; Blacher C., Das Wasser in d. Damp!- u. War-metechnik, Lpz., 1925; Her berg &., Handbuch der Feuerungstechnik und des Dampfkesselbetriebes, 3 Aufl., B., 1928; Nernst W., Theoretische Che-mie, Stuttgart, 1921; D u b b e 1 H., Taschenbuch fur den Fabrikbetrieb, Berlin, 1923; Obering K. und Schmidt K., Reinigung und Untersuchung des Kesselspeisewassers, B., 1921; Paul .1. H., Boiler Chemistry a. Feed Water Supplies, L., 1923; В u n d e und E i t n e r, Beriehte tiber Geheimmittel, welche zur Verhiitung und Beseitigung von ICesselstein dienen sollen, Hamburg, 1905; Zsigmondy R., Lehrbuch d. Kolloidehemie, Lpz., 1925; О s t w a 1 d W., Grund-riss d. Kolloidehemie, Lpz., 1923; FreundlichH., Kolloidehemie u. Biologie, Dresden—Lpz., 1924; Tillmans J., Die chemische Untersuchung v. Wasser u. Abwasser, Halle a/S., 1915; Tillmans J., Wasser -reinigung und Abwasserbeseitigung, Halle a/S., 1912; G a u s R., Zeolite u. ahnl.Verbindungen, ihre Konstitu-tion und Bedeutung fiir d. Technik, B., 1906; Spalk-ha v e r-S c h e i d 1 e r-R (Ister, Die Dampfkessel, 2 Aufl., B., 1924; Wehrenfennig E., Dber d. Untersuchung und d. Weichmachen d. Kesselspeisewassers, 2 Aufl., Wiesbaden, 1905; HausbrandE., Verdampfen, Kondensieren und Kiihlen, Berlin, 1924; «Gesundheits-Ingenieur», Miinchen, 1902—27; «Deutsche Medizin Wochenschr.», Lpz., 1898; «Ztschr. f. Hygiene u. Infektionskrankheiten», B., 1874; «Gesundheit», Char-lottenburg, 1905; «Z. ang. Ch.», 1912, 1917,1919, 1920, 1923; «Ch.-Ztg.», 1904, 1907, 1908, 1910, 1917; «Ztschr. f. physik. Chemie», Lpz., 1904, 1911, 1914; «Ztschr. d. anorg. u. allgem. Chemie», Lpz., 1919; «Archiy f. W&rmewirtschaft u. Dampfkesselwesen», B., 1922—25; «Feuerungstechnik», Lpz., i 926; «Brennstoff und War-mewirtschaft», Halle, 1926; «Mitteil. d. Vereinigung d. Grosskesselbesitzer», B., 1925—26; «Mitteil. d. Mate-rialprufungsamtes u. d. K. Wilhelm Inst. f. Metallforschung», B., 1915; «Ztschr. f. Metallkunde», B., 1922; «Journal fur Gasbeleuchtung», Miinchen, 1891, 1897, 1898, 1899, 1901,1906. 1907,1910,1912; «Wochenschrift f. Brauerei», B., 1910; «Ztschr. f. d. ges. Brauereiwe-sen», Nurnberg, 1912, 1914; «Ztrbl. f. d. Zuckerindu-strie», Magdeburg, 1905; «Bull, de Ia Socidtd d’encou-ragement pour 1industrie», Paris, 1891; «Chaleur et industrie», Paris, 1925; «GC», 1910. И. Гордон.