 > Техника, страница 32 > Вольтаметр
> Техника, страница 32 > Вольтаметр
Вольтаметр
Вольтаметр, прибор для измерения силы тока по его химическим действиям. По законам Фарадея для электролиза, сила тока/, проходящего через раствор соли какого-
нибудь металла,равна 96,540 · ” · у=где
96,540—коэфф-т, одинаковый для всех веществ, значение которого вытекает из определения единицы силы тока, п—валентность вещества в данном его соединении, А—ат. в., М — масса (в мг) вещества, выделившегося на электродах. Количество вещества в мг, выделяющееся в течение 1 ск. при силе тока +_
Фигура 3.
в 1 А, то есть при прохождении электрич. заряда в 1 С, называют электрохимия, эквивалентом этого вещества (в формуле обозначен буквой тонн). Наиболее тщательно и многократно определялся электрохимия. эквивалент серебра. На основании этих определений Международный электротехнический конгресс в Лондоне в 1908 году принял mAg== 1,11800 мг, и это значение было положено в основу определения международн. ампера.
Применяются В.: медный—для измерения сильных токов, серебряный—для слабых токов при точных измерениях и газовый (иначе водяной)—в лабораторной практике. Следует упомянуть также о вольтаметре свинцовом, бромовом, иодовом и ртутном. Последний употребляется иногда в качестве счетчика ампер-часов.
В следующей таблице приведены значения т для различных веществ.
Величины электрохимических эквивалентов.
| Наименование вещества | Химич. знаки | Атом ный вес | Валент ность | Электро химии. эквивал. |
| Серебро. | Ag | 108 | 1 | 1,118 |
| Медь. | Си | 63,6 | 1 | 0,658 |
| Медь. .v. | Си | 63,6 | 2 | 0,329 |
| Водород. | Н | 1,008 | 1 | 0.0104 |
| Кислород. | О | 16 | 2 | 0,0828 |
| Ртуть. | Hg | 200 | 1 | 2,07 |
| Ртуть. | Hg | 200 | 2 | 1,04 |
| Иод. | J | 126,9 | 1 | 1,314 |
| Бром. | Br | 79.9 | 1 | 0,828 |
| Свинец. | РЬ | 207,1 | 2 | 1,072 |
| Свинец. | РЬ | 207,1 | 4 | 0,537 |
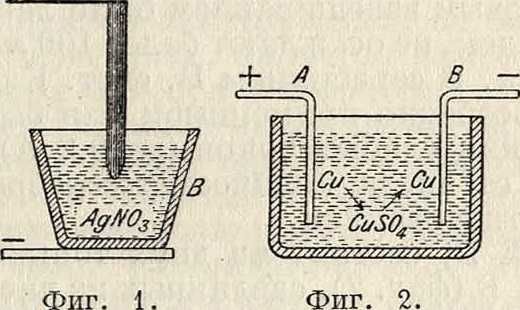
В серебряном В.системыКольрауша анодом служит серебряный массив А (фигура1),
который висит на серебряном же стерженьке, защищенном стеклянной трубочкой. Катодом служит платиновый тигель В, наполненный 15—30%-ным водным раствором нейтрального азотнокислого серебра AgN03, получаемого перекристаллизацией продажного химически чистого AgN03. Серебро оседает на стенках платинового тигля в виде мелкокристаллическ. осадка. Тигель перед опытом и после него взвешивают. Для того чтобы частички серебра, могущие во время электролиза отделиться от анода механически, не попали на дно тигля и не увеличивали т. о. вес осадка, на краях платинового тигля подвешен при помощи трех стеклянных крючков стеклянный защитный стаканчик, не допускающий также до катода часть электролита, близкую к аноду, в которой образуются кислородные соединения серебра, влияющие на процесс. Для достаточной плотности осадка необходимо, чтобы плотность тока на катоде не превосходила 0,02 А на 1 см2, а на аноде—0,2 А на 1 см2. Для того чтобы перед новым взвешиванием было легче удалить осадок, не осаждают более 100 мг на 1 см2 катода. В серебряном В. сист. Ки-стяковского, особенно применимом для быстрого измерения слабых токов (до 0,2 А), отделившееся от анода количество серебра определяется титрованием.
Me д н ы и В. состоит из двух тонких пластинок А и В (фигура 2), сделанных из чистой меди, а иногда одна (катод)—из платины. В качестве электролита употребляется ие вполне насыщенный раствор чистого медного купороса CuS04, иногда подкисляемый небольшим количеством H2S04. Чтобы получить плотный осадок меди на катоде, берут плотность тока на нем не более 0,04 А на 1 см2. Результаты, даваемые медным В., не могут иметь большой точности по причине сравнительно малого электрохимического эквивалента меди и из-за сложных химических процессов, сопровождающих электролиз CuS04 и могущих изменить количество осажденной током меди. Для более удобного пользования медным В. катод подвешивают непосредственно к одному плечу весов.
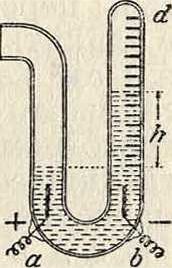
В газовом В. электролизу подвергают 10—20%-ный водный раствор H2S04 и измеряют объём выделившегося водорода. В. состоит из U-образной стеклянной трубки с запаянным концом d (фигура 3). В трубку запаяны два платиновых электрода а и b. Конец трубки d градуирован на см2. При 0° и 760 миллиметров давления 1 см3 водорода весит 0,0893 мг. Следовательно, объём водорода, выделяемый при этих условиях 1 С электричества, равен:
о,оюзб
θ)θ89ΪΓ
= 0,116 см3.
Сила тока, выделившая в ί ск. при темп-ре t и давлении р объём водорода υ см3, определится из следующего выражения:
1 =
Ό
1 + 0,00367t
_Р_
760
1
0,116 (
А,
где р—давление сухого водорода (без паров воды). Если р0—показание барометра в миллиметров ртутного столба, a h—разность уровней электролита в В., то, принимая плотность ртути почти в 12 раз больше плотности раствораH3S04, имеем: Р=Р—уу- В действительности в водороде присутствуют водяные пары. Поэтому надо внести поправку /’, которая обычно берется из таблиц. Так как водяные пары находятся над раствором поглощающей их серной кислоты, то поправку следует уменьшить. Обыкновенно вместо f берут 0,88f. Вводя эти поправки, получают:
V — Ро —^ - 0,88 f.
Лит.: Хвольсон О.Д., Курс физики, т. 4,
5, Берлин, 1923; Эйхеввальд А. А., Электричество, 4 изд., М.—Л., 1927. Е. Нитусов.