 > Техника, страница 35 > Гальванические элементы
> Техника, страница 35 > Гальванические элементы
Гальванические элементы
Гальванические элементы, первичные элементы, источники элек-трич. энергии, получаемой непосредственно в самих приборах за счет химической энергии входящих в них веществ, способных к диссоциации электролитической (смотрите). Известны случаи (концентрационные цепи), когда возможно гальванич. получение электрической энергии, не связанное с химич. превращениями; поэтому более широкое понятие—гальвапиче ьо цепи—охватывает и группу явлений чисто физическ. характера, к-рые, однако, в качестве источника электрической энергии в виде особого прибора не применяются.
Внутреннее устройство всякого Г. э. включает следующие части: 1) ионизированную среду, составленную из проводников второго класса (электролитов), представляющих в практически применяемых Г. э. (гидроэлектрич. элементах) водные растворы химич.соединений; 2)электроды из про-
где стрелками обозначено направление тока внутренней и внешней цепей, причем эдс, возникающие в местах соприкосновения разнородных частей цепи, должны быть направлены от одного электрода к другому. На фигуре 1 показана правильно составленная цепь: результирующая эдс направлена от одного электрода к другому; на фигуре 2— неправильно составленная цепь: две коротко
| ! +
1 1 1 |
" | ||||
| 1
1 1 |
+ | + | |||
| 1
1 1 1 _1_ |
J | 1 | 1 | ||
Фигура 1. Фигура 2.
замкнутые цепи, эдс которых направлены вдоль электродов и результирующая равна нулю. Схема токопрохождения в замкнутой гальваническ. цепи представлена на фигуре 3. Для электрода, на котором происходит разряд отрицательно заряженных ионов (анионов), в электрохимии установилось название анода; для того же, на котором происходит разряд положительных ионов катионов),—к атода. Таким образом во внутренней цепи Г. э. анодом является отрицательный электрод, а катодом—положительный. При пропускании же тока извне возникающее обратное направление тока, или разряд анионов на положительном электроде, сделает его анодом, а разряд катионов сделает отрицательный электрод катодом. С точки зрения химии, процесс, происходящий на аноде, идентичен реакции окисления, а обратный процесс на катоде— реакции восстановления.
I. Теория Г. з. Как источник электрич. тока Г. э. изучают: 1) со стороны его электрических характеристик, 2) со стороны связанных с прохождением тока химических превращений и 3) со стороны физического состояния и физико-химических свойств действующих веществ.
Общие характеристики Г. э. Характерными величинами всякого Г. э. служат: Е—эдс; V=f([, В, t) — напряжение замкнутого элемента, как функция силы тока /, внешнего сопротивления В и времени разрядки t г—внутреннее сопротивление, зависящее от размеров электродов и сопро-
^имение электронов Направление тока Анион
Катион "
Анод — эл -т — Катод Фигура 3.
тивления электролита; иногда r — f(t, t), то есть г является функцией времени разрядки t или времени хранения tэдс поляризации Ер=/(7, /) иногда объединяется с г под общим названием—внутренние потери, иногда Ер выражается в % от Е. Ур-ия, связывающие эти величины, следующие:
V=Е-Е. - Гг=77?,
(Е - Ер) - V
Г=i
Полагая эдс поляризации пропорциональной силе тока, т. e. Ер=kl, что близко к действительности, и принимая к + г — с получим выражение внешней характеристики Г. э.: ТаОл. 1.—т е м не р ату рн ы е
V=E-cI=E где с— cV 7 =
вой эффект химической реакции с электродвижущей силой Г. э. Ур-ие Гельмгольца:
Е =
0.239ПК
+ Ί
,dE
dT
где Е—эдс Г. э. в V; Q—тепловой эффект в cal; п—число валентностей ионов, вступающих в химическ. реакцию, тепловой эффект к-рс и Q; 1·—фарадей=96 540 С=26,8 Ah; 0,239—коэфф-т перевода J в cal; Т—абсо-
dE
лютная темп-pa химич. процесса; dr —температурный коэфф. эдс; для Г. э. он обычно меньше lmV на 1° (смотрите табл. 1).
коэффициенты эдс гальванического элемента!1).
с
R
и силы тока: Е
R + с ’
при последовательн. соединении п элементов в батарею:
7 =
| Гальваническая цепь | dE
-dT В V на 1 |
E при 0° |
| Cu|CuSO.+100 H,O||ZnSO,+ l00 Η,0|Ζη.
Ag, AgCl|Zn C1.+ 100 Π,Ο Ζη. PbO,IH,SO, уд. в 1,280 (при 25°)|Pb. |
+0,34X10-* -4,02 x 10-· +3,98X10-· | 1,0962 V 1,015 * 2,111 * |
пЕ
ΙΪ + пс
+ с при параллельном соединении Е
п элементов:
7 =
С
R+n
в батареях в применяется. иная группировка элементов настоящее время почти не Электродвижущая сила:
III + 1с;
мощность
Робщ=1Я=РИ + Рс отдача
Р полезн.
*1 »
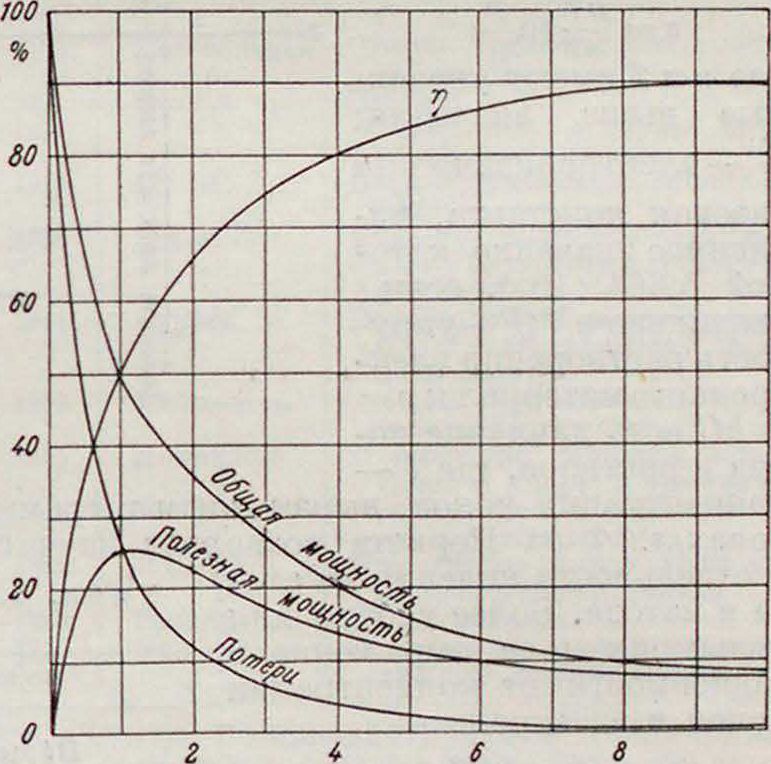
* общ. максимальная мощность при Я — с Я полезн. тах=ЕЯ=-д · Графически внешние характеристики для Г. э., у которого E=IV и с=19, изображены на фигуре 4; очевидно, что Г. э. по существу дела предназначены для работы при весьма малой разряди, мощности, т. к. максимальная полезн. мощность составляет лишь 25% возможной при данной силе тока и напряжении цепи=эдс источника. Емкость по току: при 7=Const, Ai=It0;
t.
при Я=Const, А н=Vr£—=l;J Vdt,
Для данного Г. э. температурный коэфф. эдс может менять свою величину и знак в зависимости от концентрации реагирующих веществ и Т°. Приводимая табл. 2, дающая
Фигура 4.
значения эдс Г. э. при различных t°, позволяет вычислить также и соответственные значения температурного коэффициента эдс и убедиться в его изменчивости.
Т а С л. 2.—Э д с гальванического элемента при низких t° [’].
где t0 —разрядный период в часах.
Емкость по энергии:
t,
при 7=Const, Wi=7. Vcp.t0 =. 1 f Vdt;
0
ίο
при Я=Const, И д=v v£—= д f v2 dt.
О
Термодинамические теории. Химические процессы, имеющие место в Г. э., с точки зрения термодинамики рассматривают как изотермически обратимые и, прилагая к ним уравнение свободной энергии, получают выражение, связывающее тепло
| e° | Обычный сухой элемент (в V) | Элемент с хлорист. серебром (в V) | Кислотный аккумулятор (в V) |
| 20 | 1,540 | 1,06 | 2,116 |
| 10 | 1,537 | 1,05 | 2,113 |
| 0 | 1,533 | 1,04 | 2,111 |
| -10 | 1,523 | 1,03 | 2,107 |
| -20 | 1.512 | 1,02 | 2,103 |
| -30 | 1,508 | 1,01 | 2,100 |
| -40 | 1,530 | 1,00 | 2,096 |
| — 50 | 1,540 | 0,99 | 2,092 |
| -60 | 1,540 | 0,98 | 2,087 |
| -70 | 1,526 | 0,97 | 2,081 |
Г. э., обладающие наименьшим температурным коэфф-том, при соблюдении ряда других условий применяются как эталоны эдс. При значении ^, близком или равном нулю, для вычисления эдс Г. э. применима более простая формула (правило Томсона):
_Q_
0,239nF
Пользование вышеприведенными формулами требует экспериментального определения и точного учета суммарного теплового
,1Е
лт эффекта химических реакций Г. э., что затруднительно и не всегда возможно. Это затруднение устранятся помощью 3-го начала термодинамики, дающего возможность исчислять эдс Г. э. из одних термических данных [*].
Осмотическая теория Г.э. Потенциал s соприкосновения пары электрод-электролит на основании осмо-тич. теории Г.э. Периста выражается следующей формулой:
RT, Р ε=—= In ->
л К р где п и Т имеют указанные выше значения;
г —электролитическая газовая константа, численное значение которой 0,864x10-1, если ε выражено в Р—упругость растворения электродного материала;р—
— кС есть давление попов в растворе, где С— концентрация ионов, выраженная в грамм-ионах/л. Ф-ла Периста позволяет изучать в отдельности явления на аноде и катоде. Более удобно для пользования ее выражение в зависимости от концентрации ионов в электролите:
ε=«. + ~ 1Ц С,
где я0—постоянная, характерная для каждого иона величина, называемая электролитическим потенциалом соотв. электрода относительно электролита, содержащего 1 испытуемый грамм-ион в л (г0 дается для 18° со знаком, отвечающим электроду в справочных таблицах нормальных потенциалов) [*], -~8 lg С—поправочный член на изменение концентрации,—берется со знаком (+) в случае образования катионов М-»М и со знаком (—) в случае образования анионов Х-»-Х-[*].Эдс гальванич. цепи получается как разность потенциалов отдельных электродов:
Е=[± Е(+)] — [ ±8(-)] ВОЛЬТ.
При непосредственном измерении ε в качестве условного нуля применяются вспомогательные электроды, обычно нормальные:
водородный ен или каломельный ес, связанные уравнением:
еи=яс-(- 0,280 вольт (при 18°).
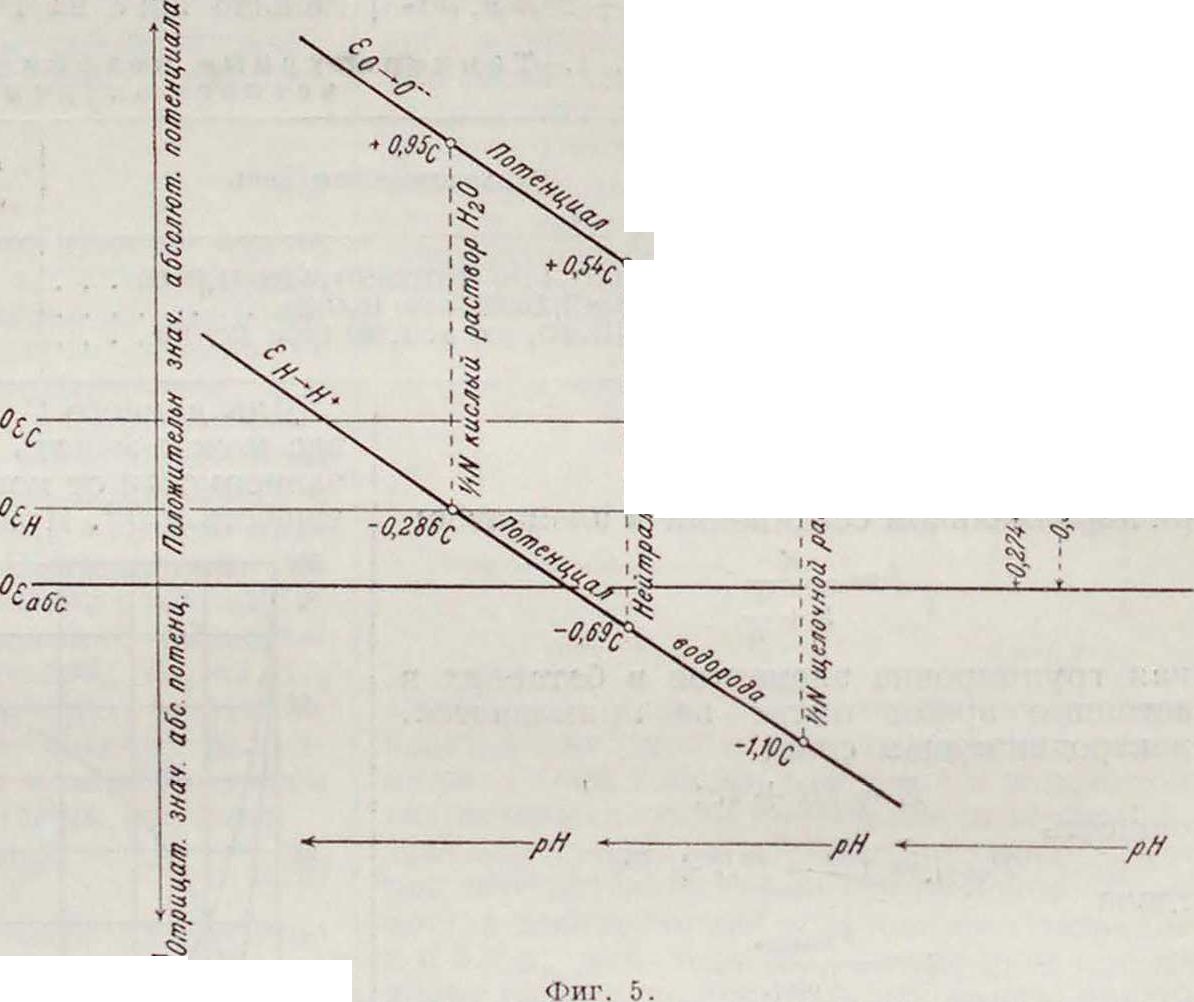
Абсолютный потенциал (не общепризнанная величина Iе]) испытуемого электрода через вспомогательный определяется из ур-ий: Яабс.=εΗ + 0,274; (абс. — яс -I- 0,560
или графически—см. фигура 5 и табл. 3 [4]. На фигуре 5 С указывает на потенциал относительно каломельн. электрода, Н—относительно
εο~*2Η·~~Η2ο ‘£о~£н- >, гз у
| 14:
S |
||
| 1 ч 1*5 | V
8 |
i i
_ |
водородного электрода, pH—концентрация ионов водорода, N·—нормальный раствор.
Таблица 3.—Н ормальныс потенциалы водород а и кислорода (в V).
| Водородный электрод | Кислородный электрод | ||||
| пары | с | επ | П4ры | £с | *н |
| Н*|’/, jvoir. η,Ιη,ο.
H,;Viivн+. |
-1,10
-0,69 -0,28 |
-0,82
-0,41 ±0,00 |
О,I1/, JVOH-. 0,11,0.
0,|V,1VH+. |
4-0,13
4-0,54 4-0,95 |
4-0,41
4-0,82 4-1,23 |
Явления в замкнуто и ц е п и (п о-ляризация Г. э.). При прохождении тока потенциалы электродов, а с ними и эдс, изменяют свои первоначальные значения в разомкнутой цепи в зависимости от плотности тока па электродах и времени разрядки Г. э., благодаря изменению сопротивления электролита и отчасти электродов и в связи с изменением во времени состава и концентрации действующих веществ. Совокупное действие этих причин, выражающееся в нарастании внутренних потерь Г. э. по мере его разрядки, носит название поляризации Г. э. Характером и степенью поляризации (в этом общем смысле) обусловлены наиболее важные технические свойства Г. э. Различают следующие виды гальванической поляризации (табл. 4):
T a G л. 4 .—•В иды н о ляризации г а л ь в а-вических элементов.
| Наименование и причина | Размер и место возникновения | Устранение |
| Концентра-ц и о и н а я | Значительная у пористых электродов; незначительная у сплошных электродов | Химии, средствами; обычно не устраняется |
| X и м и ч е с к а я: малая скорость реакции, выделение водорода и других веществ с нротиво-электродвижущей силой | Имеет место гл. обр. на катоде | Катализаторы. Химии, деполяризаторы. Адсорбирующие средства |
| Механическа я: выпадение нерастворимых и непроводящих ток осадков | На обоих электродах, сильнее—на пористом (катоде) | Локализация осадка или другие б. ч. химии, средства |
Степень действия металлических пар (группа А, а) обусловлена не столько эдс цепи Μ, I электролит | М2,
раств·. электрод постор. металл сколько эдс следующей цепи:
Mj I электролит | Н/Мг),
к-рая определяется величиной добавочного напряжения (перенапряжения), необходимого для выделения водорода на поверхности данного материала. Величины этих добавоч. напряжений для наиболее важных материалов при гладкой поверхностиданывтабл.СИ·
Таблица 6.—IIереиапряженин водорода на гладкой металлической поверхности.
| Металл | Перенапряжение в V | Металл | Перенапряжение в V | Металл | Перена-пряже-ние в V |
| Pt | 0,08 | Си | 0,415 | Zn | 0,70 |
| Fe | 0,23 | Cd | 0,48 | РЬ | 0,78 |
| Ni | 0,29 | Ag | 0,495 | нет | 0,80 |
Этим, например, объясняется безвредность присутствия свиица в цинке Г. э.
II. Основные виды Г. э. История развития Г. э. видна из табл. 7.
Деполяризация. В применении к Г. э. под деполяризацией обычно подразумевают лишь катодную деполяризацию в виду того, что против анодной, по незначительности ее, мер не принимается. Отсюда под названием деполяризатор понимают не добавочный материал, а основное действующее на катоде вещество, что, разумеется, не совсем правильно. В силу технических и экономии. причин наибольшее практич. значение приобрели Г. э., в которых в качестве анода применен сплошной металлический, т. н. растворимый, электрод, а в качестве Катода—пористый, нерастворимый, большей частью кислородный электрод.
Явления в разомкнутой цепи (саморазряд Г. э.). Побочные процессы в Г. э. связаны с второстепенными реакциями, имеющими место при разомкнутой внешней цепи. Они имеют большое значение для хранения Г. э., вызывая так называемый саморазряд элементов. Внутренние причины (исключая, разумеется, короткие замыкания, небрежное изготовление и прочее) саморазряда сгруппированы в таблице 5.
Таблица
-Исторические даты развития элементов.
| Годы | Автор | Открытие или изобретение |
| 1789 | Гальвани | Опыты с физиологическим действием тока |
| 1794 | Вольта | Первый Г. э. |
| 1800 | * | Кольтов столб и первая батарея из Г. э. |
| 1833 | Грове | Перв >е применение деполяризатора |
| 1836 | Даниель | Введение принципа различных упругостей растворения металла |
| 1841 | Бунзен | Изготовление искусственного угля; хромовый деполяризатор |
| 1859 | Мейдингер | Техннч. применение I. э.: телеграфный элемент |
| 1865 | Леклйнше
i |
Применение перекиси мар-. ганца и хлорист. аммония |
| 1879 | Меш
! |
Применение деполяризации кислородом воздуха |
| 1882 | Лаланл | Применение окиси меди и щелочного электролита |
| 1888 | Гаснер | Сухой элемент |
| 1914 | Фери | Техническое применение воздушной деполяризации |
Эта с показывает, что в отношении анода вопрос технически удовлетворительно
Таблица 5.—К л а с с и ф и к а ц и я побочных явлений в гальванических элементах.
| Группа явлений | Причина | Действие | Внешнее проявление |
| Группа А | а) Местная пара создается | Неравномерный из- | Незначительн. умень- |
| Действие на металли- | присутствием в исходном ма- | нос, потеря емкости | шение эдс, заметное |
| териалеэлектродов или элек- | одного электрода, пре- | увеличение внутрен- | |
| электрод | тролита посторонних примесей (металлов или их соединений); 0) концентрационная цепь создается неодинаковой плотностью электролита или неодинаковой физической структурой металла в разных дочках поверхности; в) химич. растворение электрода, Например действием растворенного в электролите кислорода | ждевременный выход из строя всего элемента | них потерь |
| Группа Б | г) Присутствие в элсктроли- | Потеря емкости обоих | Возможно зпачитель- |
| Взаимодействие эле к- | те примесей в виде ионов | электродов (незначн- | ное уменьшение эдс и |
| тродов | развой валентности, наприм. Fe · Fe-’ ·
д) Диффузия растворенного катодного материала к аноду или обратно |
тельная)
,· · I ’ |
значительное увеличение внутренних по- ? терь |
был решен уже в первом Г. э. Вольта. Цинк и по настоящее время, за исключением очень редких случаев, является незаменимым материалом в качестве анода. Вся история гальванических элементов связана с отысканием наиболее подходящего материала в качестве катода вообще, кислородного электрода в частности и отчасти состава и обработки электротита.
Классификация Г. э. может быть произведена по разным признакам. Конструктивное деление па элементы с одной и элементы с двумя жидкостями в настоящее время устарело. Существенное значение, подтверждаемое историей элементного дела, имеет химич. состав и исходное фнзич. состояние катодного материала (табл. 8).
Изображения типичных представителей разных групп гальванических элементов даны в таблице I, где указаны и основные химические процессы и соответствующие последним электродвижущие силы. а) Г. э. с жидким катодным материалом (деполяризатором). Г. э. группы «а»—в большинстве случаев элементы с двумя жидкостями, с проницаемой перегородкой или без нее, имеют гл. обр. историч. интерес и академии. значение (классическая гальванич. цепь Даниеля). Находят более заметное применение в телеграфной практике элементы Мейдингера без диафрагмы. Более поздние Г. э. этой группы—элементы Шустера [8] с диафрагмой:
I. Zn амальг. | КОМ [ Nh*^o°’ ! C’ эДС-2,75 V II. Zn амальг. [ КОН С, эдс-2,85 V
и Л. Даримонта [“] с полупроницаемой перепонкой в порах перегородки.
Таблица 8.—К л а с с и ф и и а ц и я гальванических элементов по х и м и ч е с к о м у составу и исходному физическому состоянию катодного материала.
| Химич. состав катодного матери-Физвч. ала состоппие | А. Содержит соль катодного металла | Б. Содержит активный кислород или другой анион |
| а) Жидкий | а) Напп.эле-м даты Даниеля, Мейдингера | а) Напр. хромовый элемент |
| б) Твердый (мало растворим) | б) Напр. элемент с хлористым серебром | б)Напр.эле-
меитЛеклан- ше |
| в) Газообразный | в) Такого элемента не имеется | в) Напр. элемент Фери |
б) Г. э. с твердым катодным материалом. Г. э. группы «б» имеют в настоящее время наибольшее практич. значе-
Т а С л. IТ и п и ч н ы е представители гальванических элементов.
Группа А, а Г. э. Мейдингера
Группа А, б Г. э. с хлористым серебром
Группа А, в

Zn + CuSO,=ZnSO, + Си эдс «1,1 V
Zn + 2 AgCl=ZnCl, + 2 Ag эдс - 1,1 V
Не имеется
Группа Б, а Г. э. с хром, жидкостью (Грене)
Группа Б, б Г. э. типа Лекланше
Группа Б, в Г. э. типа Фери
3 Zn + 2 CrO, + G H,SO,=Cr,(SO,), + + 3 ZnSO, + 6 Н,О эдс - 2,0 V


Zn + 2 N11,01 + 2 MnO,=ZnCl, + + Μη,Ο, + 2NH. + Η,Ο ЭДС - 1,5 V
Zn + Η,Ο + О - Ζη(ΟΗ), ЭДС - 1,25 V
ние. По разряду «А» к ним относятся, помимо указанного в таблице I элемента с хлористым серебром, применяющегося для медицинских целей, известные как эталоны
Фигура 6.
напряжения нормальные элементы—Кларка: Zn -I- HsTjSO*=ZnSUj + 2 Hg, эдс 1,433 V при 15, и Вестона: Cd + Hg,S04=( d304 + + 2 Нц, эдс 1.0184 V i ри 20с по разряду «Б» к этой группе Г. э. относятся, помимо многочисленных форм выполнения известных элементов Лекланше с нейтральным электролитом, несколько типов элементов со
щелочным электролитом (Лаланда, Эдисона, Ведекинда и других), работающих по следующей схеме:
Zn I NaOH I CuO I Си, эдс 0,8—1,0V;
химическая реакция:
Zn + 2 NaOH + CuO=Zn(ONa), + H,0 + Cu.
(25° B6)
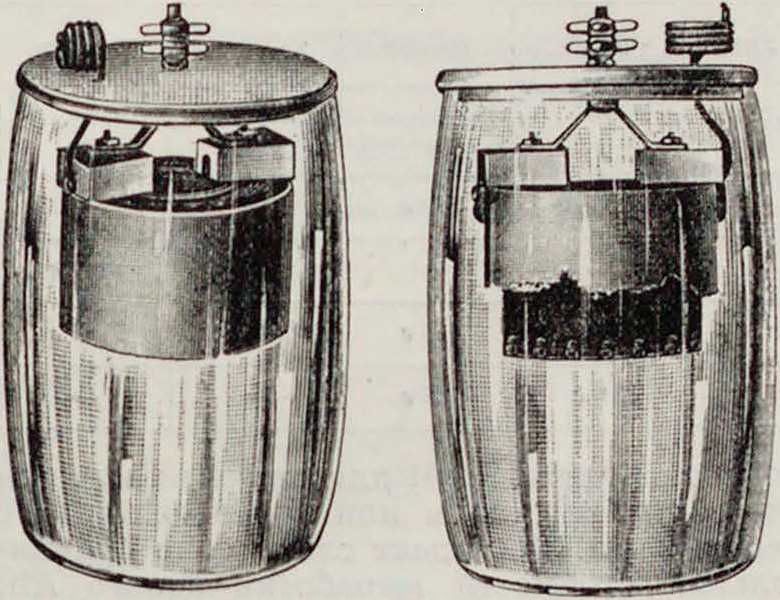
Одна из подобн. современ. американ. конструкций [10] представлена на фигуре 6 (левый
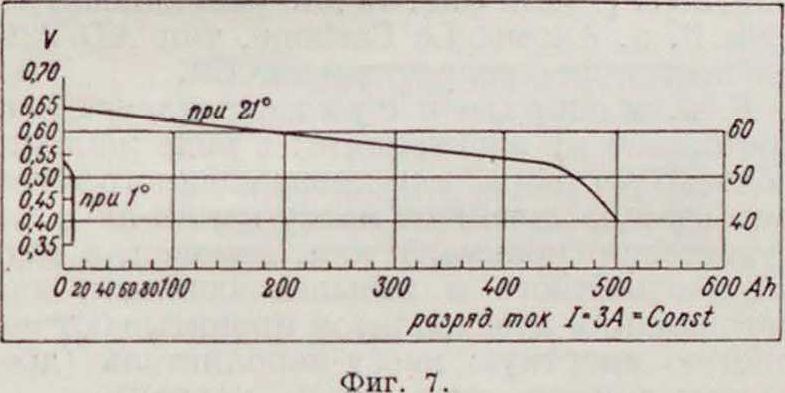
рисунок—Г. э., не бывший в употреблении, правый—разряженный); разрядный график показан на фигуре 7. Эти элементы применяют ся для железнодорожной и другой сигнализации и изготовляются размерами на 100— 600 Ah емкости. Вследствие их низкого напряжения эксплуатя обходится дорого; элементы эти чувствительны к колебаниям t°. Известны также элементы этой группы с кислотным электролитом, работающие по схеме:
Zn I Н,304 I РЬО, эдс - 2,40V;
химическая реакция:
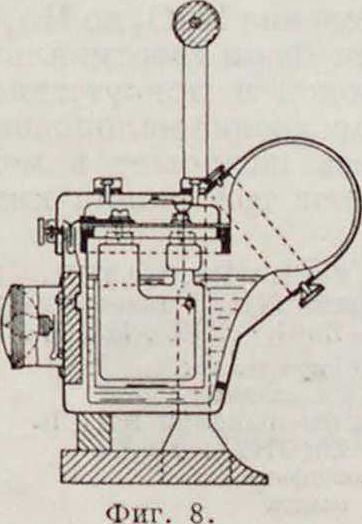
Zn + 2 H.SO, + РЬО,=ZnSO, + PbSO, + 2 Η,Ο. Форма выполнения элемента этого типа для карман, фонаря изображена на фигуре 8 [“].
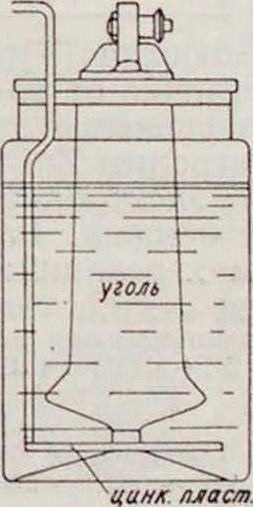
в) Г. э. с газообразным катодным материалом. Г. э. группы «в» в последние годы начинают приобретать промышленное значение (до сих пор, главным обр., во Франции); известны как элементы с воздушной деполяризацией, вернее — деполяризацией кислородом воздуха. Одним из первых получил более широкое признание элемент Фери. Своей работой с газовым электродом Фери не только дал пути к разрешению вопроса о значительной экономии расхода цинка в Г. э., но и удачно обошел затруднения, связанные с переходом кислорода из газа в ионное состояние, попутно осветив опытным путем механизм деполяризации [1г. 14]. Сущность устройства (фигура 9) это го элемента такова: на дне сосуда расположена горизонтально цинковая пластинка; в непосредственной с ней близости находится вертикальный угольный электрод,
V
сутки
О SO WO ns
Фигура 12.
особым образом изготовленный, с высокой пористостью и электропроводностью, выступающий над электролитом (раствором хлористого аммония).
Физико-химические процессы элемента Фери. Теоретическое ур-ие Zn + Hi О -f Оео30_=Zn(OH)t не совсем точно. Фактически процесс распадается на две фазы. В первой фазе:
Zn + 2 NH.Cl + Η,Ο + О=ZnCl, + 2 ΝΗ,ΟΗ образуется ZnCI2, как и в обычном элементе Лекланше, но затем, по мере работы, происходит расслоение электролита на три слоя:

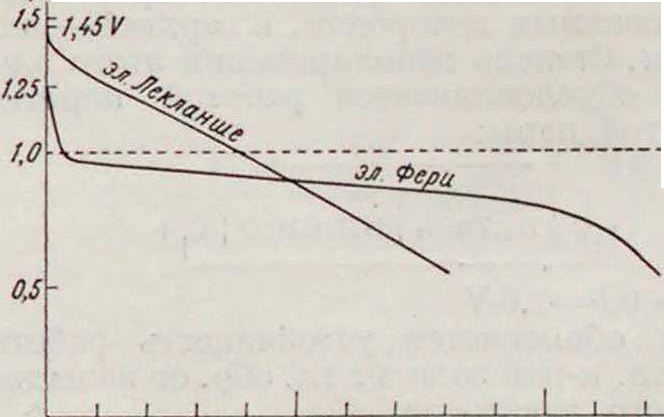
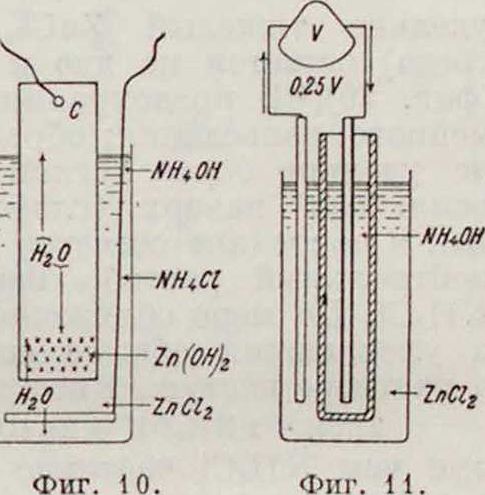
Таблица 9.—С р а о н е н и е элементов’ Фери, Лекланше и Мейдингера по расходу г л а в н ы х мате р и а л о в (на 1 Ah).
|
Материалы | Эл. Ферн - 1,25 V | Эл. Лекланше ^ 1,50 V | Эл. Мейдингера - 1,1 V | ||||
| теорет. | практ. | теорет. | практ. | теорет. | практ. | ||
| На катоде | Кислорода.
Воздуха.. |
208,5 см3 992 » | 208,5 см3 992 л | — | — | — | — |
| МпО, | , - | — | 3,25 г | 5,0 г | — | - | |
| CuSO, + 5 II,О | — | — | — | - | 4,62 г | 28,9 г | |
| На аноде. | Zn | 1,228 г | 1,25 г | 1,228 г | 5,5 г | 1,228 г | 7,63 г |
| Электролита. | NH.C1 | 0 | 1,0 г | 2,ог | 2,5 г | - | - |
удельно тяжелый ZnCl2 (слабо кислая среда) остается на дне и покрывает цинк (фигура Ю)[151, предохраняя его от неравномерного разъедания; образующийся на угле удельно более легкий раствор ΝΗ„0ΙΙ всплывает наверх (слабо щелочная среда), а посредине остается по преимуществу нейтральный раствор неизрасходованного NH4C1. По мере сближения крайних слоев и уменьшения общего содержания NH4C1 в растворе наступает вторая фаза процесса:
ZnCl, + 2 ΝΗ,ΟΗ=Ζη (ОН), + 2 NH.Cl,
при чем NH4C1 частично регенерируется, а осадок окиси цинка выпадает на границе соединения крайних слоев; нижняя, обращенная к цинку, часть угольного электрода все время остается чистой и, главное, погруженной в раствор ZnCl2. Противоположно направленная эдс жидкостной пары (фигура 11) L1SJ
+ ΖηΟ,ι ΝΗ,ΟΗ —,
приблизительно равная 0,25 V, не уменьшает основной эдс, т. к. замкнута накоротко угольным электродом. Угольный (газовый) электрод в нижней части насыщается адсорбированным водородом, в верхней—кислородом. Степень деполяризации этого электрода обусловливается работой коротко замкнутой пары:
-С I Η,ΖηΟ, i ΝΗ,ΟΗ,О I С| + с эдс - 0,5—1,0 V.
Этим объясняется устойчивость работы элемента, которая зависит гл. обр. от качества угольного электрода.
Сравнение Г. э. с газовым, твердым и жидким катодным материалом. Сравнительный график разрядок элемента Фери с элементом Лекланше
| сутки |
ίο го зо to so ео го so so wo iw /го ш но
Фигура 1 3.
показан на фигуре 12 [15]. Сравнительный расход материалов в элементах с различным физическим состоянием катодного материала показан в таблице 9 [15] для случая разрядки очень слабым током или более сильным с перерывами. Фери дает следующие сравнительные стоимости выработки одного Ah:
| Эл. Фери | Эл. Лекланше Эл. Мейдингера | |
| 1 | 4,5 | 13,5 |
Другой метод сравнительной оценки Г. э. смотрите ниже. Кроме элементов Фери, в настоящее время известны элементы с воздушной деполяризацией Le Carbone [ιβ] и со щелочным электролитом Нея [“], Нюберга [18] и Юигнера [19].На фигуре 13 дан разрядный график Г. э. фирмы Le Carbone, тип AD 220, на постоянное сопротивление 52.
Г. э. мокрые и сухие различают по состоянию их электролита: в виде жидкого водного раствора, или превращенного в желеобразную, клейкую массу каким-либо загустителем (крахмал), или, наконец, в виде малоподвижного и невыливающегося, для чего жидким электролитом пропитывают пористую инертную массу-наполнитель (древесные опилки, гипс, песок, картон).
Сухие Г. э. типа Лекланше. Г. э. типа Лекланше с сухим электролитом издавна получили наибольшее практич. применение и промышленное значение. В связи с этим в последнее время проделано много работ для освещения происходящих в нем физико-химических процессов. Схема гальванической цепи этого элемента:
- Ζη I ZnCl„ NH,C1, Aq I MnO, i C ( +
Установлено[п] раскисление Мп02до Мп203. В отличие от элемента Фери (вертикальное расположение электродов и присутствие в электролите ZnCl2), расслоение малоподвижного электролита здесь наступает в меньшей степени. Различают три стадии химических реакций:
I. Zn + 2NH,C1 + 2МнО,= ZnCl,+ Mn,0,+2NH, + 11,0 (начальная при насыщенном NH.C1 электролите).
II. Zn + 2NH.C1 + 2MnO,=ZnCl, · 2NH, + Mn,0,+ H,0
кристаллик. осадок
(спязыпание NH, при уменьшении Nil,Cl).
III. Zn + 11,0 + 2MnO,=Zn(OH), + Μη,Ο, аморфный осадок
(связывание II,О при большой концентрации ZnCl, и малой ΝΙΙ,Ο).
Кроме того, взаимодействие ΝΗ4ΟΙΙ и ZnCl, при нек-рых условиях [2)] сопровождается
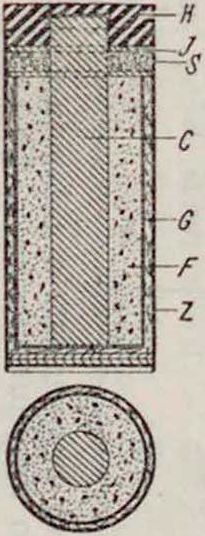
Отличается от «б> тем, что G— слой картона, пропитанного электролитом

Г. II. 403060, М. Цейлер. Нажатием подставки К загущенный электролит продавливается между электродами.
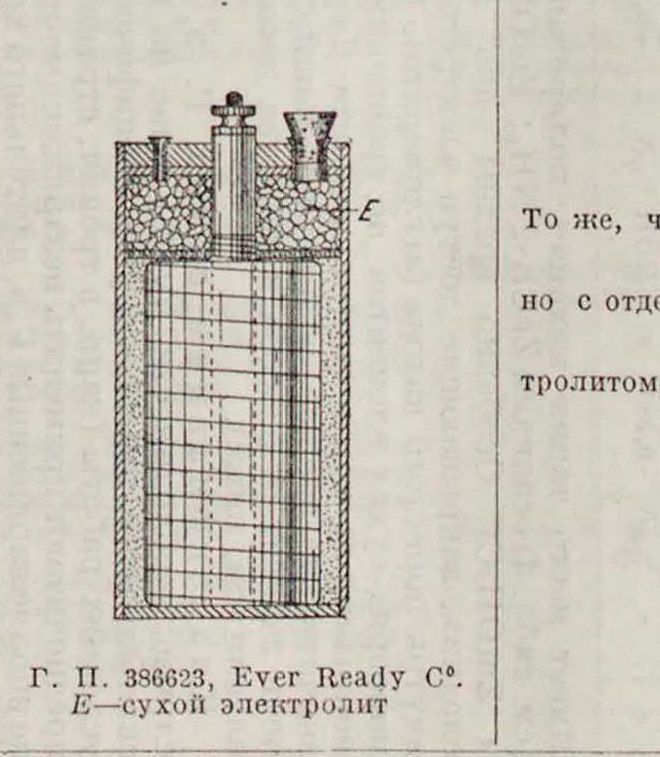
Г. П. 402307, Ле-Карбон. Е— сухой электролит
То же, ч но с от;
ж ид КС
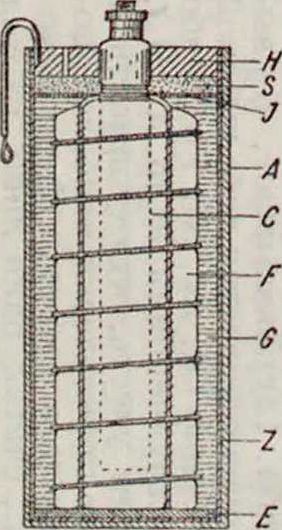
Λ—картон, футляр, Z—цинк, полюс, С—уголь, Е—изоляция от дна, F—деполяризатор, G— желатинир. электролит, И— заливочная смолка, J—парафин. картон, прокладка, S— прослойка из опилок“
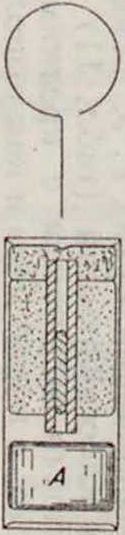
Г. II. 415233, Маннесман. Λ— стеклянная ампула
образованием также и хлорокиси цинка по следующему уравнению:
IV. ZnClj + ΝΗ,ΟΗ=Zn(OH)Cl + NH.C1 (с частичной регенерацией NII»01).
Фактин расход Мп02 иногда меньше, чем требуется ур шнениями 1,2 или 3, что объясняется участием в реакциях кислорода воздуха, поскольку обеспечен доступ последнего, или может быть другими, еще мало освещенными явлениями адсорбции на катоде [1]. Поляризация электродов обусловлена глав, образом повышением концентрации ионов ОН- и в меньшей степени Zn++ (табл. 10) [7].
Таблица 10.—П оте и циалы электродов элемента Лскланше в различных электролитах.
| 1
о О сб Н |
Элек тролит | &абс. в V | Элек трод | Элек тролит | &абс. в V |
| Ζη | ZnSOj 7,iV | -0,522 | МпО, | H,so,y,iv 1
MnSO.Vio.N 1 |
+ 1,73 |
| » | » 7 .IV | -0,551 | » | N11,i 1 7,.V | + 0,98 |
| » | » Vioo-N | -0,580 | » | κυа у,л | +0,69 |
Имеет место также механич. поляризация (смотрите табл. 4) осадками ZnCl22 ΝΓΙ3; Ζη(ΟΗ), и Zn(OH)Cl Особенно вредны два последних, закрывающие доступ электролита внутрь пористого катода (аггломерата). Саморазряд сухих элементов по сравнению с мокрыми, за исключением элемента Фери, значительно меньше, но в значительной степени зависит от способа и качества изготовления (смотрите ниже).
Классификация сухих Г. э. В случае необходимости иметь запас на несколько лет, а также в других специфическ. условиях работы (например втропич. странах), предпочитают применять незаряженные или не вполне заряженные Г. э. длительного хранения, которые перед употреблением должны быть приведены в действующее состояние. Но при этом надо иметь в виду, что срок службы таких элементов меньше, чем обычных сухих Г. э. В виду большого разнообразия в выполнении сухих Г. э. ниже приведена их классификация (табл. 11) по конструктивным признакам с кратким указанием того, в какой мере и как выполняются условия длительного хранения; кроме того, в таблице II [ — 23] показаны примерные формы выполнения некоторых из них.
III. Применение Г. э. Стоимость Электр и ч. э н е р г и и от Г. э. Теоретич. расход материалов, которые могут быть применены в качестве электродных, и соотношение стоимостей (до войны 1914—18 гг.) этих материалов на 1 Wh (табл. 12) показывают, что выбор последних ограничивается либо высокой стоимостью (особенно Cd, Ag, Ni, Pb), либо техническ .ми затруднениями παπρ. AI, II,). Кроме того, если учесть, что стоимость 1 полезного Vh от практически наиболее экономично работающего элемента Фери обходится ок. 80 к., считая один лишь расход материалов [7], то станет понятным, что и по экономическим и по технич. причинам Г. э. находят применение лишь в случаях потребления приемником малого расхода энергии вообще и с малой разрядной мощностью
Таблица 12. — Относительные стоимости электродных материалов на 1 тонна е о р с-т и ч е с к и и Wh.
| Веществ | Эквива-
леитн. вес |
АЫз | *абс. | Wh/г | Отиоси-
тельн. стои мость |
| а) анодные материалы | три стоимости Zn Vh=l: | ||||
| Н,. | 1,0 | 26,8 | + 0.274 | 7,3 | 0,025 |
| Λ1. | 9,0 | 3,0 | -1,01 | 3,0 | 0,53 |
| Ζη. | 32,7 | 0,S2 | -0,50 | 0.40 | 1 |
| Fe. | 27,9 | 0,96 | -0,16 | 0,15 | 1 |
| mb. | 12,2 | о ·> | -1,28 | 2,8 | 3,0 |
| Cd. | 56,2 | 0,48 | -0,13 | 0,06 | 50,0 |
|
б) катодные материалы при стоимости MnO,/Wh=i:j | |||||
| О,. | 8 | 3,35 | + 1,50 | 5,0 | 0,01 i |
| 2 МпО,. | 87 | 0,31 | + 0,98 * | 0,3 | 1 |
| Na,Cr,0, | 43.6 | 0,61 | + 1,40 ** | 0,85 | 7 |
| Си. | 31,8 | 0,85 | + 0,61 | 0,50 | 8 |
| Сио. | 39,8 | 0,67 | + 0,40* *· | 0,27 | и |
| РЬО,. | 119,6 | 0,22 | + 1.87 | 0,41 | 18 |
| Ni,О,. | 82,7 | 0,33 | + 0,75 | 0,25 | 160 |
| Ag. | 107,9 | 0,25 | + 1,07 | 0,27 | 520 |
* В растворе NH<C1. ** В растворе IIa.SO«. •••В растворе NaOIi.
в частности. Кроме того, во многих случаях применение Г. э. диктуется не столько их экономичностью, сколько их незаменимостью и рядом практических удобств. Последним объясняется преимущественное распространение элементов типа Лекланше, в особенности сухих.
Классификация Г. э. по роду службы. Электротехнически применение Г. э. можно объединить в режимах, указанных в таблице 13 (несколько иные способы
Т а б л. 13.—К лассифик а ц и я Г. э. по р о д у с л у ж б ы.
| Удельная пагрузна | Действие | Пример применения |
| 1. Малая, порядка десятых и меньше долей А на л объёма или кг веса | а) Непрерывное | Телеграф и. служба |
| б) Периодическое | Телефонная и радиосвязь | |
| 2. Более значительная, порядка 1—к и больше А па л объёма или кг веса | а) Непрерывное | В исключительных случаях |
| б) Периодическое | Сигнализация, запал и карманные лампы |
деления приведены в «Материалах совещания по источникам тока» |2βί).
Если сравнить технич. данные элементов различных видов, например элементов типа Фери с сухими типа Лекланше, то оказывается, что одно и то же удельное использование порядка 50 Wh/л может быть получено при удельной нагрузке для элементов типа
| К о н с т | р у к ц и я | |||
| Л? Л"? | Группа | Отличительные признаки | Дополнительная маниция | Срок |
| I | Сухой i | а) Раствором электролита насыщена гигроскопич. масса внутри элемента б) Желеобразный электролит заполняет внутреннее пространство элемента | Нет
(элемент окончательно собирается на заводе) |
Обычно ПС тельного храз саморазряжас |
| II | С готовым электролитом внутри | а) Готовый электролит смачивает один электрод; другой помещается в особой камере б) Готовый электролит помещается в специальной камере, не смачивая ни одного из электродов | Подвергается внешнему воздействию, благодаря i отогому свосолный электрод перемещается η активную область элемента: вся маниция проходит в несколько минут
То же, но только перемещается электролит, к-рый заполняет активную область элемента. Хотя маниция совершается быстро, но элемент становится готовым для дсйстпия примерно через 1—2 часа |
Теоретически ни чей |
| III | Водо наливной | а) Сухой электролит помещается в соприкосновении с обоими электродами
С) Сухой электролит помещается в особой камере |
Приводится в действие вливапием воды, которая должна вводиться небольшими порциями в течение i—2 ч., после чего элемент совершенно готов | Л*ТКО В03М( элемента пг складах в аггломе
Частичный с жен иногда, притянет дс |
| а) Готовый электролит помещается в особом фла> оне независимо от корпуса элемента | Приводится в действие вливанием готового электролита небольшими порциями в течение 1—2 ч. | |||
| IV | Наливной | б) Сухой электролит помещается в специальной упаков е независимо от самого элемента | Для приведения в действие сначала растворяют электролит, а затем поступают обычным порядком; на это требуется о;;. 2 ч. | Теоретически ничей |
| V | С отдельным электродом | а) Отдельным электродом является цинк, к-рый хранится надетым на корпус элемента
С) Отдельным электродом является положительный электрод с аггломератом и электролитом, изолированными от цинка |
Для приведения в действие вставляется цинк, для чего требуется некоторое вскрытие элемента: на это идет около Vi ч. времени
Приводится в действие вдвиганием пг-гломерата с электролитом в неподвижный цинк. .Маниция занимает 1—2 минуты |
Возможен ча ряд в сырь |
| * Составлена инж. | В. В. Новиковым. | |||
Таблица 14. — Производство сухих элементов.
| Количество | ||||
| Страна | Годы | шт. или еди- | Стоимость | Примечание |
| ниц | ||||
| СССР | 1926—30 | 4 ооо ооо ед. | 2 000 000 р. | В среднем но |
| 5-лсти. программе [*Vr] | ||||
| С.Ш.Л. | 1923 | 221 859 831 ШТ. | 18 903 269 [”] долл. | Производство с 1899 НО 1926 ГОД увеличилось в 35 раз [30] |
| 1923 | — | 37 238 607 [“] » | ||
| 1926 | — | 80 000 000 [’*] » | Производство анодных батарей С 1921 НО 1926 г. | |
| увеличилось в 500 раз |
Лекланше 0,1—0,25 А /л, для элементов же типа Фери лишь при 0,02—0,05 А /л. Этим объясняется сравнительно малый успех Г. э. типа Фери, несмотря на их преимущество в отношении экономичности. При более полной сравнительной оценке необходимо принять во внимание также и допустимый диапазон разрядного напряжения и ряд других условий. Наиболее удачной системой, легче других приспосабливаемой к различным встречающимся на практике режимам работы приемников, до настоящего времени следует считать систему Лекланше, чем и объясняется ее широкое распространение.
Промышленное изготовление Г. э. Наибольшее промышленное значение имеют Г. э. группы «1, б» (табл. 13), то есть сухие с желеобразным электролитом. Масштаб производства этих Г. э. виден из табл. 14. В настоящее время во многих странах проведена нормализация продукции Г. э. В Германии [31] стандартизованы 8 типов сухих элементов, 2 типа мокрых и 1 тип карманных батареек. В Америке [|2]—2 типа сухих элементов, 5 типов карманных батареек и 2 типа анодных радиобатарей. Проект общесоюзного стандарта на Г. э. цинк—уголь— перекись марганца с неподвижным электролитом [33] (табл. 15) предусматривает 7 типов сухих и водоналивных Г. э.
К производству радиобатарей (анодные и накала), в особенности первых, предъявляются наиболее высокие требования, например в отношении однородности элементов. В настоящее время конструкцию их еще нельзя считать окончательно установленной не только у нас, по и за границей, хотя в последнее время, особенно в Америке, техника их изготовления достигла большого совершенства [30]. На фигуре 14 показаны графики [31] периодической разрядки анодной батареи, а на фигуре 15 дан вид одного из элементов радиобатареи.
Основные материалы для производства сухих элементов. Перекись или двуокись марганца, в виду ее малой проводимости, чаще всего применяется в тесной смеси с графитовым порошком, в виде так называемых аггло-мератов—пористых (до 40%) тел, окружающих угольный токоотводящий стержень (смотрите табл. II). Баланс стоимости материалов в основном складывается (в процентах) из:
цинка. 20—40 графита. ок. 15
угля.ίο—30 электролита. »10
перекиси мар- прочих ча-
ганца. ю—20 стер. 5—20
Промышленные требования максимального использования действующих материалов в Г. э. следует рассматривать с двух сторон:
а) со стороны стойкости этих материалов к самопроизвольному расходованию и б) со стороны их активности во время работы. Первое требование относится по преимуществу к аноду, второе—к катоду. В отношении цинка установлено [35, зв], что не меньшую (если не большую) роль, чем химическ. состав, играют состояние его поверхности и кристаллическ. Структура, то есть свойства, зависящие от обработки этого прокатного материала. В качестве двуокиси марганца применяют: а) марганцевую руду (пиролюзит),
б) искусственную (химически полученную) перекись марганца, в) смесь той и другой, например 2 вес части первой и 1 вес. часть второй [36]. Первая отличается большей стойкостью и электропроводностью, вторая — большей активностью [*7]. Минералогическое происхождение и степень полимеризации пиролюзита также имеют большое значение. В СССР применяется почти исключительно чиатурский пиролюзит [38]. Использование Мп02 в аггломе-рате находится в весьма сложной зависимости от: а)природы применяемого графита [3“, “], б) степени измельчения обоих ингредиентов (величина зерна порядка 0,05 миллиметров |40!), в) их электропроводности I»9], г) состава смеси и ее приготовления (давления) i37], и, наконец, д) адсорбирующей способности М п02 и графита. В среднем при непрерывной разрядке до 0,7 V использование пиролюзита в сухих элементах составляет не более 20—30% (раскисление до Мп203), а искусственной перекиси марганца (Мп02) составляет
60—70%. Отношение Mn0 в современных графит элементах равно 2—4.
Таблица 1 5.—О б щ е с о ю з и ы и стандарт на Г. э. (проект).
| Размеры в | м~н | £ «S н | Миним. емкость | |||
| Наименование и условное обозначение | а а | rt | Л
ь а о « |
£ Ξ о *- ~ о к ~<я | в Ah до 0,7 V напряжен. на 10 2 сопротивл. | |
| 1 | Ч | зЗ?
ВО л |
Из | сухой | водонал. | |
| Большой (Б. Э.) | 40 | 80 | 175 | 1,40 | 42 | 35 |
| Нормальн. (Н. Э.) | 55 | 55 | 125 | 1,40 | 23 | 20 |
| Средний (С. Э.). | 40 | 40 | 90 | 1,36 | 6 | 5 |
| Малый (М. Э.). Нормальн. круг- | 32 | 32 | 75 | 1,36 | 3 | 2,5 |
| лый (И. Э. К.) Средний круглый | 55 | — | 125 | 1,40 | 23 | 20 |
| (С. Э. К.). Малый круглый | 40 | — | 90 | 1,36 | 6 | 5 |
| (М. Э. К.). | 32 | 75 | 1,36 | 3 | 2,5 | |
Электролит сухих Г. э. Качество сухих Г. э., в особенности способность к храпению, в сильной степени зависит не только от химического состава электролита, но и от физич. свойств, способа наполнения и ир. Зависимость разъедания гладкого металлического цинка в растворах нашатыря различной концентрации изображена на фигуре 16 [ 35J,
V
60
so
iO
зо
25
| * | А | Λ | Л | А | |||||||||||||||
| 4 | п | А | А | А | А | А | А | А | 4 | ||||||||||
| А | А | д | А | ! | |||||||||||||||
| А | Ц. | ||||||||||||||||||
| А | |||||||||||||||||||
| Д | |||||||||||||||||||
| суп | ш |
12 6 δ 10 12 H 16 /в >0
Фигура 14.
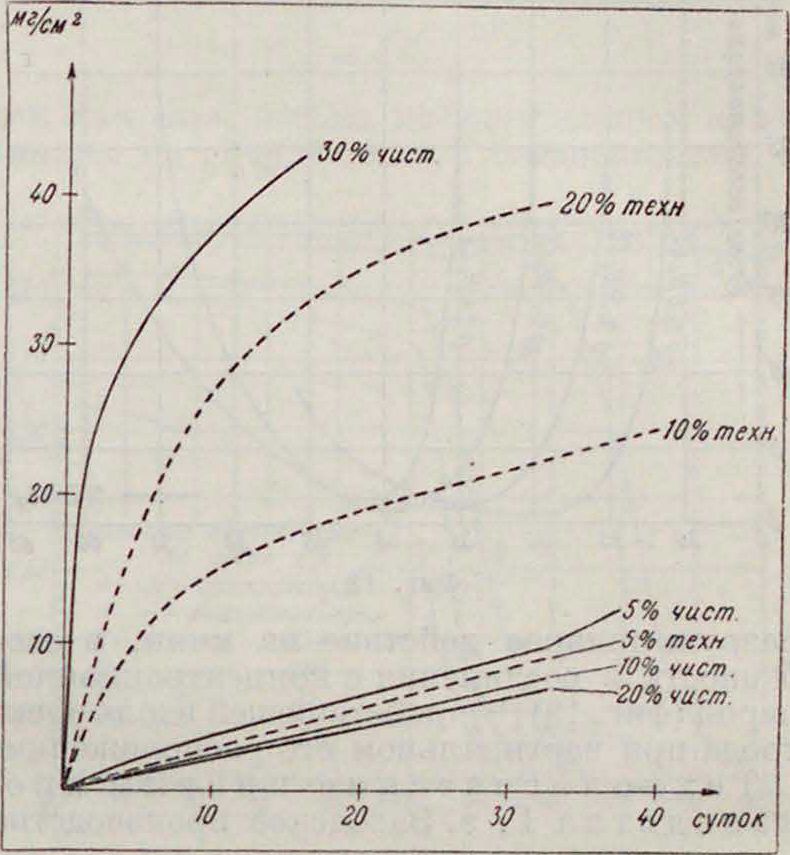
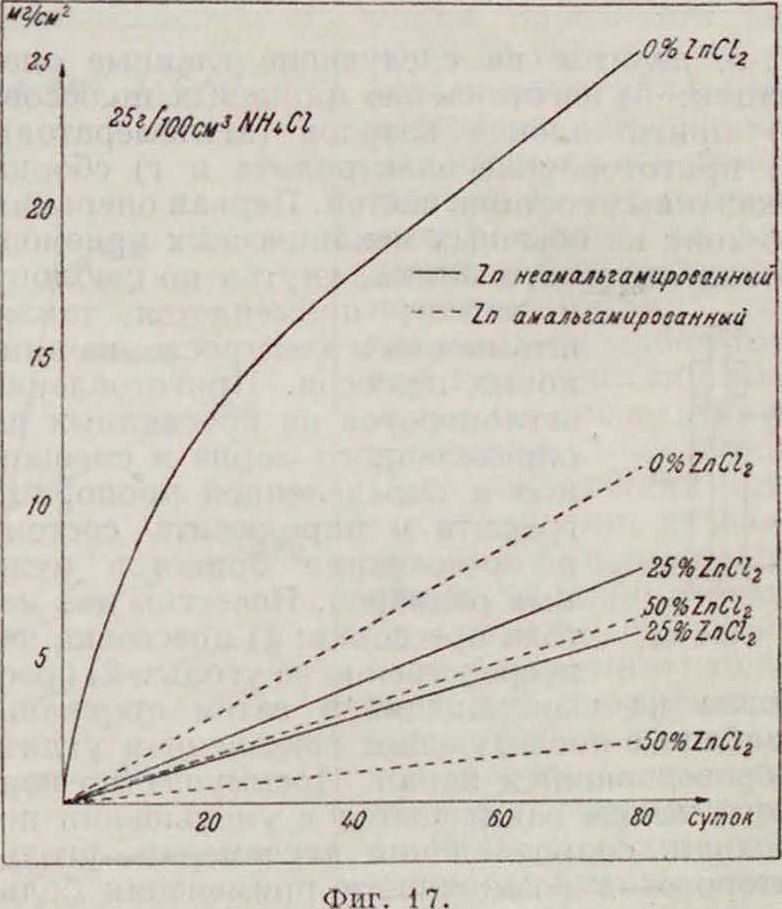
из которой видно, что минимальная коррозия имеет место с 20%-ным чистым раствором NIIjCl (влияние отдельных примесей рассматривается Друкером |35)· Концентрацию NIljCl в электролите сухих элементов, согласно теории, желательно иметь максимальную. Одной из полезных добавок в смысле уменьшения растворения цинка является хлористый цинк (смотрите ур-ие Нернста), как видно нз фигура 17 i42!, для раствора, содержащего 25 г NH4C1 на 100 см· цаствора Zn(_ 12 различной концентрации. Из этого графика также видно, что влияние амальгамирования цинка существенно сказывается на коррозии лишь в отсутствии ZnCl., а также, что увеличение содержания ZnCl2 сверх 25% (уд. вес 1,24) сказывается на коррозии значительно меньше, притом, как следует из теории, невыгодно в отношении скорого образования Zn(OH)2. Интересно отметить, что оптимальная, повидимому, концентрация ZnCl;, отвечает комплексу ZnClj-2NH4C1.
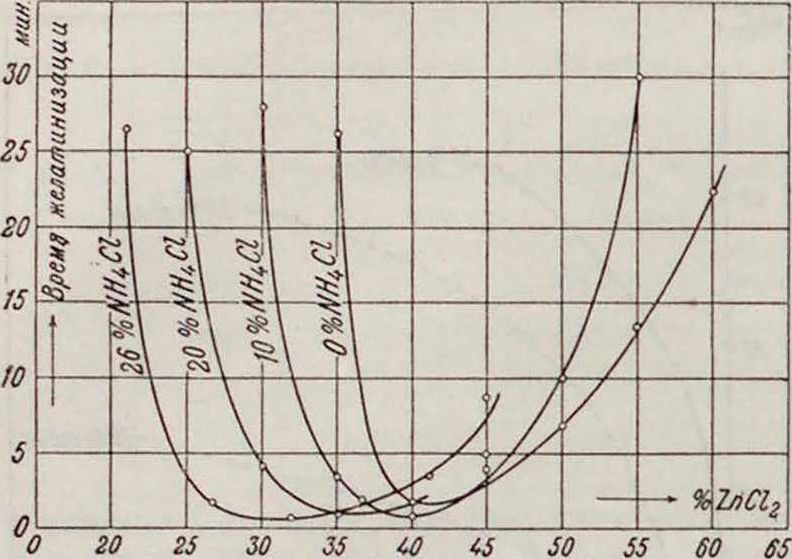
Из других свойств электролита существенным оказывается его вязкость. Но Друкеру [**], 5%-ный клейстер раствора NH4C1 оказывает меньшее действие на цинк, чем 10%тный. Известны два метода желатинизации электролита: 1) жидким электролитом наполняют элемент и затем нагревают до образования клейстера (обычный способ) 2) жела-типизацию производят при обыкновенной t° действием хлорис того цинка [43]. В качестве загустителя обычно применяют смесь двух в ч. крахмала на одну весовую часть муки. Установлено, что наиболее пригодной для сухих элементов является вязкая желтоватая масса, которая получается в случае состава с наименьшим временем желатинизации. Влияние концентрации ZnCl2 на скорость желатинизации растворов видно на фигуре 18. Полученные соотношения позволяют применять два негустеющих в отдельности состава (табл. 1(>), которые при сливании вместе при комнатной температуре дают массу требуемых свойств, и притом в заранее рассчитанное время. Этим ценным качеством

Фигура ι5.
ZnCl2, наряду с отмеченными выше, а также в виду его гигроскопических и консервирующих свойств, объясняются как непонятное на первый взгляд введение в свежий
Фигура 16.
Г. э. материала, образующегося как продукт работы элемента, так и те преимущества в отношении емкости и срока хранения, которыми обладают изготовленные сухими на заводе элементы перед наливными и другими их формами без применения ZnCl2. Образованию двойных соединений с NH3 в последнее время препятствуют применением
электролита без NH4C1, а именно из хлористого магния с добавкой хлористого марганца!30]. Способ напнтывания аггломерата электролитом и наполнение элемента следует рассматривать в отношении его сохраняемости как предохранение Zn от действия на него кислорода воздуха. Необходимый для правильного функционирования и безвредный для расположенного на дне цинка в элементах типа Фери кислород воздуха в сухих Г. э., наоборот, оказывает сильное
Фигура 18.
разрушительное действие на цинк, в особенности в соединении с концентрационной парой (фигура 19) [“], действующей вдоль электрода при вертикальном его расположении.
Технологические приемы производства Г. э. Заводское производство
Таблица 16. — Составы для приготовле-н и я ж с л е о 0 р а з н о г о электролита холодным способом.
| Составные части | Состав А частей | Состав Б по весу |
| ZnCl,.. | 14,3 | 3,8 |
| NH.C1.. | 9,3 | 10,6 |
| н“о.. | 13.6 | 24,1 |
| Крахмал.. | — | 24,5 |
| Итого. | 37,2 | 63,0 |
Г. э. делится на следующие главные операции: а) изготовление цинковых полюсов,
б) приготовление катодов (аггломератов),
в) приготовление электролита и г) сборка указанных составн. частей. Первая операция состоит из обычных механических приемов: резки листового цинка, гнутья по шаблону и пайки; применяется также штамповка и электросварка цинковых полюсов. Приготовление аггломератов из просеянных до определенного зерна и смешанных в определенной пропорции графита и пиролюзита состоит Ч-й{-ь>аг в прессовании брикетов нужных размеров. Известны два ме-Фигура 19. тода прессовки: 1) прессовка непосредственно на уголь и 2) прессовка на вынимающийся затем стержень-итблон с последующим вставлением угля в образовавшийся канал. Преимущество пер-
-ЩС1
вого метода заключается в уменьшении переходи. сопротивления аггломерат—уголь; второго—в возможности применения больших давлений при прессовке. В последнее время распространяется автоматическая прессовка. Отпрессованный аггломерат, надетый на уголь, помещается в матерчатый или бумажный чехол, обычно затягиваемый по спирали тонким шнурком, для придания большей механической прочности и для предохранения массы от выкрашива ния. Этот прием носит название обвязки аггломерата и обычно производится ручным способом. В Америке практикуется более совершенный прием—картонной обшивки аггломерата без хлопотливой обвязки, причем картонная оболочка, заполняя все пространство между аггломератом и цинком, одновременно служит и в качестве сепаратора, а также играет роль наполнителя для электролита. Один из возможных приемов такой механизации обвязки для малых образцов изображен на фигуре 20, согласно которой аггломераты с надетыми на них чехлами с легким трением продавливаются через отверстие холоди, или подогретой матрицы, причем соответственно устроенный пуансон запечатывает донышки. Для надевания зажимов—латунных колпачков—также применяются полуавтоматы. Устройство одного из них дано па фигура 21. Технические данные: вес 9G кг, потребляемая мощность 1/г 1Р, производительность 1 500 шт. в ч. Подобно этому при массовом изготовлении б. или м. механизированы и друг, приемы сборки Г. э.
Испытание Г. э. Испытание электрических свойств производится но двум методам: 1) постоянной силы тока 7=Const и 2) на постоянное сопротивление 7i=Const. В виду простоты более распространен второй метод. Испытания делятся на следующие виды: 1) Испытание внешней характеристики или внутреннего сопротивления; для получения линейной зависимости V=f(l) отсчет V необходимо брать при установившемся его значении. 2) Испытание емкости непрерывной разрядкой V—f{t) при 7=Const
Фигура 21.
или 7i=Const. 3) Испытание способности к хранению; надежного метода до настоящего времени не выработано; косвенно и далеко не точно судят по изменению эдс или по увеличению внутренних потерь за определенный промежуток времени хранения Г э [31|.
4) Испытание максимальной отдачи в условиях б. или м. близких к условиям действительной работы Г. э. (периодич. разряд по америк. нормам). В СССР применялись гл. обр. первые два вида испытаний; в настоящее время имеются попытки применения и третьего вида [33]; наиболее распространена разрядка Г. э. на 10 и сопротивления.
Установлено [J5j. что вид функции Ir—f(<) при /i’=Const для Г. э. с МпОг весьма близко выражается ур-ием: V— VH. — Ьj t, где F„. есть начальное напряжение, Ь—постоянная
Фигура 20.
элемента, t—время. Это соотношение дает возможность аналитически определять среднее напряжение УСр. до любого конечного напряжения Ук из ур-ия:
rr V«. + 2V*.
Vcp.= -ϊ-.
а следовательно, и соответственную емкость гальванического элемента [45·46] ν„ + 2VK i
Ar —
з R
где l0—разрядный период в часах. Первое из уравнений применимо в пределах до Кк.=0,7 V и ниже при разрядных режимахдо 500 часов. При более длин, режимах (обычно не применяющихся на практике)возможно наблюдающееся отклонение (не у всех Г. э.) кривой от своей первоначальной нара-болпческ. формы (на фигура 22 и 23—кривые, снятые для Г. э. одних и тех же размеров и
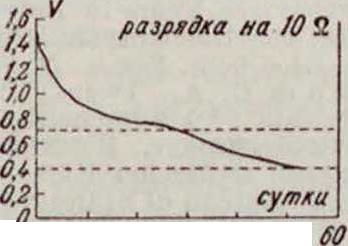
W 20 30 10 50 Фигура 22.
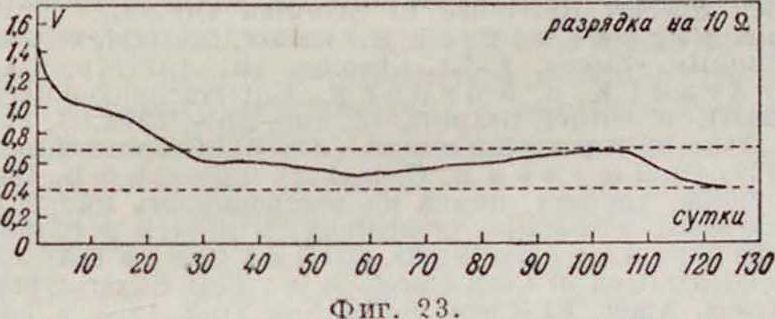
в одинаков!,IX условиях П). В этих случаях применение уравнения V=VU,— b t ограничено более высоким конечным напряжением. Характер изменения емкости Г. э. русской
(фигура 24) [48] Из диаграммы видно, что точки, отвечающие одним и тем же режимам для разных размеров Г. э., лежат на прямых, проведенных из начала координат (лучи сопротивлений), как то следует из уравнения
Т _V„.+ 2VK.
Уср,- з-,
так как, при весьма незначительных колебаниях У,., VCp,=Const, а следовательно, и
V
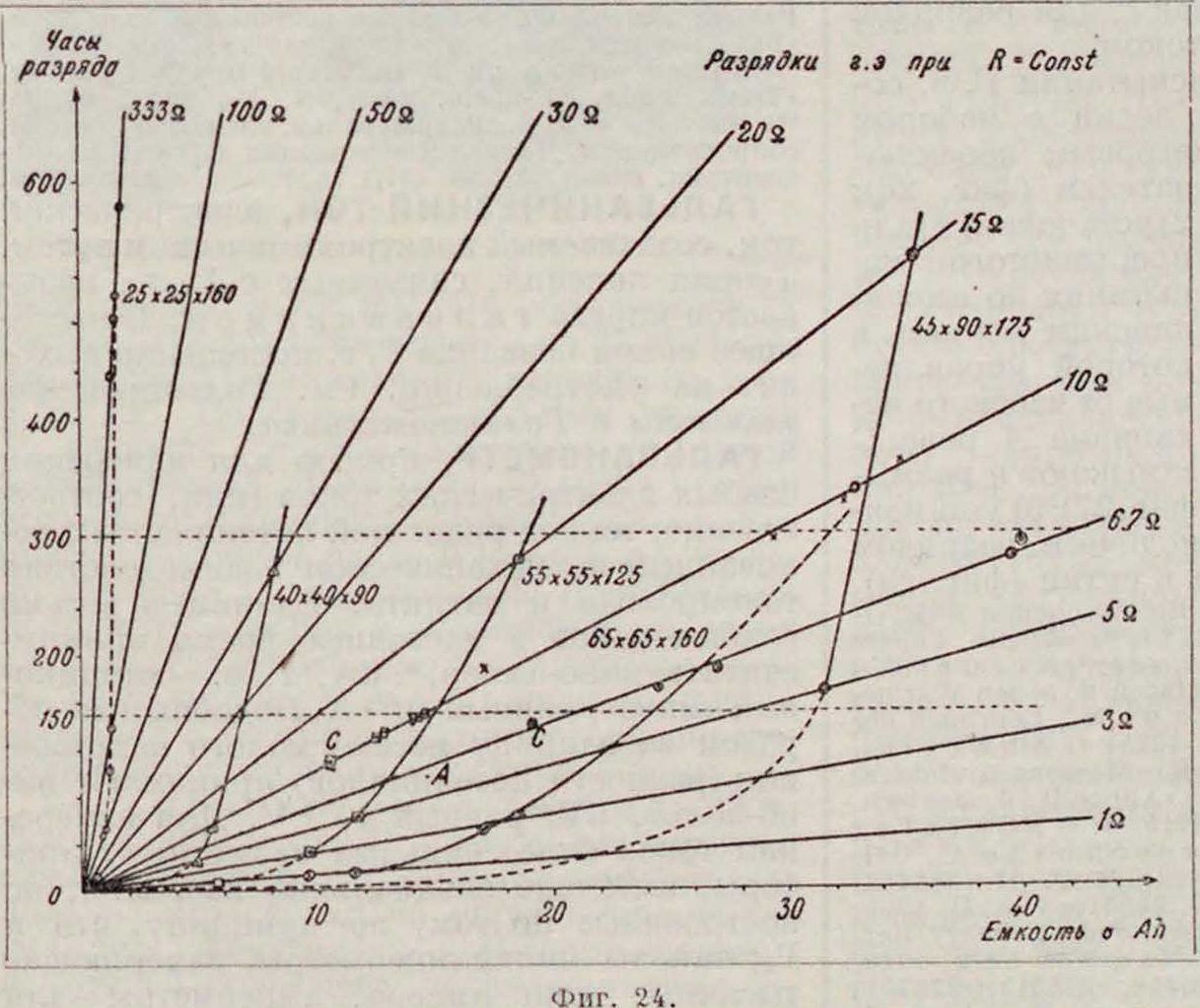
продукции при различ. режимах R=Const показан для нескольких.размеров элементов на диаграмме «время разрядки—емкость»
величина 1Ср., которая определяет наклон луча сопротивления к координатным осям, также=Const, другими словами—средняя разрядная сила тока практически может быть принята независимой от размеров и формы Г. э. и определяется лишь проводимостью внешней цепи (разрядным сопротивлением). Полученные простые соотношения позволяют легко из графика по времени разрядки определять емкость до того конечного напряжения, для которого построена диаграмма. Что касается изменения емкости Г. э. с разрядным режимом, то ряд появившихся в последнее время формул дает возможность с достаточной для практики точностью производить необходимые вычисления. При пользовании этими формулами не надо только забывать что они являются эмпирическими и поэтому, строго говоря, применимы только к той продукции и в тех условиях,в которых эти формулы выводились. Для разрядок при 1=Const к сухим элементам применима формула Пейкерта (смотрите Аккумуляторы электрические): ln-t0=k,
где tu—разр. период в часах; для русск. продукции значение показателя и до FK.=0,7V было найдено [4,1 равным 1,3. Для амери-кан. продукции [13] ташке была установлена справедливость формулы Пейкерта, причем до FK.=0,75V для одного из типов сухих элементов значение п — 2; постоянная к

Фигура 26.
зависит от размеров элемента. Для разрядок при А*=Const формула получает вид:
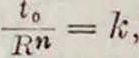
где п равно 1,5 ,t.oFk.=0,75V для америк. продукции [48] и 1,3 до FK.=0,70 V для русской продукции [47]. Вообще относительно постоянных п и к следует иметь в виду, что обе они зависят от FK- и, кроме того, к определяется количеством деполяризующейся массы и степенью ее использования, а п определяется формой элемента и главн. образом толщиной активного слоя деполяризатира.
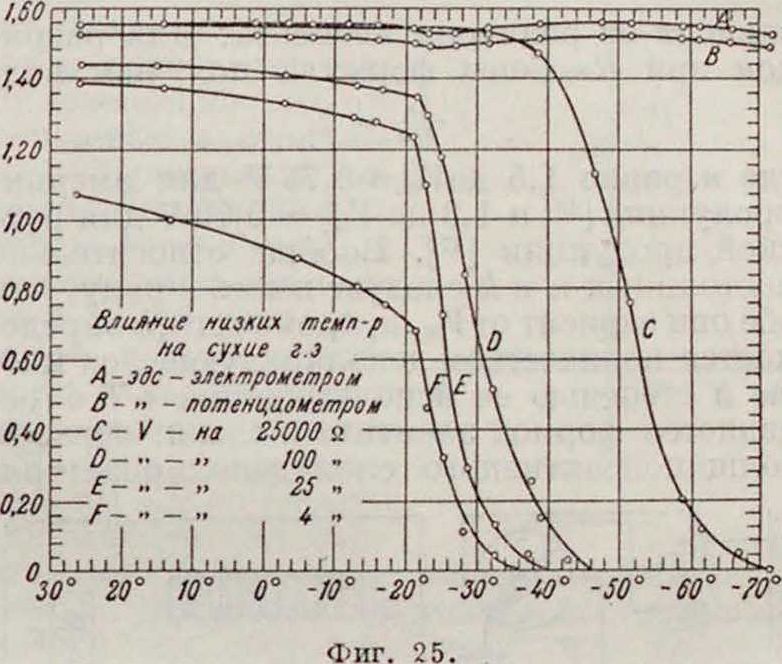
Зависимость разрядного напряжения сухих элементов от Г и разрядного сопротивления видна на фигуре 25, которая показывает, что — 22° является критической t° для разрядок б. или м. значительным током.
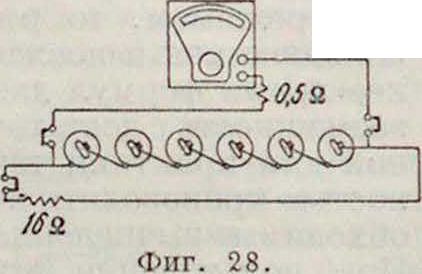
Аппаратура для испытания Г. э. состоит из: 1) разрядной доски с набором сопротивлении и
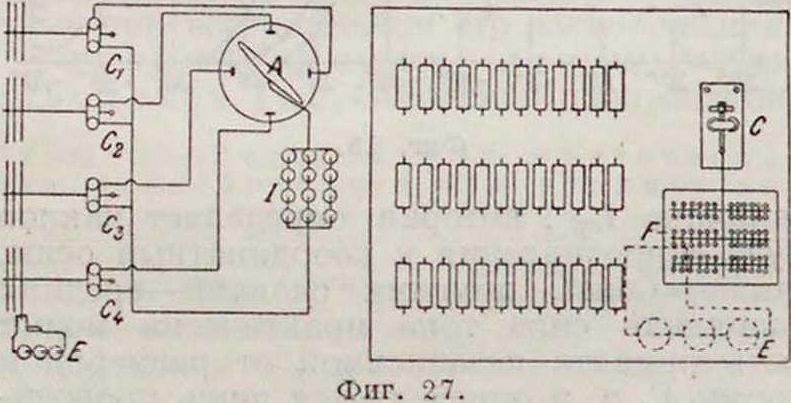
вольтметровым переключателем (фигура 26); 2) установки [23] для прерывистого испытания по американским нормам, в которой управляемые от часового механизма А реле С
замыкают и размыкают испытуемые цепи 7?(фигура 27);3) установки 1231 для испытания периодическ. разрядом батарей запала по 2 часа в сутки (фигура 28).
Лит.: ‘1 Foerster F., Elektrochemio. wiisseri-ger Lflsungen, 4 AtifJ. Lpz., 19‘33; s) -Scient. Papers Bureau of Standards», Wsh. 1922. 434; *) N crust. V. Die tlieor. u. experiment. Grundlagen d. neuen Warme-satzes, Ilalle, 1918; ·) L c HI a n с M., Lehrbuch dor Klektrochemie, 12 Aufl. Lpz., 1 925; 4 Λ Ii e s s It. Auerbach F., L и l Ii e r It. Messnngen elektro-motor. KrSfte ealwan. Kettcn, -Abhandl. d. deutsch. Bunsen-Ges.». Halle, 1911. -5. 1915, “; ·) F о e r s t e r F. ibid., 1909. 2; ’) G il n t h e r s c h и I z e A. Gal-vanlsche F-lemente, Halle, Ю28; *) г. II. 305863, 306942, 309531, 31282,; ») Г. II. 386320; Con. II. 1924; ,a) M a r t и s M. L. The Caustic Soda Primary Bal-tery. «Trans. Amer. Kl.-Chem. Soc.», New York, 1928,
V. 53; ) Г. II. 319477, 326318, 326319. 333751; ”) F 6 г у C h. C li hi 6 у e a η et P a i 1 1 a r d. Piles primaires et accnmulateurs, P., 1925: ls) F6ry C h., Pile in density et и raible usurc locale, «RGE», 1917, t. I. .9, p. 323; “1 Флоренский II. A., ilouue идеи u электрохимии элементов и аккуму ляторов, “Электричество», Москва, 1925, Λ; *) Каталог фирмы Gaiffe-Gallot & Pi Ion. 30, Paris, 1924; “1 Каталог фирмы I.e Carbone -Pile AD». Gennevil-liers; ’) A rndt K., «Z. ang. Cheniie». 1926, B. 39; ’·) Г. II. 387072; “) Г. II. 334890; =’) Daniels F., Physico-Chemical Aspect of the LeclanchO Dry Cell, Trans. Amer. El.-Chem. Soc.», New York, 1928, v. 53; J1) .1 f г c c E. O., Adsorption Phenomena in Primary Cells, ibid.; !!) V. II. 386623, 391151, 402307, 403060, 415233, 457806; ”) Coper V. It. Primary Batteries. L., 1917;·*) Каталог фирмы Siemens & Halske, B.; ,s) Каталог The Chloride of Silver Dry Coll Battery C°, Baltimore; ,s) «Материалы Совещания no источникам тока при Гланолектро ВСН×>, м., 1926; ”) Ф ло ре н-с к и ii II. А., Экономии элементного цинка, «Вест-пик теоретич. и эксперимент, эл.-техники», М., 1928, 1; **) С a in )) A., Chemical Row Material for Dry Cell Industry, «Chem. a. Met. Eng.·. N. Y. Marcii, 1928; ”) И a m bueche n C., Twcntyfive Years in Retrospect: the Electrolytic Rectifier, the Electrolytic Iron, tlie Dry Cells, «Trans. Amer. El.-Chem. Soc.», N.Y. 1927, v. 51; 3°) G о 1 1 i n к h a in C. A., Twcntyfive Years in the Dry Cell Industry, ibid.; J1) Vorschritten-bucb d. Verb. Deutseher Elektroteehniker, I!. 1927; Normen d. Elektrotechnik,Verband Deutseher Elektro-techniker, 1!. 1927; SJ) Circulars Bureau of Standards, 1919, ?9, 1923, 139; **) «Вестник стандартизации». Μ., 1927, б; S,1 Н arms G. Die Stroinvorsorguiig v. l ernmelde-Anlagen, B. 1927; *) I) r u c ke r G., Der Angriff d. Zinks durch Chlorammoninmlftsung, «Ztselir. fur El.-Cbemie», Berlin. 1923. p. 412; ”) A r η n t K., Das Lerlanchi - Element, «ETZ», 1928, 42, p. 816; ) G r u li 1 M., Leclanchi-Element, «Ztselir. filr El.-Cb.», 1925, p. 21 4; *") Z e r e t e 1 i D., Manganese Ore with Special Reference to Georgian Ore, E. 1925; ”) U у s c h k f w it.se h E., Eleklr. Leitfahigkeil d. Grapliits, «Ztschr. f. El.-Chemle», B., 1922, p. 4 74 ; ") A rndt К. и. К δ r n e r E., Untersucbiingen 0 lier ktinstl. n. natiirl. Grapbit, </. ang. Ch.», 1922, B. 35, p. 440; “) Ryschkewitsc b K., Grapbit, Epz., 1926; *’) Л ы 3 л о в Б. C. и И л ь и н с к и ii В. Н. Влияние хлорист. цинка на растворнмост!. цинка в растворах нашатыря (подготопл. к печати в сборн. ПТУ); “) s t a i е у W. И. а. Η о 1 i г,е eht A. J., Gelatinization of Corn Starch in Dry Cell Electrolytes. «Trans. Amer. El.-Chem. Soc.», New York, 1928, v. 53; “) Am. II. 1292764, 1370056; **) Лызлов В. С. Η К а л a ii д а T. Н., Формы разрядных кривых некоторых видов химии, источников тока (яодготовл. к печати в сборн. 11ТУ): *·) М о розов Г. Г., Элементное дело в СССР, доклад Конференции лабораторий по эл. связи, Л., 2П—31/1. 1927(гюдготовл. к печати в сборн. ПТУ); *’) Э л ь с н и ц А. Г. и Морозов Г. Г., Разряд гальванич. элем, при постоянной силе тока, • Война и техника», М., 1926.23 9/281. стр. 20—25; *) /. i in m e r m a n n J. G. Rapid Dry Cell Test i ne. «Trans. Amer. El.-Chem. Soc.», N. Y., 1927, v. 53; *·) Л ы 3 л о в В. C., Разряд гальв. элем, при постояв, сопротивления, Доклад Конференции лабораторий но электрик, связи. Л. 29—31/1 1927. В. Лызпов.