 > Техника, страница 37 > Гидрирование
> Техника, страница 37 > Гидрирование
Гидрирование
Гидрирование, гидрогенизация, присоединение водорода к простым и сложным химич. телам. Только немногие из элементов обладают свойством непосредственно реагировать с газообразным водородом. Подавляющее же большинство сложных химических тел, из которых наибольший интерес с точки зрения Г. представляют органич. соединения, могут связывать водород только в присутствии катализаторов. Т. о., под Г. чаще всего понимают каталитич. связывание водорода органич. со-е д и н е н и я м и. Вместе с Г. целесообразно рассматривать также и каталитич. восстановление (дезоксидацию), так как оба процесса в одинаковой степени связаны с явлениями активирования и практически достигаются тождественными методами.
Явления Г. относятся к области гетерогенного катализа, и решение вопроса о механизме Г. неразрывно связано с выяснением общих каталитич. проблем (смотрите Катализ). В истории катализа крупную роль сыграла т. н. теория промеж у.т очи ы х соединений. Применительно к Г. эта теория наиболее полно развита французским химиком Сабатье. Он считает, что на поверхности катализирующего металла при взаимодействии с водородом образуются малоустойчивые, но поддающиеся стехиометрия, учету соединения, которые способны отдавать свой водород ненасыщенным или содержащим кислород веществам в активной (по всей вероятности, атомной) форме. Так. обр. каталитич. активность, по Сабатье, зависит от двух важных моментов: от способности
Класс и ф и к а ц и я гидр и д о в.
| Соле- | ||||
| образные МеталлоподоОные | Летучие | |||
| гидриды гидриды | гидриды | |||
| Ile | ||||
| L1 | Be IB | С N 0 F | Ne | |
| Na | Mg A1 | Si P S Cl | Ar | |
| К Са | Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga | Ge As Se Br | Kr | |
| Rl) Sr | Yt Zr Nb Mo Ma Ru Rh Pd Ag Cd In | Sn Sb Te J | X | |
| Cs Ва | • Ilf Та V Re Os Ir Pt Au Hg Tl | Pb Bi Po | Em | |
| Ra | Ac Th — U | |||
| * Редьле земли. | ||||
данного металла образовывать с водородом гидриды и от степени устойчивости последних, то есть от большей или меньшей степени легкости отдачи ими атомного водорода (смотрите). Так, например, Г. этилена может быть выражено уравнениями:
2 Νί + Н,=NUH,;
Ni,II, + С.П,=С.Н, + 2 Ni.
Действительно, некоторые металлы, являющиеся катализаторами в процессах Г. (наир, палладий), обладают свойством в мелкораз-дробленпом состоянии поглощать водород. Однако, вопрос о том, образуются ли при этом химические соединения или системы типа твердых растворов, до сих пор нельзя считать вполне выясненным.
Рентгеноскопич. исследования металлов, заряженных водородом, и измерения теплот адсорбции не дали вполне однозначных результатов [’]. Тем не менее, в некоторых случаях химич. путем удалось доказать, с большей или меньшей степенью достоверности, образование гидридоподобных металлич. соединений. Так, папр., Шленк [2| из водорода и никеля получил соединение, отвечающее ψ-ле NiHj и обладающее гидрирующим действием. В связи с углублением и расширением областей катализа, доступных детальному изучению, выявилось много новых моментов, частью физич., частью же химич. порядка, показавших, что гидрогенизацион-пые явления протекают значительно сложнее, чем это представляется теорией проме-жуточных соединений в той форме, в которой она была дана Сабатье. Большое значение для Г. имеют явления адсорбции и связанная с последними ориентировка адсорбированных молекул, их деформация и др. явления, имеющие место в поверхностном слое.
Вместе со старой теорией промежуточных соединений потерпела крушение и чисто физическая теория Г., согласно которой катали-тич. активность мелкораздробленных металлов вызывается исключительно физическими факторами—сильным сжатием поглощенных реагирующих веществ и происходящими при этом местными разогреваниями.
Первые наблюдения в области каталитнч. восстановления были сделаны в начале 19 в Деви и практически использованы Деберей-нером (водородное огниво) над соединением кислорода и водорода под влиянием платины. В 1838 г. Кульман нашел, что при нагревании азотной кислоты или ее паров вместе с водородом в присутствии платиновой черни происходит образование аммиака. Каталитнч. свойства платины были далее использованы Коренвиндером для соединения иода и водорода и Дебусом для восстановления синильной кислоты в метиламин. Зайцев с успехом применил порошкообразный палладий для восстановления нитробензола в анилин. В 1874 г. де-Внльде провел Г. ацетилена в этилен и далее—в этап. Широкое применение Г. начинается с 1897 года, после того как Сабатье иСандерен разработали метод гидрирования органическ. соединений впарообраз-ном состоянии в присутствии мелкораздробленных металлов, главным образом, никеля. Дальнейшее развитие гпдрогснизационного катализа связано с именами Фокина, Ипатьева, Вилынтеттера, Пааля, Скита и Шретера.
В зависимости от того, в каком аггрегат-ном состоянии применяется гидрируемое вещество—в виде пара (газа) или жидкости (раствора), различают два метода Г.
1) Г. в парообразном состоянии. Этот метод состоит в том, что через слой катализатора, которым могут служить металлы: никель, кобальт, железо, медь и платина, пропускают пары гидрируемого вещества вместе с водородами. Наибольшей активностью обладает никель;затем следуют по порядку: кобальт, платина, железо и медь. Однако, на практике почти всегда пользуются никелем и в редких случаях—медыо (папр., для восстановления нитросоедипе-ний). Иногда Г. происходит уже при обыкновенной темп-ре; чаще же всего оптимальная t° лежит между 150 и 200°. Схема расположения частей лабораторной аппаратуры показана на <риг. 1. Водород, получаемый при
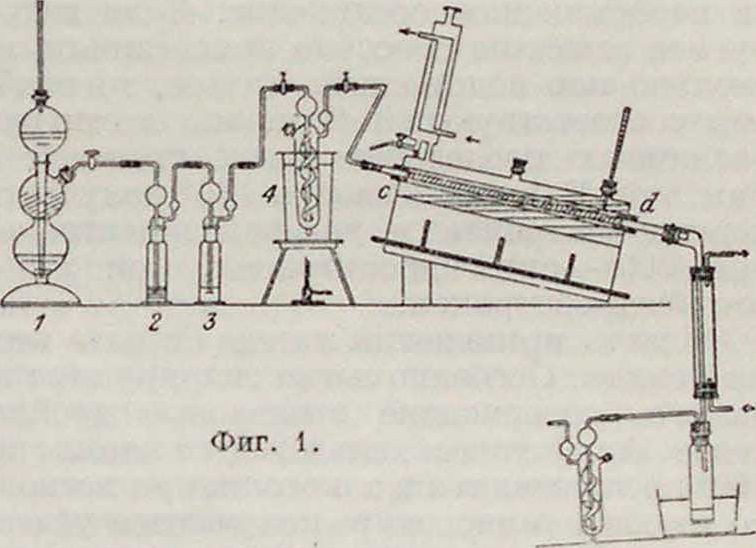
помощи аппарата Киппа 1, проходит через промывные трубки 2, 3, сосуд с гидрируемым веществом 4 и затем в трубку cd с катализатором.
Для выполнения Г. большое значение имеет способ приготовления никелевого катализатора. Он обычно получается восстановлением в токе водорода окиси, гидроокиси или основного карбоната никеля. Активность катализатора в значительной степени зависит от 1° восстановления: чем она ниже, тем активность больше. Так, например, никель, восстановленный из окиси при t° выше 350°, уже непригоден для Г. ароматическ. соединений, а выше 450°—почти лишен заметного каталитнч. действия. Вместе с каталитическ. активностью растет также свойство катализатора вызывать побочные реакции (распад, перегруппировки, отщепление воды). Так, например, фенол при Г. в присутствии никеля, восстановленного при 250°, превращается в циклогексан (бблыная часть), циклогексен и циклогексанол; при Г. же никелем, приготовленным при 310°, циклогексан почти вовсе не образуется. Присоединение водорода к различным ненасыщенным группам происходит с различной скоростью, и потому, выбирая ту или иную темп-ру восстановления окиси никеля, то есть получая катализатор различной степени активности, можно достигнуть частичного Г. Для увеличения ак-тивн. поверхности катализатора никель иногда отлагают на различных веществах (носителях). Для этой цели применяют: пемзу, кизельгур, глину, различные сорта гидросиликатов алюминия п магния, животный или костяной уголь, липовый, сахарный уголь, а также сульфат бария, окись алюминия и т. и. индифферентные вещества, выдерживающие высокую 1°. Хлор, бром, иод, фосфор, сера и сернистые соединения вызывают даже в минимальных количествах сильное падение активности катализатора. Отсутствие сернистых соединений особенно важно при I’. веществ ароматического ряда. Поэтому водород, применяемый при операциях Г., предварительно подвергают самой тщательной очистке.
Темп-ру Г., в зависимости от гидрируемого вещества, необходимо держать в определенных, иногда очень узких, пределах. При низких темп-pax скорость Г. мала, при высоких—она достаточно велика, но с повышением 1° иногда происходит обращение процесса — наступает дегидрирование, то есть водород отщепляется, и образуется снова ненасыщенное соединение. Если гидрируемое вещество способно присоединять несколько пар водородных атомов, то подбором соответствующей t° можно достигнуть различных последовательных ступеней Г. Так, при Г. антрацена при 180° получается пергидроантрацен и додекагидроантрацен, при 200°·—октогидроантрацен, при 260°— тетрагидроаптрацен.
Область применения метода Сабатье весьма велика. Особенно легко гидрируются вещества, содержащие этиленовые двойные связи. Алифатнческ. альдегиды и кетоны при 160° превращаются в голи; при несколько высшей температуре получаются углеводороды. При каталитическом восстановлении ацетальдегида в этиловый втехнике берут большой избыток водорода (приблизительно в 30 раз больше, чем требует теория) для более равномерного распределения теплоты реакции. Примеси уксусной кислоты понижают активность катализатора; небольшие примеси кислорода, наоборот, выгодны, т. к. при полном отсутствии кислорода образуется около 15% этилового эфира. Ароматич. альдегиды и кетоны превращаются в углеводороды; например, из ацетофенона образуется этилбензол, из бензола—дифенилэтан. Из алифатич. азотистых соединений (нитросоединений, алкилнитрнтов, оксимов, азинов, анилов, нитрилов) при 180—220° получаются первичные, вторичные и третичные амины. Восстановление в присутствии никеля ароматич. питросоединепий не дает удовлетворительных результатов. Поэтому в таких случаях пользуются медным катализатором, к-рый получают восстановлением в токе водорода гидрата окиси меди при 180—200°. Для этой лее цели были предложены также золото и серебро (Г. II. 263396), закись и закись-окись железа (Г. П. 273322). Одним из наиболее важных применений метода Сабатье является гидрирование ароматических соединений. Бензол при 180—190° коли-Фигура 2. чественно переходит в циклогексан, —в метил-циклогексан. Гомологи бензола при повышенных температурах гидрируются с отщеплением наиболее длинных боковых цепей; фенол при 180—190° превращается в смесь цик-

логексанола и циклогексанона, наряду с небольшими количествами циклогексана. При повторном пропускании этой смеси вместе с водородом над никелем при 140—150° получают чистый циклогексанол, находящий широкое применение в технике. Ароматич. амины, наряду с нормальными продуктами Г., частично отщепляют аммиак и превращаются во вторичные амины. Гетероциклические соединения при Г. легко разлагаются, а потому рекомендуется приготовлять их гидропродукты иными способами.
2) Г. в состоянии раствора. Метод Сабатье непригоден, если тело, подлежащее гидрированию, при переходе в парообразное состояние разлагается. Этот недостаток устраняется методами проведения процесса в состоянии раствора. Впервые ги-qjt) дрнрование в жидкой фазе применено Норманом при —η—у? гидрогенизации ненасы-
/( JF щенных жирных кислот и
J J f j жиров на гидрогенизаци-
/<? окном заводе 1-Ierforder Ма-
schinenfett- unci Olfabrik
Фигура з.
(Г. Π. 149029). В 1906 г. Ипатьевым был найден новый способ Г.—при повышенных давлениях. Около этого же времени Пааль и Скита разработали методику Г. посредством коллоидального палладия или платины. Первое Г’, жидких органических веществ при помощи платиновой (или палладиевой) черни было осуществлено Фокиным и впоследствии детально разработано Вилылтеттером. Способы Г. в состоянии раствора имеют ряд преимуществ перед способом Сабатье, так как, кроме возможности точного учета расходуемого водорода, они позволяют вести Г. при низких темп-pax; этим устраняются вредные побочные явления в виде перегруппировок, отщепления воды и разложения образующихся продуктов.
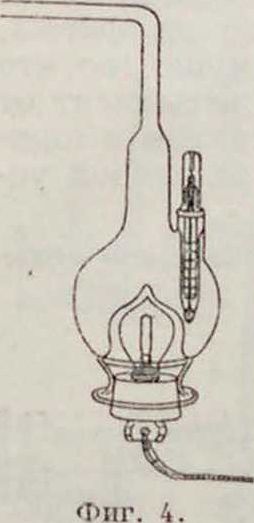
Одним из существенных условий Г. в жидкой фазе является возможно полное перемешивание гидрируемого вещества, катализатора и водорода. В лабораториях для этой цели применяют сосуды специальной формы (фигура 2 и 3), которые или помещают на болтушку или встряхивают при помощи особых приспособлений. Для гидрирования при нагревании применяют сосуды, в нижней части которых вставлена электрическая лампочка. служащая источником тепла (фигура 4). В технике тесное соприкосновение реагирующих веществ с катализатором достигается применением эмульсий или просто энергичным перемешиванием; в качестве катализатора применяется почти исключительно никель (его окиси и соли). Гидрирование приходится вести при несколько повышенных температурах (100—170°) и давлениях (3—15 atm).
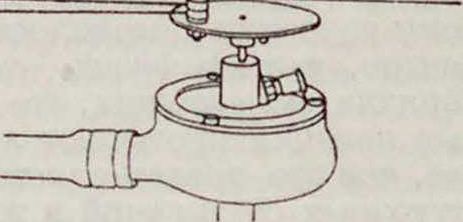
Способ Ипатьева состоит в том, что вещество, подлежащее Г., нагревают в авто-клаве (катализаторы—железо, медь или, лучше, никель или его окись), в который нагнетают водород под давлением свыше 100 atm. Автоклав, так называется Ипатьева, сделан из мягкой стали и способен выдерживать давления около GOO atm при 000°. Он находится в электри-ческ. реостатной печи, соединенной с приводом для встряхивания (фигура 5). Ход Г. контролируется показаниями ма-нометра.Но Ипатьеву,окислы никеля обладают бблыней ка-талитическ. активностью, чем свободный металл. Обладают ли при этом окислы специфич. свойства^! или только изменяют физическ. структуру катализатора, увеличивая его активную поверхность,—вопрос, несмотря на многочисленные попытки, до снх пор нерешенный. Область применения способа Ипатьева та же, что и способа Сабатье.
В методе Фокина-Вилыптеттера в качестве катализатора применяется платиновая или палладиевая чернь. Она приготовляется восстановлением формальдегидом щелочных растворов хлористых солей платины или палладия. По Вильштеттеру, каталитическими свойствами обладают только те металлы, которые заключают в себе небольшое количество кислорода []. В процессе Г. платиновая чернь теряет кислород, и потому активность катализатора постепенно падает, и, наконец, поглощение водорода совсем прекращается. При повторной обработке катализатора кислородом или воздухом его

активность достигает первоначальной величины. Чем труднее гидрируется вещество, тем чаще приходится прибегать к периодич. зарядкам кислородом. Вместо платиновой или палладиевой черни эти металлы можно осаждать на индифферентных носителях: карбонате кальция, сульфате бария, животном или костяном угле или мелко размолотой пемзе. Многие вещества действуют, как каталитические яды. Особенно следует остерегаться ртути, сероводорода, сероуглерода, сернистых и овистых соединений и синильной к-ты. Присутствие хлороводорода также сильно понижает активность катализатора. В качестве растворителей применяются: вода, ацетон, эфир, этилацетат и ледяная уксусная к-та. Природа растворителя имеет весьма большое значение для скорости Г. При Г. ароматических соединений рекомендуется пользоваться ледяной уксусной кислотой. Область применения этого способа почти неограничопа.
Способ Пааль-Скита основан на применении коллоидальных растворов платины и палладия. Для получения устойчивых золей этих металлов пользуются защитными коллоидами. В качестве таковых Пааль предложил продукты щелочного гидролиза яичного альбумина—т. н. лизальбнновую и протальбиновую кислоты; Скита предложил гуммиарабик. Для приготовления катализатора но Паалю раствор протальбиново-кислого натрия, соды и хлористого палладия (или платины) восстанавливают гидразином или водородом. После диализа,выпарки в вакууме и сушки в эксикаторе получают черные пластинки, которые образуют с водой растворы коллоидального металла. По Скита, коллоидальные растворы приготовляют нагреванием хлористого палладия с водным раствором гуммиарабика. После охлаждения в раствор пропускают водород, благодаря чему получается темный коллоидальный раствор палладия. Небольшое количество этого раствора служит «затравкой» при получении палладиевых золей: к раствору хлористого палладия приливают затравку и обрабатывают водородом, причем образуется металлический палладий в виде устойчивого золя.
Но способу Пааля Г. необходимо вести в щелочных или нейтральных растворах, т. к. в кислых средах соли протальби повой или лизальбиновой к-т разрушаются, и свобод-πι,ю кислоты выпадают в виде осадка. Способ лее Скита пригоден для Г. и в кислых (уксуснокислых) растворах. Кельбер рекомендует в качестве защитного коллоида продукты гидролитич. распада глутина. Г. этими способами б. ч. ведут при обыкновенной t°, редко—при повышенной; иногда применяют и повышенное давление.
В технике Г. пользуются для приготовления твердых жиров из жидких растительных масел (смотрите Гидрогенизация жиров) и для получения разнообразных гидрированных ор-ганич. соединений; некоторые из этих соединений нашли в последнее время широкое применение в качестве растворителей (д е-калии, тетралин, гексалинаце-т а тонн), осветительных масел и топлива для моторов. Ожижение угля, то есть превращение его в жидкие углеводороды (процесс Бер-гиуса), является одной из важнейших технически осуществленных гидрогенизацион-ных операций. Гидрирование окиси углерода проводится в технике в широком масштабе с целью получения синтетического метилового а — метанола. Г. окиси углерода привело к получению смесей разнообразных химич. соединений, пригодных для моторного топлива (смотрите Синтол), и к разработке способов получения искусственной нефти. Гидрирование ацетальдегида одно время проводилось в техннческ. масштабе
на Elektrizitatswerken Lonza в Базеле с целью получения этилового а, но в настоящее время оставлено вследствие повышения цен па уголь и нерентабельности.
Лит.: ) Jamado М., «Philos. Мар.». London, 1924, у. 4 5, р. 241; Fo resti, «(Jazz. chim. ital.». Roma,
1 923, v. 53, p. 487; *) S c h 1 e n к W. nndWeich-selr elder 1923, B. 56, p. 223П; *) W 11 1-
Statter R„ «11», 1918, B. 51, p. 767, 1921, B. 54, p. 113, 1923, B. 56, p. 138S; Waldschmidt-L e i t z E., «R», 1927. B. 58, p. 563; Sabatier P., Hie Katalyse in d. organ. Chemie, 2 Auf). Lpz., 1927; H oubrn J. Die Methoden der organ. Chemie, B. 2, Lpz. 1 925. С. Медведев.