 > Техника, страница 45 > Едкий натр
> Техника, страница 45 > Едкий натр
Едкий натр
Едкий натр, NaOH, гидрат окиси натрия, каустическая сода, белая непрозрачная масса с волокнистым изломом, уд. в 2,0—2,13, плавящаяся в безводном состоянии при 318°, t°mm_ 1388°; Е. н. легко растворяется в воде с значительным выделением тепла, давая сильно щелочи, раствор.Теплота образования NaOH из элементов—101,9, а в растворе 111,8 Cal. Для теплоты растворе-нияв 200 молях воды Томсен нашел величину +9,9, а Вертело (в 135—154 молях при 10,5°) + 9,8 Cal. Теплота образования моногидрата из безводного NaOH равна 3,25 Cal; удельная теплоемкость NaOH между0 и 98°—0,78. В 1/1N растворе диссоциировано на ионы более 70% NaOH, а в 1/10N растворе—ок. 90%. Существует несколько гидратов Е. н.: с 1, 2 и 3,5 молекулами Н20 (их Кпл. соответственно: 64,3, 12,7 и 15,6°). Во влажном воздухе Е. н. расплывается, но в присутствии углекислоты быстро покрывается белой коркой соды, и расплывание прекращается (отличие от едкого кали).
Растворы Е. н. уже давно приготовляли кустарным путем для целей мыловарения, но первая попытка заводского производства была сделана лишь в 1844 году в Англии. С 1890 г. начинает применяться электролитический метод. Для получения Е. н. можно исходить или из маточных растворов, остающихся при производстве соды по способу Леблана после выделения главной массы соды, то есть из т. н. красного щелока, или же из содового плава, изменив пропорции при его получении, то есть увеличив количество угля. Плав выщелачивают водой при 50° и выпаривают раствор, причем выделяются сода, сернокислый и хлористый нат рий, и жидкость приобретает кирпично-красный цвет (вследствие образования двойного соединения сернистого натрия с сернистым железом). Отделенный от солей щелок, содержащий также и цианистый натрий, продолжают сгущать. Для разрушения примесей через раствор продувают воздух (при этом происходит окисление Na2S в Na2S203) и при более высокой 1° прибавляют малыми порциями селитру; цианистый натрий разлагается с выделением аммиака, железо осаждается, сернистые соединения окончательно окисляются. Освобожденный от солей (путем вычерпывания их) и осветленный щелок с уд. в 1,5 переводят в плавильный котел.
Общеизвестным и наиболее распространенным способом получения Е. н. является взаимодействие раствора соды с известковым молоком (известковый способ):
Na2C03 + Са(ОН)2 ^ 2Na0H + CaC03.
Выход Е. н. тем больше, чем слабее раствор соды, но в технике предпочитают пользоваться 10—12%-ным раствором соды. Реакцию ведут в железных цилиндрах, снабженных мешалками, нагревая раствор в течение 1—Р/2 часов паром до кипения. Высокая t° только ускоряет течение процесса, но не изменяет существенно выхода. Увеличение давления не сказывается на результате. Для реакции пользуются обыкновенно аммиачной содой, как более чистой. Для фильтрования растворов пользуются или фильтрпрессами или вращающимися нучами. Последние имеют вид барабанов, обтянутых фильтрующей тканью, а поверх нее—дырчатыми железными листами. Такой цилиндр медленно вращается вокруг горизонтальной оси в корыте, наполненном фильтруемой жидкостью. Радиальными перегородками он разделен на ряд камер, соединенных с отсасывающими насосами. Жидкость засасывается в эти камеры, откуда поступает в сборные чаны, а осадок остается на поверхности цилиндра. Содержащийся в нем NaOH промывают струей воды, после чего осадок удаляют скребком. Щелок, получающийся при работе по известковому способу, содержит 10—12% NaOH.
Из других химическ. способов получения Е. н. можно упомянуть еще о способе Лё-вига (Г. П. 21593), предложенном в 1882 г. По этому способу, возможно более чистую соду прокаливают с чистой окисью железа, свободной от кремнезема и глинозема, в муфельных или ных печах при ярко-красном калении. Происходит выделение углекислоты и образование феррита натрия: Na2COs + Fe3Os=Na2Fe20, + С02. Последний, представляющий собой крупнозернистый зеленоватый порошок, разлагается горячей водой на NaOH и окись железа, которая снова поступает в производство: Na2Fe20i + Н20=2 NaOH + Fe303. Предварительно извлекают холодной водой легко растворимые соли: Na2C03, NaCl. Получаемый щелок очень чист; содержание NaOH достигает в нем 25—30%. Хотя такие крепкие растворы требуют для выпаривания меньше топлива сравнительно с растворами, получающимися при известковом способе, но в общем расход топлива при работе по способу Лёвига оказывается выше. Больше всего примесей содержит технич. Е. н., полученный из соды, приготовленной по способу Леблана.
Электролитически Е. н. получается из раствора хлористого натрия по уравнению:
2 NaCl + 2 Н.О=2 NaOH + Н2 + С1„.
Как ни проста эта реакция, однако, прак-тич. осуществление ее уже в первых стадиях встречает ряд затруднений: освобождающийся хлор легко реагирует со щелочью, давая ряд побочных продуктов (соли хлорноватистой и хлорноватой к-т). Во избежание этого растворы, находящиеся у катода и у анода, предохраняются от взаимного смешения, например,путем установки в ванне диафрагмы. Диафрагма должен быть устойчивой к хлору и щелочи, достаточно проницаемой и недорогой. Образовавшаяся щелочь также принимает участие в электролизе, причем к аноду передвигаются ионы ОН, обладающие наибольшей подвижностью из всех анионов. При комнатной ί° и при падении потенциала в 0,1 V на 1 см, подвижность их составляет 0,0018 миллиметров/ск, или 6,48 миллиметров/ч. Реагируя с растворенным в жидкости хлором, ионы ОН будут давать ионы хлорноватистой кислоты: 2 ОН + С1„ -»· СЮ + СГ + Н,0.
Кроме того, и элементарный хлор реагирует у анода с водой по ур-ию:
ei, + н,о ί; н· + Cl + н· + ocr. Разряжение ионов СЮ сопровождается образованием кислорода, примешивающегося к хлору, и ионов хлорноватой к-ты:
6СЮ + ЗН20 -S- 6Н + 2СЮ; + 4С1 + 30.
Кислорода образуется тем больше, чем слабее раствор соли. Поэтому необходимо работать с концентрированными растворами. Кислород может образовываться на аноде и при разряжении анионов SOi, если в техническом NaCl присутствует примесь сернокислых солей. Поэтому нужно заботиться о том, чтобы в исходной поваренной соли их было возможно меньше. Очень серьезным является вопрос о материале электродов, особенно анода, у которого выделяется хлор. Раньше аноды изготовлялись из размолотого кокса или ретортного угля с прибавлением смол и последующим обжиганием их. Отличаясь устойчивостью по отношению к хлору, они окисляются кислородом в момент его выделения, и т. о. к хлору примешивается углекислота. При значительном ее содержании (до 10%) хлор становится уже непригодным для получения хорошей белильной извести. Вообще, чем более порист уголь, тем быстрее он разрушается. Значительно устойчивее аноды из графита Ачесо-на, изготовляемые в Америке, а в настоящее время и в Германии. Совершенно не образуется С02 при магыетитовых анодах из сплавленной при ί° 2 000—3 000° закиси-окиси железа Fe304 (Г. II. Грисгейм-элек-трон 157122 и 193367). Они проводят ток несколько хуже, чем угольные аноды, и требуют поэтому большего напряжения (4,05— 4,1V вместо обычных 3,65V). Зато они очень прочны, служат по 5—7 лет и по нерастворимости не уступают платине. Материалом для катодов служит обычно железо. Правда, оно не вполне устойчиво в щелочной среде и разъедается в концентрированных растворах соли (особенно в присутствии хлоратов), но зато на железе в щелочной среде водород очень легко выделяется (разряжается), а, кроме того, железо дешево, почему его и предпочитают никелю и меди.
Способы электролитич. получения едких щелочей м. б. сведены к 3 типам. Отличительными признаками их являются: 1) твердые катоды и диафрагмы, 2) твердые катоды без диафрагм (с применением колоколами 3)жид-кие катоды (ртутный способ).
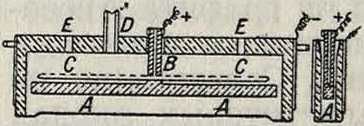
I тип (с применением диафрагмы). Электролитич. производство едких щелочей впервые было осуществлено в технич. масштабе на заводе в Грисгейме.в 1890 г., после того как удалось приготовить надлежащую диафрагму из цемента на растворе поваренной соли (Г. Г1. 34888). После затвердевания цемента соль выщелачивается водой, благодаря чему получается очень мелкопористая прочная пластина. Было предложено много различных диафрагм (состоящих обыкновенно из асбеста или асбеста с цементом и тому подобное.) и различных видоизменений первоначального способа. Способ, принятый в Грисгейме, состоит в следующем. Ряд железных ванн площадью 5x3,5 ж2, содержащих каждая по 12 ячеек, соединены последовательно группами по 30 шт. (ячейки каждой ванны включены параллельно).Каждаятакая группа питается постоянным током от динамо-машины в 110 V при 2 500 А, так что на каждую ванну приходится в среднем напряжение в 3,65 V; при большей силе тока напряжение—выше. На фигуре 1 показаны ячейки в вертикальном разрезе. В каждой ячейке находится продолговатый оцементи-рованный ящик D площадью в 1,1x0,75 ж2 и высотой в 1 метров В боковых стенках каждого ящика вставлено 6 пористых цементных диафрагм (по две на длинных и по одной на узких сторонах ящика). Против диафрагм в каждом ящике подвешены 6 толстых угольных анодов А, которые присоединены к одному общему проводнику. Посредине помещается глиняный сосуд i с отверстиями, наполненный твердой солью, периодически добавляемой. Снаружи ящиков (в катодном отделении) укреплены железные пластины К, соединенные со стенками ванны и служащие катодами. Анодное и катодное отделения закрыты крышками, через которые выходят трубы а и h для отвода хлора и водорода. Ванну наполняют крепким раствором соли, который нагревают до 80—90°; нагревание ведется при помощи паровой трубы w. Когда разложится ок. % соли, катодный раствор, содержащий 60—80 з NaOH (или 80—110 з КОН) на л, выпускают из ванны и подвергают выпариванию, ванну же наполняют свежим раствором. По мере увеличения количества щелочи в жидкости ионы ОН принимают все большее и большее участие в
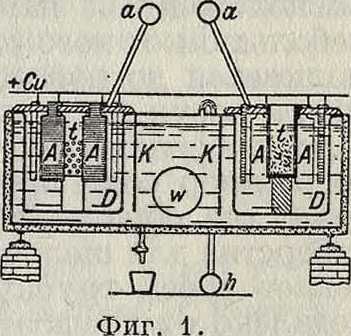
переносе электричества, и на аноде начинает выделяться не более 80—85% теоретич. количества щелочи и хлора. Уменьшение выходов хлора и щелочи, обусловливаемое передвижением гидроксильных ионов к аноду, пытались парализовать (например в способе Гар-гривс-Бёрда, Нельсона) тем, что раствор заставляли непрерывно протекать в обратном направлении (от анода к катоду) при вертикальном положении диафрагм. Впоследствии были предложены горизонтальные диафрагмы.
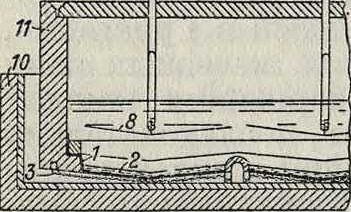
Одним из лучших и довольно распространенных способов I типа в настоящее время является способ Биллитера (Г. П. 191234 и 254780), разработанный им совместно с фирмой Сименс и Гальске. Аппарат Биллитера снабжен горизонтальной диафрагмой, и в нем имеется постоянное движение раствора соли от анода к катоду. Продольный и поперечный разрезы аппарата приведены на фигуре 2 и 3. Аппарат состоит из колокола 11, закрытого снизу диафрагмой 2, покрывающей железную или никелевую сетку 3, служащую катодом. Колокол окружен
Фигура 2. Фигура 3.
сосудом 10. Внутри колокола находится анод 8 из платины, угля или магнетита, расположенный параллельно катоду и на небольшом от него расстоянии. Колокол наполняется до известной высоты электролитом, а сосуд 10 остается временно пустым. Т. к. диафрагма проницаема для жидкостей, то раствор соли проникает через нее к катоду, где образуется NaOH; 13—выходное отверстие для щелочи. Свежий раствор притекает через трубку 12, оканчивающуюся недалеко от диафрагмы. Во время электролиза уд. вес верхней части раствора уменьшается, так как она беднеет солью, а уд. в нижней части увеличивается. Т. о., непосредственно над диафрагмой образуется довольно резкая поверхность раздела. Если к колоколу присоединить камеру 9 из непроницаемого материала,наполненную твердой солью, так, чтобы слой, непосредственно прилегающий к диафрагме, постоянно насыщался ею, то уд. в его еще более увеличится. В сосуде 10 помещена еще перегородка 5, через к-рую должен перетекать раствор, так что он омывает катод также и с нижней стороны. Благодаря этому приспособлению удаляются даже незначительные количества NaOH, продиффундировавшего в колокол, т. к. переливаться через перегородку должен именно самый нижний слой, непосредственно прилегающий к диафрагме. (Для большей наглядности расстояние между 5 и 11 на чертеже несколько преувеличено; в действительности же оно очень невелико.) Диафрагмой 2 служит паста из асбеста и сернокислого бария, которая накладывается слоем на асбестовое полотно 1, покрываю щее катод; паста эта приготовляется осаждением сернокислого бария с мелким асбестом из 20%-ного раствора поваренной соли; ее легко высушивать, придавая любую форму, к-рую она сохраняет даже при продолжительном нахождении в жидкой среде. Такие диафрагмы очень прочны и в случае надобности могут быть легко сменены. Вследствие своей гибкости диафрагма плотно прилегает к катоду и не отстает от него при выделении водорода; т. о., равномерность процесса не нарушается. Варьируя количество асбеста и тяжелого шпата, можно по желанию изменять пропускную способность диафрагмы. Для облегчения выхода водорода ей придают б. ч. не горизонтальную, а волнообразную поверхность. В зависимости от силы тока напряжение в ваннах составляет 3,5—4 V, утилизация тока—до 95%. Аппарат дает Ϊ2—16%-ный раствор NaOH и 18—20 %-ный раствор КОН. Способ Биллитера требует меньше электрич. энергии, чем способ Гри-сгейм-электрон, и, кроме того, на 30—40% меньше топлива на выпарку щелочных растворов, т. к. они получаются более крепкими. Биллитер предложил еще один способ, не описанный пока подробно в литературе и характеризующийся присутствием стеклянной диафрагмы (из стеклянной ваты, пропитанной силикатом) с вертикальными анодами. Вообще, как показал опыт, вертикальное расположение анодов является очень удобным; ваннам такого типа теперь уделяется много внимания.
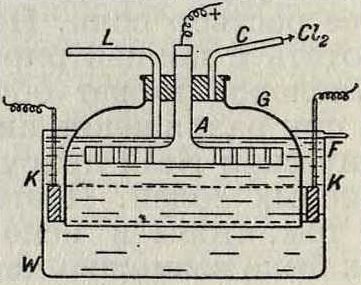
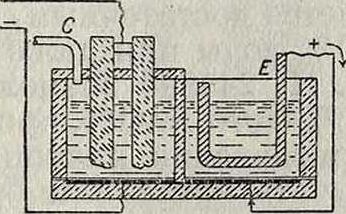
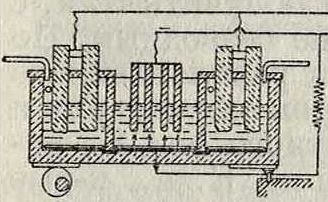
II тип (с применением колокола). Принцип этого способа (Г. П. 141187) можно видеть из помещенного ниже схематич. чертежа (фигура 4). В ванне W находится колокол G из непроводящего материала с анодом А; катодом служит К, по трубке L поступает раствор соли, через С выходит хлор, а через F вытекает щелочной раствор. В практике употребляются узкие, прямоугольные, за- фигура 4.
крытые сверху железные ящики (колокола), размером приблизительно 150×30×(15-У 20) см, покрытые внутри толстым изолирующим слоем (фигура 5). В них находятся угольные аноды А. Раствор соли поступает через канал В и трубку С, которая имеет сверху ряд отверстий, обеспечивающих равномерное и спокойное поступление электролита. Через трубку D выделяется хлор. Отверстия Е служат для скрепления смежных колоколов. На фигуре 5 представлен продольный и поперечный разрез отдельного колокола. Работа ведется при темп-ре не выше Фигура 5. 35°. Сила тока не дол жна превышать 30 А на колокол. На заводе в Ауссиге, потребляющем 2 000—3 000 IP, таких колоколов должен быть до 25 000 шт. При утилизации тока в 85— 90 % и при напряжении в 4—5 V получается раствор с содержанием 100—150 г едких щелочей в л. Недостатком описанного
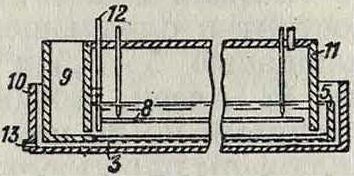
способа является чересчур, малый размер отдельных колоколов, вследствие чего требуется большое количество их и соответственно значительная площадь. Сама работа требует очень внимательного наблюдения.
III тип (ртутныйспособ). Способ основан на образовании амальгам щелочных металлов при электролизе растворов их хлористых солей с ртутью в качестве катода. Затем амальгамы разлагаются водой с выделением водорода и образованием растворов NaOH или КОН. Щелочные растворы при этом получаются с содержанием щелочи не
Фпг. 6. Фигура 7.
менее 20% при ничтожном содержании хлористых и сернокислых солей. Существует много видоизменений этого способа. Можно указать на патенты Кастнера, Кельнера и Сольве. Позднейшими способами с уменьшенным количеством ртути являются способы Вильдермана (Г. П. 130118, 172403идр.) и Уайтинга. Из них очень удобным оказывается способ Вильдермана, при к-ром при небольшой массе ртути и самые ванны занимают малую площадь (3 м2 каждая ванна). Напряжение не меньше 4—4,5 V. На фигуре 6 дано схематич. изображение прибора Кастнера, представляющего ванну, разделенную двумя перегородками, не доходящими до дна, на три отделения. Крайние отделения содержат угольные электроды, среднее—железные электроды. На дне прибора тонким слоем налита ртуть. При помощи расположенного под ванной эксцентрика ей сообщается колебательное движение, и ртуть переливается из одного отделения в другое. В крайних отделениях находится раствор соли, в среднем—раствор щелочи. При замыкании тока ртуть в крайних отделениях служит катодом и растворяет металл с образованием амальгамы. Здесь же происходит и выделение хлора. В среднем отделении ртуть является анодом, а железные электроды— катодом. Здесь происходит электролиз раствора щелочи, причем ионы натрия разряжаются на железных электродах с образованием NaOH и Н2, а гидроксильные ионы извлекают из амальгамы натрий, давая новое количество NaOH, то есть раствор щелочи становится постепенно более концентрированным. В виду того что в среднем отделении, вследствие разных потерь, натрия оказывается меньше, чем это соответствует поступающему туда количеству электричества, то во избежание окисления ртути приходится включать сопротивление между ртутыо и железным катодом, чтобы в среднее отделение поступало только 90% тока. Аппарат Кельнера (фигура 7) состоит из двух отделений. Левое является анодным и содержит угольные электроды и трубу С для вывода хлора. Катодом служит ртуть, непрерывно протекающая через аппарат. Здесь перегородка, так же как и в приборе Кастнера, не доходит до дна. В
правом отделении находится изогнутый железный электрод Е, образующий со ртутью коротко замкнутый гальванический элемент Fe-NaOH-амальгама. Натрий растворяется с образованием NaOH и выделением водорода. Т. к. содержание Na в амальгаме должен быть незначительным (ок. 0,02%), то необходима быстрая циркуляция ртути. Требуется также наблюдать за тем, чтобы поверхность ртути была блестящей. К хлору всегда примешивается водород в незначительном количестве. При платиновых анодах содержание Н2 не превышает обыкновенно 0,2%, но при угольных оно может доходить до 2,5—3%. Нужно иметь в виду, что содержание водорода в 5% и выше (случай невозможный при правильной работе) образует с хлором чатую смесь.
3-ды работающие по ртутному способу, занимаются гл. обр. производством Е. н. Хотя таким путем получаются очень чистые и концентрированные растворы щелочи, требующие сравнительно небольших расходов для получения готовых продуктов, однако, в виду необходимости применять сравнительно высокое напряжение, при этом методе потребляется значительно больше электрич. энергии. Кроме тога, требуются большие денежные затраты на приобретение больших количеств дорогой ртути. Утилизация тока составляет 95 %. Полученный тем или иным путем щелок подвергается выпариванию или в чренах из кованого железа или в многокорпусных чугунных аппаратах, аналогичных тем, которые употребляются в сахарном производстве. Аппараты снабжаются особыми приспособлениями для удаления выпадающей соли, которой особенно"много в электроли-тич. щелоках. Щелок, выпаренный до крепости 35° Вё, концентрируется дальше в
Фпг. 8.
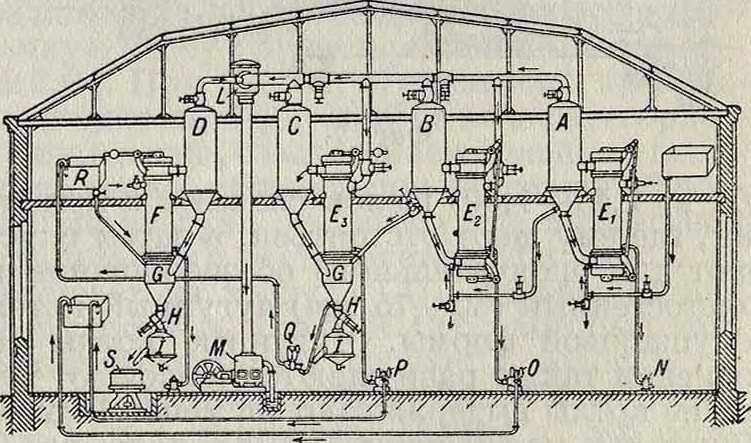
чугун, аппаратах, т. к. кованое железо начинает уже разъедаться щелочью. На фигуре 8 изображена выпарительная установка машиностроительного завода Э. Пассбурга в Берлине, состоящая из трехкорпусного аппарата, в к-ром щелок упаривается до 25° Вё, и отдельного чугунного выпарителя, где сгущение доводится до 50° Вё. 4, В и С представляют собою выпарительные пространства трехкорпусного аппарата, соединенные с нагревателями Е1г Е2 и Е3. Разведенный натровый щелок нагревается острым паром, пускаемым в нагреватель Ег. Пары, выделяющиеся от испарения щелока в А, поступают во второй нагреватель Е„, к-рый наполняется подвыпаренным щелоком из первого аппарата. Пары, выделяющиеся в В,
обогревают Е3, а пары, образующиеся в пространстве С, поступают через уловитель! в насос М, где они и конденсируются для поддержания вакуума. Сгущенный раствор из испарителя С накачивается насосом Q в сборник В, откуда по трубе поступает для окончательного выпаривания в Ώ. Выделяющиеся здесь пары также проходят через уловитель L для удержания увлеченного щелока и поступают в насос М. Поваренная соль, выделяющаяся при выпаривании уже в последнем испарителе Сив испарителе D, попадает в отделители соли G, откуда ее через вентиль Н выпускают в сосуды I. Когда последние наполнятся солью, вентили Ы запирают, и соль поступает на центрифугу S, где она освобождается от щелока. После растворения и нейтрализации остающихся в ней незначительных количеств щелочи она м. б. опять пущена в электролиз. Конденсационная вода, образующаяся из острого пара в нагревателе Е1г отводится в конденсационный горшок Ν, так же как и конденсационная вода из нагревателя F. Что касается нагревателей Е3 и Е3, в которых поддерживается разрежение, то образующаяся в них конденсационная вода отсасывается насосами О и Р. Концентрированный до 45—48° Be
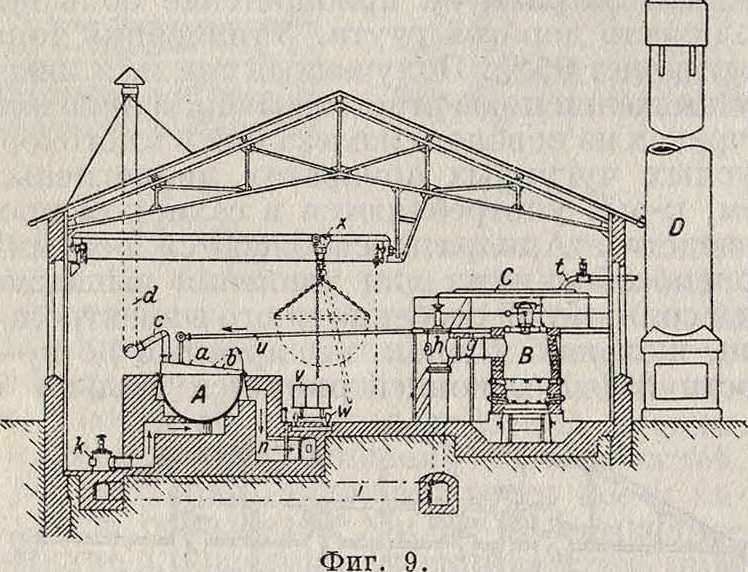
(уд. в 1,45—1,50) щелок сливают в приемник, где ему дают отстояться, а затем спускают для окончательного обезвоживания в толстостенный (50—75 миллиметров) чугунный котел полушаровой формы. Чугунные котлы со временем также разрушаются щелочью; хорошие котлы выдерживают не менее 10 мес. Никелевые могут служить более долгое время, но они дороже. Котлы делают емкостью на 10—20 тонн NaOH. На фигуре 9 показана плавильная установка для Е. ы. того же з-да. Котел А нагревается генераторным газом, производимым в генераторе В. Котел снабжен крышкой а с откидной частью Ь, водяные пары через с отводят в дымовую трубу d. Генераторный газ через трубу д и регулирующий вентиль И поступает в канал г. После прохождения через вентиль к газ поджигают, и он по каналам п обходит по спирали кругом котла, равномерно его нагревая. Отработанные газы идут по каналам вверх и, прежде чем попасть в дымовую трубу D, подогревают плоский сосуд С, наполненный щелоком. Последний, крепостью ок. 50° Be, подается сюда через трубу t. Из чаши С щелок по трубе и поступает в плавильный ко тел А. Обезвоженный едкий натр выливают в железные сосуды ν, стоящие на весах м-·. Для облегчения смены котлов имеется подвижной кран х.
NaOH нагревают до 400—500° и выше и поддерживают его в расплавленном состоянии 8—12 ч. для того, чтобы успели осесть окись железа и алюминат натрия. После этого его сливают или вычерпывают железными черпаками в барабаны из тонкого железа. Предложено (Г. П. 129871 и 182201) производить обезвоживание крепких растворов NaOH в вакууме в чугунных сосудах с мешалками, причем нагревание до 180° оказывается достаточным, чтобы получить Е. н. с 10% воды или даже вполне безводным. По Г. П. 247896 возможно из расплавленного 90%-ного NaOH, при нек-ром охлаждении и прибавлении низкопроцентного NaOH, получить кристаллы безводного Е. н., которые затем отделяют в нагреваемых центрифугах. Продукт содержит 99% NaOH.
Анализы английского и немецкого едкого натра.
| Немецкий NaOH | |||
| Продажный | |||
| едкий натр | 3-Д | Гей- | Людвиге- |
| Сольве | фельд | гафен | |
| NaOH. | 94,88 | 92,34 | 94,60 |
| Na2C03. | 2,38 | 3,10 | 2,27 |
| N8,30,. | 0,19 | 2,82 | 2,62 |
| NaCl.. | 1,69 | 1,71 | 0,51 |
| Na2S03. | — | 0,01 | — |
| Na3Si03. | — | — | — |
| NasA103. | — | Следы | |
| Английский | ЧаОН | ||
| Продажный | |||
| 60°-ный | 70°-ный | высоко градусный | |
| едкий натр | |||
| NaOH. | 79,8 | 89,6 | 96,0 |
| Na,C03. | 1,1 | 2,4 | 0,2 |
| Na2S04. | 3,6 | 3,4 | 1,5 |
| NaCl.. | 15,1 | 3,9 | 1,3 |
| Na„S03. | — | — | —. |
| Na2SiOs. | ο,ι | 0,3 | 0,1 |
| Is a3A103. | 0,4 | 0,2 | 0,2 |
Химически чистый Е. н. для аналитич. целей готовят из металлич. натрия, действуя водой или водяным паром в определенных условиях. Ашкрофт (Ам. П. 1198987) для этой же цели рекомендует готовить натрий-амид и разлагать его затем парами воды: NaNH, + Н20=NaOH + NH3.
В то время как у нас Е. н. оценивается по процентному содержанию NaOH, в Германии пересчитывают NaOH naNa2C03, а в Англии—на Na20. Т. о., наш 100%-ный NaOH в Германии обозначается как 132,5%-ный или 132,5-градусный (100 :х= 80:106),а в Англии как 77,5%-ный или 77,5-градусный (100:х==80:62). Лунге приводит анализы нескольких образцов Е. ы. немецк. и англ, происхождения (СМ. ВЫШе табл.). М. Рождественский.
Применение Е. н. NaOH потребляется в громадных количествах различными отраслями промышленности: в текстильной (при отварке и мерсеризации хл.-бум. волокна, при изготовлении искусственного шелка), в мыловаренном производстве, в бумажной промышленности (для приготовления целлю-
лозы), при очистке нефтяных погонов и фракций каменноугольного дегтя, при производстве разнообразных продуктов из каменноугольного дегтя (фенол, резорцин, нафто-лы, ализарин, индиго и другие полуфабрикаты) ит. д. Наибольшее потребление NaOH имеет место в С. Ш. А.:
Для целей
Мыловарения..
Химия, промышленности.
Нефтяной промышленности.
Производства искусств, шелка Текст, промышленности.
Производства каучука и гуттаперчи ..
Очистки растит, масел.
Бумажной промышленности.
Экспорта ..
| Всего. | 521 000 | 556 000 |
| В дореволюционное время в пределах б. Российской империи NaOH потреблялся в | ||
| следующих количествах: | ||
| Для целей | 1913 Г. 1916 г. В тоннах | |
| Мыловарения.. | 8 412,6 | 17 200,6 |
| Химич. промышленности. | 1 055,8 | 5 092,1 |
| Нефтяной промышленности. | 2 135,5 | 6 165,1 |
| Текст, промышленности. | 10 325,4 | 4 987,2 |
| Дистилляции и сахароварения | 1 005,5 | 3 047,8 |
| Специального назначения. | — | 4 906,7 |
| Прочих потребителей. | 13 651,8 | 1 795,3 |
| Всего. | 36 586,6 | 43 194,8 |
| Потребление в пределах СССР за послед- | ||
| ние годы сильно возросло: | ||
| Для нелей 1927/28 г‘ 1928/29 г* для целей в тоннах | ||
| Мыловарения. | 15 500 | 15 000 |
| Химич. промышленности. | 5 071 | 6 085 |
| Нефтян. промышленности. | 4 500 | 6 875 |
| Текст, промышленности. | 16 000 | 16 500 |
| Прочих отраслей промышл. | 10 156 | 12 570 |
| Прочих потребителей. | 4 600 | 12 190 |
Всего. 55 827 69 220
Мировое производство Е. н. достигло весьма значительных размеров; по данным 1925 года оно составляло 2 390 000 то, в том числе производство Англии 756 000 то, С. Ш. А. —608 000 то, Германии — 436 000 т, Бельгии—252000 т, Франции—72 000 то, Австрии—46 000 т, Польши—46 000 т, Чехословакии — 44 000 то, Италии — 44 000 то. Главнейшими экспортерами NaOH являются: Англия (211014 то), С. III. А. (50 000 то), Германия и Бельгия. В последние годы на мировом рынке выступает и СССР, экспорт которого в 1927/28 г. достиг 8 000 то. Имевший место до войны 1914—18 гг. импорт NaOH (442,5 то в 1913 году) с 1914 г. прекратился.
Оптовые цены на Е.н. франко-завод (за то):
| СССР, в черв. руб. | 1926 Г. 1927 г. 207,40 195,0 | 1928 Г. 195,0 | |
| СССР, в долл. | 105,10 | 100.0 | 100,0 |
| Германия ». | 59,0 | 74,0 | 61,90 |
| Англия ». | 78,0 | 76.0 | 76,0 |
| Франция ». | 48.0
80.0 |
68,0 | 57,50 |
| С. Ш. А. ». | 70,0 | 60,0 | |
| Валовая выработка NaOH | в пределах б. | ||
Российской империи до войны 1914—18 гг. неуклонно росла: в 1900 году—32101,6 то, в 1910 году—47 780,1 то, в 1913 году—49 373,2 то. Непрерывный рост производства NaOH происходит в последнее время и на заводах СССР: в 1924/25 годах—36031,4 то, в 1925/26 г,— 39 047,8 то, в 1926/27 годах —52 045,8 то, в 1927/28 г .—
1927 Г. 1928 г. в тоннах
| 90 | 000 | 97 | 000 |
| 80 | 000 | 82 | 500 |
| 82 | 500 | 90 | 000 |
| 65 | 000 | 78 | 000 |
| 77 | 500 | 69 | 500 |
| 31 | 000 | 35 | 000 |
| 12 | 000 | 11 | 000 |
| 33 | 000 | 33 | 000 |
| 50 | 000 | 60 | 000 |
55 827,0 то. Выработка NaOH производится на Донецком содовом заводе им. Ленина Южхимтреста (ст. Переездная, Донецких жел. дорог): в 1926/27 годах было выработано 27 982 то, в 1927/28 г,—30 324 то. На Березниковском содовом заводе Северохима (ст. Усолье, Пермской ж. д.) в 1926/27 годах выработано 16092 то, в 1927/28 г.—15 528 те. На Славянском содовом заводе Южхимтреста (ст. Славянск, Донецких ж. д.): в 1926/27 годах— 7 363 то, в 1927/28 г.—9 975 то. На Донецком заводе выработка Е. н. производится по способу Лёвига и по ртутному способу, на Березниковском заводе по способу Лёвига и электролизом по методу Сименс-Биллитера, на Славянском заводе—по известковому способу и электролизом по методу Грисгейм-
ЭЛеКТрОН. В. Белавнцкий.
Лит.: С а с с-Т исовскийБ. А., Новое в области производства электролитическ. хлора, «ЖХП», 1925, т. 1, 3, стр. 16а; Лукьянов П. М., Современное состояние производства электролитам, хлора и хлорной извести за границей, «ЖХП», 1927, т. 4, i—5, стр. 293—294; Lunge &., Handbuch cl. Soda-industrie, B.2, 3, Braunschweig, 1909; Forster F., Elektrochemie wasseriger Losungen, Handbuch der angew. physik. Chemie in Einzeldarstellungen, hrsg. v. &. Bredig, 4 Aufl., В. 1, Lpz., 1923; В 1 1 1 i t er .T., Die elektrolytische Alkaliehloridzersetzung mit festen Kathodenmetallen, Monographien tiber angew. Elektrochemie, B. 43, T. 2, Halle a/S., 1913; В i 1 1 i t e r J., Technlsche Elektrochemie, Die elektrochem. Verfahren d. ehem. Grossindustrie, B. 2, Halle a/S., 1924; A s-kemsyP., Einfiihrung in die techn. Elektrochemie, B. 2, Brschw., 1916; Lueion R., Elektrolytische Alkalichloridzerlegung mit fliissigen Metallkathoden, Monographien iiber angew. Elektrochemie, B. 23, Halle a/S., 1906: Landolt-Born stein, Physikn-lisch-chem. Tabellen, 5 Aufl., В. 1—2, B. 1923; M e s-s i n g e r A., Dictionary of Chemical Solubilities (Inorganic), N. Y., 1921; Ullmanns Enz., B. 3, 8; F e r c h-land P., Die elektrochem. Industrie Deutschlands, Monographien iiber angew. Elektrochemie, B. 12, Halle a/S., 1904; Kershaw I. B. C„ Die elektrochem. u. elektrometallurg. Industrie Grossbritanniens, aus d. Engl, iibers. Monographien iiber angew. Elektrochemie, B. 28, Halle a/S., 1907.