 > Техника, страница 46 > Жидкий уголь
> Техника, страница 46 > Жидкий уголь
Жидкий уголь
Жидкий уголь, термин, получивший широкое распространение, обозначающий жидкие продукты переработки различных сортов угля, применяемые в качестве горючего. Быстрый рост моторного движения
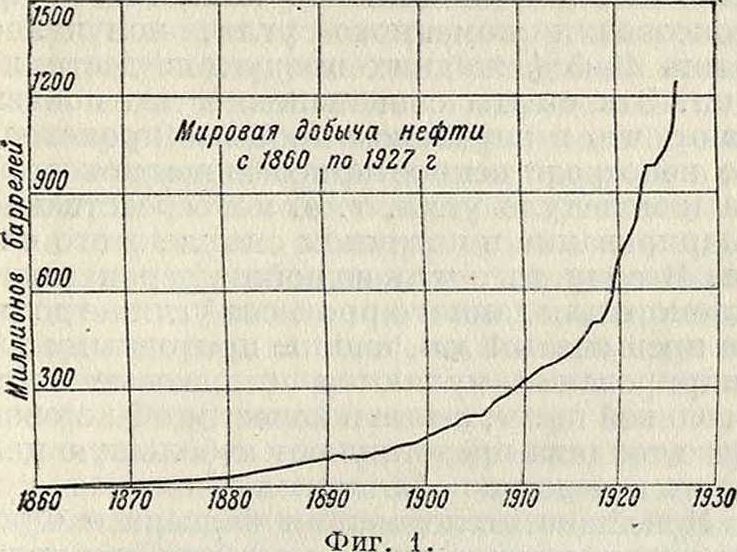
Коксование всех родов значительно повысил за последние годы потребность в жидком горю-чем. В стремлении к иаилучшему использованию горючего современная техника все больше переходит к нефтяному топливу и к дизель-моторам; при установке последних на судах некоторое значение имеет также и возможность лучшего использования трюмов для хранения горючего. Многочисленные преимущества нефти как горючего обусловили увеличение мирового потребления нефти с 1910 года в четыре раза (фигура 1). В 1927 г. вся мировая добыча нефти выразилась в 1 242 500 000 баррелей (1 баррель=163,65 л); из них С. III. А. доставили 900 млн. баррелей, СССР—
70 млн., Румыния—28 млн. и Германия— 700 000 баррелей. Таким обр.,на С. III. А. падает 72,5, на СССР—5,6, на Германию— 0,06%. Большая потребность в жидком горючем при незначительности или отсутствии собственной добычи нефти вызывает в большей части европейских стран необходимость широкого ее ввоза, к-рый, например, для
Германии выразился в 1927 г. в 1 684 187 тонн нефти на сумму 246 млн. марок.
Часть потребности в жидком горючем, особенно в Германии, м. б. покрыта бензолом, бензином, тяжелыми маслами и смазочными материалами, добываемыми посредством коксования или путем сухой перегонки местных углей. Но коксование и сухая перегонка каменного угля, а равно и сухая перегонка богатого битумами бурого угля не м. б. осуществлены в любом объёме, т. к. главк, продуктом по количеству и по стоимости в этих процессах является кокс, рыночный сбыт которого имеет определенные границы. Фигура 2 показывает в круговых диаграммах, что при коксовании камеи, угля получается 4—5% жидкого горючего, при сухой перегонке 10— 12%, при современных процессах сжижения угля 50%, а по последним изысканиям—даже до 65% жидкого горючего. Несмотря на коксование и сухую перегонку, которые гл. обр. доставляют масла для топлива и для дизелей, ощущается острый недостаток в летучих углеводородах, вызываемый усиливающейся моторизацией промышленности и сельского хозяйства. Это явление даже в странах с богатыми источниками нефти привело к тому, что составные части ее с высо
Сухая перегонка Сжижение
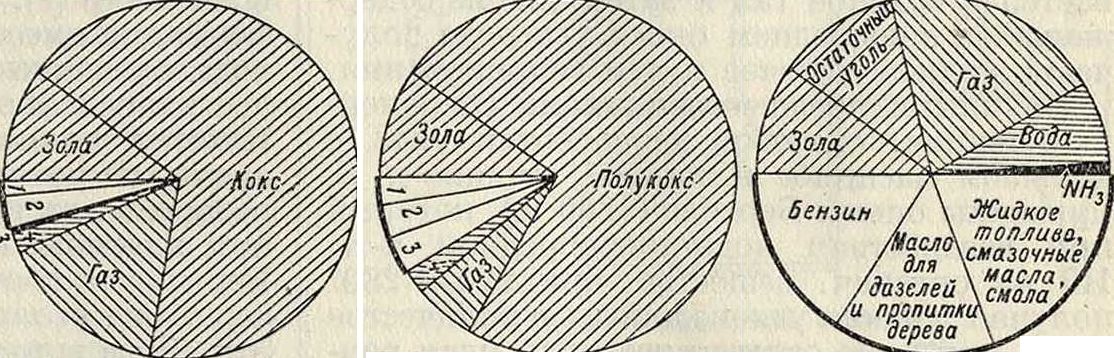
1 легкое масло 2тяжелое масло, смола 2-N/13 Ь-8ода
1 бензин _ 4 вода
2 масло для дизелей и пропитки дерева
3 жидкое топливо, смазочное масло, смола
Фигура 2.
кими точками кипения посредством дестил-ляции под повышенным давлением по раз-личным запатентованным методам (Дуббс, Блюмнер) подвергаются крекированию (смотрите Бензин-крекинг), то есть процессу разложения на соединения с более низкими точками кипения И· Для стран, которые не имеют собственных источников нефти, этот путь закрыт; они должны использовать имеющиеся у них запасы угля для получения жидкого топлива. При этом нужно стараться, чтобы при процессе обращения весь уголь превратился в жидкое горючее, а также по возможности употреблять такие сорта угля, которые не поддаются облагораживанию путем коксования и сухой перегонки.
При искусственном добывании нефтепродуктов ценные жидкие углеводороды получаются посредством гидрирования (смотрите), то есть введения водорода в молекулы углеводородов. Этот процесс, при наличии свободных или ненасыщенных единиц сродства, сводится к непосредственному присоединению водорода; в соединениях же, богатых кислородом (наир. водяной газ), кислород замещается водородом с одновременным образованием воды. Незначительная энергия водорода при обыкновенной 1° заставляет работать при высоких давлениях (100—200 atm) и <° в 400—500°. Для дальнейшей активизации водорода прибегают обыкновенно к катализаторам с весьма большой полезной поверхностью действия (смотрите Катализ в технике). В качестве катализаторов для гидрирования при добывании жидкого горючего, наряду с Ре, Ni, Pt и Pd, оказались пригодными такя-се окислы трудно восстановимых металлов. В некоторых случаях к катализаторам примешивают едкие щелочи. Активность контактных веществ м. б. значительно понижена т. н. отравляющими свойствами некоторых примесей. Особенно вредным каталитическим ядом является сера, к-рую поэтому еще до процесса следует удалять. Необходимо различать процесс непосредственного гидрирования угля и образование жидких продуктов от гидрирования углеродистых соединений. При непосредственном превращении угля в жидкое горючее по способу Вертело и Бергиуса задача заключается в получении масла путем присоединения водорода к самой молекуле угля, то есть без предварительной переработки угля в газообразные продукты в особых генераторах. При добывании жидкого горючего по способу BASF, по Фишеру и по Па-тару, наоборот, уголь сначала перерабатывается в водяной газ и затем уже из содержащейся в последнем окиси углерода получают жидкое горючее путем гидрирования.
Научными предшественниками современных технич. способов переработки угля в большом масштабе в жидкое топливо должен быть признаны опыты Вертело (1869 г.), который при воздействии иодистоводородной кислоты HJ на органич. вещества при 270 — 280° получал жидкие углеводороды в количестве 67%; при этом остаток твердого угля равнялся 33%. При опытах с франц. каменным углем получалось до 60% жидких углеводородов. В виду дороговизны иодистоводородной кислоты все эти опыты имели только чисто теоретическое значение.
Бергиус заменил дорого стоящую иоди-стоводородную к-ту более дешевым водородом. Он исходил из того положения, что тот крупный молекулярный комплекс, который обозначается собирательным понятием «уголь», представляет собою целую группу молекул, с богатым содержанием углерода и малым содержанием водорода (не свыше 4% Н2). Этот комплекс можно путем присоединения водорода превратить в смесь жидких углеводородов. К этому заключению он имел полное право прийти на основании целого ряда опытов, проведенных в его лаборатории и относившихся к процессу обугливания и расщепления тяжелых масел на легкие в присутствии водорода. Опыты показали, что тяжелые углеводороды, при достаточно высоком парциальном давлении водорода во время проводимого при 100— 120 atm процесса их расщепления, способны присоединять водород даже в отсутствии катализаторов [2]. Исходя из этого вывода, был предпринят ряд планомерных опытов по непосредственному гидрированию угля водородом под давлением ок. 100 atm. Наиболее благоприятные для процесса t° реакции оказались от 450 до 480°. Выяснилось, что большая часть всех сортов угля пригодна для гидрирования, причем переработка угля в жидкие продукты не наступала, если при тех же условиях опыта вместо водорода вводился азот или какой-нибудь другой инертный газ; в последних случаях, как и при коксовании каменного угля, получалось лишь 4—5% жидких продуктов дестилля-ции. Эти опыты с несомненностью показывают, что в изучаемом процессе происходило непосредственное присоединение водорода к молекуле угля, то есть непосредственное гидрирование в истинном смысле этого слова. В виду того что величина зерен загружаемого для данного процесса угля не должна превышать 1 миллиметров, вполне пригодными для гидрирования являются и дешевые сорта угольной пыли, которые в качестве обыкновенного топлива представляют небольшую ценность вследствие обилия золы.
Новейшие исследования Фишера и Фрея по гидрированию угля, в особенности полукокса из бурого угля по способу Бергиуса [*], показали, что тощий неспекающийся уголь и полукокс из бурого угля даже более пригодны для гидрирования, чем спекающийся каменный уголь. Абсолютная способность перехода в жидкие углеводороды различных сортов угля зависит от геологии. возраста последнего [4]. В общем, уголь позднейшей формации имеет ббльшую способность перехода в жидкие углеводороды, чем уголь более ранней формации. В то время как при газовом пламенном угле количество веществ, не могущих перейти в жидкие углеводороды, достигает 10%, а при обыкновенном пламенном угле—15%, исследованные Бергиусом сорта бурого угля давали содержание угольного остатка менее чем 1%. Эта более широкая способность перехода в жидкие углеводороды угля позднейшей формации станет сразу понятной, если ближе рассмотреть химическ. соединения, входящие в состав различных сортов угля, и соотношение в них между углеродом и водородом.
На фигуре 3 изображен в виде диаграмм ряд наиболее известных горючих материалов (расчет взят без содержащейся в них воды и золы), которые отчетливо показывают значительное количество водорода, содержащегося в природном топливе более поздней формации. Присоединение вводимого при гидри ровании молекулярного водорода происходит, по Бергиусу, Клингу и Флорентину [5], в связи с тем, что применяемые t° в 450— 480° являются критическими, при которых прочная связь в углеродных молекулах ослабляется. При этой t° распада угольных
Антрацит
Тощий уголь
Кузнечный уголь
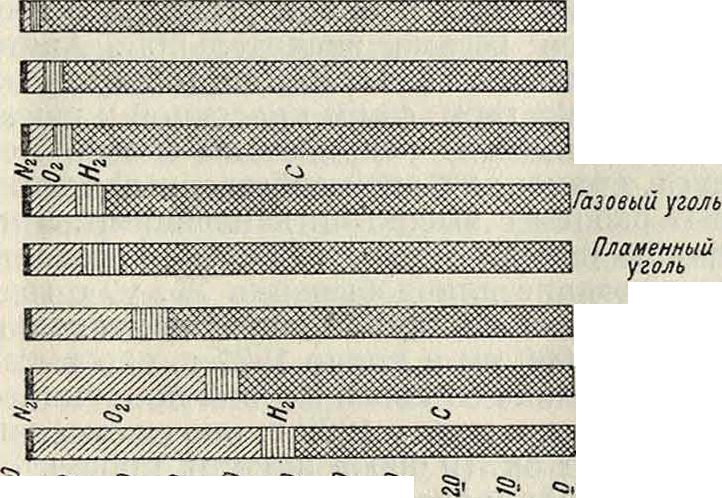
бурый уголь Τορφ
дубовые дрова
Q. Ό, 4J. ча.
t-jl с©· {чП «о“ “-о“
Фигура 3.
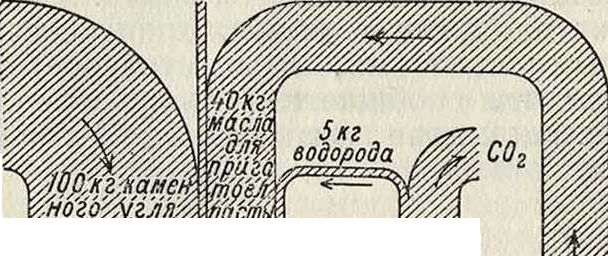
молекул водород имеет возможность тотчас >ке соединяться с осколками исходных молекул и таким путем предотвратить крекирование угля, идущее до образования кокса. Количество связываемого водорода колеблется между 3 и 5% от веса гидрируемого угля. Т. к. водород вводится в этом процессе в избытке, то часть содержащегося в угле кислорода переходит в воду, другая же часть участвует в образовании гидроксильных групп, то есть фенола; при этом сера переходит в сероводород, а азот—в аммиак, причем оба газа уходят вместе с реакционными газами. Общий выход аммиака при этом приблизительно в три раза больше, чем при процессе коксования. Этот процесс идет без добавления контактного вещества. Применяемая Бергиусом контактная масса, Lux-masse, состоящая главным образом из окиси железа, должна лишь связывать освобождающуюся при реакции часть серы, дабы воспрепятствовать нежелательной полимеризации тяжелых масел в присутствии серы. Продукт гидрирования не зависит от выбранного исходного материала и походит на сырую нефть; одна треть его состоит из легко кипящего бензина или родственных бензину веществ и гидроароматич. соединений с низкими точками кипения, затем идут вещества с более высокими точками кипения, похожие на керосин и другие нефтяные масла, и, наконец, составные части с самыми высокими точками кипения—смазочные масла и асфальт. Олефины или еще более ненасыщенные соединения, которые всегда находятся в бензине-крекинг, не встречаются в продуктах гидрирования по системе Бер-гиуса в виду избытка водорода при реакции. После того как многочисленными лабораторными опытами в автоклавах высокого давления с объёмом в 40 л этот способ был вполне обоснован и были выяснены все условия для его успешного проведения, нужно было еще, для перевода его в форму, технически и хозяйственно приемлемую“ создать непрерывный рабочий процесс. Для этого из мелко размолотого угля вместе с получаемым во время процесса маслом образуют пасту и эту пасту непрерывно вдавливают насосами в аппаратуру. Посредством пресса а особой конструкции (фигура 4) паста вводится под давлением в 150 atm в сосуд с двойными стенками Ь, снабженный мешй, в котором паста вместе с нагнетенным в тот же сосуд при помощи компрессора с газообразным водородом нагревается до рабочей температуры. Отсюда смесь течет в реакционный сосуд d, и через трубопровод е продукты реакции уходят из этого сосуда. После пропуска их через охладительные змеевики в вентиле g происходит расширение их с понижением давления до атмосферного; отсюда продукты направляются в приемник-сепаратор h. Газ, после удаления легкого бензина, вводится в газгольдер г, а твердые и жидкие части удаляются из сосуда h через вентиль. Во избежание местных перегревов, которые при применяемых высоких давлениях и ί° могут способствовать химич. реакции между Н2 и железом стенок, понижающей стойкость железных стенок и повышающей возможность несчастных случаев, применяют, по Бергиусу, наружное отопление посредством инертных газов,—например азота или свободных от кислорода топочи, газов. Газ подогревается сначала веществами, выходящими из реакционного сосуда с двойными стенками, а недостающее количество теплоты сообщается путем нагревания в отдельной печи. Отапливающий газ доводится
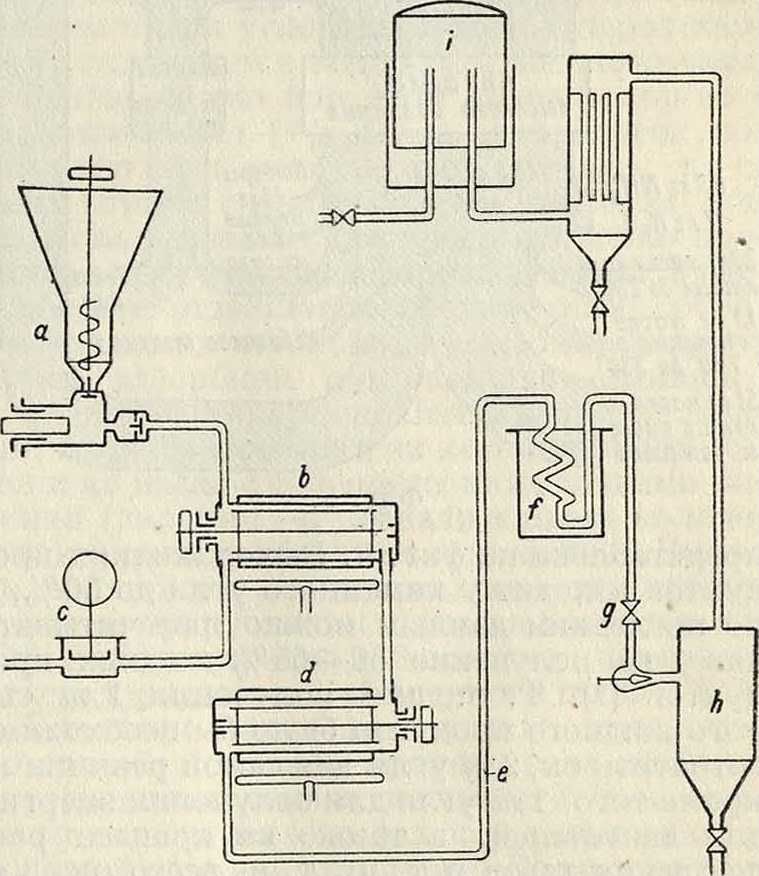
Схема промышленной опытной установки непрерывного процесса
Фигура 4.
посредством сжатия до такой Г и такого давления, что он становится в состоянии передать рабочему пространству необходимое количество теплоты. Благодаря тому что для отапливающего газа применяется высокое давление, стенки внутреннего сосуда b частично разгружаются.
Находящаяся в течение нескольких лет в работе большая испытательная станция в Маннгейм-Рейнау (Баден) работает с макси-
мальной расчетн. производительностью 20 тонн в 24 ч. Хозяйственное использование этого процесса зависит от возможности получения необходимых значительных количеств водорода независимо от остальных продуктов. Посредством соответственной обработки водяным паром при 1100° получаемого при реакции газа, состоящего гл. обр. из метана, Бергиус разрешил также вопрос получения водорода при затрате небольшого количества топливного угля. Реакция протекает по следующим ур-иям:
СН4 + Н20=СО + ЗН2;
НаО + СО + Н.=С02 + 2 Н2.
Т. о., при этом процессе из одной молекулы метана образуются четыре молекулы водорода; другими словами, вес образовавшегося водорода равен приблизительно половине веса взятого метана. Образующаяся углекислота поглощается водой при повышенном давлении, и получающийся при этом газ с 85%-ным содержанием свободного Н2 обладает достаточно высоким для гидрирования парциальным давлением водорода. Схема непрерывного производственного процесса превращения угля в жидкий продукт
5 килограмм окиси железа
| Аппарат | аппарат | |
| высокого давления | расщепле ниягазсв |
0.5 килограмм NH,
7 килограмм Нг0
20кг масел ки лящих до 230
10 килограмм масел киоящих от 230°до 330"
51 килограмм масел ки. лящих выше 330, и остаток Ш
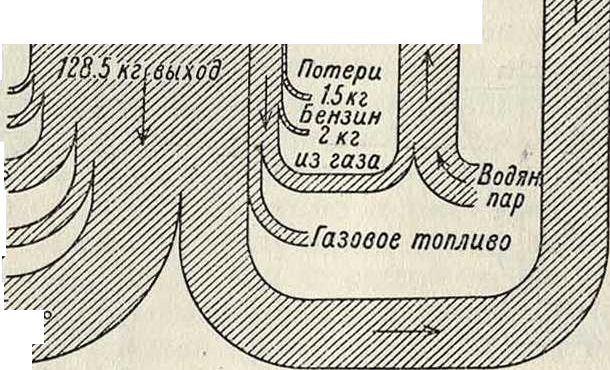
Фигура 5.
представлена на фигуре 5. Выход жидких продуктов доходит у каменного угля до 50%, а по последним данным можно рассчитывать даже на получение 60—65% жидких продуктов [6]. Т. о., для получения 1 тонна сырого жидкого продукта было бы необходимо затратить ок. 2 тонны угля для самой реакции и, кроме того, 1 тонна угля для получения энергии для двигателей, а также на процесс расщепления газов и т. д., то есть всего ок. 3 тонны топлива. Для переработки 1 тонна угля в час установка, в которой протекает процесс, должна располагать объёмом реторты в 3 м3. Рентабельность этого процесса подвергалась обследованию со стороны Бергиуса [’J и других авторов [8], которые пришли к заключению, что в некоторых определенных условиях он является вполне рентабельным.
По вычислениям же самого Бергиуса, лишь при понижении мировой рыночной цены керосина приблизительно на половину этот процесс перестал бы быть рентабельным. Вследствие необходимости значительных капитальных затрат полное оборудо вание для получения 40 000 тонн жидких продуктов в год обходится при 4 установочных единицах в настоящее время в 6 млн. марок; приходится признать, что для рентабельности метода Бергиуса большое значение имеет уменьшение амортизации всей аппаратуры, которая, однако, вследствие высоких <°, содержания серы и окиси углерода в газе, оказывается весьма значительной. Акционерное общество I. G. Farben (объединение крупнейших герм, фирм красочной и химич. промышленности) разработало способ Бергиуса, применяя и свой собственный технич. опыт работы с высокими давлениями, и построило у Мерзебурга, в Средней Германии, оборудование для добывания Ж. у. с годовым выходом жидких продуктов несколько более 100 000 т; в конце 1927 г. оно выступило на рынке со своей первой продукцией, и по данным к марту 1928 г. оно ежемесячно производит ок. 10 000 тонн жидких продуктов. Процесс гидрирования регулируется и проводится здесь с целесообразным изменением условий t°, давления и скорости течения водорода, а главное—в отличие от метода Бергиуса—при действии различных катализаторов, причем, в зависимости от того продукта, получение которого является желательным, применяются различные катализаторы в различных стадиях процесса гидрирования. Благодаря этому становится возможным по желанию видоизменять характер получаемых при гидрировании жидких продуктов и вырабатывать, например, такой синтетич. бензин, к-рый уже непосредственно содержит составные части, препятствующие стуку в двигателях [*]. Большое экономии, значение имеет тот факт, что получающийся при производстве искусственных фосфорных и азотных удобрений избыток водорода на фабрике Leunawerk этого об-ва м. б. применен для целей гидрирования, а также и то, что в распоряжении этой фабрики находится богатый битумами бурый уголь. Общество красочной промышленности I. G. Farben имеет, т. о., возможность превращать в жидкие горючие продукты получающийся в большом количестве при сухой перегонке мелкий кокс, к-рый не имеет достаточно большого спроса на рынке, но к-рый, согласно исследованиям Фишера и Фрея, оказался особенно пригодным для реакции гидрирования с образованием жидких продуктов. Из этого мелкого кокса (Grudekoks) очень легко, а главное без необходимости шурования, образуется в генераторах газ. Генераторы работают поэтому лучше и дешевле генераторов для доменного кокса или каменного угля. Необходимо, наконец, отметить также и интересное сообщение Крауха (об-во
I. G. Farben), сделанное им в комиссии экспертов Союза нем. деятелей металлургии, промышленности в Дюссельдорфе 22 мая 1927 г., в котором он указал, что наряду с обычными катализаторами, применяемыми на з-дах I. G. Farben, в настоящее время производятся опыты применения ускорителей реакции совсем другого рода, например электрич. поля и разрядов, а также действия лучистой энергии в точно определенной форме; в соответствии с этими опытами разрабатываются и технич. установки.
Методы получения из угля жидкого топлива непрямым путем по способу BASF (Фишер и Патар) заключаются, в отличие от метода Вергиуса, в том, что сначала разлагают природный уголь, получая водяной газ, и затем гидрируют этот водяной газ под различными давлениями, применяя соответственные катализаторы. Вследствие выбора различных контактных веществ, а также вследствие соблюдения различных, вполне определенных для обоих случаев условий Г, оба способа приводят к совершенно разным конечным продуктам. BASF работает по выданному уже в 1913 году Г. П. 293787; он характеризуется применением водяного газа, содержащего избыток окиси углерода, и проведением реакции при давлении 130 atm и t° 400°; применяемые при этом различные контактные вещества состоят гл >вным образом из окиси цинка; вследствие этого процесс удается вести так, что образуется метиловый голь по формуле:
CO + 2H2=CHsOH.
Метиловый голь можно получать из окиси углерода, смешанной с теоретич. излишком" водорода, непосредственно в результате одного производственного процесса, почти без примеси воды и в очень чистом виде. Благодаря этому после поступления на рынок немецкого метанола (так назвала Баденская ф-ка, в соответствии с рациональной женевской номенклатурой, искусственный метиловый голь) цена на него оказалась на 60% ниже цены америк. натуральн. метилового голя, получаемого при перегонке дерева. Эта исключительная дешевизна метанола обусловливается отчасти употребляемыми ф-кой Leimawerk новыми винкле-ровскими генераторами, которые ежедневно перерабатывают ок. 4 000 тонн бурого угля, в то время как прежние генераторы могли перерабатывать только до 100 тонн в день.
Опыты Фишера, предпринятые им отчасти под влиянием работ BASF, имели целью получение жидкого горючего из водяного газа[10]. Для этой цели метиловый голь, содержащий ок. 50% кислорода и отличающийся незначительной теплотворной способностью всего только в 5 300 Cal, является мало целесообразным продуктом. Фишер (Kaiser-W ilhe lm- Institut fur Koh lenf orschung в Мюльгейме-Рур) исходит также из водяного газа, но, в отличие от Баденской фабрики, работает с избытком водорода. В качестве контактных веществ он употребляет элементы железной группы в смеси с сильными щелочами. Реакция протекает при давлении 100—130 atm, причем водяной газ должен быть хорошо очищен от каталитических ядов, в особенности от сернистых соединений. Наиболее целесообразной оказалась ί° в 410°. Образующаяся при этом (вероятно, при промежуточном образовании формальдегида) смесь из высокомолекулярных голей (вплоть до С9), альдегидов и кетонов получила название с и н т о л а и имеет следующие свойства: светложелтая легкоподвижная жидкость, смешивающаяся с бензолом и бензином, точка замерзания —30°, удельный вес при 20° 0,829, теплотворная способность 7 540 Cal. В виду того что почти 88 % сырого синтола перегоняется при тем пературе ниже 200°, можно признать синто л прекрасным легкокипящим горючим, в особенности для двигателей; этот продукт имеет преимущества перед бензолом, что и было доказано целым рядом опытных пробегов [“]. Посредством многократного пропускания водяного газа через контакт можно было ок. 30% теплотворной способности водяного газа получать в виде синтола; в остатке получается газ с высокой теплотворной способностью. Нагреванием синтола до 400° можно перевести ы в бензиноподобные продукты; получаемому этим путем продукту Фишер дал название с и н т и н.
Основываясь на старых работах Сабатье и Сандерена, получавших количественно из окиси углерода метан при обыкновенном давлении, и применяя в качестве катализатора мелкораздробленный никель, Фишер совместно со своим сотрудником Тропшем нашел, что при соблюдении других условий и применении других катализаторов образуется не метан, а его высшие гомологи. В качестве катализаторов, наряду с металлами восьмой группы периодич. системы, Фишер применяет также окиси Zn, Be, Si, Mg, Μη, Cr, U и A1 [12]. Существенной особенностью метода Фишера является применение не столь высоких Г (200—300°), в то время как метан образуется при значительно более высоких t°. Образование углеводородов идет таким путем, что катализатор образует предварительно карбид с углеродом, принадлежащим окиси углерода. Затем углерод карбида гидрируется водородом водяного газа, и одновременно при этом катализатор восстанавливается [13]. Т. о., углеводород образуется при этом непосредственно, то есть иным путем сравнительно с синтезом при высоком давлении, где предварительно происходит образование формальдегида. Углеводороды отделяются частью сами собой, частью же их необходимо выделять из газов путем адсорбции при помощи активного угля или силикагеля. Получающиеся жидкие продукты состоят из легкокипящих масел и из масел с более высокими точками кипения (парафин—в незначительном количестве), а равно из бензина с уд. в 0,68. Выход по водяному газу составляет при многократном пропускании через катализатор ок. 52%, соответственно 100 г жидких и твердых углеводородов на 1 м3 водяного газа. О рентабельности получения жидких продуктов по способу Фишера-Тропша пока никаких определенных данных не имеется, т. к. опыты производились до сих пор только на небольшой опытной установке. Во всяком случае приходится иметь в виду возможно большее удешевление исходного продукта—водяного газа. Весьма выгодным является то обстоятельство, что нет необходимости соблюдать в точности отношение Н2: СО=1 и поэтому представляется возможным применять для описанных процессов генераторный и доменный газы, в особенности, если их улучшить, добавив нек-рое количество водорода и освободив от каталитических ядов.
Метод франц. исследователя Патара имеет много общего с методом Фишера; он также Основан на непосредственном взаимодействии СО и Н2 с применением катализатора и высокого давления. Патар в продолжение нескольких лет испытывал на своей опытной установке с производительностью от 150 до 200 килограмм в 24 ч. свойства различных катализаторов и нашел (что было установлено также и BASF), что окиси цинка в определенных условиях наиболее способствуют образованию ов. Эти смеси из катализаторов оказываются сравнительно менее чувствительными к каталитическим ядам, и их регенерирование осуществляется очень просто. Этот метод связан с применением давлений до 300 atm [14]. Камера, в которой находится катализатор, не должна иметь железных частей, т. к. тогда реакция потечет в том направлении, что будут образовываться метан, вода и пентакарбонил железа. Патар проработал свой метод гл. обр. для получения метилового голя, причем он достиг почти теоретич. выхода. Из 1 то бурого угля он предполагает получать не менее 400 килограмм метилового голя. Капитальные затраты на оборудование для ежедневного получения 20 то метилового голя исчисляются, по Патару, в 1,7—2,1 млн. мар.
Резюмируя изложенное, можно сказать, что пока только нек-рые нем. способы имеют шансы оказаться рентабельными в промышленном масштабе L16]· Технически наиболее успешно разработан метод Бергиуса и особенно метод I. G. Farben. В какой мере объединение I. G. Farben убеждено в рентабельности своего нового метода, введенного им недавно на практике на одном из его крупных з-дов, видно из того, что оно недавно решило закрыть свои з-ды сухой перегонки среднегерм. бурого угля, оборудованные по последнему слову техники, например, установками для получения легких масел из остаточного газа посредством активирован, угля; это решение повидимому продиктовано стремлением использовать целиком этот ценный, богатый пирописситом уголь для процессов гидрирования. Интерес остальных европ. стран к работам Бергиуса виден из того факта, что целый ряд лицензионных об-в в Англии [16], Франции и даже в юж. Африке делает попытки организовать предприятия по гидрированию местных углей; эти страны стремятся создать собственные базы получения искусств, жидких горючих продуктов. Мировые нефтяные концерны, как Standard Oil и Royal Shell, также проявляют интерес к Ж. у., вкладывая капиталы в предприятия, осуществляющие метод Бергиуса [17].
Лит.: ’) «Petroleum», В., 1928, В. 24, р. 175; а) «Z. ang. Ch.», 1921, Jg. 34, р. 341; 3) «Brennstoffche-mie», Essen, 1925, В. 6, р. 69; *) «Gliickauf», Essen,
1925, В. 61, р. 1317; ·) «CR», 1926, р. 182; ·) «Petroleum», В., 1928, В. 24, р. 30; ’) W о 1 b 1 i n g Η., Ilydrierung, Hallea/S., 1926;*) «Braunkohle», Halle a/S.,
1926, В. 25, p. 1068; *) «St. u. E.», 1927, B. 47, p. 1125;10) Die Umwandlung d. Kohle in Ole, «Gesain-melte Abhandlungen zur Kenntnis der Kohle, 1915— 1921», B., 1924; “) «Z. d. VDI», 1925, B. 69, p. 17; “) Naphtall M., Leichte Kohlenwasserstoffole, B., 1928; 13) «Mining Journal», L., 1926, v. 155, p. 1040; ”) L’alcool mbthylique synthetique, «Bulletin de la Soc. d’encouragement pour l’industrie nationale», P., 1925; “) «Petroleum», В., 1928,В. 24, p.254;1*)«Colliery Guardian a. Journ. of the Coal a. Iron Trade», L.,
1927, 135, p. 1216; ”) «Tagliche Berichte iiber d. Petroleum-Industrie», B., 1928, B. 22, p. 1. Ф. Прокат. жидкости, тела, находящиеся в жидком аггрегатном состоянии, характеризуемом легкой изменяемостью внешней фор мы тела (легкоподвижностью частиц) и весьма малой изменяемостью объёма. Эти основные свойства Ж. обусловлены тем, что расположение их частиц не является определенным, как в твердых телах (крист), и что в то же время их частицы расположены весьма близко друг к другу с малыми междумолекулярными промежутками. Жидкое аггрегатное состояние занимает среднее положение между твердым кристаллическим и газообразным; при сжатии газы при i° ниже критической переходят в Ж. С точки зрения ур-ия состояния Ж. можно рассматривать как весьма сжатые газы (смотрите Газ), у которых поправки К и Ь в ур-ии (р + К) (v — b)=ПТ
велики (то есть Ж. ведут себя подобно газам под очень высокими внешними давлениями).
Вследствие легкой изменяемости формы все Ж. под действием собственных между-молекулярных сил принимают форму шара, отвечающую при постоянстве остальных условий (объёма v и t°) наименьшей свободной (потенциальной) энергии жидкой массы. Форму шара надо рассматривать, по Плато, как собственную форму всех Ж. Эта форма изменяется под действием внешних сил (тяжести, смачивания), принимая, например, форму сосуда или растекаясь по пластинке. Чем менее масса Ж., не смачивающей пластинку, тем более правильную сферич. форму она принимает и тем меньше искажает ее действие силы тяжести.
Молекулярное давление Ιί и поверхностное натяжение а—результат действия междумолекулярных сил—являются наиболее характерными свойствами Ж. Молекулярное давление представляет собой равнодействующую всех сил, втягивающих молекулы поверхностного слоя внутрь
Ж., отнесенную ,к 1 смг оно равно (по
Ван-дер-Ваальсу) и связано с существованием поверхностного натяжения а, то есть с работой изотермического и обратимого об-
разования 1 смг поверхности Mi.; σ=,
где δ—толщина поверхностного слоя, равная радиусу сферы молекулярного действии (смотрите Капиллярные явления); <5 близка к диаметру молекулы; v—постоянное целое число, равное 3, 4, 5, зависящее от вида функции о
/(/г) в уравнении а= jf(h) dh,rfs,ef(h)—сила,
d
которую необходимо преодолеть для извлечения изнутри Ж. на ее поверхность всех молекул, требующихся для образования 1 см2 поверхностного слоя. Величина <5—порядка 10~Ч~10_8 см, α= 20-И00 эрг/сти2, а К =
= 109 -У 1010 дин/сж2, то есть К есть вели чина порядка 1 00СЧ-10 000 Atm (в полном согласии с величиной К, вычисленной из ур-ия: К=Уже этим огромным внутренним давлением все Ж. чрезвычайно сильно «каты, чем и объясняется их весьма ма-
о 1 1дх>
лая сжимаемость Р=--(^L· под влиянием внешнего давления; β для разн. жидкостей изменяется обратно пропорционально их молекулярному сцеплению, то есть обратно пропорционально К или а (смотрите табл. 1). По эмпирическому правилу Ричардса-Метыоза, а #=2,5-10-8 при обычной ί° (σ—в эрг/с.и2, а β—в Atm~l). Для всех Ж. β уменьшается с возрастанием р и возрастает с ί° (за исключением, например, воды и глицерина, ведущих себя аномально, благодаря сильной ассоциации их молекул). Сжимаемость и другие свойства изучены Бриджменом при давлениях до 12000 Atm.
Таблица 1.—С вязь с ж и м а е м о с т и ж и д к о-сте и с поверхностны м н а тя же н и ем (Г=20°).
| Жидкость | β в Atm-1 | О в эрг/с.и2 |
| Ртуть. | 3.9 · 10“ | 470 |
| Вода. | 46.0 · 10-* | 72,8 |
| Бензол. | 90 · 10-· | 28,8 |
| Гексан. | 143 · 10-* | 18,5 |
Ассоциация и полярность Ж. Все Ж. характеризуются большей или меньшей степенью ассоциации (смотрите) их молекул. Т. о., частицы вещества в жидком состоянии представляют собою комплексы из большего или меньшего числа одинаковых молекул; все эти комплексы—А2, А3 и вообще Ап, А,„ — испытывают взаимные превращения, распадаясь на простые молекулы А и вновь из них образуясь. В Ж. мы имеем картину динамич. (химического) равновесия таких комплексов. Так, вода (смотрите), типичная ассоциированная Ж., при обычных Г, кроме небольшого числа «моногидролей» (Н20), состоит из «дигидролей» (Н20)2 и «тригидро-лей» (И20)з и содержит также «полигидро-ли» (Н20)„. С повышением t° ассоциированные комплексы обычно распадаются, и Ж. становится все менее ассоциированной; но и в парах ассоциация молекул имеет место, и ее считают в этих случаях одной из причин отклонения паров и газов от законов идеально-газового состояния. Ассоциацией молекул и падением степени ассоциации с повышением Г объясняются аномальные свойства многих сильно ассоциированных Ж., например воды, многих ожиженных газов (смотрите Сэюижепие газов), гелия. Понятно, что изменение величины z, характеризующей какое-либо свойство ассоциированной Ж., можно представить в виде такого соотношения:
dz (dz. /dz dx
dT ~ ЭгУаР (йс/Г «it
Первый член этого соотношения дает чисто Г-ное изменение свойства z при постоянной степени ассоциации х, второй член определяет влияние изменения степени ассоциации х с изменением t° и может совершенно исказить картину явления. Так м. б. объяснено аномальное тепловое расширение воды (максимум плотности) и других Ж.
По молекулярному состоянию Ж. можно разделить на б групп (по Кистяковскому). К 1-й относятся нормальные, неассоциированные Ж. (предельные углеводороды), ко
2-й—малоассоциированные Ж. (галоидопро-изводные, эфиры, амины), к 3-й—сильно ас социированные Ж. (вода, нитрилы, ы), пары которых неассоциированы, и к 4-й— ассоциированные Ж. с ассоциированными парами (органич. к-ты, сера, селен, фосфор). Ж., относящиеся к этим группам (в чистом состоянии), являются диэлектриками и почти не проводят электрич. тока. Отдельно стоит 5-я группа—ионопроводящие Ж. (расплавленные соли)—и 6-я группа—расплавленные металлы, то есть электронопроводящие Ж.
Интенсивность междумолекулярных сил в Ж. может быть определена как ее п о л я р-н о с т ь; с возрастанием ассоциации (полярности) Ж. сильно возрастают поверхностное натяжение, молекулярное давление, скрытая теплота испарения, диэлектрич. постоянная ε и другие функции полярности (табл. 2). Так, жирные углеводороды (неполярные Hi.) дают наименьшие значения этих молекулярных величин, для воды же получаются наибольшие значения.
Одним из общепринятых способов количественного определения ассоциации Ж. является способ Этвеша-Рамзая и Шильдса. Для неассоциирован. Ж. имеет место установленное на обширном опытном материале соотношение, обоснованное и теоретически:
σ(Μυγ=1с(Тк-Т), т. e. d[°(^P)?]=-к,
где M.v—молярный объём, σ(Μν)·—молярная свободная поверхностная энергия, Ί -абс. темп-pa, приблизительно на 6° ниже критической, а 7с =2,12 эрг/град.—универсальная постоянная. Можно сохранить это значение к и для ассоциированных Ж., подставляя вместо М в Μυ истинный мол. вес в жидком состоянии, то есть средний мол. в жидких комплексов, и понимая под Тк т. н. метакритическую t° (по Бачинскому). м
Тогда отношение м~=х, средний фактор ассоциации, будет мерой ассоциации Hi. (смотрите табл. 2; М0—наименьший мол. в.,определяемый химич. ф-лой). Полярным, ассоциированным Ж. присущ дипольный характер, то есть молекулы их обладают значительным дипольным моментом (смотрите Диполь м о л е к у-л я р и ы й); неассоциированиые Ж. имеют дипольный момент, близкий к 0. Разность полярностей между двумя соприкасающимися жидкостями определяется величиной поверхностного натяжения <г12 на поверхности раздела между ними. Чем больше взаимная растворимость обеих Ж., тем меньше различие в их полярностях, тем меньше σ12 на границе между ними. Так, с повышением t° взаимная растворимость двух жидких фаз обычно возрастает и обращается в со при У=TK?wnl. (критич.темп-ра смешения), когда σ12 обращается в 0. Так же определяется и i°,;pmn. Ж. в собственном смысле слова, то естьсмешения Ж. с ее насыщенным паром (смотрите Капиллярные явления, Растворы). Растворенные, примеси (вещества, распределенные между двумя соприкасающимися жидкостями) адсорбируются на поверхности раздела между ними (смотрите Адсорбция) в том случае, когда полярность их лежит между полярностями обеих Ж. (правило уравнивания полярности Ребиндера). Это сопровождается уменьшением свободной поверхностной энергии системы (σ12).
Таблица 2.—Свойства я; ид к остей, зависящие от полярности (ί°=20°).
| Название жидкостей | К
в кг/см2 |
σ в
ЭРГ/СЛ12 |
Диэле ктрич. посто янная
ε |
Фактор ассоциации
(2,12« |
Коэфф.
Рамзая и Шильдса k |
| Гексан. | 18,5 | 1,87 | 1,00 | 2,11 | |
| Бензол. | 3 800 | 28,8 | 2,29 | 1,01 | 2,10 |
| 3 700 | 28,5 | 2,37 | — | 2,10 | |
| Амиловый.. | — | 22,3 | 16,7 | 2,0 | 1,35 |
| Этиловый.. | — | 21,6 | 27,0 | 2,7 | 1,08 |
| Гликоль. | — | 46,7 | 41,2 | 2,9 | 1,04 |
| Глицерин. | — | 65,0 | 56,2 | — | — |
| Вода.. | 14 800 | 72,8 | 81,0 | 3,7 | 1,03 |
Отсюда следует, между прочим, что чем менее растворимо вещество в наиболее полярной из двух соприкасающихся Ж., тем оно более поверхностно активно, то есть сильнее понижает поверхностную энергию на границе. Молекулярно-статистич. теория этих явлений развита Семенченко.
Тепловое расширение Ж. Изменение объёма с температурой хорошо удовлетворяет (вплоть до нормальной t°Kun.) закону Менделеева:
или
D=D0(l-kty,
при этом Коновалов показал, что закон Менделеева получается теоретически из допущения, что работа расширения Ж. на 1°
^=(К + р) не зависит от t°. Полагая
К=и отбрасывая р (малое сравнительно с К), находим из условия (1):
к в формуле Менделеева для различных Ж. меняется в пределах от 0,00080 до 0,00155.
При изучении теплового расширения Ж. важную роль играет «закон прямолинейного диаметра» Кальете и Матиа для двух сосуществующих фаз — жидкости и ее насыщенного пара:
2 »=A-at ; (2)
здесь В, — ортобар и чес кая плотность Ж., то есть плотность Ж. под давлением насыщенного пара с плотностью 1)2; при низких темп-pax 1)2 ^0, a ГД можно считать обычной изобарич, плотностью, и формула (2) дает закон Менделеева. Чем выше Ткрмп., тем меньше коэфф. расширения Ж. α=, причем имеет место приближен-
V0 Cti )j)
ное соотношение: а-ТКр,ти=0,34. Клееман устанавливает связь между а, коэфф-том сжимаемости β и внутренним давлением К:
К=—Т. Из обратной пропорциональности между а и TKpum. видно, что чем полярнее жидкость, чем больше поверхностное натяжение σ, тем меньше коэффициент расширения а ; приближенно для всех Ж. имеем: α·σ= 0,032. Общего ур-ия состояния (как и для газов) для Hi. не существует, если не говорить об ур-ии Ван-дер-Ваальса, количественно не удовлетворяющем экспериментальным данным для Ж. Для высоких внеш
них давлений р от 1 000 до 3 000 Aim хорошо применимо уравнение Таммана:
(«-«*-«. )Ч~=АТ=С.Т, где К — аналогично внутреннему давлению, С — константа, не зависящая от р и Г, а vp =οο=ντ=0 — наименын. объём, занимаемый жидкостью.
Собственный объём Ь молекул Ж., по Клаузиусу-Моссоти, м. б. вычислен для нормальных Ж. по соотношению:
= · Μν, или b=”j· Μν,
ε+2 ’ na -j-2 ’
где ε—диэлектрич. постоянная, а п—показатель преломления Ж. Для бесконечно длинных волн ε=η2 (смотрите Дисперсия света). Р. Лоренц и В. Герц назвали «коэффициентом заполнения» (Raumerfiillungszahl) ψ=А или е-1 „
Ψ=—2, который при соответственных температурах одинаков для всех нормальных Ж. Так, при T—Ts (нормальная точка кипения) ψΒ=2ί3· Молекулярный критический объём vKpum, (равный, по Ван-дер-Ваальсу, 3b) обладает свойствами аддитивности. Траубе определяет Ф—«свободный молярный объём Ж.», считая, что объём, занятый молекулами Ь, всегда аддитивно слагается из атомных объёмов va компонентов: b=Σηνα и Μν — Σηνα=Ф, где Μν—объём 1 г-мол. Ж. Оказывается, что для всех неассоциированных Ж. Μν — Σηνα—25,9 см31моль, для ассоциированных же всегда меньше; отсюда молено вычислить фактор ассоциации.
Внутренняя скрытая теплота испарения Ж. qi: дает изменение внутренней энергии при переходе 1 килограмм (или 1 г-моля) Ж. в насыщенный пар. Из ур-ия Ван-дер-Ваальса имеем:
*-α(έ“έ)’
где v1 и т2—объёмы Ж. и насыщенного пара.
Изменение молекулярной энтропии при испарении, или т. н. коэфф. Пикте-Трауто-
на, равно ~=/(Ts), где Т$ — нормальная
* S
темп-pa кипения, a qM=q{M -f RT—полная теплота испарения; для всех нормальных Ж.,у которых Ts=3004-500°, этот коэфф. почти одинаков и равен 20,5 cal/град. Вообще же принимается (по Кистяковскому, Кирееву и другим), что /(Ts) есть нек-рая мало изменяющаяся ф-ия Т:
(Ts)=R In R + R In Ts. Давление насыщенного пара Ж.—быстро возрастающая функция Т, достигающая наибольшего значения и обрывающаяся при T=TKptm. когда р=рщтт. (критич. давлению). По Карпену, для всех нормальных Ж. ———=±50, то есть рктт со-
ставляет До молекулярного давления.
Точка плавления бинормальная точка кипения Те для неассоциированной Ж. оказываются соответственными темп-рами; 3,s= 0,64 и-~=0,44, следова-
* с -L к тельно ~=0,68 (Гульдберг). Поэтому и для
1 S
других величин имеем аналогичные условия: 2,68, ^=0,58 (Р. Лоренц и В. Герц).
Теплоемкость Ж. при постоянном давлении С.р отличается от теплоемкости при постоянном объёме С„ на величину внешней и внутренней работы. Весьма значительна внутренняя работа, направленная против молекулярных сил, идущая на увеличение запаса потенциальной энергии Ж. при удалении их молекул друг от друга.
Cp-Cv=(K + p) v
( υ—увеличение объёма при нагревании на 1° при p=Const); это соотношение может служить для определения молекулярного давления К (смотрите Теплоемкость).
Вязкость Ж. (смотрите Вязкость). Для нормальных (неассоциированных) Ж. хорошо применимо ур-ие Бачинского: η=^, в котором С—константа, ν—молярный объём Ж., а-О, аналогично вандерваальсовской постоянной b, измеряет собственный объём молекул Ж. Эта формула может служить для определения изменения вязкости с t° (ί° влияет на η через ν) и для определения вязкости смесей нормальных жидкостей (зависимость η от концентрации). Для явной зависимости η нормальных Ж. от ί° Бачинским предложена эмпирическая формула: η=·
Механика Ж., то есть законы равновесия и движения идеальных и реальных Ж., рассматривается гидростатикой (смотрите) и гидродинамикой (смотрите). Межмолекулярные силы, действующие в Ж., изучаются теорией поверхностных явлений и капиллярности (смотрите Поверхностное натяжение).
В виду сложности теплового движения частиц в Ж., мы и до сих пор не имеем мо-лекулярно-кинетич. теории жидкого состояния; в этом отношении газообразное и кристаллическое состояния теоретически гораздо лучше изучены. Относительно аморфного переохлажденного состояния Ж. см. Аморфное состояние вещества, Стекло.
Лит.:×в о л ь с о н О. Д., Курс физики, т. 3, Берлин, 1923; Бирон Е. В., Учепие о газах и жидкостях, М.—П., 1923; Обреимов И. В., Состояние вещества, П., 1922; Иоффе А. Ф„ Лекции по молекулярной физике, И., 1922; Бачинский А. И., «Временник об-ва им. X. Леденцова», М., 1913, прилож. 3, стр. 23; «Изв. физич. ин-та», М., 1921, т. 1, вып. 5—6; Менделеев Д. И., «Ж», ч. хим., СПБ, 1884, т. 16; Коновалов Д. II., «Ж», ч. хим., СПБ, 1886, т. 18, стр. 395; К и с т я к о в с к и и В. А., Прикладная физич. химия, ч. 1 (описательная), Л„ 1926; «Ztschr. f. phys. Chemie», Lpz., 1913, В. 86, p. 82, 84, 90, 643; К г επί a η η R., Meehan. Eigensehaften d. fltissigen Stoffe, Handbuch d. allgem. Chemie, hrsg. ν. P. Walden u. C. Drucker, B. 5, Lpz., 1928; Bridgman, «Proc. ot the Amer. Acad, ol Arts a. Sciences», Boston, 1912— 1913, y. 48—49; Tammann G., Kristallisieren und Schmelzen, L., 1927; Tammann G., Aggregat-zustande, 2 Aufl., Lpz., 1923; «Ann. d. Phys.», 1912, 4 Folge, B. 37, p. 975; J e 1 1 i n e k K„ Lehrhuch d. phys. Chemie, В. 1, 2 Aufl., Stg., 1928; Walden P., «Ztschr. f. phys. Chemie», Lpz., 1909, B. 65, p. 129; В a k k e r &., Kapillaritat, Handb. d. Experi-mentalphysik, hrsg. von W. Wiener und Fr. Harms, B. 7, Lpz., 1928; Rehbinder P., Grenzsflachen-aktivitat u. Dielektrizitatskonstante, «Ztschr. f. phys. Chemie», Lpz., 1927, B. 129, p. 163; Semen-tschenko W., ibid., p. 178; T r a u b e J., Ober d. Raumd. Atome, «Sammiung chem. u. chem.-techn. Vortrage», hrsg. v. W. I-Ierz, Stg., 1899, B. 4, H. 7—8; Lorenz R„ Raumerlullung u. Ionenbeweglichkeit, Lpz,., 1922; Richards Th., «Am. Soc.», 1912, V. 34, p. 971. П. Ребиндср.