 > Техника, страница 48 > Изотопы
> Техника, страница 48 > Изотопы
Изотопы
Изотопы, химия, элементы с различными ат. весами, но расположенные в одной и той же клетке периодич. системы Менделеева (ίσος τόπος—то же самое место). Химические и большинство физич. свойств И. почти тождественны. В современном учении о строении атомов понятие И. характеризуется тем, что массы центральных положительных ядер у них различны, в то время как заряды этих ядер, а следовательно и число внеядерных электронов (атомный, или порядковый Ν»), одинаковы. Химические свойства атомов определяются числом и расположением внешних электронов; поэтому у И. эти свойства совпадают; наоборот, свойства, зависящие от строения атомного ядра, именно—радиоактивные свойства, глубоко различны у разных И. Тонкие детали спектров так же определяются ядерными массами и поэтому неодинаковы у разных И. Понятие об И. введено в науку Ф. Содди на основании данных, полученный при исследовании радиоактивных элементов. Корпускулярные излучения радиоактивных тел приводят к следующим правилам изменения положения соответствующих атомов в периодич. системе:
1) при излучении α-частицы, атомного ядра гелия с двумя положительными зарядами (смотрите Атомная теория), остающийся элемент уменьшается по ат. весу на 4 единицы и по валентности отступает в периодич. системе на два столбца назад; 2) при излучении 0-луча (электрона) в остающемся элементе ат. в практически не изменяется, но по валентности элемент перемещается в периодич. системе на одно место вперед. Вследствие та- ких прерывных изменений и становится воз-
и
^ о“ р
I t I
N
и
О Q
! *
т S
101-
II2 —
114— 116-«
- - -mi
| 118-1 | 2 | - -116 |
| 12°-| | я£§ | 7 118 |
| I22-* | ф | - -120 |
| I24-» | г | • -122 |
| -124 |
- Л 32
- -133 -134
1:i35
136
л__—
.-99 ~-100 ~ -101 "102
-20
24-
25-
26-
26-3-
28
22 27 — 29
I
- 78 79
* -80 * -81 82 t 83 -84
-86
jg 28-
28-
29-
30-
32--
. 33-“
-28 34 —
35- -
36- -
37- -
»-31
38--
82
83-84 -
86-.
- -32
39- 5--33 40-
40- 5-
31-=-34
" -99 ~.400 32-"? “ΙΟΙ 102
44 ш
-64
-66
-14
45
-16
Г
— -
-
79
80 -81 -82
13-
14-
15- =
19
16- ~
-93
94
-95
96
-99 -100 -101 -102
- 44
!Э- ;
-24
“-Ι2
-13
•4-14
12 —
~ -15
“ -12
—13
—14
—15
-~-|6
25
4 6
Массовые спектры Астона. I. Простой спектр группы С4, виден дублет кислорода и ме1ана. И. Двойные спектры: сравнение линий Вг. III. Двойной спектр: сравнение СН3 и С при напряжениях 280 и 352 V, дублет О и СН4 виден в самом низу. IV. Двойной спектр: сравнение F и С2 при напряжениях 280 и 352 V, заметна также линия В11. V. Простой спектр СН3Вг: видны по две линии, соответствующие Вг, НВг, СН2Вг и СН:!Вг; ниже—второй порядок группы Hg. VI. Двойной спектр: сравнение Вг84 с С02 при напряжении 300 и 324 V. В спектре, снятом при 324 V, видна очень слабая линия трехвалентного Вг при 26,3. В спектре имеются линии серы, хлора и прочие, и он служит прекрасной иллюстрацией равномерного распределения линий, отличающихся на единицу по массе. VII. Двойной спектр: видны линии Р и его водородных соединений между линиями Р и СО. VIII. Двойной спектр: сравнение Кг86 с Hg138. Линии криптона видны ближе к середине. IX. Спектр, показывающий весьма ясно линии второго порядка группы Hg. X. Спектры а и b показывают равномерное распределение линий монометил-олова и ксенона, с—показывает одиннадцать изотопов олова. XI. Шесть двойных спектров: а) Кг88 : С02; Ь) Кг78 : Кг80 и Кг80 : Кг82; с) Кг40 : Кг82 и Кг82: Кг84; d) Кг82 : Кг84; e) Кг84: Кг86; f) после добавления бромистого метилена, Вг73 : Вг84*



.
.



1
Ч
4

ыожным тот факт, что в одной и той же клетке системы элементов оказываются расположенными несколько различных атомов с раз-ныхми ат. весами, но с одинаковым числом внешних электронов; эти атомы и будут И. В табл. 1 приведен пример группы радиоактивных И., имеющих общий ат. номер 84.
Таблица 1.—Р а д и о а к т и в н ы е изотопы с общим атомным номером 84.
| Изотопы | Прибл. ат. в. | Период полураспада |
| Полоний. | 210 | 140 дней |
| Радиы-А. | 218 | 3,0 мин. |
| Торий-А. | 216 | 0.14 ск. |
| Актиний-х. | 214 | 2-10-3 ск. |
| Радий-С. | 214 | 10-* ск. |
| Торий-С. | 212 | 10 -11 ск. |
| Актиний-С. | 210 | 5-10 3 ек. |
Элементы этой группы не разделимы химии, путем, но, как видно, необычайно различны по своим радиоактивным свойствам. Тщательно исследована изотопич. группа свинца (ат. номер 82); к этой группе относится по крайней мере 10 представителей с интервалом значения ат. в от 201 до 214. Прямые измерения ат. в свинца различного происхождения (из разных радиоактивных минералов) обнаружили вполне заметные вариации ат. в По Ричардсу, ат. в обыкновенного свинца равен 207,19, свинца из австралийского карнотита—206,34, из урановых руд— 206,08. Содди высказал предположение, что и другие, нерадиоактивные элементы во многих случаях являются смесью различных И., чем и объясняются отклонения ат. в от целых чисел. Это предположение вполне подтвердилось в замечательных исследованиях Астона, произведенных с т. н. массовым спектрографом.
Метод и прибор Астона для исследования И. явились развитием метода химич. анализа при помощи положи-7 тельных, или каналовых, лучей (смотрите Лучи корпускулярные), предложенного и осуществленного Дж. Дж. Томсоном. Частица, летящая в пучке каналовых лучей, является положительным ионом с определенным зарядом е, массой т и скоростью V. Подвергая эту частицу одновременному действию параллельно направленных магнитного и электрического полей, можно заставить каналовый луч отклониться, причем величина отклонения будет зависеть от отношения и скорости v. Лучи с одним и тем же значением ^, но различными v, развернутся в поверхность (фигура 1), оставляющую при пересечении с какой-нибудь плоскостью YZ (например фотографии, пластинкой или фосфоресцирующим экраном), перпендикулярной к первоначальному направлению луча ОХ, параболическ. след. Изменение направления поля OY на противо положное вызовет поворот параболы. Разные точки параболы соответствуют разным скоростям. Для других значений — парабола будет иная, но с той же вершиной. Т. о., частицы с разными массами и одинаковыми зарядами дадут разные параболы, положение и форма которых и дают средство определения т.
Еще в 1912 г., до работ Содди, Томсон обнаружил указанным методом для каналовых лучей неона две параболы, соответствующие ат. в 20 и 22, что заставило предположить существование нового элемента с ат. в 22. Для изучения этого обстоятельства Астон построил массовый спектрограф, в к-ром метод Томсона был усовершенствован в различных направлениях. Соответственно располагая магнитные и электрич. поля, Астон достиг своего рода «ахроматизации» пучка каналовых лучей, заставив их при одном и том же — сходиться в одной «точке» независимо от различных скоростей v. Комбинация магнитного и электрич. полей в приборе
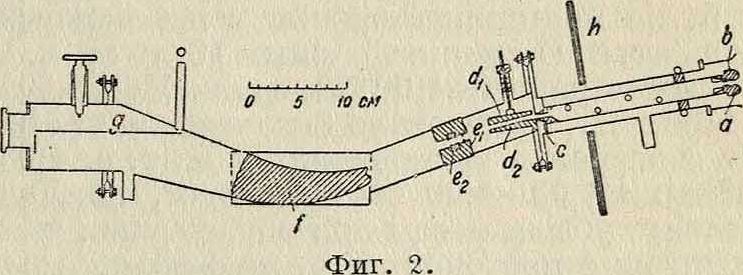
Астона действует подобно ахроматич. призме, отклоняющей световой луч, но не разлагающей его на цвета; угол отклонения определяется только отношением ~. На фигуре 2
дана схема последней модели прибора. Разряд происходит в цилиндрическ. или шаровом сосуде, не изображенном на схеме. Через щель, или канал, а в катоде Ь каналовые лучи попадают во вторую щель с (обе щели шириной ок. 0,02 миллиметров). В несколько искривленном пространстве между пластинами dj, d2 лучи подвергаются действию электро-статич. поля, проходя диафрагму ех, е2, и затем попадают в область сильного магнитного поля /, образуемого мощным электромагнитом с полюсами, имеющими сечение, изображенное заштрихованной площадью. Лучи фокусируются на фотографии, пластинке д. Железные экраны h служат для защиты от магнитного поля. На вкладном листе воспроизведены массовые спектры Астона, полученные с новой моделью спектрографа. Каждой линии соответствуют каналовые частицы определенной массы, значения которой написаны сбоку (при чем масса атома кислорода считается равной 16). В спектре I виден дублет, соответствующий кислороду и метану (16), в спектре X, с видны линии 11 И. олова и т. д. Разрешающая способность нового прибора такова, что массы, различающиеся примерно на 7боо> дают отдельные, не сливающиеся линии, а точность определения положения линий составляет около 0,1%0. При помощи массового спектрографа прежней и новой конструкции Астон обнаружил большое число И. для разных элементов (смотрите вкладной лист). В табл. 2 приве-
| X | |
| 2 | |
| у | |
| ° | Z |
| /у |
Фигура 1.
дены в виде примера новые данные Астона (1927 год) для четырех элементов.
Таблица 2.—Д анные Астонадля серы, олова, ксенона и ртути.
| Эле мент | Ат. число | Ат. вес | Штатам, число изотопов. | Массовые числа изотопов в порядке их интенсивности |
| S. | 16 | 32,06 | 3 | 32, 33, 34 |
| Sn. | 50 | 118,70 | 11 | 120, 118, 116, 124, 119, 117, 122, 121, 112, 114, 115 |
| Хе. | 54 | 130,2 | 9 | 129, 132, 131, 134, 136, 128, 130, 126, 124 |
| Hg. | 80 | 200,6 | 6 | 202, 200, 199, 198, 201, 204 |
Наличие И. у многих элементов, которые являются, т. о., смесью атомов с разными массами, объясняет отклонения средних ат. весов от целых чисел. Есть, однако, и другой источник этих отклонений, менее значительный, но принципиально не менее важный. Если ат. в О принять равным 16, то ат. в Н окажется равным 1,00778, ат. в Не—4,002; у Ы нет И., и следовало бы ожидать, что вес Не должен быть равен учетверенному Н, то есть 4,03. Разница 4,03—4,00 соответствует, по Лан-жевену, убыли массы при образовании ядра гелия из 4 протонов, то есть из 4 водородных ядер. Эта убыль, как предполагается, эквивалентна радиации, сопровождающей процесс образования Не; она определяет огромную устойчивость ядер Не, вылетающих при радиоактивном распаде в виде α-частиц. Новые измерения Астона позволили установить, что ат. веса изотопов большинства элементов, даже в том случае, когда эти отдельные И., составляющие какой-нибудь один элемент, отделены друг от друга, также не выражаются целыми чи. В табл. 3 приведена величина убыль массы на каждый протон, входящий в состав ядра данного атома, где dr— отклонение действительного ат. в от массового числа т (числа протонов, входящих в состав атома). В этой табл, (в отличие от установленного в последнее время в химии правила) ат. в Н, конечно, принимается равным точно 1,000,
поэтому — для него равно точно нулю. Числа, стоящие в скобках около обозначений атомов, указывают атомное массовое число то. Из табл, видно, что ~ имеет максимум в области изотопов криптона и затем начинает убывать. Возможно, что это уменьшение — — первый признак повышающейся неустойчивости ядер тяжелых элементов,
d
Таблица 3. —Значения величины
| Атом. | Н | Не | Li(6) | И(7) | в (10) |
| *10*.. Ш | 0 | 72 | 58 | 61 | 64 |
| Атом. | в (и) | с | N | О | F |
| *ю“.
т |
63 | 75 | 72 | 78 | 78 |
| Атом. | Ne (20) | Ne(22) | Р | С1(35) | А (36) |
| - 101____
т |
78 | 75 | 83 | 82 | 84 |
| Атом. | С 1(37) | А (40) | As | Кг(78) | Кг(79) |
| *10*.
т |
83 | 85 | 86 | 87 | 87 |
| Атом. | К Г (80) | Кг(81) | К г (82) | КГ(83) | Кг(84) |
| - 10*.
т |
87 | 86 | 87 | 87 | 86 |
| Атом. | Кг(86) | 1 | Sn(120) | Хе(134) | Hg(200) |
| — 10*____
Ш |
86 | 83 | 85 | 83 | 79 |
которая резко проявляется в радиоактивных явлениях.
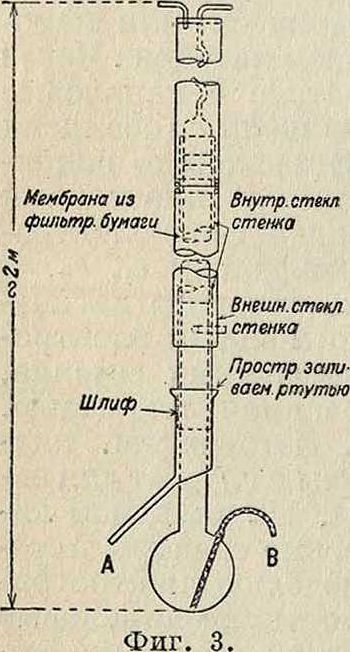
Массовый спектрограф Астона, разделяя И., не дает, однако, возможности изолировать их в количествах, достаточных для изучения их физическ. свойств. Принципиально возможно, пользуясь различием атомных масс у И., разделить их в газообразном состоянии путем фракционированной диффузии и фракционированного испарения или путем комбинации обоих указанныхметодов. На фигуре 3 изображен аппарат Гаркинса для разделения И. ртути комбинированным испарением и диффузией. Испаряющаяся ртуть диффундирует через мембрану из фильтровальной бумаги. При многократном повторении этого процесса Гаркинсу и Мортимеру удалось получить фракции ртути, ат. веса которых отличались на 0,02 единицы.
Лит.: Астон Ф. В., Изотопы, пер. с англ.,
М.—П., 1923; M-me Pierre Curie, Lisotopie et les dldments isotopes, P., 1924; Aston F. W., A New Mass-Spectrograph and the Whole Number Rule, «Proc. of the Royal Society of London», L., 1927, series A, v. 115, p. 487; Harkins W. a. Μ о r t i-m e r B., The Separation of Isotopes a. a Further Sepa ration of Mercury by Evaporative-Diffusion, «Philos. Magazine a. Journ. of Science», L., 1928, v. 6, p. 601, 1928; Discussion on the Structure of Atomic Nuclei, «Proc. of the Royal Society of London», L., 1929, series A, V. 123, p. 373. С. Вавилов.