 > Техника, страница 49 > Индикаторы в химии
> Техника, страница 49 > Индикаторы в химии
Индикаторы в химии
Индикаторы в химии, вещества, прибавляемые в весьма незначительном количестве к раствору одного из участвующих в реакции веществ для того, чтобы при помощи цветной реакции установить конец (или в нек-рых случаях начало) процесса, протекающего между этим веществом и другим, прибавляемым к нему при титровании (смотрите Анализ химический). Особенно важное значение имеют применяемые в ацидиметрии и алкалиметрии кислотно-щелочные И. В качестве последних находят применение многие естественные и синтетич. красящие вещества (смотрите Спр. ТЭ, т. I, стр. 445), отличающиеся способностью изменять свою окраску при перемене активной кислотности среды, в которой они растворены. Последнее обстоятельство обусловливает широкое применение таких И. для измерения концентрации водородных ионов по индикаторному способу.
Вильгельм Оствальд разработал теорию кислотно-щелочных И. Они являются слабыми электролитами (кислотами или основаниями), причем ионы их имеют окраску, отличную от окраски недиссоциированных молекул. Прибавление к-т или соответствен-
но щелочей к раствору, в к-ром присутствует И.,оказываетсущественное влияние на ионизацию последнего, а следовательно, на его окраску, которая, по Вильгельму Оствальду, зависит от заряда иона И., подобно тому как заряд иона манганата обусловливает его окраску, отличную от окраски перманганата, имеющего неодинаковый с ионом манганата заряд. Однако, в виду того, что нек-рые индикаторные реакции протекают в течение измеримого промежутка времени (тогда как ионные реакции должны были бы протекать мгновенно), а также в силу нек-рых других возражений, выставленных против теории Оствальда,—этой теории была противопоставлена химич., т. н. хромофорная теория, предложенная Ганчем (Hantzsch). Последний на примере некоторых нитросоединений и нитрофенолов, также служащих И., равно как и на других примерах, показал, что И. в зависимости от условий могут принимать форму двух неодинаково окрашенных изомеров. Такой изомеризацией и объясняется, по мнению Ганча, перемена окраски И. Так, нитросоединения могут иметь две изомерные формы: аци-форму (или, соответственно, базо-форму) и форму псевдокислоты (соответственно—псевдооснования); например, для р-нитрофенолов:
0:R:N
.
он’
oh-r-no2
аци-форма псевдокислота
Аналогичная изомеризация наблюдается и у основного красителя, каким является кри-сталлвиолет:
N(CH3)2 N(CH3):
N(CH3)2 N(CH3)2
I I
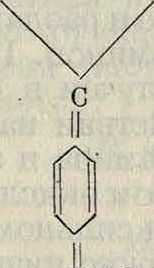
N(CH,1,
OH
базс-соединение
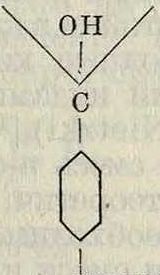
N(CH3)2
псевдосснованке
Параллельно с протекающей во времени изомеризацией, сопровождаемой переменой окраски, изменяется и электропроводность раствора, содержащего смесь обеих форм И. С точки зрения Кольтгоффа хромофорная теория не дает объяснения перехода окраски, но указывает лишь на явление, которое протекает одновременно с изменением окраски. Вместе с изменением окраски изменяется также и строение; однако, это само по себе не может служить причиной изменения окраски. Такой причиной является равновесие между ионогенной аци-формой и нормальной псевдоформой данного соединения, применяемого в качестве И.; установление же. этого равновесия является процессом уже не ионного характера, в отличие от ионного процесса диссоциации одной из обеих форм И. (именно, ионной формы). Поэтому константа диссоциации (смотрите Диссоциация электролити ческая) И. является кажущейся суммарной константой (смотрите Концентрация водородных ионов), слагающейся из истинной константы диссоциации ионогенной формы И. и константы равновесия между обеими изомерными формами И. (аци-формой и псевдоформой). Такая точка зрения согласует между собой обе теории И.: ионную—Оствальда и хромофорную—Ганча.
Кроме поименованных двух теорий M, Вольфгангом Оствальдом была еще предложена коллоидная теория, сводящая изменение окраски И. к изменению степени дисперсности его коллоидальных частиц. Однако, эта последняя теория, недостаточно подтвержденная фактами, не может объяснить многообразия явлений, связанных с изменениями окраски И. под влиянием ионов водорода и гидроксила. Во всяком случае, каждому красителю, могущему иметь применение в качестве кислотно-щелочного И.,
• свойственна определенная область изменения окраски, выраженная в единицах Рн(смотрите Водородные ионы). В зависимости от положения этой области на всей шкале значений Рн, а также в зависимости от раздви-нутости пределов этой области, И. может иметь большее или меньшее применение для целей титрования. Однако, именно эта специфичность положения области перемены окраски для различных И. позволяет применять различные И. с целью определения концентрации водородных ионов различных растворов, встречающихся в биологических и технологич. объектах исследования, и служит поэтому основанием для индикаторного метода определения концентрации водородных ионов. Подробный перечень применяемых в качестве И. химич. соединений и природных красителей, равно как и подробности о их применении,—см. Спр. ТЭ., т. I, стр. 445. О методике измерения Рц индикаторным методом — см. Концентрация водородных ионов.
Лит.: Кольтгофф И. М., Применение цветных индикаторов к нейтрализационному анализу и к колориметрии, определению концентрации водородных ионов, пер. с нем., 3 изд., Л., 1929; Л е м а н и Г., Измерение концентрации водородных ионов, пер. с нем., М.—Л., 1929; Мисловицер Е., Определение концентрации водородных ионов в жидкостях, перевод с нем., Ленинград (печатается); Clark W. М., The Determination of the Hydrogen Ions, Baltimore, 1925. Б. Беркенгейм.