 > Техника, страница 50 > Кадмий
> Техника, страница 50 > Кадмий
Кадмий
Кадмий, Cd, химич. элемент II группы периодич. системы, ат. в 112,41, порядковый номер 48; металл, серебристо-белого цвета; кристаллизуется в гексагональной системе; ковок, тверже олова, режется ножом, легко вальцуется и вытягивается; при этом, в противоположность цинку, не теряет полностью своей кристаллич. структуры; рекристаллизация протекает медленно при комнатной t° и быстро при 200—250°; t°,„. 320,9°, t°mn. 763—786°. Удельная теплоемкость 0,054 cal на г (при 28°). Теплота плавления 13,66 cal на з (1,54 Cal на г-атом); теплота испаре-ния-х.240 cal на г (-^27 Cal на г-атом). Плотность металлич. К. зависит от способов его обработки: так, плотность плавленого К,— 8,64819, кованого—8,6944, прессованного при 20 000 aim—8,642007. Твердость К. по шкале Моса 2,0, склерометрическая твердость (на штрих) при нагрузке 10 г—от 0,022 до 0,027; твердость по Бринелю при нагрузке 200 килограмм и диам. шарика 9,52 миллиметров—22,0 килограмм/мм2, а при нагрузке 100 килограмм—15,1-1-15,4 килограмма/мм“. Эти значения изменяются в зависимости от условий отливки К.; так, например, плавленый и медленно охлажденный К. показывает твердость по Бринелю (при нагрузке 100 килограмм) 16,5, а быстро охлажденный— 17,5. Теплопроводность для плавленого К. при 18° равна 0,2216, а при 100°—0,2149 в единицах CGS: температурный коэфф. в этом случае равен 0,0038. Для кадмиевой проволоки теплопроводность при 18° равна 0,2236, при 100°—0,2209; в этом случае температурный коэфф. равен 0,001. Электропроводность К. при 18° равна 12,9— 13,2 мо-сж.
К.—двувалентный элемент; на воздухе он легко окисляется, образуя окись; сильно нагретый, горит, окрашивая пламя в красный цвет; при окислении образует не только окись, CdO, но и субокиси. Пары К. окрашены в желто-коричневый цвет, ядовиты. Химически чистый К. плохо растворяется в к-тах; из растворов солей он вытесняется металлич. цинком. К. разлагает пары воды только при высокой ί°. В природе К. встречается в виде сернистого К., CdS, и в виде карбоната, CdC03.
Применение К. в технике. Сплавы К. со свинцом, цинком и висмутом применяются для изготовления легкоплавких пробок для автоматич. огнетушителей. Наибольшим распространением пользуются следующие сплавы: Вуда (12,5% Cd, 25% Pb, 12,5% Sn и 50% Bi, t°nl 70°), Ньютона (10% Cd, 28% Pb, 17% Sn, 45% Bi, t°nJl 70°), Липови-ча (10% Cd, 27% Pb, 13% Sn и 50% Bi, f°„. 55—60°); легкоплавкие припои: шнеллот. Schnellot (25% Cd, 50% Sn, 25% Pb, t°njl. 149°), сикерлот, Sickerlot (63% Sn, 37% Pb; прибавление 8% Cd понижает ί°„Λ. до 136°) применяются как добавка к нейзильберу и к сплавам магния для повышения их механических свойств. Кадмий служит для замены олова в припое и в подшипниковых сплавах. Далее К. находит применение в ювелирной технике для придания своеобразных оттенков изделиям из серебра, золота и платины; в типографском деле для изготовления клише; как припой для алюминия и свинца; как добавка к меди для по лучения телефонных и телеграфных кабелей с высокими механич. качествами; прибавкой 1 % К. к меди достигается значительно большая прочность проволоки на разрыв и истирание (втрое больший срок службы) без понижения электропроводности. Амальгамой К. пользуются в зубной технике. К. применяется и в никелировании: отчасти как грунт для последующего покрытия никелем, отчасти в качестве составляющей электролита (CdCl2 до 0,1% делает осадок никеля более плотным и светлым).
В последнее время К. нашел большое применение в гальванотехнике. Покрытие К. (кадмирование) является лучшей защитой железа и стали от коррозии на воздухе и в морской воде.Наиболее распространено кадмирование электролитич. путем. К. можно осаждать как из щелочных, так и из кислых растворов; кислые ванны применяются редко; они содержат обычно смеси сернокислых солей Cd, NH4 и Mg (или соответствующих двойных солей) и свободной серной к-ты.Из такого электролита К. отлагается в виде игол, непрочно сидящих на поверхности покрываемого предмета. Для улучшения качества покрытия было предложено вводить в электролит различные органич. вещества (пептон, декстрин и тому подобное.); однако, распад их, происходящий в процессе работы, часто влечет за собой не улучшение, но в нек-рых случаях значительное понижение качества получаемого слоя.
Лучшие результаты дают перхлоратные, фтороборатные и кремнефтористоводородные ванны. Покрытия из этих ванн, особенно в присутствии коллридов, получаются равномерные, плотные и крепко держатся на покрываемом предмете. Однако, эти ванны вследствие дороговизны и сложности ухода за ними применяются только в исключительных случаях. Самое широкое распространение имеют щелочные, особенно цианистые, ванны; они лишены недостатков сернокислых ванн и отличаются большой продолжительностью работы. Примерные составы электролита: а) 8,5 г двойной цианистой соли К. и калия, KCN- Cd(CN)2, 3,5—7 з едкого кали, КОН, 2 г декстрина, Ϊ000 г воды или б) све-жеосажденный CdC03, приготовленный из 14 г сернокислого К., CdS04, 35 а цианистого калия, KCN, 1 000 г воды. Первая ванна работает при комнатной i°, при плотности тока 15 А на м3 и напряжении на клеммах 2 У; анодом служит сырой К. Для правильного растворения анода необходимо время от времени прибавлять цианистого калия, а для сохранения постоянной электропроводности добавлять едкого кали. К. отлагается равномерно; покрытие прочно держится на железе и стали. Вторая ванна работает при плотности тока 0,4—0,8 А на дм2 и напряжении 3 V; анодом служит сырой К. Для получения блестящих отложений в раствор рекомендуется вводить пептон в количестве до 2 г/л. Нагревание предметов, покрытых слоем металлич. К., до 170—250° улучшает качество покрытия как в отношении прочности, так и в смысле предохранения от коррозии. Электролитич. кадмирование нашло широкое применение в технике и служит для замены цинкования и никелирования.
В настоящее время главными поставщиками металлического К. являются С.Ш.А. и Германия. Производство К. в С.Ш.А. в 1927 г. равнялось 486 525 килограмм металлич. К., при цене 60 центов за англ. ф. Д. Степанов.
К. в металлургии.
Незначительное содержание К. в рудах (смотрите Кадмиевые руды) делает совершенно нецелесообразным непосредственное применение их в качестве исходного материала для получения К. В этом отношении более пригодными оказываются нек-рые побочные продукты цинкового и свинцового производств. Таковыми являются: 1) цинковая пыль, которая собирается в аллонжах и конденсерах при дистилляции цинка из обожженной руды, 2) пыль мешочных камер свинцово-плавильных заводов, 3) остатки от очистки растворов цинковых электролитных з-дов и 4) остатки литопонного производства. Содержание К. в этих продуктах следующее. 1) Цинковая пыль силезских заводов, полученная в течение первых двух часов дистилляции, содержит в среднем около 6 % кадмия; собранная же после этого срока содержит 1,2—2,0 % К. В конденсерах системы Danger цинковая пыль получается с содержанием 3—4% К. Содержание К. в цинковой пыли бельгийских з-дов варьирует от 0,52 до 1,3% и иногда до 1,8%, а з-дов С.Ш.А. в среднем ок. 2%. 2) Пыль мешочных камер свинцовоплавильных з-дов в первое время своего осаждения содержит лишь следы К.; но эта пыль после многократного возвращения в плавильную печь в течение нескольких лет значительно обогащается К. Полученная т. о. пыль на з-дах С.Ш.А. содержит до 5% К. и иногда даже выше. 3) Остатки от очистки растворов на цинковых электролитных заводах содержат около 12 % К., а 4) остатки литопонного производства ~ 8 % К. Получение металлич. К. из указанных продуктов производится двумя способами—сухим и мокрым; по последнему способу его можно вести как чисто химическим путем, так и электрохимическим.
Сухой способ применяется для переработки цинковой пыли и состоит в фракционированной дистилляции ее. Такая переработка основана на более легкой восстановимости CdO по сравнению с ZnO и на большей летучести металлического Cd, чем цинка. Заметное восстановление CdO в условиях практики происходит в 4°-ном интервале от 772 до 813°, a ZnO—при 1022—1088°. 1°кип. 778°, a Zn—935°. С понижением ί° упругость паров Cd и Zn понижается, причем кривая упругости пара Cd на всем своем протяжении лежит выше кривой для Zn, благодаря чему скорость испарения К. при всех ί° будет выше, чем для цинка. Вследствие этого отношение Cd : Zn в дистиллате будет выше, чем в дистиллируемом веществе; подвергая дистилляты повторной перегонке, мы можем дойти до отгона, содержащего почти чистый К.
Большая часть металлич. К. получается в первые 11/2—2 часа дистилляции. Полученный продукт содержит от 3,8 до 4,2% или 6,0—8,0% К., в зависимости от состава руды. Его смешивают с 50% угля и снова
15
Г. 9. т. IX.
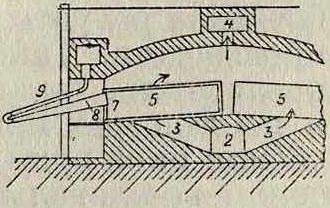
подвергают дистилляции. Эту операцию повторяют несколько раз. В результате получают так называемый сырой К., который расплавляют в отдельной печи и разливают в формы. Обычно дистилляцию производят в муфельных печах; конструкция их в общем однотипна, изменяются лишь количество муфелей, их распределение и размеры. На фигуре 1 изображен тип такой печи. Газ, получаемый в генераторе со ступенчатой колосниковой решеткой 1, через каналы 2 п 3 проходит в печное пространство, где он
Фигура 1.
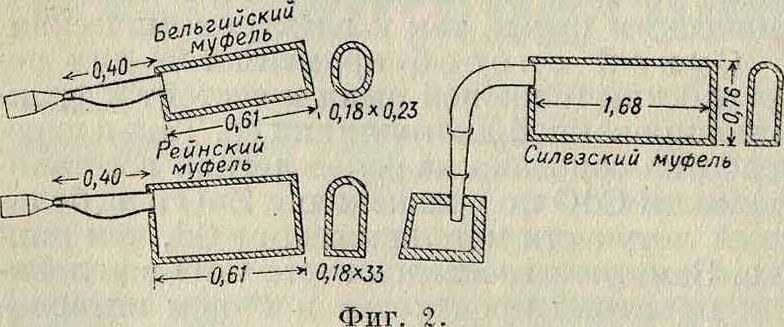
сгорает, и продукты горения уходят через отверстие в своде печи по борову 4; в печь вмазан ряд цилиндрич. реторт 5 длиною 1,2 метров и 30 сантиметров в поперечнике, загруженных смесыо цинковой пыли, содержащей К., с углем; 6—силезский муфель с размерами 1,3x0,5x0,2м. Реторты закрываются круглыми крышками 7, к отверстиям которых присоединены собирательные металлич. конусы 8, сообщающиеся далее через S-образные трубки 9 с дымоходом. Различные конструкции муфелей представлены на фигуре 2. Чтобы уменьшить число дистилляций, Гишес и Эр-бен смешивают цинковую пыль, содержащую К., с коксом (115 килограмм продукта с 17 килограмм кокса) и в специальной печи дистиллируют в течение 20—22 час. Продукт собирается в металлич. конусах частью в виде сплавленного металла, частью же в форме порошка. Металл непосредственно переплавляют и отливают в штанги. Порошок перегружают в меньший дистилляционный муфель, находящийся в той же печи, и вновь дистиллируют при более высокой В этом случае вся операция
отделения К. проводится при помощи только двух дистилляций. Метод дает продукт с содержанием 99,5% К., в то время как указанные выше способы в лучшем случае дают продукты с 57—80% К. Для получения чистого К., свободного от цинка, Р. Бикенд предложил при перегонке применять как восстановители металлич. железо или записные его соединения. Реакция протекает но схемам:
4 Ге + всей=2FeaO, + 6Cd:
6FeC03 + 2 CclO=2 Fe,Ot + 6C02 + 2 Cd. Неудобство сухого способа заключается в большой потере металла при переработке. По Шухарду, выход К. при первой перегонке достигает 52,7%, а при второй—96,86%·
В среднем нужно считать, что потеря металла достигает 40%. Главная часть потерь зависит от трудности конденсации паров К.; с целью уменьшения послед-, ней Армстронг предложил приспособление для улавливания и конденсации паров металла (фигура 3). Принцип этого приспособления заключается в том, что пары К. пропускают через ванны с расплавленным хлористым кальцием или поташом.
Мокрый с п о с о б м. б. применен ко всем вышеуказанным побочным продуктам, содержащим К. Он состоит в переводе К., а также и других металлов, заключающихся в перерабатываемом материале, в растворимые сернокислые соли и в удалении из полученных растворов вредных примесей и осаждения из очищенного раствора металлич. К. Перевод в сульфаты производится следующим образом. Перерабатываемая пыль смешивается с 10—15 % (по весу) H2S04в 60° Вё для образования сульфатов и разложения овистых и овокислых соединений; прибавляется некоторое количество воды для получения легко перемешиваемого теста. При перемешивании массы начинается химическое взаимодействие между H2S04 и составными частями пыли, сопровождающееся значительным выделением тепла. После того как закончится первый бурный реакционный период, ί° поднимают до 230° и выдерживают массу при этой ί° дня 4. Затем 1° снова повышают, доводя ее до 325°; по истечении 48—60 ч. реакции сульфатирования заканчиваются полностью. Полученные сульфаты выщелачивают полученным от предыдущих обработок раствором, содержащим-V. lb % CdS04; при этом получается крепкий раствор, содержащий ~ 34 % CdS04 и подвергающийся затем очистке от вредных примесей. Полученный после первого выщелачивания раствор промывается дважды (раствором с 5 % CdS04и затем чистой водой), причем получаются растворы, содержащие 10 и 5% CdS04.
Очистка растворов, богатых CdS04, производится двояким образом в зависимости от способа осаждения К. В случае выделения К. металлич. цинком из растворов от выщелачивания достаточно удалить As и Си. Это производится прибавлением к ним CuS04п железной ломи. Осадок отфильтровывают и в чистый раствор погружают полосы Zn; собранный, осевший губчатый Cd не м. б. переплавлен из-за его быстрого окисления, поэтому спрессованный осадок, сохраняемый в керосине, подвергают дистилляции в графитовых тиглях.
Наилучшим способом получения К. является электролит и чес к и и спо-с о б. В этом случае исходный раствор подвергается более тщательной очистке; для этого его обрабатывают сначала СаСО- или СаО, пока не осядут полностью Fe* As, Zn(OH)2 и PbS04, а затем сернистым натрием для удаления следов Си. В других случаях после обработки СаО к раствору прибавляют цинковую пыль; собранный при этом осадок, содержащий Си, Cd и Zn, подвергают переработке на Cd обработкой без
Фигура з. доступа воздуха слабым раствором H2S04(растворяются Cd и Zn) и осаждением из полученного раствора цинка окисью кальция. Электролитический способ в большом масштабе применяется на заводах Elektrolytic Zink Со. в Австралии. Подготовка электролита обычно сводится к обработке цинковой руды обжигом, последующему растворению обожженного продукта в серной кислоте и выделению К. из раствора цинковой пылью. Отход сернокислого цинка служит для получения электролитического цинка, а остаток, содержащий кадмий, медь и цинк, в случае отсутствия кобальта, подвергают окислению при нагревании и вновь растворяют в серной кислоте. Растворение ведется с таким расчетом, чтобы в раствор перешла главная часть цинка и К. Этой операцией продукт освобождается от меди. Если же остаток содержит кобальт, то после окисления его растворяют в слабой серной к-те, количество которой варьирует в зависимости от содержания К. и кобальта. Из полученного раствора К. вытесняется цинковой пылью в виде губки, к-рую тщательно отмывают, подвергают нагреванию на воздухе для окисления и вновь растворяют в разбавленной серной к-те или в растворах электролитов, применяемых при электролизе К. Для успешной электролитич. рафш-нировки К. существенное значение имеет отсутствие в полученном электролите солей Zn, Со, Ni, Fe, As, Си и Т.1, сильно понижающих выходы по току и качество отложенного металла. Так, в присутствии солей Т1 выход по току падает до 50 %, и получающийся осадок К. губчат и окрашен в темный цвет. Применяемые для электролиза катоды обычно изготовляют из алюминия, а аноды—из свинца, покрытого двуокисью марганца. Плотность тока колеблется в пределах от 100 до 165 А на м2; напряжение на клеммах достигает 3—4 V; выход по току 85 %; чистота металла 99,95 %. Для получения на катоде толстого и плотного слоя К. необходимо вести электролиз в слабо кислых растворах. Колебания концентрации кислоты допускаются в пределах от 10 до 90 г на л электролита. Однако, и в этих условиях осадок К. склонен к образованию крупных кристаллов, шишек и даже губки. Для устранения этих нежелательных явлений применяют циркуляцию электролита и вращающиеся электроды; эти приемхч обеспечивают достаточно ровное и плотное наслоение металла. Полученные кадмиевые катоды переплавляют под слоем ТЯЖ0ЛОГО масла. г. Уразов.
Соединения Н.
Окись К., CdO, получается нагреванием при доступе воздуха металлического К., его солей (нитрата, карбоната) или гидрата окиси. Окись кадмия полученная из металла, аморфна и почти бесцветна. При сжигании К. в атмосфере чистого кислорода образуется кристаллич. окись, окрашенная в темнокоричневый цвет; CdO, полученная разложением солей, имеет различную окраску в зависимости от характера соли и t° прокаливания; уд. вес 8,15. CdO сублимируется, не плавясь,при ί°700—1 000ъ; легко восстанавливается до металла углем при 700°, а водородом при 270°. В атмосфере СО восстановление протекает через стадию субокисей Cd40 и Cd20; легко растворяется в кислотах с образованием соответствующих солей. Гидрат окиси К., Cd(OH), белый аморфный порошок, уд. в 4,8, легко растворимый в к-тах и аммиаке; получается обработкой CdO разбавленными растворами едкого кали или осаждением щелочами растворов солей К. Гидрат окиси и окись К. применяются для изготовления растворов при электролитическ. покрытии железных изделий. Углекислый К., CdC03.—белый осадок, получаемый при осаждении растворов солей К. растворами поташа или соды; уд. в 4,26; разлагается при Г выше 300°. Применяется для изготовления красок и в гальванотехнике. Азотнокислый К., Cd(N03)2-4H?0,— кристаллич. бесцветная соль; уд. в 2,46; легко растворим в воде, растворяется в е; плавится при 60°, теряя воду; безводная соль имеет t°tu_ ок. 350°; получается растворением металла или окиси в азотной к-те; служит исходным материалом для приготовления других солей К. Бромистый К., CdBr2,—бесцветная кристаллич. соль, сильно гигроскопичная; уд.в. 5,2; приготовляется растворением К. в броме или карбоната К. в бромистоводородной к-те; сублимируется при 585°, растворим в е и ацетоне; применяется в фотографии как замедлитель при проявлении. Хлористый К., CdCl2, получается пропусканием хлора в расплавленном К., или обработкой CdO сухим хлором при нагревании, или растворением металла, его окиси, карбоната или сернистого К. в соляной к-те, после чего соль выпаривают досуха и сплавляют в токе сухого НС1; t°nu 566—570е; уд. в 4,05; на воздухе кристаллы выветриваются и рассыпаются в белый порошок; легко окисляется; из воды кристаллизуется, в зависимости от условий, с 1,2, 4 и 5 молекулами воды. Щавелевокислый К., CdC204-3H20,—трудно растворим в воде, легко—в минеральных к-тах. Получается осаждением из растворов солей К. щавелевокислым калием или щавелевой к-той; применяется при изготовлении красок. С е р-нокислый К., CdS04,—бесцветная соль, получаемая растворением металла, его карбоната или окиси в серной кислоте. Кристаллизуется из водных растворов с 7 частицами воды. Безводная соль (уд. вес 4,7; 1°ил. ок. 1 000°) получается при обработке растворов сульфата и нитрата К. конц. серной к-той или действием персульфата аммония или калия на расплавленный К. Применяется при изготовлении желтых красок, вестоновских нормальных элементов и в гальванотехнике. Цианистый кадмий, Cd(CN)2,—аморфный порошок, плохо растворимый в воде и легко—в синильной к-те или в растворах цианистого калия или натрия. Получается растворением свежеосажденного Cd(OH)2 в синильной к-те или осаждением из раствора солей К. цианистым калием. Применяется главы, образом в гальванотехнике. Сернистый К., CdS, желтого цвета; уд. в 4,5—4,8; t°„. около 1750°; приготовляется сплавлением К. или его окиси с серой или нагреванием солей К. с безводным гипосульфитом, или осаждением из водных растворов солей К. сероводородом. В зависимости от условий получения бывает окрашен в различные оттенки желтого цвета. Применяется в качестве краски (смотрите ниже).
Лит.: Gmelin-Kraut’s Ilandbuch d. anorg. Chemie, 8 Aufl., 33—Kadmium, Lpz., 1925; Ullm. Enz., 2 Aufl., B. 2, 1928; Melior J. W., A Comprehensive Treatise on Inorganic a. Theoretical Chemistry, V. 3, L., 1923; Burgen N., Cadmium, its Metallurgy, Properties a. Uses, L., 1924; Hof man H, Metallurgy of Zink a. Cadmium, N. Y., 1922; Liebig M., Zink und Cadmium, Lpz., 1913; S e n n, «Ztschr. f. Elektrochemie», Halle a/S., 1905, B. 11; Siemens, «Ztschr. fur anorg. Chemie», Hamburg—Leipzig, 1904, B. 41, p. 257; Mylius F., ibidem, 1897, B. 13, p. 157; Smith E. F., ibid., 1892, В. 1; Rieger, «Ztschr. fiir Elektrochemie», Halle a/S., 1900, B. 7, p. 874; Fischer A., «Chem. Ztschr.», B., 1904, p. 1209; Juretzka G., «Metall und Erz», Haile, 1915, Jg. 12, p. 235; Hanley H.R., Chem. a. Metall. Eng., N. Y., 1920, v. 23, p. 1257. Д. Степанов.
Кадмиевые краски.
Сернокислые соли К. при обработке их хромовокалиевой солью или сернистым водородом образуют ряд желтых красок различи, тонов—от светложелтого до темного. Хромокадмиевая желть приготовляется осаждением из растворов желтого хромовокислого калия, К2Сг04, и сернокисл, кадмия, CdS04. Выпавший осадок, хромовокислый К., CdCr04, имеет красивый желтый тон, не уступающий свинцовой хромовой желти; его отфильтровывают, промывают и сушат. Краска эта имеет большое распространение в художественной живописи; в малярном деле она имеет малое применение, т. к. изменяется от атмосферных влияний .Кадмиевая ж е л т ь (по химич. составу сернистый К., CdS, в природе встречается в виде минерала гринокита) вырабатывается двумя способами: мокрым и сухим. При мокром способе кадмиевая желть получается пропусканием сероводорода через подкисленный раствор сернокислого К. или же действием на последний раствора сернистого натрия, согласно уравнениям:
CdS04 + H2S=CdS + H2SOt;
CdSOj + NasS=CdS + NasSOj. Светложелтые тона, начиная с лимонно-желтого, получаются при пропускании сероводорода в раствор CdS04, не содержащий примеси цинка; при осаждении сернистым натрием получаются более темные тона краски, а при выработке сухим путем тон краски можно получить любой густоты. Материалами при сухом способе служат углекислый К., CdC03, и порошкообразная сера. Засыпка тигля идет в последовательном порядке: сперва засыпают CdC03,a потом слой порошкообразной серы, причем последней берут вдвое больше по весу, чем соли К. Темп-ру нагрева доводят до белокалильного жара. Если при остывании получается краска нежелательного желтого тона, то к ней добавляют серы и вновь прокаливают. Затем массу растворяют в горячей воде, осадок фильтруют, промывают и сушат. Этот способ дает шесть оттенков краски — от лимонножелтого до темнооранжевого. Кадмиевая желть, как краска, стойка к слабым щелочам и к-там; в сухом виде она хорошо смешивается с ультрамарином, образуя красивого тона зеленую краску, известную под названием кадмиевая зелень.
Кадмиевые краски нельзя смешивать с медными красками, т. к. с последними они изменяют цвети разрушаются; при смешивании с олифой они дают прочные масляные краски, обладающие хорошей укрывисто-стыо. Кадмиевые краски применяются в художественной живописи и рисовании по фарфору, в печатном и в малярном деле. Для удешевления, в продаже их фальсифицируют примесью желтого хрома, гипса и мела. Смесь кадмиевой желти со свинцовыми белилами идет в торговле под названием Jaune briliant.
Лит.: см. Краски минеральные. С. Михайлов.