 > Техника, страница 50 > Кальций
> Техника, страница 50 > Кальций
Кальций
Кальций, Ca, химич. элемент II группы периодической системы, аналог Sr, Ва и Ra, составляющий вместе с ними подгруппу т. н. щелочноземельных металлов; ат. вес 40,07, ат. номер 20. В свободном состоянии К.—серебристо-белый металл, на воздухе быстро желтеющий (вследствие образования пленки азотистого соединения), довольно вязкий, способный коваться и вытягиваться; твердость его несколько выше, чем свинца. Кристаллизуется в ромбоэдрах или гексагональных табличках. Уд. вес 1,52—1,55 (различные образцы металла дают от 1,413 до 1,85); г°,гд. 800—810°; t°Km. около 1 170°. Спектр К. характеризуется рядом ярких линий в оранжевой части спектра, несколькими линиями в фиолетовой и полосой в зеленой. В продажу К. выпускается в виде зерен или палочек; сохраняется лучше всего в легких минеральных маслах.
К. обладает ярко выраженными металлич. свойствами и высокой реакционной способностью. В совершенно сухом воздухе он устойчив, во влажном—быстро окисляется на поверхности. При нагревании до 300° загорается и горит ярким пламенем, соединяясь не только с кислородом, но и с азотом атмосферы, причем образуется смесь окиси—СаО и нитрида—Ca3N2. При нагревании в струе азота или водорода до ί° красного каления К. соединяется с ними, образуя азотистый К. (Ca3N2) или водородистый К. (СаН2). В аналогичных условиях К. легко соединяется с галоидами, серой, фосфором, ом, висмутом, углеродом (образуя карбид, СаС2) и кремнием; дает ряд сплавов с магнием, цинком, алюминием, оловом и никелем. При высоких t° К. восстанавливает окислы многих металлов, а также и металлоидов, например: В203, Si02, С02 (образуя СаС2 и СаО), СО (лишь частично), N0, Р205 (со ом), S02 и S03. При f° 5*800° К. реагирует с фтористыми и хлористыми солями Na и К, восстанавливая свободный щелочной металл. Сероводород, аммиак и углеводороды при нагревании с К. разлагаются, причем последний дает соединения с элементами этих веществ. С аммиаком, при темп-ре не выше 15°, К. дает неустойчивое твердое соединение Ca(NH3)4(кальцийаммоний), легко распадающееся с образованием кристаллического кальций-амида, Ca(NH2)2. К. энергично разлагает при обыкновенной 4° воду (но медленнее, чем калий или натрий), выделяя водород; бурно реагирует с разбавленными к-тами, с ангидридами и хлорангидридами кислот; конц. соляная к-та на него почти не действует; дымящая серная кислота разлагается с выделением S02 и S; обычная конц. H2S04 выделяет также и H2S. Валентность К. во всех устойчивых его соединениях равна 2.
По распространенности в природе К. занимает среди элементов пятое место; среднее содержание его в доступных исследованию слоях земного шара равно 3,25% по весу; в твердых частях земной коры К. составляет по весу ок. 3,5% (шестое место), в воде океанов—0,05%. Многие горные породы, образующие мощные залегания, состоят целиком или в значи-
вался ложкой и погружался в керосин. Горячим прессованием сырого продукта отжимали большую часть шлаков и получали металл примерно 90%-ной чистоты. Дальнейшая очистка (переплавление в закрытых железных или никелевых тиглях) давала 99— 99,3%-ный К. Другой способ электролиза, принадлежащий Ратенау (1904 год) и технически наиболее совершенный, характеризуется применением т. н. прикасающегося электрода: катод (железный или медный) поддерживается при возможно низкой 4° и не погружается в электролит, но лишь соприкасается с его поверхностью. Выделяющийся металл застывает на нижнем конце катода; последний в процессе электролиза постепенно приподнимают так, что К. нарастает на нем в виде столбика неправильной формы, поверхность которого защищается от окисления коркой шлака; этот столбик в дальнейшем сам служит электродом. Современный тип заводской ванны (смотрите фигура): ,л
Разрез по AS
евых солеи: углекисло-
мел, мрамор, доломиты), сернокислого (гипс), фосфорнокислого (фосфориты, апатиты) и фтористого К. (плавиковый шпат). Кремнекислый К. является составной частью огромного большинства природных силикатов. Нерастворимые соли К. образуют основу костей животных и раковин моллюсков, а растворимые содержатся в воде природных бассейнов и в соках растений.
Получение металлич. К. в чистом виде представляет большие трудности. Впервые К. был выделен Деви в 1808 году, но добывание его в технич. размерах началось лишь с 1904—05 гг. Металлич. К. может быть получен двумя путями: чисто химическим и электрохимическим. Первый метод (восстановление солей К., например CaJ2 или смеси СаС12 и КС1, металлич. натрием или магнием при высокой 4°) не нашел применения в технике вследствие его дороговизны, плохих выходов (обратимость реакции) и нечистоты получающегося продукта. Электрохимические методы основаны на электролизе расплавленной соли; электролитом служит СаС12 (4%, 780°), или смесь из 100 в ч. СаС12 и 16,5 в ч. CaF2 (4°м. 660°), или же смесь 85% СаС12 и 15% КС1. Конструкция печи (ванны), предложенная в 1902 г. Бор-херсом для промышленных целей, представляла собою цилиндрический сосуд, сложенный из угольных брусков или плиток и служивший анодом; дно его покрывалось набойкой из CaF2, а остальное пространство заполнялось электролизируемой солью. Соль расплавлялась током при помощи тонкого угольного стержня^—сопротивления, зажатого предварительно между анодом и катодом; в качестве последнего брали железный прут, расположенный вертикально по оси печи и своей нияшей частью погруженный в электролит. К., отлагающийся на катоде в виде губчатой массы, вычерпы
| — | . | О |
£. - + г ΙΊ η Π п П.п Π π П пП η___ |
|||||||
| i i - ; i i i j; i 5 | i : i | : · · !: i i | ||||||||
| и и | fr | |||||||||
| i—= | if г | —. j| | ||||||||
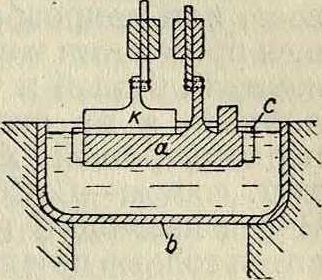
I в железный резервуар Ь в форме корыта, вдоль к-рого, на подобие зубьев гребенки, расположены электроды — непогруженные железные катоды к чередуются с погруженными анодами а, угольными или графитовыми, обернутыми металлической сеткой с. Процесс ведется при температуре 660—800°, напряжении ванны 18 — 42 Ϋ и плотности тока 50 — 250 А/см2; продукт содержит до 98% чистого К.
Примерный состав продажного электро-литическ. кальция (в % по весу): 98,01 Са, 0,94 С1, 0,837 О, 0,14 Mg, 0,032 Si, 0,028 AI, 0,013 Fe. Выходы по току меняются в пределах 30-4—82%; соответственно этому для получения 1 иг К. требуется 424-110 kWh. Весьма значительная часть энергии тока расходуется на нагревание электролита. По методу Ратенау до настоящего времени ведется техническое получение К. на электрохимии. заводе в Биттерфельде (Германия); продукция его, однако, незначительна.
Применение К. в промышленности пока еще очень ограничено. Он употребляется вместо щелочных металлов для обезвоживания некоторых органических соединений; по сравнению с калием и натрием, для него является большим преимуществом менее бурное реагирование с водой и меньшая щелочность его гидроокиси. Большие надежды возлагались на К. как на удобный аккумулятор водорода: водородистый К., СаН2 (смотрите Кальция соединения), одно время готовился в Германии в техническ. масштабе для нужд воздухоплавания; производство это, однако, не развилось вследствие дороговизны К. Делались также попытки использовать К. в металлургии как восстановитель и как средство для удаления (связывания) серы и фосфора. Иногда К. при бавляют в небольших количествах (1—3%) к свинцу для придания последнему большей твердости. Наконец, в самое последнее время К. (в сплавах с другими легкими металлами) нашел применение в качестве газообразователя при изготовлении газобетона (ем.). Специфич. областей применения для К. не найдено.
Лит.: О б щ а я— см.Кальция соединения. М е т а л-л у р г и я кальция — Изгарышев. Н А., Электрохимия и ее технические применения, Ленинград, 1929; R a the паи, «Zeitsehrift f. Elekt.ro-chemie», Halle a/S., 1904, В. 10, p. 502.; В i 1 1 i t e г, Die elektrochemischen Verfahren d. chemischen Gross-industrie, B. 3, Leipzig, 1918: Regelsberger, Chemische Technologie d. Leichlmetallo u. ihrer Legie-rungen, Leipzig, 1926; Г. Π. 96672, 144777, 153731, 155433. В. Янновский.