 > Техника, страница 53 > Коллоиды
> Техника, страница 53 > Коллоиды
Коллоиды
Коллоиды, системы из двух фаз (смотрите), одна из которых,т. н. дисперсная, или внутренняя, фаза находится в мелкораздробленном дисперсном состоянии; вторая, которая окружает отдельные частицы первой, называется дисперсионной, или внешней, фазой (средой). Под указанное определение подходят, кроме К., с одной стороны, истинные растворы (смотрите), называемые так в отличие от коллоидных растворов, в которых степень раздробления дисперсной фазы доходит до размеров одной молекулы или иона, и с другой стороны—грубо дисперсные суспензии (смотрите) и эмульсии (смотрите), содержащие относительно крупные твердые или жидкие частицы, иногда непосредственно видимые глазом. Поэтому в определение К. необходимо добавить средний размер частиц дисперсной фазы, к-рый у К. колеблется в пределах от 1 до 100 тр (10~7—10_5сл). Системы с более мелкими частицами относят к истинным растворам, с более крупными— к суспензиям или эмульсиям. Коллоидные частицы могут содержать весьма различное число молекул: крупные частицы неорганич. К. с простой молекулой содержат тысячи молекул; при переходе к органич. веществам с более сложными молекулами число последних в одной коллоидной частице уменьшается и для очень сложных соединений, например белков, может доходить до одной. В этом случае стираются границы между коллоидными и истинными растворами: те и другие молекулярно-дисперсны. Тем не менее они связаны с типичными К. рядом •общих свойств, отличающих их от истинных растворов: высокой вязкостью, низким осмотическим давлением, медленной диффузией, оптичеек. и электрическ. свойствами и др.
Классификация. Дисперсионная и дисперсная фазы коллоидов могут находиться в различных агрегатных состояниях, например:
Твердые частицы в твердой среде (рубиновое стекло, опал)
Твердые частицы в жидкой среде (суспензоиды)
» » » газообразной среде (дымы)
Жидкие » » жидкой среде (эмульсоиды)
» » » газообразной среде (туманы)
Газообразные частицы в жидкой среде (иены)
Другой принцип систематики К. основан на степени сродства между дисперсной и дисперсионной фазами, определяемой поверхностной энергией на границе раздела. Если сродство между обеими фазами мало, К. называется лиофобным, если же велико—л иофильным. Если дисперсионной средой является вода, коллоиды называют соответственно гидрофобными и гидрофильными. Коллоидные растворы называют также золями; водные коллоидные растворы называются гидрозолями, коллоидные растворы в органических растворителях—о р г а и о з о л я м и (овые растворы—а л к о з о л и). При известных условиях (смотрите ниже) коллоидные растворы способны выделять дисперсную фазу в виде осадка либо целиком застывать в эластичн. студень, называемый гелем; соответственно золям различают гидрогели, органогели (гели).
Образование К. Способы получения К. делятся на конденсационные и дисперсионные.
I. Конденсационные методы основаны на том, что коллоидные частицы получаются путем конденсации, укрупнения или агрегации отдельных более мелких частиц. Так, при быстром охлаждении водяного пара в воздухе он превращается в мельчайшие жидкие капельки, составляющие туман; при охлаждении жидким воздухом слабого раствора воды в пентане получается коллоидный раствор льда в пентане. К этой же группе относится метод Бредига и Сведбер-га, заключающийся в том, что металлические электроды, погруженные в какую-нибудь жидкость, при помощи электрическ. разряда превращаются в пар; быстрое охлаждение паров металла в растворителе заставляет молекулы пара собираться в более крупные частицы, образующие К. (Pt, Ag и другие металлы в воде). На этом же принципе основан новый метод Шальникова и Рогинского, состоящий в испарении обоих компонентов коллоидного раствора в вакууме (посредством небольших электрич. печей) и конденсации паров на стенках сосуда, охлаждаемого жидким воздухом (щелочные металлы в эфире, ксилоле и прочие). Для ряда веществ общим методом получения их в коллоидальном состоянии является растворение вещества в подходящем растворителе (например е) и вливание этого раствора в воду. Так получаются коллоидные растворы серы, мастики, гуммигута и других смол; этот метод основан на том, что водный раствор соответствующего вещества является пересыщенным и поэтому оно конденсируется из молекулярно дисперсного состояния в большие агрегаты; при определенном подборе концентрации идругих условий конденсация останавливается по достижении частицами коллоидных размеров. На том же принципе основано получение К. при образовании нерастворимых соединений из растворимых. Так, от прибавления к истинным растворам хлорного золота восстанавливающих веществ (раствора фосфора в эфире, формальдегида, гидроксиламина и т. д.) выделяются кристаллы металлического золота, рост которых при определенных условиях задерживается в области коллоидных размеров частиц. Этим путем получаются очень устойчивые коллоидные растворы золота, красного цвета, который при коагуляции (смотрите ниже) переходит в синий. Путем химических реакций двойного обмена получается целый ряд нерастворимых в данной среде кислот и оснований, что также приводит к образованию коллоидных растворов. Так, реакция NasSi03+2 НС1=2 NaCl+Ha0+Si02обычный метод приготовления коллоидальной кремневой кислоты. Этим же путем получаются коллоидные растворы солей, например галоидных соединений серебра, AgNO, + МеХ=AgX + MeN03, дающих устойчивые золи в случае избытка одного из реагентов. Пропусканием сероводорода в раствор овистой кислоты получают коллоидальный сернистый :
As20,+3 HsS=3 H„0 + AsaS„
причем на частицах As2S3 всегда присутствует адсорбированный H2S. Приготовленные таким способом золи сульфидов а и других металлоидов, принадлежащих к V группе, весьма устойчивы.
II. Дисперсионные методы, в противоположность конденсационным, основаны на уменьшении величины частиц вещества вплоть до достижения ими коллоидных размеров. Иногда для этого бывает достаточно простого растворения. Таким путем переходят в К. те вещества, размеры молекул которых очень велики и совпадают с размерами коллоидных частиц, например белки, крахмал, многие органич. краски. Другие, менее высокомолекулярные вещества, например K4Fe(CN)e, образуют, К. при растворении как промежуточную стадию между крупными кристаллами твердого вещества и индивидуальными молекулами истинного раствора. Нек-рые вещества для перехода в К. требуют механическ. измельчения; для этой цели применяются коллоидные мельницы (смотрите), получившие в последние годы широкое распространение; однако эти аппараты дают не очень высокую степень измельчения и во всяком случае не позволяют получить частицы тех размеров, которые характерны для коллоидного состояния.
Стабилизация К. Многие вещества, проходя при увеличении или уменьшении размеров частиц через область коллоидных размеров, неспособны задержаться в ней на б. или м. продолжительное время. В таких случаях необходимо своевременно прервать дальнейший рост или, наоборот, растворение частиц. В ряде случаев это достигается путем «защиты», то есть обволакивания частиц тонким слоем какого-нибудь другого вещества, обычно также коллоидной природы, на зываемого защитным К. Этим путем получаются например коллоидные растворы серебра, защищенные протальбиновой или лизальбиновой кислотами, золи золота, защищенные желатиной, и т. д. Общие условия устойчивости коллоидных систем рассмотрены ниже.
Свойства К. 1. Оптическ. свойства. Цвет. Если вещество само по себе не окрашено, и следовательно не имеет резко выраженного поглощения в видимой части спектра, то и коллоидные растворы его обычно получаются бесцветными или почти бесцветными. Цвет коллоидных растворов определяется не только поглощением света, в золях,но и его рассеянием. Релей (Rayleigh) показал, что интенсивность света, рассеянного мелкими частицами, обратно пропорциональна четвертой степени длины волны. Поэтому, если на золь, содержащий коллоидные частицы, падает белый свет, то различные составляющие его лучи рассеиваются неодинаково: в рассеянном свете наибольшую интенсивность имеют лучи с наименьшей длиной волны,то есть синие и фиолетовые. Действительно, большинство бесцветных коллоидов при рассматривании в отраженном, то есть рассеянном, свете имеют синеватый отлив. В проходящем свете те же растворы имеют красноватый или оранжевый оттенок, т. к. прошедший сквозь них белый свет лишен своих синих и фиолетовых лучей, рассеянных во все стороны, и окрашен дополнительно к рассеянному свету. Эта окраска характерна для всех т. н. мутных сред. Если же самое вещество частиц имеет определенную окраску, то и весь коллоидный раствор получает яркий цвет, как например оранжевые золи As2S3, темнокор ячневые золи Fe(OH)3, яркосиние—берлинской лазури и т. д. В нек-рых случаях цвет золя тесно связан не только с химическим составом, но и с размером частиц. Так например яркокрасные золи золота при коагуляции становятся синими— явление, позволяющее вести количественный контроль хода коагуляции (при помощи спектрофотометра). Другие золи, например Fe(Ori)3, многие коллоидные органические краски и защищенные К. при коагуляции своего цвета не изменяют.
Нефелометрия и тиндалимет-р и я. Как всякая мутная среда, К. рассеивают часть падающего на них света. Поэтому, если рассматривать в темноте узкий (конический) пучок света, проходящий через К., в направлении, перпендикулярном направлению пучка, то он выделяется светлым конусом на темном поле. Это явление, получившее название конуса Тиндаля, является чрезвычайно характерным для К. В конусе Тиндаля рассеянный свет прямолинейно поляризован, что отличает это явление от флуоресценции. Количество света, рассеянного коллоидом, позволяет судить о концентрации последнего. Оно определяется различными приборами, называемыми н е-фелометрами, а наиболее точно—т и н-далиметрами, например системы Мекленбурга и Валентинера.
Ультрамикроскопия. На рассеянии света частицами К. основана конструкция ультрамикроскопа — прибора, сыгравшего большую роль в коллоидной химии. Если конус Тиндаля, полученный от очень яркого источника света, рассматривать в микроскоп даже при небольшом увеличении, то диффракционные изображения отдельных частиц разделяются и каждая частица становится видимой как отдельное световое пятно. Изображения частиц, видимые в ультрамикроскоп, не являются однако правильными геометрии, изображениями. В оптике доказывается, что не м. б. получено изображения частиц меньших, чем ^, где
Я—длина волны, а п—показатель преломления света в веществе частицы. Так как п вообще не многим превосходит единицу, то можно считать, что частицы становятся невидимыми, если их поперечник меньше длины полуволны падающего на них света. Поэтому для рассматривания очень мелких объектов пользуются светом с возможно более короткими волнами—синим и фиолетовым, а для фотографирования—ультрафиолетовым, до λ=275 тр. Однако и при таком освещении коллоидные частицы размером < 100 тр остаются невидимыми, то есть не дают правильного геометрич. изображения в обычном микроскопе. Такие частицы м. б. видимы только в ультрамикроскопе, к-рый часто применяется для количественного подсчета частиц в единице объёма коллоидного раствора. При этом необходимо точно измерять видимый (освещенный) объём К., для чего либо промеряют микрометрами ширину и глубину изображения щели в щелевом и иммерсионном ультрамикроскопах либо К. вводят в кварцевую камеру определенной емкости, обычно глубиною в 2μ (в ультрамикроскопах коаксиального типа). Для получения надежных результатов приходится производить счет частиц десятки, даже сотни раз и брать среднее из отсчетов на различных полях. При рассматривании в ультрамикроскоп коллоидные частицы, находящиеся в жидкой или газообразной среде, обнаруживают интенсивное броуновское движение (смотрите), к-рое значительно затрудняет подсчет, но в нек-рых случаях дает возможность делать заключения о форме и природе частиц.
2.Размеры и форма коллоидных частиц. Ультрамикроскопич. исследование не дает возможности непосредственно установить размеры и форму коллоидных частиц: эти данные м. б. найдены лишь косвенным путем. Так, подсчет частиц дает способ косвенного определения их среднего размера. Если аналитически установлено весовое содержание р дисперсной фазы, а счет частиц показал, что в единице объёма их содержится п, то отсюда легко найти средний вес частицы νη ; далее, принимая плотность частиц равною плотности вещества ρ в сплошном виде и делая определенные допущения относительно формы частиц, можно вычислить средний линейный размер частицы. Так, при допущении шарообразной формы частиц имеем:
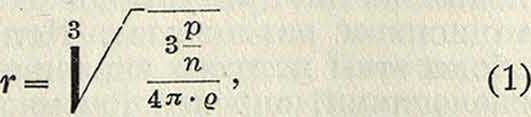
где г—радиус частицы. Точность этого метода понижается тем обстоятельством, что кроме частиц, видимых в ультрамикроскоп, т. н. ультрамикронов, или субмикронов, в К. почти всегда присутствуют еще более мелкие, не обнаруживаемые даже в ультрамикроскоп частицы — а микро н ы, присутствие которых не учитывается; поэтому значения ^ и г получаются больше истинных. Чисто оптический метод определения размера (для относительно крупных коллоидных частиц) выработан в последнее время Гергардтом и Байером. Он основан на том, что частица освещается одним источником света из двух точек (наир, через два отверстия в диафрагме) и полученные «изображения» интерферируют между собой; расстояния между полосами интерференции позволяют вычислить размер частицы.
Для суждения о форме частиц очень полезной оказалась азимутальная диафрагма Шегвари (Szegvari) в применении к ультрамикроскопу коаксиального типа. Уже в обычном ультрамикроскопе щелевого типа нек-рые К. обнаруживают явление т. н. искрения, состоящее в том, что частица, находящаяся в поле зрения, то вспыхивает, то угасает. Это объясняется тем, что удлиненные коллоидные частицы не при всяком положении в пространстве рассеивают свет в направлении оптич. оси микроскопа: частица становится невидимой, если она расположена параллельно падающему на нее лучу или оси микроскопа; обратно, наибольшая яркость получается, когда ось частицы перпендикулярна к этим двум направлениям. Изменяя свое положение в пространстве, коллоидные частицы временами ярко вспыхивают, временами же сливаются с темным полем. Диафрагма Шегвари усиливает это явление и позволяет т. о. отличать золи с частицами удлиненной или плоской формы от золей с б. или м. шаровидными частицами. Еще более точные заключения о форме частиц позволяет вывести применение поляризованного света и изучение двойного лучепреломления, появляющегося при течении золей с нешаровидными частицами, даже если эти частицы состоят из оптически изотропного вещества. Наконец рентгенографический анализ дает возможность определять одновременно как средний размер, так и внутреннее строение коллоидных частиц. У многих К. частицы оказались мельчайшими кристаллами (раньше коллоидальное состояние вещества считалось аморфным и противопоставлялось кристаллическому); например коллоидные частицы золота являются кристаллами кубической системы, с тем же расположением атомов, как и в крупном куске золота. Кристаллики эти столь малы, что во всем объёме коллоидной частицы иногда находится лишь 380 атомов.
Диализ и ультрафильтрация. В виду крайне малых размеров частиц дисперсной фазы К. их не удается отделить от дисперсионной среды теми относительно грубыми методами, которые приняты в аналитической химии для отделения осадков от раствора (декантацией, фильтрованием и т. д.). О размерах пор обычных механич. фильтров дает представление следующая таблица наименьших размеров отверстий:
Проволочных сит.. 0,25 миллиметров
ВОЛОСЯНЫХ СИТ.. 33 Λί
Иенских стеклянных фильтров. 100—5 μ Фильтровальных бумаг обычных. 4.8 μ
Фильтровальных бумаг твердых. 1,6 μ
Свечей Шамберлана. 0,4—0,2 μ
Так как частицы К. мельче ОД /г, они проходят через все эти отверстия и м. б. задержаны лишь специальными ультрафильтрами, с размерами пор 3—1 m/г, приготовляемыми из К.—геля. В качестве тако вого применяются пленки нитроцеллюлозы, получаемые из коллодия испарением растворителя, или же листочки целлюлозы (м е м-бранные фильтры).Так как частицы К. испытывают громадное механическое, а иногда и электростатич. сопротивление при прохождении через столь малые отверстия, то ультрафильтрацию приходится вести, создавая по обе стороны фильтра значительную разность давлений (до 6 atm и более). Подбирая ряд ультрафильтров с различной величиной пор, можно не только выделять дисперсную фазу из К., но и фракционировать коллоидные частицы по.их величине.
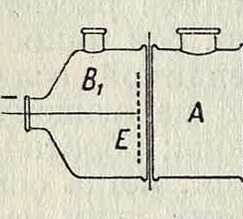
Если отделить водный коллоидный раствор от истинного (или от чистой воды) перегородкой, проницаемой для воды и для обыч ных ионов и молекул, но непроницаемой для коллоидных ча-стиц, то происхо-#г _η+ дит диализ: в JT воду диффундиру-
_ ют кристаллоидные примеси, а коллоид Фигура 1. постепенно очища ется. Такие полупроницаем. перегородки изготовляют обычно из коллодия, пергаментной бумаги и др. Процесс диализа можно ускорить, если содействовать переходу ионов из коллоида в окружающую воду, поместив К. в электрическое поле. Электродиализатор Паули (фигура 1) состоит из трех отделений: в А находится коллоид, в В1 и В2—вода. Камера А отделена от Вх и В2 полупроницаемыми перегородками. В Вх и В2 находятся электроды Е. Если создать на электродах определенную разность потенциалов (несколько десятков или сотен У), то отрицательные ионы из К., притягиваясь к положительному электроду, а положительные—притягиваясь к отрицательному электроду, будут уходить через соответствующие перегородки. Этим путем достигается быстрая и совершенная очистка коллоидных растворов желатины, многих ферментов, кремнекис-лоты и прочие.
3. Осмотические свойства К. Коллоидные растворы, подобно истинным, должны обладать определенным осмотическим давлением. Однако абсолютная величина его крайне мала, т. к. частицы К. очень велики по сравнению с молекулами и ионами истинных растворов, а осмотическ. давление пропорционально числу частиц растворенного вещества в единице объёма. С другой стороны, эта малая величина часто маскируется сравнительно большим осмотич. давлением истинно растворенных примесей, почти всегда присутствующих в коллоиде. Лишь с усовершенствованием методов очистки К. и самой методики измерений удалось определить осмотич. давление, вызываемое коллоидн. частицами: оно приблизительно совпадает с тем, которое можно вычислить, исходя из числа и размеров частиц данного К. Измерение осмотич. давле
ния является в настоящее время одним из методов определения концентрации частиц в коллоидных растворах. Наличие осмотич. давления обусловливает диффузию К., то есть переход дисперсной фазы в области меньшей концентрации. В соответствии с ничтожной величиной осмотич. давления, скорость диффузии коллоидных частиц также очень мала; это является характерным для коллоидального состояния.
4. Оседание частиц К. Под действием силы тяжести коллоидные частицы стремятся опуститься на дно сосуда. Скорость их падения (υ) представляет постоянную величину и, по закону Стокса, выражается следующей формулой:
2. г2(ег~еi)g 9 η
(2)
где г — радиус частиц, ρ2·—их плотность, дх—плотность среды, д—ускорение силы тяжести и η — вязкость среды. Оседанию (седиментации) частиц под влиянием силы тяжести препятствует диффузия, стремящаяся выравнять то накопление частиц, к-рое получается у дна сосуда, и создать равномерное их распределение. В результате этих противоположных влияний, в конце концов устанавливается седиментационное рав новесие, подобное тому, к-рое наблюдается в земной атмосфере. Соответственно большему весу частиц К. по сравнению с молекулами газов воздуха, толщина коллоидной «атмосферы» во много раз меньше, чем газовой: так, например при г= 30 m/г она равна 1,8 миллиметров, при г=5 т/г равна 38 ем. Время, в течение которого достигается полное седиментационное равновесие, будет тем больше, чем мельче частицы; для К. оно вообще очень велико, достигая например 6 лет в случае золя серебра со средним радиусом частиц 5 т/г. В таких К. оседание частиц практически не происходит, т. к. оно нарушается конвекционными токами, вызываемыми неизбежными колебаниями температуры. Искусственно удается вызвать (или ускорить) оседание коллоидн. частиц, заменяя поле силы тяжести гораздо более мощными полями— наприм. центробежной силы. Сведберг сконструировал ультрацентрифугу для К., дающую 44 000 об/мин. и развивающую центробежную силу, в 105 раз превосходящую силу тяжести. Скорость оседания в ультрацентрифуге
= 2 г2(ег—ρ i)m2d ^ v 9 η ’
где со—угловая скорость Еращения и d—расстояние частицы от оси вращения. Отсюда можно определить радиус г и массу частиц, а следовательно и осмотич. давление. Последнее м. б. вычислено также из распределения частиц при установившемся седимен-тационном равновесии. Получающиеся по обоим этим методам значения совпадают со значениями, определенными непосредственно. Ультрацентрифуга является новым ценным средством для изучения К.
5. Электрические свойства К. У большинства К. частицы дисперсной фазы заряжены положительным или отрицательным электричеством. Обычно каждая частица К. несет на себе довольно большое число элементарных электрич. зарядов (е), что может быть установлено косвенными методами. Существуют различные теории происхождения этих зарядов; наибольшее значение имеют теории диссоциационная и адсорбционная. Согласно первой из них заряды возникают вследствие того, что вещество дисперсной фазы, по крайней мере на по-. верхности раздела с дисперсионной средой (в особенности с водой), частично диссоциирует на ионы; ионы одного знака диффундируют в окружающий раствор, а ионы другого знака остаются связанными с частицами и сообщают им свои заряды. Согласно адсорбционной теории, заряды возникают вследствие того, что коллоидные частицы адсорбируют из электролитов (находящихся в растворе в виде примеси) преимущественно ионы одного знака, оставляя противоположно заряженные ионы в растворе. Так как К. в целом не обладает свойством заряженного тела, то ионы противоположных знаков (одни на частицах, другие в растворе) имеются всегда в эквивалентных количествах и не м. б. разделены методами фильтрования или центрифугирования. Гельмгольц впервые ввел понятие о двойном электрическом слое, предположив, что электрич. заряды частиц компенсированы слоем ионов противоположного знака, причем в отрицательных золях против каждого отрицательного заряда частицы в жидкости находится положительный ион, а в положительных золях—наоборот. Противоположно заряженные ионы, составляющие внутренний и внешний листок двойного слоя, должны находиться друг от друга на расстоянии порядка 10-7 сантиметров и удерживаться на этом расстоянии силами электростатич. притяжения. Позже в представления Гельмгольца о двойном слое была внесена поправка, в том смысле, что внешний листок (обкладка) этого слоя находится под влиянием не только электрич. сил, но и силы диффузии, стремящейся вырвать ионы из двойного слоя и распределить их в жидкости равномерно; совместное действие тех и других сил создает нек-рое равновесное распределение ионов, придающее двойному слою диффузный характер.
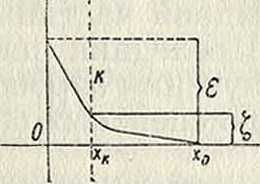
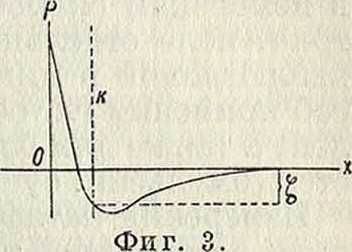
Так как вокруг коллоидной частицы существует неравномерное распределение электрич. зарядов, то между ней и окружающей средой должна установиться определенная разность потенциалов ε. Однако непосредственное измерение потенциала частиц относительно окружающей их среды, основанное на наблюдении перемещения частиц в жидкости, не приводит к определению величины ε. Это объясняется тем, что движущиеся частицы всегда увлекают с собой тонкий слой адсорбированной ими жидкости, в к-ром находится значительная часть ионов, окружающих каждую частицу. Поэтому потенциал, измеряемый при катафоретическом (смотрите ниже) движении частиц (по Фрейндлиху—электрокинетический потенциал, или ^-потенциал), составляет лишь часть полного термодинамического потенциала между частицей и жидкостью. Это показано графически на фигуре 2 и“ 3, где по оси абсцисс отложены расстояния от поверхности частицы, а по оси ординат— соответствующие им значения потенциала Р (в условных единицах). Согласно теории диффузного двойного слоя, по мере удаления от частицы в глубь жидкости, Р уменьшается сначала быстро, затем медленно. Вся разность потенциалов между значениями Р на поверхности частицы и внутри жидкости е
Фиг.
(последнее условно принято за нуль) составляет полный электрич. потенциал ε коллоидной частицы (определяемый термодинамически). Т. к. часть жидкости, прилегающая к частице, увлекается при движении последней (на фигура 2 до прерывистой черты if), то фактически измеряется не весь ε-потенциал, а лишь часть его, приходящаяся на промежуток от хк (границы между неподвижной жидкостью и жидкостью увлекаемой) до такого слоя жидкости х0, где Р обращается в нуль: эта часть и является ^-потенциалом. Вообще говоря, ζ меньше ε, а в некоторых случаях может иметь даже обрати, знак (фигура 3); последний случай имеет место при адсорбции противоположно заряженных ионов в таком количестве, что общая сумма их зарядов превышает первоначальный заряд частицы. Как видно, t-потенциал в сильной степени зависит от количества и распределения адсорбированных ионов, тогда как на значении ε-потенциала указан, факторы не отражаются. Введение электролитов также сильно влияет на строение двойного слоя; чем выше концентрация введенного электролита и валентность его ионов, тем тоньше становится двойной слой, тем меньше его диффузность (отрезок хкх0) и тем меньшее значение следовательно приходится на долю ^-потенциала.
Перемещение заряженных частиц К. в электрическом поло носит название тупафореза (смотрите) или электрофореза. Для изучения этого явления обычно применяется прибор (фигура 4), состоящий из U-образной трубки со впаянными в нее неполяризующимися электродами. В трубку наливают исследуемый коллоидный раствор, а поверх него—чистую жидкость, идентичную с дисперсионной средой данного К. (например воду). Прилагая к электродам нек-рую разность потенциалов, наблюдают перемещение границ фиг 4между водой и К. в обоих коленах трубки (в одном вверх, в другом вниз). Положительно заряженные частицы перемещаются к катоду, отрицательные—к аноду; этим путем узнают знак заряда частиц. Скорость V перемещения границ зависит от электрокинетич. потенциала ζ:
*=(4) где Е—напряженность электрического поля
(в V см), Ώ—диэлектр. постоянная и η—вязкость той среды, в которой движутся частицы. Измеряя V и зная остальные величины, входящие в формулу (4), можно определить ς-потенциал. Описан, способ определения скорости катафореза (массового переноса частиц) называется макроскопическим в отличие от микроскопического, заключающегося в измерении скорости движущейся в элек-трич. поле отдельной коллоидной частицы, наблюдаемой в микроскоп. Последний способ применим гл. обр. для изучения аэрозолей, а также для более грубодисперсных систем (эмульсий, суспензий).
Измерения катафореза, не отличающиеся пока достаточной точностью, показали, что значения ζ-потенциала у различных золей колеблются обычно в пределах 30—70 mV. С прибавлением к золю электролитов скорость катафореза падает тем значительнее, чем выше концентрация и валентность ионов прибавляемого электролита. О техническом использовании явления катафореза см. Электрофорез.
Устойчивость коллоидных растворов. Высокодисперсное коллоидальное состояние не является, вообще говоря, устойчивым, равновесным состоянием материи. Предоставленные самим себе коллоидальные растворы (золи) через больший или меньший промежуток времени коагулируют, частицы их имеют стремление укрупняться, сливаться и выделяться в осадок. Это объясняется существованием междумолекулярных сил притяжения, проявляющихся особенно энергично, когда частицы коллоида, находящиеся в непрерывном броуновском движении, сближаются или сталкиваются друг с другом. В эмульсоидах, представляющих микроскопии. или ультрамикроскопич. капельки жидкости, диспергированной в другой жидкости, наличие междумолекулярных сил притяжения проявляется в слиянии этих капелек и сводится к поверхностному натяжению, стремящемуся придать капелькам минимальную поверхность при данном объёме. 15 с у с п е η з о и д а х, представляющих мельчайшие твердые частицы, взвешенные в жидкости, слияние частиц происходит более сложным образом и сопровождается их р е-к р и с т а л л и з а ц и е й, то есть перестройкой различно повернутых кристаллических решеток в единую решетку.
Несмотря на наличие междумолекулярных притягательных сил многие коллоидные растворы весьма устойчивы и, как показывает опыт, могут сохраняться не коагулируя годами и десятками лет. Следовательно далеко не всякое столкновение менаду частицами К. приводит к их слиянию. Важнейшими факторами стабильности К. являются: электрич. заряд частиц и сродство поверхности коллоидных частиц к растворителю. Одноименно заряженные частицы должны электростатически отталкивать друг друга; это отталкивание не дает им настолько сблизиться, чтобы начали действовать силы ме-ждумолекулярного притяжения, проявляющиеся лишь на очень малых расстояниях. По современной теории диффузного двойного слоя толщина его превышает радиус действия молекулярных сил, и поэтому при столкновениях частиц сферы действия этих сил не могут пересечься. Как указал Габер, такое пересечение может наступить, когда толщина двойного слоя уменьшается (например введением электролитов) до размера радиуса сферы действия междумолекулярных сил. Известны однако Κ.,κ-рые не коагулируют даже при полном снятии электрич. зарядов с частиц; здесь очевидно играет роль второй из указанных факторов устойчивости—сродство поверхности частиц к растворителю (дисперсионной среде). Действительно, такие К. принадлежат к разряду лиофильных, то есть обнаруживают значительное сродство менаду фазами. Как показал Крюйт (Kruyt), для уничтожения стабильности таких золей и коагуляции их нужно не только снять заряд с поверхности их частиц, но и создать между этой поверхностью и растворителем прослойку из другого вещества, обладающего большим сродством к растворителю, чем вещество частиц. Для золей например агар-агара в воде таким веществом является. Иногда удается создать аналогичную прослойку из вещества, сильно адсорбирующегося на частицах золя (например таннин на агар-агаре).
Коагуляция, или превращение золя в гель, то есть соединение коллоидных частиц, приводящее к выпадению их в осадок (у лио-фобных К.) или к застыванию всей массы К. в студень (у лиофильных К.), наступает тогда, когда нарушаются основные факторы устойчивости коллоидной системы и создаются благоприятные условия для действия междумолекулярных сил притяжения. Коагуляция м. б. вызвана изменением Г, действием света, электрич. поля, механич. влияниями, но наиболее полно изучена коагуляция, происходящая от прибавления к золю определенных химич. веществ (смотрите Коагуляция). Для лнофобных золей особенно характерна коагуляция под действием растворов электролитов. Роль последних объясняли раньше т. о., что заряды коллоидных частиц электростатически нейтрализуются теми ионами электролита, которые несут противоположный заряд. Нейтрализованные частицы, лишенные отталкивательных сил, притягиваются друг к другу междумолекуляр-ными силами и сливаются в более крупные частицы. В настоящее время считают, что прибавление электролитов понижает ^-потенциал, уменьшает диффузность и толщину двойного слоя (смотрите выше) и позволяет частицам К. сблизиться на расстояние, при к-ром начинают действовать силы притяжения. По Шульце-Гарди, коагуляция протекает тем энергичнее и тем меньше может быть конечной концентрация электролита в золе, чем выше валентность иона, несущего заряд, противоположный заряду частицы. Так, коагулирующая способность солей К очень мала; двухвалентные ионы Ва и Mg действуют значительно сильнее; еще эффективнее трех-и четырехвалентные ионы А1 и Th. Последний часто не только понижает ^-потенциал, но и вызывает изменение его знака; с точки зрения адсорбционной теории (смотрите выше) это объясняется тем, что число положительных зарядов ионов Th", адсорбированных ча-* стицей, превышает число притянувших их. отрицательных зарядов, и т. о. происходит перезарядка частиц К. Концентрации трехвалентных, двухвалентных и одновалентных ионов, при которых наступает коагуляция одного и того же золя, относятся друг к другу как 1 : 20 : 1 000 или, по другим данным, как 1 : 10 : 500. Это отношение не постоянно, т. к. оно зависит от концентрации золя и изменяется вместе с ней различно для ионов разной валентности. Фрейндлих показал, что нек-рые ионы (например катионы а и других ов) обладают гораздо большей коагулирующей способностью, чем это следует по их валентности; все подобные ионы отличаются ненормально высокой адсорбируемостыо, которая действует т. о. аналогично валентности. Из сказанного выше видно, что коагулирующая способность солей по отношению к отрицательным •золям определяется катионом, а по отношению к положительным — анионом. Однако некоторое влияние оказывают и ионы, заряженные одноименно с частицами; они также адсорбируются последними и при малых концентрациях могут повышать ^-потенциал, а следовательно и устойчивость К. При смешении двух золей противоположного знака заряды их частиц взаимно нейтрализуются, и при известном соотношении концентраций происходит быстрая коагуляция; так ведут себя например золи As2S3 (отрицательный) и Fe(OH)3 (положительный). Влияние электролитов сказывается значительно слабее на гидрофильных и вообще лиофильных К., стабильность которых зависит не столько от заряда частиц, сколько от сродства поверхности частиц к растворителю; здесь большее коагулирующее действие оказывают вещества (например ), способные отнимать воду или другой растворитель. Нек-рые электролиты в очень высоких концентрациях действуют сходным образом, дегидратируя частицы коллоида; в этом смысле ионы могут быть расположены в так называемый лиотропный ряд по степени их сродства к воде. Так например коагулирующее действие анионов возрастает в следующих двух рядах:
CHS < ,Т < Вг и N03 < Cl < SO,.
Валентность иона здесь играет значительно меньшую роль, чем у лиофобных К.
Когда стабильность К. тем или иным способом нарушена, частицы при столкновениях начинают соединяться в агрегаты, к-рые, постепенно укрупняясь, в конце концов выпадают на дно сосуда. Если каждое столкновение ведет к слиянию частиц, то наступает быстрая коагуляция; если же стабильность К. отчасти сохранилась—наблюдается медленная коагуляция. Математич. теория коагуляции построена Смолуховским, который дал следующее выражение для времени Т, в течение которого общее число коагулирующих частиц уменьшается на половину:
(5)
гдеП—константа диффузии, R—радиус сферы действия молекулярных сил притяжения и v0 — первоначальная концентрация частиц К. Эта теория коагуляции хорошо согласуется с опытом; она была впоследствии распространена на полидисперсные золи (с части цами различной величины) и на золи с частицами удлиненной формы.
Золи. Г и д р о ф и л ь н ы е з о л и. Из лиофильных лучше всего изучены гидрофильные К. В эту группу входят нек-рые неорганические К., например кремневая к-та, а из органических—мыла и белки. Белковые вещества по своим химич. свойствам являются амфотерными электролитами, то есть могут отщеплять при диссоциации либо Н-ионы либо ОН-ионы; первый случай имеет место в щелочной среде, второй—в кислой. Свойства белковых К. стоят т. о. в тесной зависимости от концентрации водородных ионов (смотрите), измеряемой величиной Рн в данной среде: при низких значениях Рн частицы белков заряжены положительно, при высоких—отрицательно. При определенном Рн заряд частиц проходит через нуль; это состояние называется изоэлектрической точкой. Для большинства белков изоэлектрич. точка лежит при Рн=4,7—5,5 и замечательна тем, что вблизи нее ряд физических свойств белков (осмотическое давление, электропроводность, вязкость, набухаемость и др.) проходит через минимум.
При смешении гидрофобных золей с гидрофильными последние обволакивают частицы первых и защищают их от коагулирующего действия электролитов. Так, золи золота м. б. защищены золями желатины от коагуляции в присутствии NaCl. Мерой этого защитного действия может служить золотое ч и с л о, то есть число мг желатины или другого гидрофильного К., защищающее 10 см8 золя золота от коагуляции в присутствии 1 ел3 10%-ного раствора NaCl. Если заряды гидрофильного и гидрофобного золей противоположны по знаку, то вместо защитного действия может наступить сенсибилизация, напоминающая взаимную коагуляцию двух гидрофобных коллоидов. Так, серумальбумин сенсибилизирует коагуляцию золей Fe(OH)3.
Органозоли изучены значительно менее, чем гидрозоли. Несмотря на громадное технич. значение таких К. (каучук в бензоле и других растворителях, эфиры целлюлозы в ацетоне и т. д.), в этой области имеются пока лишь отрывочные данные эмпирич. характера. С теоретич. стороны эти К. также представляют большой интерес, так как на них возможно проследить влияние таких важных факторов, как диэлектрич. постоянная среды, электрич. моменты молекул среды и К., и т. д.
А э р о з о л и—К., в которых дисперсионная среда является газообразной, а дисперсная фаза—твердой (пыль, дым) или жидкой (туман). Они обладают многими свойствами, общими с гидрозолями, но обнаруживают и нек-рые существенные отличия; например в отношении электрич. свойств аэрозоли отличаются от гидрозолей отсутствием двойных электрич. слоев на частицах, что обусловливает их меньшую устойчивость. Подробнее об аэрозолях, их свойствах и технич. значении см. Дымы и туманы.
Гели. В то время как в результате коагуляции гидрофобных К. получаются преимущественно кристаллич. агрегаты и порошки, процесс коагуляции гидрофильных К.приво-
дит б. ч. к застудневанию, желатинированию всего раствора. Процесс желатинирования является одним из видов коагуляции К. От обычной коагуляции он отличается тем, что здесь не образуется осадка, то есть отдельной макроскопическ. новой фазы, но вся масса К. принимает своеобразное полужидкое состояние, приобретая вместе с тем некоторые свойства твердого тела (например сопротивление сдвигу). Часто такую застывшую форму называют гелем, но правильнее называть ее с т у д н е м, т. к. гелями называются и всякие другие твердые формы К. Факторы, вызывающие желатинирование К., могут быть весьма различны; в одних К. оно происходит под действием электролитов, аналогично обычной коагуляции, в других (и это случается гораздо чаще)—при изменениях {°. В последнем случае наблюдаются различия в поведении К.: нек-рые из них застудневают при низкой и разжижаются при высокой t°(желатина), другие—наоборот (альбумин). Многие К. способны застудневать даже при очень низких концентрациях дисперсной фазы—порядка нескольких десятых процента (желатина, агар-агар). Студни делятся на хрупкие и эластичные. Первые обладают тем свойством, что при выделении из них жидкой фазы они сохраняют первоначальную форму и могут снова воспринять в себя жидкую фазу без различия ее химич. индивидуальности (вода в студне кремневой кислоты м. б. постепенно заменена ом, затем бензолом, хлороформом и т. д.); кроме того такие студни, будучи лишены жидкой фазы, легко рассыпаются в мелкий порошок. Эластичные студни, лишаясь жидкости, значительно уменьшают свой объём и превращаются в упругую роговидную массу; жидкость, которую они способны снова воспринять, всегда индивидуальна (желатина воспринимает только воду, каучук—только ор- * ганические растворители); это поглощение жидкости всегда сопровождается значительным увеличением объёма—н а б у х а н и е м. Ыабухаемость золей сильно зависит от Рн жидкости, в которой они набухают. Минимум набухания наблюдается вблизи изоэлектри-ческой точки; при большем или меньшем значении Рн набухаемость значительно возрастает. При достаточном введении жидкой фазы набухание может окончиться разжижением (растворением) студня, но это наблюдается не всегда: большинство упругих студней при достаточно низкой ί° только набухают, но не растворяются. Поэтому набухание и растворение следует рассматривать как два самостоятельных процесса. Растворение (плавление или разжижение) студня не имеет постоянной Г-н ой точки. Студнеобразная форма вещества является очень важной как в биологии, так и в технике, так как, соединяя в себе механич. признаки твердого и жидкого тела, она кроме того обладает чрезвычайной подвижностью состояния.
За последние годы сделаны большие успехи в смысле изучения структуры гелей. Для нек-рых из них ультрамикроскопически доказано, что они имеют волокнистое, войлокообразное строение и содержат в промежутках (ячейках) между волокнами более разбавленный раствор К. Иногда структура таких гелей м. б. нарушена простым встряхиванием; гель при этом разжижается, а при стоянии в покое вновь застывает. Образование крупных агрегатов иногда имеет место уже в золе; это видно из того, что например вязкость растворов желатины падает, если пропустить их несколько раз через капилляр (при этом агрегаты разрушаются).
К.в природе итехнике. К. играют громадную роль как в неорганич. природе (воды многих источников и водоемов являются разбавленными К., многие минералы и горные породы образуются при коагуляции золей кремнекислоты электролитами или др. К.; погода зависит от процессов, протекающих в аэрозолях атмосферы), так и, в особенности, в живых организмах. Ткани животных и растений по большей части представляют собою сложные коллоидные системы, состоящие из золей и гелей. За последние годы К. вызвали к себе большой интерес со стороны медицины. Роль К. в технике также громадна: почти не существует таких областей техники, где не приходилось бы иметь дела с К.; нек-рые же отрасли промышленности представляют собою почти целиком отделы прикладной коллоидной химии. Таковы например промышленность кожевенная (дубление кожи), текстильная (волокно, его обработка и крашение), мыловаренная (образование коллоидного раствора и коагуляция его при высаливании), искусственного волокна, резиновая, пластических масс, стекольная, керамическая, фотографическая (приготовление светочувствительных эмульсий, точнее—суспензий), производство клея и желатины, многие отрасли пищевой промышленности (например производство масла и маргарина); сюда же относятся: применение флотации (смотрите) для обогащения руд, очистка сточных вод, осаждение дымов, и т. д. Во многих из этих производств теории коллоидной химии способствовали выяснению сущности технологическ. процессов или привели к их существенному улучшению. Подробности этих процессов и свойства технических К.—см. в соответствующих статьях.
Лит.: Гатчек Э., Введение в физику и химию коллоидов, пер. с англ., М.—Я., 1927; Менделеев Д. И., Основы химии, 9 изд, т. 1, М.— Л., 1927; Наумов В. А., Химия коллоидов, Л. 1926; Песков Η. П., Коллоиды, Физико-химические основы коллоидной науки, Иваново-Вознесенск, 1925; Дюкло Ж., Коллоиды, перевод с Франц., Л., 1924; М е н ь е Л., Коллоидная химия и ее применение в промышленности, пер. е Франц., М., 1926; Zsigmondy R., Kolloidchemie, В. 1—2, Leipzig, 1925—1927; Freundlich Н., Kapillarchemie, 3 Auflage, Lpz., 1923; Freundlich H., Fortschritte der Kolloidchemie, Dresden—Lpz., 1926; Hahn F. Dispersoidanalyse, Handbuch der Kolloidwissenschaft. in Einzeldarstellungen, hrsg. v. Wo. Ostwald, B. 3, Dresden—Lpz., 1928; Pauli W. u.Valk о E., Elektro-chemie der Kolloide, Berlin, 1929; LiesegangR.E. Kolloidchemische Teehnologie, Dresden—Lpz., 1926— 1927; Alexander ,1.,Colloid Chemistry, Theoretical and Applied, by Selected International Contributors, v. 1—1Theory a. Methods, N. Y., 1926; Liesegana R., Kolloide in der Technik, Dresden—Leipzig, 1923; «Kolloid-Zeitsehrift», Dresden, 1906. А. Рабинович.