 > Техника, страница 54 > Комплексные соединения
> Техника, страница 54 > Комплексные соединения
Комплексные соединения
Комплексные соединения, химич. соединения, образуемые путем сочетания двух или нескольких целых молекул, из которых каждая способна к самостоятельному · существованию. К обширному классу К. с. относятся двойные соли, гидраты, аммиакаты, комплексные кислоты и т. д. Ниже приведено несколько характерных типов комплексных соединений.
PtCl2-2NH3 CoCl3-6NH3 Fe(CN)2-4 KCN
PtCl4-2KCl CrCl3-5NH3 Fe(CN)3-3 KCN
Pt(CN)4-2KCN CrCl3 · 6 H20 Na2W04-4W03
CoCl3-4NH3 CrCl3 · 6 NH3 K2Cr04-Cr03
CoCl3-4NH3-2H20 Κ3ΜοΡ07·Μο03·3Η20
Теории, пытавшиеся объяснить строение К. с. (Бломстранда, Клеве, Иергенсена), основывались первоначально на классической теории строения и на допущении переменной валентности образующих К. с. элементов. Более удовлетворительное объяснение строения большинства комплексных соединений дает координационная теория, предложенная А. Вернером, которая хорошо согласуется с фактами и в ряде случаев позволила сделать предсказания, блестяще подтвердившиеся на опыте.
По Вернеру, один из атомов (чаще всего металл) занимает в молекуле К. с. центральное место; вокруг него располагаются остальные атомы, образующие два слоя. Во вну-трен. слой, или в первую координационную сферу, входят атомы или молекулы, прочно связанные с центральным атомом; число их ограничено и обыкновенно равно 4 или 6
(координационное число). Все остальные атомы (если они имеются) входят в состав внешней сферы и, как более удаленные от центрального атома, связаны с ним слабее; они могут поэтому, в противоположность атомам внутренней сферы, легко отделяться в виде ионов. Представления Вернера легко м. б. прослежены например на ряде соединений хлорной платины с аммиаком. Присоединяя 2NH3 к PtCl4, получаем PtCl4(NH3)2, где число отдельных групп, связанных с центральным атомом Pt, равно 6, и следовательно все они могут войти во внутреннюю сферу; соединение это ионов не образует. При введении двух новых молекул аммиака получается PtCl4-4NH3, где все группы не могут поместиться во внутренней сфере: два атома С1 будут вытеснены во внешнюю сферу, и молекула К. с. примет вид [PtCl24 NH3] С12 (в формулах внутренняя сфера заключается в прямые скобки). Соединение это будет электролитом: оно способно диссоциировать на ионы СП и на двухвалентный комплексн. катион [PtCl24NH3]". Действительно, в этом случае лишь половина хлора легко и быстро осаждается AgN03; вторая половина реагирует значительно медленнее. Действуя далее на [PtCl24NH3] С12 аммиаком, получаем соединение [Pt6 NH3] Cl4,—соль с комплексн. 4-валентным катионом, во внутренней сфере которой расположены 6 молекул NH3. Аналогичную структуру должен иметь хлоро-платинат калия, [PtCle]K2; находящиеся во внутренней сфере 6 атомов хлора сообщают комплексу [PtCle] характер электроотрицательного кислотного остатка, связывающего положительные ионы калия. Измерение молекулярной электропроводности таких солей хорошо подтверждает изложенную теорию. Координационные ф-лы можно приписывать также гидратам солей, например: [Са6Н20] Cl2; [Zn6H20] (NO,)“; [А16НаО] С13и т. д. Сульфаты, кристаллизующиеся с 7 молекулами воды, также могут быть изображены координационными ф-лами: [Zn6H20] (S04H20); [Ni6H20] (S04H20). Замена в них остатка (S04H20) на (XS04) (здесь X—щелочной металл) приводит к известному ряду двойных сернокислых солей типа:
[Me 6Н20] (XSOa).
Между приведенными выше аммиакатами и гидратами возможен непрерывный переход: [Сг 6NH3] С13; [Сг 5ΝΗ3Η20] Cl„; [Cr4NH32HaO] Cl,; [Сг 3NH, зНаО] С13; [Сг 2NH, 4Н30] С1,; [Сг 6Н20] С13.
Координационная теория позволяет развить совершенно новый взгляд на строение гидратов кислот и солей: их можно рассматривать также как соединения оксония, то есть кислорода, имеющего координационное число 3:, it
[н>-н]С1 или [н>~н]С1 ·
Для объяснения многочисленных случаев изомерии К. с. Вернер приписывает атомам, находящимся во внутренней сфере, определенное пространственное расположение. В соединениях с координационным числом, равным 4, атомы или молекулы располагаются по углам квадрата; например соединение строение:
[Pt4NH3]Cl2 имеет следующее ггш3
.NH,
[Pt
l···
|_ΝΗ3 ;— ΝΗ,
При замещении двух молекул ΝΗ3 двумя атомами С1 возможны два изомера:
соль Пейроне соль 2-го основания Рейзе
| rei_ΝΗ3η | γνη3__ci η | |
| |pt| | И | Μ |
| |_ci— nhJ | L Cl- NHaJ |
cis - форма trans - форма
Оба изомера действительно известны; третий изомер, имеющий тот же состав, но вдвое больший молекул, вес—зеленая соль Магнуса, [Pt4NH3][Pt4Cl], является комплексной солью комплексной к^гы. В соединениях с координационным числом, равным 6, группы внутренней сферы расположены в вершинах правильного октаэдра; таков например катион соединения [Co6NH3] С13. При замещении 2молекулЫН3 двумя группамиХОгздесь также возможны и найдены два изомера: cis-форма (флавосоль, фигура 1) и trans-форма (кроцеосоль, фигура 2); они различаются между собою по растворимости, цвету и химии. свойствам. Октаэдрическ. модель позволяет также предвидеть возможность оптич.
Г А С СП
изомерии для молекул строения I ме в D DJ · Вернеру удалось получить изомерные оптически деятельные соединения кобальта, хрома, железа и ряда др. элементов, что явилось блестящим подтверждением развитой им же теории. В последнее время Шерер и Столле при помощи рентгеновского анализа определили истинное расположение атомов в крист хлороплатината калия K2PtCl6, или [PtCle]K2. Оказалось, что в элементарн.
NHi
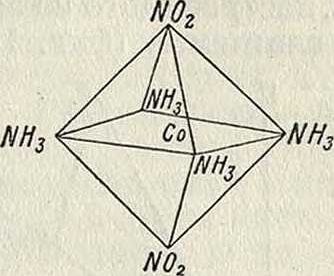
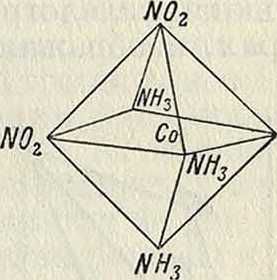
Фигура 1.
Фигура 2.
ячейке кристаллич. решетки каждый атом Pt окружен шестью атомами С1, расположенными в вершинах октаэдра, а атомы К находятся на большем расстоянии и располагаются в вершинах кубов, центрами которых являются атомы Pt; таким образом теория Вернера получила новое веское подтверждение. В настоящее время исследование К. с. направлено к выяснению природы и характера сил, связывающих отдельные части комплексных молекул.
Лит.: Чугаев Л. А., Теория строения комплексных соединений, М., 1910; Ч и Ί и б a G и и А., Координационная теория Вернера—см. Менделеев Д. И., Основы химии, т. 2, М.—Л., 1929; Чугаев, «Новые идеи в химии», СПБ, 1914, 1 Werner А., Neuere Anschaungen auf d. Gebiete d. anorganischen Chemie, 5 Auil., bearb. v. P. Pfeiffer, Braunschweig, 1923; Ephraim Fr„ Anorganische Chemie. Dresden — Lpz., 1923. А. Моносзон.