 > Техника, страница 54 > Концентрация водородных
> Техника, страница 54 > Концентрация водородных
Концентрация водородных
Концентрация водородных ионов,
содержание водородных ионов (смотрите) в единице объёма чистого вещества, воды или раствора какого-либо вещества, способного диссоциировать с образованием Н-ионов. При исследовании какой-нибудь среды результаты простого ацидиметрического или алка-лиметрического титрования (смотрите Анализ химический) обычно не дают представления об ее истинной кислотности или щелочности, т. к. слабые кислоты или слабые щелочи диссоциированы лишь в незначительной степени (смотрите Диссоциация электролитическая), и между концентрацией их ионов и концентрацией недиссоциированных молекул устанавливается подвижное равновесие. По мере нейтрализации испытуемого раствора при помощи титрования запас недиссоциированных молекул подвергается постепенно дальнейшей диссоциации—до тех пор, пока все молекулы кислоты или щелочи не будут нейтрализованы полностью. Т. о. при титровании обнаруживается лишь потенциальная кислотность, а не фактическая К. в и.; между тем только последняя обусловливает кислую реакцию среды. То значительное влияние, которое кислотность или щелочность среды оказывает почти на все биологич. и техноло-гич. процессы (скорость химическ. реакций, процессы набухания и коагуляции коллоидов, адсорбции, брожения, ферментации и многие другие), проявляется именно со стороны свободных Н*-ионов. Отсюда возникает необходимость выработать методы точного определения К. в и., а равно и методы поддержания К. в и. на определенном постоянном значении, благоприятствующем или же, наоборот, препятствующем течению того или иного технологии, процесса. В целях удобства графич. изображения К. в и. принято выражать не в абсолютных значениях [Н*], а в виде так называемым водородного показателя, обозначаемого символом Рн (или pH) и представляющего собою десятичный логарифм величины [Н‘], взятый с обратным знаком, то есть
pH--ig [н·];
например величине [Н‘], равной 10 7, соответствует Рн=7. Значение Рн=7 характеризует нейтральную реакцию среды; при Рн < 7 реакция будет кислой, при Рн > 7— щелочной. Увеличение и уменьшение величины Рн происходит следовательно в направлении, обратном изменению истинной концентрации водородных ионов.
Определение К. в и. может быть выполнено помощью одного из двух основных методов: а) электрохимического (потенциометрического), б) индикаторного. Электрохимический метод определения К. в и. основан на измерении эдс концентрационной газовой водородной цепи, то есть гальваническ. элемента, в к-ром измеряется разность потенциалов между двумя водородными электродами, погруженными в две жидкости с различной величиной К. в и. Водородные электроды изготовляют из благородного металла (чаще всего платины или золота), который насыщают газообразным водородом; весьма часто применяют платиновые электроды, покрытые электролитически платиновой чернью. Такие электроды при погружении в раствор практически обнаруживают электролитич. упругость растворения, свойственную газообразному водороду. Измерив эдс, возникающую благодаря неодинаковой К. в и. в обеих жидкостях, и зная К. в и. в одной из этих жидкостей, находят величину К. в и. в испытуемой жидкости, пользуясь формулой Нернста;
®=^·1η£’ (!)
или, с переводом в десятичный логарифм,
Е =
RT Д-Ο,4343
lg
Cl’
(2)
здесь R—газовая константа, Т—абсолютная темп-pa, F—выраженное в фарадеях количество электричества, переносимое одним з-ионом (для одновалентных ионов F — 1), С2—К. в и. в более концентрированном растворе и Сг—то же в менее концентрированном. Для различных температур выражение
RT
„.п. имеет след, значения:
0—0,054 5”—0,055 10°—0,056 15°—0,057
18°—0,058 20°—0,058 22°—0,059 24°—0,059
28°—0,060 30“—0,060 32°—0,061
34°—0,061 36°—0,061 38°—0,063
Измерение эдс обыкновенно производят при помощи мостика Витстона, в котором измеряемой эдс противопоставляется эдс нормального элемента или эдс аккумулятора, предварительно измеренная путем сравнения с нормальным элементом; индикатором отсутствия тока в мостике служит капиллярный электрометр Липмана или квадрантный электрометр; взаимная компенсация двух эдс достигается изменением сопротивления при помощи штепсельного магазина сопротивлений.
Для определения К. в и. в испытуемом растворе этот последний нали- фигура i.
вается в особый сосуд (наиболее употребительным является грушевидный сосуд, изображенный на фигуре 1); через краны его а и b предварительно пропускают тщательно очищенный водород, адсорбируемый поверхностью платиновой проволоки р, покрытой платиновой черныо. Второй точно такой же сосуд наполняют раствором, для которого К. в и. точно известна. Соединение обоих сосудов производится через боковые трубки и промежуточную ванну, которая наполнена конц. раствором КС1 (для предотвращения возникновения разности потенциалов вследствие неодинаковой скорости диффузии аниона и катиона испытуемого электролита; у КС1 скорости диффузии ионов К* и С1 имеют одинаковую величину); соединительные трубки между сосудами и ванной заполняются студнем из насыщ. раствора КС1 в 25—30 %-ной желатине. Соединяя проводниками клеммы к обоих сосудов с электроизмерительной установкой, определяют эдс концентрацион-
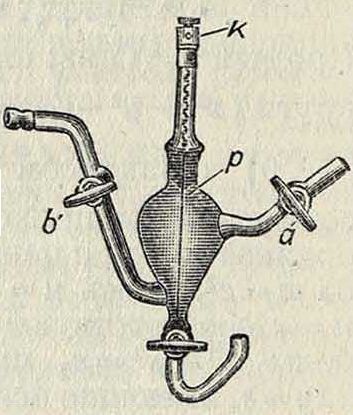
ной цепи, образованной двумя по луэцементами. В качестве полуэлемента с постоянным потенциалом нередко применяют к алом елевый электро д—сосуд, содержащий на дне металлич. ртуть, покрытую слоем каломели, затем слоем кристаллов КС1 и наконец насыщенным раствором КС1 (все вещества должен быть наивысшей чистоты). Электродный потенциал Пг такого электрода при разных ί° равен (в вольтах):
| ί° | 15 | 16 | 17 | 18 | 19 | 20 |
| Пг | 0,2525 | 0,2517 | 0,2509 | 0,2503 | 0,2495 | 0,2488 |
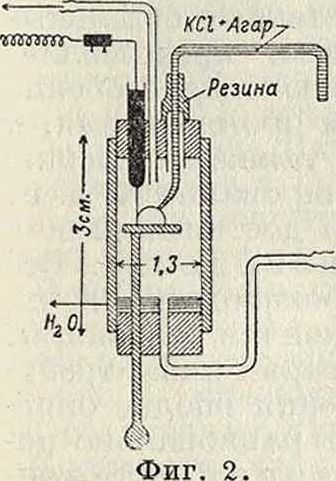
Для определения К. в и. в минимальных количествах жидкости (например одна капля) применяют микроэлектроды Лемана (фигура 2), Винтерштейна и других систем. Для измерения К. в и. в средах, компоненты которых взаимодействуют с металлом электрода, в последнее время стали применять стеклянный электрод Габера (смотрите Электролиз).
Вместо водородных электродов, описанных выше, гораздо удобнее пользоваться хингидроновым электродом. Действие его основано на том, что хингидрон в водном растворе распадается на хинон и гидрохинон, причем последний функционирует в качестве двуосновной _ к-ты, образующей двух-~иг зарядный анион, по составу одинаковый с хи-ноном, и два Н‘-иона. Хинон является окислителем, а анион гидрохинона (отличающийся от первого двумя отрицательными зарядами), — восстановителем; присутствуя в растворе одновременно, они влияют на величину эдс Eк, возникающую при контакте металла с раствором, т. о.,что где Ек, R (газовая постоянная) и Т (абсолютная температура) — постоянные величины, а [ан. гидр.] и [хин.] — концентрации анионов гидрохинона и молекул хинона в растворе. Подстановка в ур-ие (3) значения концентрации [ан. гидр.], выраженной через константы диссоциации Кг и Кг (для 1-го и 2-го Н-ионов) гидрохинона, приводит после ряда преобразований и упрощений к следующему выражению:
E=Ek- ~ In КхК.г + RT In [Η*]. Вводя обозначение:
Ek — ~ln КгК2=Ек,
получаем:
Е=Е;с + RT In [Н‘], (4)
или, обозначая, как обыкновенно, —lg[H*] через Ря и переходя к десятичным логарифмам, имеем:
Е=Ek — KRTPr,
где К — модуль перевода десятичных логарифмов в натуральные. Отсюда
Р _ Ек~_Е » KRT ’
(5)
где Е.—разность потенциалов, измеренная при помощи хингидронового электрода по отношению к исходному электроду, а Ек—· константа, зависящая от того, какой электрод выбран в качестве исходного; например для каломелевого электрода с насыщенным раствором КС1
Ек=0,4568 V.
При пользовании хингидроновым электродом достаточно всыпать в испытуемую жидкость щепотку хингидрона и погрузить в раствор электрод из обыкновенной платиновой проволоки; другим полуэлементом может служить каломелевый электрод или второй хингидроновый электрод с известной величиной К. в и., постоянство которой поддерживается определенной буферной смесью (смотрите); в последнем случае оба раствора (испытуемый и стандартный), содержащие хингидрон, помещают в один общий сосуд (прибор Мисловицера, фигура 3) с двойными стенками; в каждый раствор погружен отдельный электрод из платины или золота. Конечный потенциал в этом приборе устанавливается в несколько секунд, вследствие чего прибор Мисловицера удобен для быстрого измерения К. в и. в целой серии растворов. Однако хингидроновый электрод неприменим при измерении концентрации водородных ионов в щелочных растворах, так как в этих случаях хингидрон разлагается.
Колориметрический (индикаторный) метод определения К. в и. основан на том, что все индикаторы (смотрите) являются слабыми электролитами кислотного или основного характера, причем их ионы обладают окраской, отличающейся от окраски недиссоциированных молекул. При внесении индикатора в испытуемый раствор диссоциация его молекул либо подавляется избытком Н*-ионов либо, наоборот (для индикаторов основного характера), усиливается в присутствии более сильной кислоты и уменьшается в присутствии щелочи. При постепенном прибавлении щелочи к индикатору (имеющему характер кислоты) сначала часть его нейтрализуется, образуя щелочную соль индикатора, которая почти нацело диссоциирует на ионы. Благодаря этому образуется смесь слабой кислоты с ее щелочной солью, то есть буферная смесь, для к-рой
П
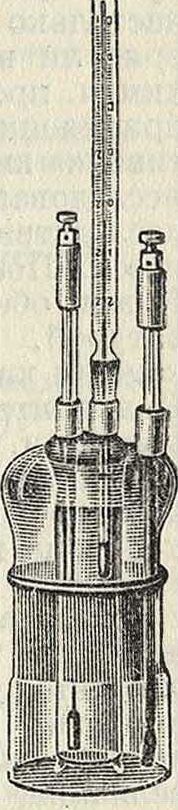
Фигура 3.
гтт1 _ гг [кислота] LH j — я -п—у- ·
(6)
В такой Смеси К. в и. является в широких пределах независимой от абсолютного разбавления, но зависит только от соотношения концентраций кислоты и соли. Другими словами, всякий индикатор имеет определенную зону значений К. в и., в пределах которой он сохраняет постоянную окраску (да же при дополнительном прибавлении кислоты или щелочи), т. к. в этом случае буферное действие смеси индикатора с его солью ограждает величину К. в и. от изменений до тех пор, пока не исчерпается емкость буферной смеси, зависящая от количества последней. Подобрав шкалу различи, индикаторов (с различными значениями К), можно определять К. в и. путем колориметрического сравнения окраски исследуемого раствора, содержащего индикатор, с окраской определенной буферной смеси, содержащей тот же индикатор. Сведения об индикаторах и буферных смесях, применяемых для определения К. в и., см. Спр. ТЭ, т. I, стр. 445.
Применение определений К. в и. в промышленности, в частности для контроля производства, за последнее время получило настолько широкое распространение, что вряд ли возможно указать такую отрасль химич. промышленности или такую область применения химич. процессов, в которой «активная» кислотность, ее регулирование и ее исследование не были бы связаны с важными последствиями для всего хода данного процесса. Поэтому периодическое определение К. в и., обеспеченное соответствующей аппаратурой, является необходимым почти в каждом химич. предприятии. Важную роль К. в и. играет например при процессах коррозии (смотрите) металлов, обусловленной соприкосновением горячей воды с металлич. стенками котлов и труб. В отсутствии кислорода коррозия железа протекает различно, в зависимости от К. в и. среды, уменьшаясь с возрастанием значения Рн от 7,0 до 9,4; при Рн=9,4 коррозия практически останавливается. В присутствии растворенного 02коррозия протекает более энергично, причем Рн снижается и никогда не достигает величины 9,4. Контроль К. в и. особенно необходим для растворов едкого натра или извести; при Рн > 12 коррозия железа возобновляется и идет так же легко, как и при Рн < 9,4. Не меньшее значение имеет исследование активной кислотности при испытании грунтов, соприкасающихся с подземными металлическ. трубами, а также при подготовке почвы под посевы культур и при ее удобрении (для большинства растений оптимальная реакция почвы соответствует Рн=6,5 4- 8,0). В биологической очистке сточных вод контроль К. в и. не менее существен: оптимумом для процессов, протекающих в иле стоячих вод, является Рн== 7,34-7,6; при Рн =7,3 процесс сопровождается усиленным образованием жидких и уменьшением выделения газообразных веществ. Поддержание определенного значения Рн необходимо также и при очистке воды от коллоидальных примесей при помощи коагуляции. В керамическом производстве пластичность глин, их коллоидальные свойства и в зависимости от этого качество изделий из обожженных и из необожженных глин в высокой степени зависят от значения К. в и. воды или раствора, применяемых для замешивания пластц-ческ. массы. В последние годы выяснилось, что К. в и. среды играет весьма значительн. роль в флотационных процессах (смотрите Флотация)·, в данном случае К. в и. оказывает влияние на величину поверхностного натяжения, от которой в конечном счете зависит эффект флотации. При гальваностегии условия отложения металлов (никеля, кобальта, марганца, хрома, цинка, железа) на поверхности металлических изделий также находятся в зависимости от Рн применяемого электролита. К. в и. в последнем часто регулируют прибавлением какой-нибудь кислоты (например Н3В03). Соблюдение надлежащих условий К. в и. имеет громадное значение в кожевенной промышленности, в частности при процессах мочки и дубления кож, а также в производстве клея и желатины. Особенно много улучшений внесло учение о К. в и. в производственные процессы с а-харной промышленности. К. в и. оказывает существенное влияние на процесс инверсии сахарозы,· увеличивая содержание в продукте инвертированного сахара и затрудняя его кристаллизацию. В последнее время в сахарной промышленности вводятся автоматич. установки для непрерывного контроля и регулирования щелочности растворов сахара, участвующих в отдельных стадиях производства. В бумажной промышленности регулирование Р„ жидкостей, в которых протекают отдельные производственные процессы, представляет не меньшее практическое значение; особенно это относится к процессам проклеивания, к сульфитному процессу, а также к белению бумаги. Контроль и регулирование К. в и. связаны с существенными достижениями в варенном производстве. Все отдельные стадии этого производства, начиная с получения солода и кончая условиями, в которых производится варка пива, требуют обязательного соблюдения вполне определенных границ К. в и. В рационально поставленном молочномхозяйстве контроль за состоянием К. в и. имеет важное значение при оценке качества молока, его свежести, состава, разбавления, фальсификации, бактериологических изменений и при оценке количества белковых веществ в молоке. Наконец не меньший интерес представляет определение К. в и. при разрешении целого ряда бактериологических, физиологических и медицинских проблем, где исследование активной кислотности и буферного действия крови, тканевых жидкостей и выделений дает ценные указания для диагностики и терапии многих заболеваний.
За границей имеются в продаже приборы разнообразных конструкций для быстрого и точного определения К. в и. в различных условиях. Одни из них представляют собою компактно и удобно смонтирован, установки для потенциометрического определения К. в и., другие—б. или м. сложные приборы, действующие по колориметрическому принципу, то есть использующие индикаторный метод. Первые пригодны для быстрых и точных измерений и допускают работу с окрашенными и мутными объектами (кровь, фрукт, соки и др.), но дороги (150—200 р.) и требуют весьма осторожного обращения; вторые более дешевы и просты в обращении, но дают не столь точные результаты, и область применения их более ограничена.
Лит.: Леман Г., Измерение концентрации водородных ионов, перевод с нем., М.—Л., 1929; М и-словицер Э., Измерение концентрации водородн. ионов, пер. с нем., Л. (печат.); К о л ь т г о ф И. М., Применение цветных индикаторов к нейтрализационному анализу и колориметрич. определению концентрации водородн. ионов, пер. с нем., 3 изд., Л., 1929; М i с h а e 1 i s L., Wasserstoffionenkonzentration, Т. 1, 2 Autlage, В., 1923; Kopaczewski W., Les ions d’hydrogdne, Paris, 1926; Clark, The Determination of the Hydrogen Ions, 2 ed., N. Y., 1927; Britton H., Hydrogen Ions Concentration, their Determination a. Importance in Pure a. Industrial Chemistry, London, 1929; Behrens, «Ztsohr. d. analyt. Chemie», 1928, B. 73, p. 129 (индикаторная бумага для определения Рн). Б. Беркенгейм.