 > Техника, страница 54 > Коррозия
> Техника, страница 54 > Коррозия
Коррозия
Коррозия металлов, поверхностное разрушение металлов под действием химич. или электрохимич. факторов. Различаются:
а) К. в электролитах и б) К. под действием газов или паров при высоких ί°.
Коррозия металлов в электролитах [х].
Сюда относятся процессы ржавления железа,разрушения металлов под действием воды и различных химических реагентов и т. д. По вычислениям проф. Мааса, мировое производство железа с 1890 по 1923 г. равняется 1 766 млн. т; за то же время потери железа от К. составляют 718 млн. т, то есть ок. 40%. При этом значительная часть потерь оказывается невозвратимой, и т. о. происходит своеобразный процесс «рассеивания» наиболее ценных для техники металлич. материалов. Американцы исчисляют убытки от К. в среднем ок. 2 млрд. долл, в год. В особенности важное значение вопросы К. приобретают в химич. промышленности. Здесь не только рациональная постановка производства, но зачастую и самая возможность ведения тех или иных процессов (например синтез азотной кислоты) зависят от правильного подбора и отыскания необходимого стойкого материала. В авиации и морском деле в связи с применением легких сплавов не менее важна проблема защиты металлическ. конструкций от разрушения влажным воздухом и морской водой. Так, в нек-рых местах Ю. Америки, где воздух содержит высокий % влаги и соляной пыли, самолеты из дур-алюмина разрушались уже через несколько месяцев несмотря на самый тщательный уход; свыше 50% эксплуатонных расхо дов ложилось только на различные предохраняющие от К. меры защиты. Совершенно понятно значение вопросов борьбы с К. в машиностроении (паровые турбины, газовые турбокомпрессоры, двигатели внутреннего сгорания и т. д.), строительном деле (особенно гидротехнич. сооружения, горная техника), коммунальном хозяйстве (водопроводы и канализация). Нет почти ни одной отрасли народного хозяйства, где коррозия и борьбй с ней не имели бы значения в той или иной мере.
Одними из первых исследователей К. были Галль (1819 г.), Деви (1824 г.) и Тенар(1819 г.),к-рые указали на роль кислорода и углекислоты и ни электрохимический характер процессов К. В 1830 г. Делярив основал теорию локальных элементов, которая служила исходной точкой для многих последующих работ в области К. металлов. В развитой форме электрохимическая теория К. появилась в 1901—06 гг. в результате работ шведской школы (Эриксон-Аурен и Пальмер), изучавшей гл. обр. вопросы ржавления железа. Балтийская школа (Центнершвер) занималась теорией коррозионных процессов и в особенности их кинетикой (1914—28 гг.). Германская школа (Тамман, Гюртлер, Гейн, Бауер, Штраус, Кон) уделила много внимапия металлографической части проблемы. Наиболее сильная и многочисленная англо-американ. школа (Уитней, Астон, Эванс, Уокер, Бенгаут, Спеллер, Френд и др.), начиная с 1903 года, дала чрезвычайно большое число работ в этой области, выяснивших влияния внешних условий на К., роль защитной пленки, концентрационных пар и т. д.
Общепризнанной в настоящее время теорией К. является электрохимич. теория. Она основывается на данных современной электрохимии и в первую очередь на учении Нернста об электрохимич. элементе. Процессы К. сводятся к основным процессам электрохимического элемента:
I. М (металл)+ H(ион) ^-М(ион) +Н(атомн.);
IX. а) 2 Н(атомн.) + Va 02(растворенный)->Н20,
Ь) 2 Н (атомз.)-э-Нг (молекулярн.).
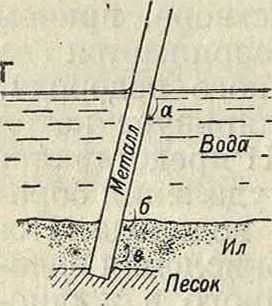
Реакция I соответствует переходу атомов металла из решетки металлического твердого тела в состояние иона в растворе, причем ион водорода одновременно разряжается (на катоде) с образованием атомного водорода. Выделяющийся водород поляризует катод (смотрите Поляризация)·, реакция II представляет процесс деполяризации, или удаления образующейся на катоде пленки водорода. Последнее возможно путем: а) окисления водорода при помощи растворенного в жидкости кислорода или же б) образования молекулярного водорода. Весьма часто наблюдается одновременное течение обоих процессов. Переход металла в раствор в виде иона возможен лишь при наличии определенной разности потенциалов, или, иными словами, при наличии гальванич. пары.Гальванич. пары м. б. здесь следующих родов: 1) в жидкость (электролит) погружены два различных металла (фигура 1, А); это—самый элементарный тип гальваническ. элемента(например: Zn I Си, Fe I Си, AI j Fe и т. д.); 2) металл структурно неоднороден; в этом случае роль электродов играют структурные составляющие. Весь металл можно представить состоящим как бы из огромного числа микроскопически малых гальванических пар (например Fe I Fe3C, A11 CuA12, Cu | Cu20 и т. д.); часто (если число структурных составляющих больше двух) образуются еще более сложные элементы (фигура 1, Б); 3) различные части металла неоднородны физически [например внутренние напряжения в металле, деформация металла (фигура 1, В; пара: М недефор-мированный—М деформированный)]; 4) различные части металла находятся в неодинаковых физико-химических условиях, наир, в разных растворах. Особенно важным случаем такого рода концентрационных пар являются гальванич. пары [фигура 1, Г; пары: а)М в растворе богатом 02—М в растворе бедном 02; б) М в воде—М в иле; в) М в иле—М в песке], образующиеся вследствие неодинакового притока кислорода к разным частям металла (диференциальная аэрация). В большинстве случаев коррозии различные типы гальванических пар имеют место одновременно.
Разность потенциалов данной гальванической пары зависит от многих условий и в первую очередь от вещества электродов. Для
Шщаемие Неимения СраВЩШИЯ МвТЭЛЛОВ ПО ИХ электронов (е) по проводнику СПОСООНОСТИ ПвреХОДИТЬ В
раствор и вытеснять водо-род их располагают в таблицу так называется стандартных, или нормальных, потенциалов. Однако необходимо заметить, что значения стандартн. потенциалов получаются при строго определенных условиях, а именно, когда металл находится в электрохимическ. равновесии с нормальным раствором,содержащим ионы того же металла. Если изменять концентрацию раствора или брать другой электролит, то потенциалы металлов будут меняться, причем может измениться и порядок их расположения, то есть произойти перестройка таблицы. Поляризация и перенапряжение водорода на катоде также оказывают большое влияние на разность потенциалов и на изменение эдс пары во времени. Поляризация зависит как от природы пары (вещества электродов), так и от свойств электролита. Уравнения I и II (а и б) показывают, что процесс коррозии слагается из двух связанных друг с другом процессов: 1) перехода ионов металла в раствор, с одновременным выделением водорода на катоде (поляризация), и 2) удаления образующейся на катоде пленки водорода (деполяризация). Можно считать, что первый процесс протекает со значительно большей скоростью, чем второй; поэтому общая скорость К. определяется скоростью деполяризации. В тех же случаях, где деполяризатором является кислород воздуха (например при ржавлении железа), скорость деполяризации в свою очередь зависит от скорости притока кислорода; последняя и будет определять суммарную скорость К.; таким образом первая часть теории К. есть в сущности применение теории электрохимического элемента к процессам химического разрушения металлов.
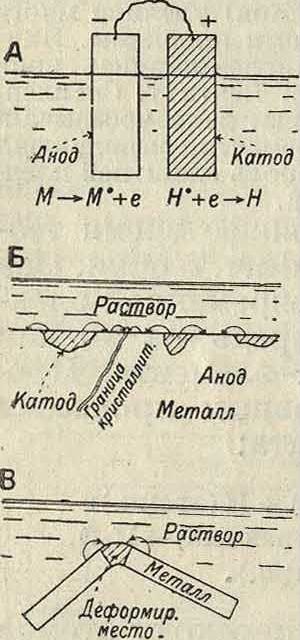
Фигура 1.
Второй частью учения о К. является теория т. наз. поверхностных защитных пленок. В процессе К., в результате вторичных реакций (особенно при участии растворенного кислорода воздуха), на металле могут образовываться пленки, к-рые, во-первых, затрудняют контакт между металлом и средой, а во-вторых, увеличивают внутреннее сопротивление электрических пар, что ведет к -замедлению или даже полному прекращению К. Простейшими примерами защитных пленок являются например пленки PbS04, образующиеся на свинце при растворении последнего в H2S04, пленка А1г03, покрывающая алюминий на воздухе, и т. д. Толщина защитной пленки колеблется от размеров молекулярного порядка до видимых невооруженным глазом. Весьма вероятно, что пленки очень малой толщины построены совершенно особым образом и в основе образования их лежат явления адсорбции (смотрите). С возникновением таких пленок (могущих в частности быть образованными и из молекул газов) связаны явления пассивности металлов, тоже играющие большую (положительную) роль в процессах К. И электрохимическая сторона явлений К. и образование защитных пленок зависят как от природы и состояния самого металла (внутренние факторы), так и от природы и состояния коррозионной среды (внешние факторы), а потому изучение К. требует полного рассмотрения всей системы металл—среда (электролит).
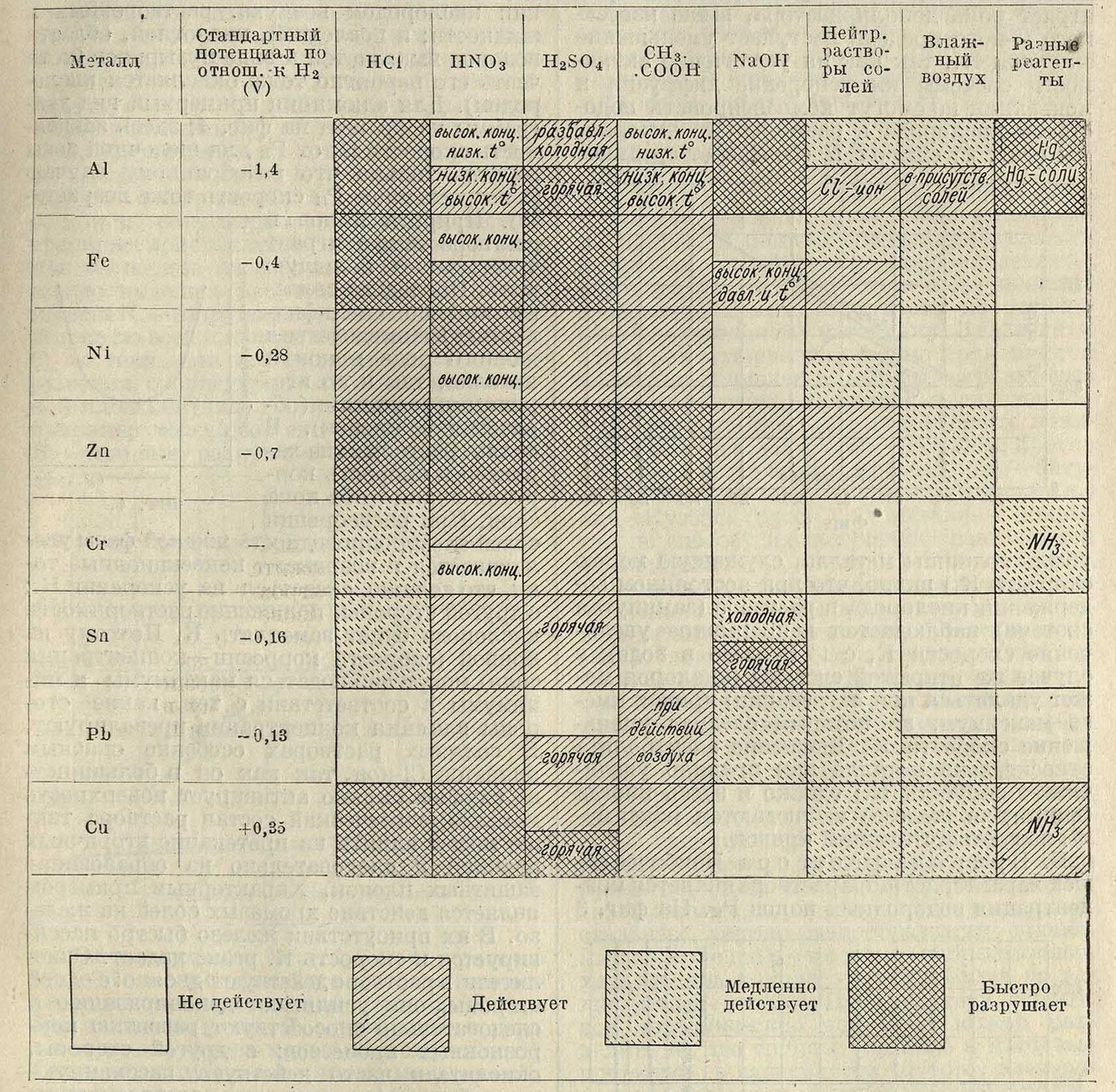
Влияние состава и структуры металла. Химия. состав дает только самое общее представление о физико-химич. природе металла. Поэтому при рассмотрении химической устойчивости металла или сплава необходимо обращаться к данным их металлограф, изучения. «Химически чистые» металлы тоже в большинстве случаев оказываются не вполне однородными (примеси, включения, поликристалличность); однако данные, полученные для наиболее чистых образцов металла, можно в первом приближении относить к свойствам атомной решетки химически индивидуального металла. В табл. 1 приведены наиболее важные данные о химия, устойчивости чистых металлов. Сложные системы, образованные несколькими составляющими, при прочих равных услсвиях будут обладать наименьшей устойчивостью, т. к. здесь имеется большая возможность образования микропар. Поэтому при получении химически устойчивых сплавов необходимо стремиться получить а) возможно более полную структурную однородность сплава,
б) максимальную устойчивость его составляющих, в) прочные и легко восстанавливающиеся защитные пленки. Эти условия достигаются таким подбором состава сплава и такой термической и механической обработкой, чтобы получались однородные твердые растворы и чтобы состав последних обеспечивал хим. стойкость металла надлежащим внутренним строением или образованием защитных пленок. В ряде случаев твердые растворы обладают также относительно высокими механич. качествами. Внутренние напряжения и деформации металла вообще уменьшают его химия, стойкость. При этом
Нейтр. растворы солей
Стандартный потенциал по отнош. к Нг (V)
Влаж ный воздух
Разные реаген ты
СН3. СО ОН
NaOII
Металл высок, конц. низ к. С
высок, кони, низк. t°
Шт высок, кони,.
высок, кони,.
высок, кони,.
Медленно действует
Быстро разрушает
Не действует
Действует особенно часто проявляется крайне опасный вид К.·—т. н. интеркристаллитная (или интеркристаллическая) К., когда разрушение происходит по границам зерен-кристаллитов металла и, несмотря на внешне благополучный вид материала, механич. свойства его м. б. уменьшены во много раз. Состояние поверхности металлатожеявляется одним из-важнейших внутренних факторов К. Влияние механич. обработки, представляющей особый вид поверхностной деформации материала, сказывается различно для разных металлов и разных внешних условий. Для железн. металлов тонкая механическая обработка поверхности (например полировка) дает увеличение химич. стойкости. Химич. обработка поверхности металла может приводить а) к образованию на металле слоя соединений, каковые в нек-рых случаях играют роль защитных пленок (пассивирование поверхности); б) к удалению ранее образовавшегося на металле поверхностного слоя (активирование поверхности),
что обычно ведет к уменьшению химическ. устойчивости; в) к возрастанию содержания включений благодаря растворению менее благородной составляющей, что ведет к увеличению числа микропар и следовательно тоже к усилению К.
Влияние внешних условий. А. Температура. С повышением ί° происходит увеличение скорости химич. реакций; кроме того увеличивается скорость диффузии и усиливаются конвекционные токи, что способствует притеканию к металлу свежих порций электролита. Келкот и Уэтзел предлагают при учете влияния ί° пользоваться ф-лой для гетерогенных реакций:
In ϋ=Α + ψ,
где R—константа скорости К. (меняющая-, ся с ί°), А и J5—постоянные, Т—абсолютная темп-pa. Во многих случаях общий характер кривых (скорость К.—темп-pa) соответствует приведенной ф-ле. Однако при повышении ί° растворимость кислорода в воде па-
дает, и поэтому в тех случаях, где кислород играет роль деполяризатора, выше известного i°-Horo предела наступает уменьшение скорости К., так как ни увеличение активности системы ни ускорение диффузии и конвекции не смогут компенсировать недостаток кислорода в растворе. Из диаграммы (фигура 2; символ П обозначает среднюю
| Г,!» | У | |||||||
| о | ж | |||||||
| со | к
,е>»® |
|||||||
| Тем | nepamyj | i а |
го 40 во so юо m т т iso Фигура 2.
убыль толщины металла, служащую мерою скорости К.) видно, что при постоянном содержании кислорода в растворе (замкнутая система) наблюдается непрерывное увеличение скорости К. с 1° (железо в воде); в случае же открытой системы (кислород может удаляться при нагревании) кривая имеет максимум, за которым следует уменьшение скорости К. Движение электролита относительно металла как правило увеличивает скорость К.; однако и здесь иногда (например для железа) наблюдаются максимумы на соответствующей кривой.
Б. П р и р о д а р а с т в о р а. Наиболее общей характеристикой раствораявляется концентрация водородных ионов Рн. На фигуре 3
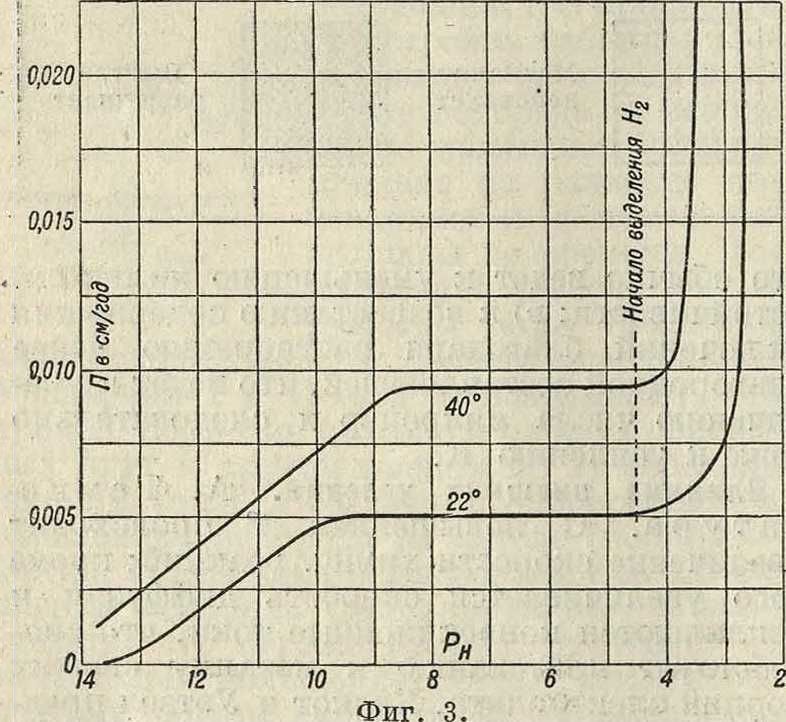
представлена кривая, изображающая зависимость скорости К. железа от Рн раствора. Можно отчетливо разделить диаграмму на три области: 1)РН > 10 (щелочная область)— К. идет медленно и скорость ее зависит от Рн| 2) Рн=4,3-р10 (нейтральная область)— скорость К. почти не зависит от Рн; 3) Рн <
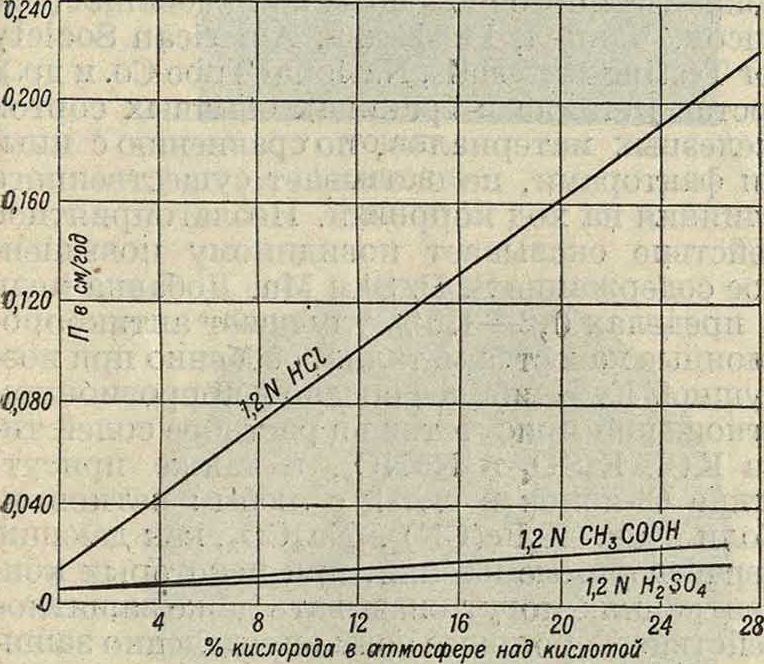
4,3 (кислотная область)—скорость К. резко увеличивается и зависит от Рн. В первых двух областях К. идет за счет деполяризации кислородом воздуха, растворенным в жидкости; в последней, кислотной, области водород выделяется в виде пузырьков (хотя часть его вероятно тоже окисляется кислородом). Для алюминия примерный вид диаграммы изображен на фигуре 4; здесь зависимость скорости К. от Рн для щелочной зоны обратна только что разобранному случаю (с возрастанием Рн скорость тоже возрастает). Природа ионов в растворе также играет чрезвычайно большую роль. Последнее связано как со специфичностью взаимодействия I данного рода ионов и | металла, так и со вто- g ричными реакциями (об- | разование пленок). В <з солян. растворах на характер и скорость коррозии влияют оба иона соли. При растворении солей электропроводность жидкой фазы увеличивается и возникают конвекционные токи, что должно сказаться на ускорении К.; с другой стороны, понижение растворимости кислорода будет замедлять К. Поэтому на кривой (скорость коррозии—концентрация соли) могут наблюдаться максимумы и минимумы в соответствии с тем, какие стороны влияния концентрации превалируют. В соляных растворах особенно опасным является Cl-ион, так как он в большинстве случаев сильно активирует поверхность металла.; химический состав раствора также может влиять на протекание вторичных реакций и следовательно на образование защитных пленок. Характерным примером является действие хромовых солей на железо. В их присутствии железо быстро пассивируется и скорость К. резко падает. Окислители в растворе действуют двояко: с одной стороны, они усиливают деполяризацию и следовательно способствуют развитью коррозионных процессов; с другой стороны, окислители часто действуют пассивирующим образом (например крепкая азотная к-та на железо и алюминий). Газы в растворе являются тоже одним из важнейших факторов: например кислород, за счет которого могут идти процессы деполяризации, или С02, участвующий во многих вторичных реакциях. Даже в случаях действия кислот деполяризация кислородом оказывается первостепенным фактором, на что указывают например случаи растворения меди в к-тах. Иллюстрацией такого влияния кислорода может служить фигура 5, где показана зависимость между скоростью К. меди в различных к-тах и составом газовой фазы над раствором. Образованию местных пар иногда способствует действие света, что отмечено например при К. некоторых медных сплавов.
Классификация явлений К. Есть несколько способов классификации явлений К.
I. Классификация по характеру деполяризации: 1) водород выделяется в виде пузырьков (К. в сильно кислой среде, К. алюминия и магния в щелочах);
2) водород окисляется кислородом воздуха
-Рн
Фигура 4.
растворенным в электролите (К. в слабо и умеренно кислой или в слабо щелочной среде,—наир, в растворах гидролизующихся •солей); 3) водород частью окисляется кислородом воздуха, частью же выделяется в виде пузырьков (разбавленные к-ты, недостаток окислителя).
II. Классификация по характеру разрушений. 1) Обычный «сплошной» тип разрушений; К. распространяется б. или м. равномерно как по телу, так и по границам кристаллитов (например обычные случаи К. железа на воздухе и в воде); здесь можно выделить две подгруппы: а) равномерная К.—разрушение равномерно распределено по всей площади металла (вкл. л., 1); б) местная, или локализованная, К.—разрушения сконцентрированы на ограниченной площади (вкл. л., 2); различают также например точечную, или перфорирующую, К.—сильные разрушения в определенных
Фигура 5.
точках поверхности (вкл. л., Зи4), полосчатую—К. распространяется полосами по определенным направлениям, и т. д. 2) Интер-кристаллитный тип К.—разрушения идут гл. обр. по границам кристаллитов (вкл.л., 5). Сюда относятся многочисленные случаи К. легких алюминиевых сплавов, железа в щелочах, латуни в морской воде. Возможна также классификация типов К. по характеру образующейся электрохимия, пары (макропары, микропары, концентрационные пары) и по нек-рым иным признакам.
Количествзнное выражение К. К. может быть выражена количественно самыми различными способами в зависимости от того, изменение какого свойства металла при к! измеряется. В технике наиболее употребительны три способа выражения К. а) Потеря в весе за определенное время (в зависимости от скорости К.) с единицы поверхности металла: например г/см2 в день, г/м2 в год и т. д. Выбор единиц измерения зависит от скорости процесса. Потерю в весе от К. принято обозначать символом К. б) Средняя убыль толщины · металла за определенное время; выражается вав день или сантиметров в год или дм. (англ.) в год. Зная уд. в металла, можно перевести потерю в весе на убыль толщины и обратно. Средняя убыль толщины как выражение коррозии удобна тем, что она сразу дает вещественное представление о размерах К. в) Потери механич. качеств (гл. обр. коэф-та крепости в килограммах/мм2 и относительного удлинения г в %), выражаемые в % от качества исходного материала.
Способы защиты металлов от К. Металлы предохраняются от К. тремя способами: покрытиями, электрохимич. защитой и обработкой коррозионной среды.
А. П о к р ы т и я. 1) Краски, лаки и смолы. Основным условием применения такого рода покрытий помимо специальных качеств (кроющая способность, непроницаемость, схватываемость, прочность и т. д.) является требование химич. инертности по отношению к защищаемому материалу. Для защиты железных материалов широко применяются масляные и эмалевые краски, асфальтовые лаки; для легких алюминиевых сплавов наилучшими против К. от атмосферных влияний считаются лаки типа «Дюраль»; против коррозии в морской и пресной воде—битуминозные лаки типа «Инертоль» (итальянок.) или «Кузбас» (русск.). 2) Металлич. покрытия по способу их получения разделяются на следующие: а) электрохимические (сюда относятся и гальванические покрытия), осаждаемые на металле из раствора с применением или без применения электрич. тока (например покрытие железа медью, оцинкова-цие); б) горячие, получаемые на металле путем погружения его в расплавленный металл (например горячее оцинкование); в) диффузионные—защищающий металл (обычно в виде порошка) заставляют при высокой t° диффундировать в защищаемый (например горячее хромирование); г) диффузионно-механические—защищающий металл при высокой t° впрессовывается в защищаемый при помощи прокатки. Здесь силам диффузии помогают силы механич. порядка (например покрытие стальных листов разнообразными сплавами); д) шоопировани.е—набрызгивание металла при помощи пульверизации на защищаемый металл. По характеру защиты все металлические покрытия можно разделить на две группы: анодные и катодные покрытия, в зависимости от того, электроотрицательно или электроположительно покрытие по отношению к защищаемому металлу. Анодные покрытия защищают металл не только благодаря изоляции его от внешней среды, но и благодаря тому, что в образующейся паре покрытие является анодом и следовательно при действии электролита будет само разрушаться, в то же время^защищая металл. Случайные царапины, обнажения и т. и. не будут опасны в этом случае, т. к. соседние участки покрытия будут защищать металл электрохимически (пример— защита железа цинком). Катодные покрытия защищают металл только при условии сохранения сплошной пленки. Обнажения металла могут повести, наоборот, к быстрой К., так как здесь защитный металл будет играть роль катода и следовательно помогать К. (пример—никелированые железные изделияв растворах солей). Из катодных покрытий для железа особенное распространение получает за последнее время хромирование (смотрите Хром). В качестве анодных покрытий для легких алюминие·.
вых сплавов предложен цинк (СССР) и кадмий (Германия). Эти способы защиты разрабатываются в ЦАГИ. Катодные покрытия для легких сплавов, предложенные французами (покрытие медью и хромом), не оправдали себя. 3) Керамические покрытия применяются в химия, промышленности. Широко также распространено эмалирование для защиты железа. Особые защитные пленки, обычно окисного характера, получаются при обработке защищаемого металла различными химия, реагентами под током или без тока. Для защиты легких алюминиевых сплавов известны способы Бауера (обработка углекислыми солями) и Ирот-ка (обработка сложными солями под током); удовлетворительные результаты дает также и анодная поляризация. Железо защищают например при помощи воронения (смотрите), нагревая· при высоких i° (горячий способ) или обрабатывая различными электролитами (холодный способ). Магниевые сплавы покрываются защитной пленкой при погружении их в растворы хромистых солей.
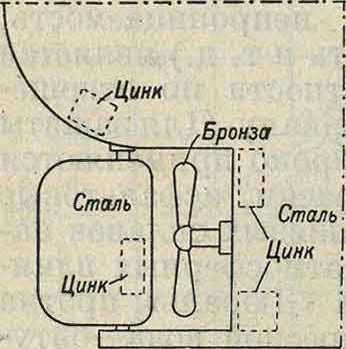
Б. Электрохимическая защита. Деви еще в 1825 г. предложил защищать латунные и медные листы от действия морской воды путем прикрепления к ним цинка. В настоящее время подобный способ применяется в морском деле для защиты например корабельных винтов. Вблизи винта (фигура 6) ставится массивный цинковый протектор, который и играет роль отрицательного электрода пары [латунь или бронза (винт)—· цинк (протектор)]. Цинк постепенно разрушается и заменяется новым, а винт остается целым. Аналогично с этим ЦАГИ{ в последнее время разработал способ защиты от
Фигура 7.
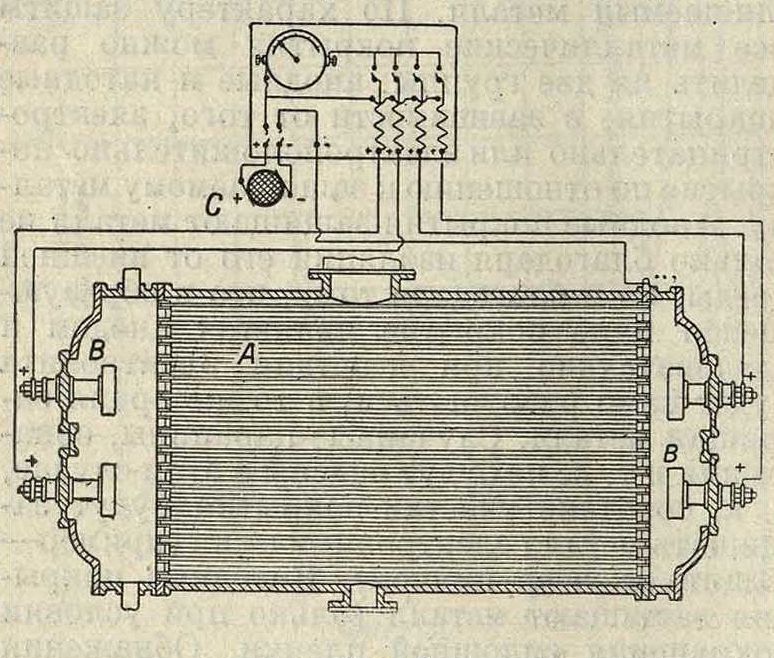
коррозии легких алюминиевых сплавов, комбинируя катодные покрытия с применением цинковых протекторов. Несколько иным способом защищают конденсационные устройства и стенки паровых котлов (фигура 7). Добавочный электрод В (например железный) соединяют с положительным полюсом батареи или динамомашины постоянного тока
С, а защищаемый предмет (конденсационные трубки А)—с отрицательным полюсом той же батареи. Добавочный электрод будет постепенно разрушаться и переходить в раствор (воду), а защищаемый металл останется целым.
В. Обработка коррозионной среды. Можно наконец видоизменить коррозионную среду т. о., чтобы ее разрушающие свойства уменьшились. Такого рода методы применяются в сравнительно редких случаях: например при защите паровых котлов соответствующими операциями удаляют кислород из питающей воды.
Материалы и реагенты. Металлы и сплавы не в одинаковой степени подвергаются воздействию различных реагентов.
Железо и железные сплавы. В воде и растворах солей К. железа происходит за счет деполяризации кислородом воздуха, растворенного в жидкой среде. Как показали многочисленные исследования (Эй-чисон, Чеппел, Гадфильд, American Society· for Testing Materials, National Tube Со. и др.). состав металла в границах обычных сортов железных материалов, по сравнению с иными факторами, не оказывает существенного влияния на ход коррозии. Неблагоприятное действие оказывает повидимому повышенное содержание S, Р, Si и Мп. Добавка меди в пределах 0,2—1,5% улучшает антикоррозионные качества металла, особенно при воздушной К. Наиболее опасно в коррозионном отношении присутствие в растворе солей типа КС1, K2S04 и NaN03, а также присутствие Cl-ионов в связи с любым катионом. Соли типа K4Fe(CN)6, Na2C03, как дающие нерастворимые пленки, при некоторых концентрациях могут оказывать даже’защитное действие. Хромовые соли определенно защищают металл. Аэрация и движение раствора являются одними из главнейших факторов усиления К. Щелочные растворы низкой концентрации в большинстве случаев неопасны, в особенности если они также содержат углекислые соли. При высокой концентрации щелочи, а также при высокой i° и давлении наблюдается сильная интеркри-сталлитная К. На микроснимках (вкл. л., 6 и 7) видна целая сеть микроскопии, трещинок по границам кристаллитов. Эти трещинки, сливаясь, дают уже видимые внутренние и поверхностные трещины. Интеркристал-литной К. в этих условиях способствуют:
а) повышенное содержание S, б) окислы (недостаточное раскисление металла при плавке или пережог при последующей обработке),
в) внутренние напряжения (возникающие например при сгибании листов, при холодной клепке и тому подобное.). Щелочам хорошо сопротивляется мягкая сталь с содержанием 3—5 %. Ni. В к-тах К. идет как с выделением свободного водорода, так и с окислением водорода кислородом воздуха или самой к-той, если последняя является окислителем (например HN03, крепкая H2S04). Обычные железные материалы вообще не рекомендуется употреблять в качестве оболочек при сильных реагентах, какими являются к-ты; здесь надо переходить к более сложным сплавам, за исключением нек-рых отдельных случаев. Так, для азотной кислоты крепостью выше 40%,
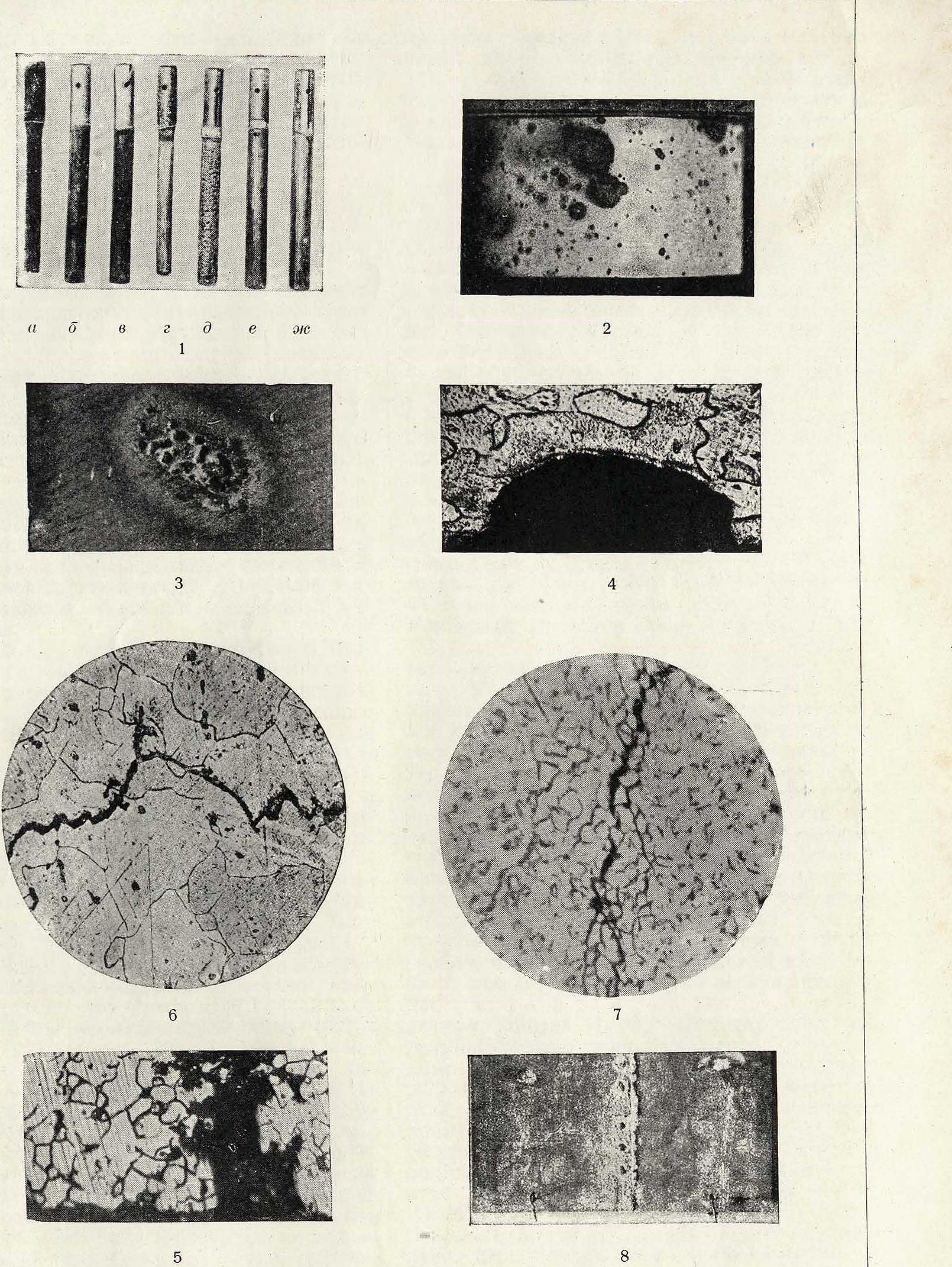
1. Коррозия металлов и сплавов железной группы в 10% НС1 по истечении 10 дней: а—химически чистое железо; 5—химич. чистый никель; в—сплав (46% Ni, 54% Fe); г—(25% Сг, 75% Fe); д—(18% Сг, 12% Со, 30% Fe); е—(15% Сг, 63% Ni, 21<у0 Fe, 1% Мп); ж—(15о/0 Сг, 62% Ni, 15°/0 Fe, 1<>/0 Мп, 7% Мо). 2. Образец отожженной нержавеющей стали, начавший корродировать после 10-дневного пребывания в морской воде. 3. Корродирующий участок тонкого дуралюминового листа, пораженного точечной коррозией.
4. Поперечное сечение дуралюминового листа; граница разрушения совпадает с границей кристаллита А.
5. Сильная интеркристаллитная коррозия дуралюмина. Образец вырезан из трубы, корродировавшей во влажном морском воздухе при неблагоприятных условиях (контакт с латунью, возможность застаивания воды). 6. Интеркристаллитная коррозия. Образец вырезан из стенкн паровbго котла. 7. Интеркристаллитная коррозия. Образец вырезан из железного бака с каустической содой. 8. Коррозия клепаной дуралюминовой пластинки после 10-дневного пребывания в морской воде. Сильная коррозия особенно у заклепок.
Т. Э.




можно употреблять обычное железо или же сталь. При производстве азотной кислоты, а также при работе с конц. серной кислотой (70—100%-ной) часто употребляют чугун. В качестве типичных образцов приводится состав двух англ, отливок, с успехом работавших в заводских условиях.
| Чугун | С
общ. |
С
связ. |
Мп | Si | Р | S |
| А. ., | 3,3 | 0,6 | 0,6 | 1,8 | 1,0 | 0,2 |
| Б.. | 2,75 | 0,65 | 0,45 | 1,5 | 0,35 | 0,35 |
В чугуне необходимо избегать слишком высокого содержания Si; связанного углерода должен быть не менее 0,6—0,8%. Весьма вредным оказывается Р, особенно если он реагирует с образованием мест фосфористой эвтектики. При работе с НС1 любых концентраций железные материалы совершенно неприменимы. Дымящая H2S04 вызывает сильную ин-теркристаллитную К. При работе с HN03 и H2S04, а также с различными растворами солей и органич. веществами можно рекомендовать применение листов очень чистого железа, например америк. Arme о (смотрите Арм-ко-железо)·, последнее обладает значительно более высокой химической устойчивостью по сравнению с обычными железными материалами.
Железо-кремнистые сплавы (высококремнистое литье) содержат обычно 13 — 18% Si, хорошо сопротивляются действию к-т H2S04, HN03 и даже НС1 (в невысоких концентрациях). В этих сплавах содержание углерода м. б. до 0,7%; S и Р должно быть возможно меньше; Si не должен получаться в т. н. графитной форме. Эти сплавы можно с успехом применять также при работе с органич. к-тами—уксусной, лимонной и т. д. Изделия из этих сплавов получаются только отливкой; механич. качества их несколько ниже, чем у обычных сортов чугуна. Наиболее известны марки Ironac (Англия), Dur-iron (США), Termisilid (Германия, Крупп).
Железо-хромистые сплавы образуют класс т. н. нержавеющих сталей. Различают: нержавеющее железо (0,1-7-0,15% С; 12-7-15% Сг) и нержавеющую сталь (0,3-7 0,4% С; 12^-15% Сг). Первое обладает несколько более низкими механическими качествами, но зато легче обрабатывается и не нуждается в термич. обработке. Хим. устойчивость нержавеющей стали в большой степени зависит от ее термич. обработки. Необходима закалка 850—900° на воздухе или в масле, с отпуском 500—600°. У отожженной стали антикоррозионные качества понижаются в несколько раз. Применение нержавеющих сталей видно из табл. 2, где сопоставлены стали: углеродистая, нержавеющая и сталь марки V2A. Добавка к стали небольшого процента меди повидимому полезна. Марганец понижает антикоррозионные качества и его присутствия необходимо избегать при изготовлении этой стали. Весьма вредны также включения окислов. Нержавеющие стали в термически обработан, виде и нержавеющее железо могут применяться при работах с водными растворами солей (морская вода, рудничные воды) и с растворами к-т невысоких концентраций (за исключением НС1); эти стали в настоящее время начинают применяться для изготовления ножей, хирургических инструментов и тому подобное.
Желез о-н и к е л ь-х ромистые спла-в ы обладают еще более высокими антикоррозионными свойствами, чем железо-хромистые. Наиболее известны следующие марки:
Марка С, % Сг, % Ni, %
V2A (Крупп). 0,25 20 7
А иска (Англия). 0,10 15 10—12
Staibrit (Америка). 0,2—0,4 18 8
Хромоникелевые стали обладают высокими механич. качествами, хорошо куются и прокатываются, не требуют термич. обработки, хорошо сопротивляются самым разнообразным химическ. реагентам. В последнее время в Германии из стали V2A приготовляют листы, трубы, части насосов, хирургические инструменты, вечные перья и т. д. Сплавы с высоким содержанием Ni дают наилучшие результаты, хотя сравнительно дороги. Сплав состава 63%Ni, 15%Fe, 15%Сг,7%Мо хорошо сопротивляется 10%-ной НС1. Против H2S04 хорошие результаты дал сплав 50%Ni, 50%Fe; против H2S0„,HN03 иНС1— сплав 63% Ni, 21% Fe, 15% Сг.
Медь и медные сплавы. Вода и водные растворы солей заметно действуют-на медь при свободном доступе воздуха. Усиливает К. присутствие в растворе H2S, С02 и особенно NH3.Meflb склонна образовывать местные концентрационные пары. Химическая устойчивость меди сильно понижается при повышенном содержании окислов в металле. В кислотах, даже в слабых растворах их, медь сильно корродирует. Бронзы (Cu-Sn) употребляются при сравнительно слабых коррозионных агентах (загрязненный воздух, слабые растворы солей). Бронзы, представляющие однородный твердый раствор, обладают более высокой химич. устойчивостью, нежели бронзы структурно сложные. РЬ повидимому ухудшает-антикоррозионные качества бронз. Кислые сточные воды действуют на бронзу в 20 раз слабее, чем на железо; бронзовая проволока в загрязненном воздухе химич. фабрик, корродирует в 2—4 раза меньше, чем железная. Против H2S04 удовлетворительные результаты дает цинковая бронза Хубертца. Против разбавленных кислот рекомендуется кобальтовая бронза. Хорошие качества, показала хромакс-бронза, то есть марганцевая бронза, в которой часть Мп заменена Сг. Повидимому наиболее химически устойчивой в соляных растворах и слабых кислотах является алюминиевая бронза—95%Си, 5%А1 или 90%Си, 9%А1,1%№. Латуни (Cu-Zn). довольно широко применяются в морском деле. Сплавы, которые содержат однородные α-кристаллы, обладают наивысшей химической устойчивостью. В латунях с высоким содержанием Zn происходит быстрое выщелачивание Zn (децинцификация) в морской воде. Прибавка 15% Ni увеличивает стойкость таких сплавов. Латуни, обладающие крупнокристаллич. структурой, корродируют .быстрее, нежели мелкокристаллические. Повышение /,° отжига ведет к увеличению К.; так же действует и закалка. Вредное влияние оказывают наклеп и внутренние напряжения: они вызывают сильную· интеркристаллитную К. В морском деле-
Таблица 2.—С равнительное действие различных реагентов на углеродистую высокохромистую и высокохромоникелевую сталь.
| Реагент | Концентрация и ί° | Углеродист, сталь средней твердости | Высокохромистая сталь (12—14% Сг) | Cr-N i-сталь (18% Сг, 8% Ni) | Реагент | Концентрация и 1° | Углеродист, сталь средней твердости | Высокохромистая сталь (12—14% Сг) | Cr-N ι-сталь (18% Сг, 8% Ni) |
| Уксусная к-та. | 100% | ❖ | @ | • | Сероуглерод. | • | |||
| » ». | 33% | ❖ | 9 | Углерод четыреххло- | |||||
| » ». | 15% | ❖ | 9 | ристый. | 1—50% | ||||
| » ». | 6% | ❖ | 9 | Хлор.. | -- | ❖ | <> | ❖ | |
| То же (пары). | — | Медь углекислая. | Насыщ. раств. в | ||||||
| Бензойная к-та. | Все концентр. | • | • | nh4oh | • | • | |||
| Борная к-та. | Насыщ. раствор | в | • | » хлорная. | 5-10% | ||||
| » ». | 5% | • | • | » сернокислая. | +2% H2S04 | • | • | ||
| » ». | 10% холоди. 1 | винный. | 100% | • | • | • | |||
| горяч. Г | Эфир этиловый. | 100% | • | • | • | ||||
| Карболовая к-та. | Все концентр. | © | Железо хлорное. | 10—50% | |||||
| Хлоруксусн. ». | Кристаллич. | » азотнокис- | |||||||
| » ». | 50% | • | лое.. | 5% | ❖ | • | |||
| Хлорсульфон. к-та. | Концентр. | • | Формальдегид. | 40% | • | • | |||
| » » | 10% | Сок фруктовый. | • | • | |||||
| Лимонная к-та. | Все концентр. | ❖ | 9 | Водорода перекись. | — | 9 | • | ||
| Синильная к-та. | — | 9 | Чернила. | — | 9 | • | |||
| Соляная к-та. | Все t° и кончен- | Иод.. | 1% | 9 | • | ||||
| трации | ».. | Насыщ. раствор | |||||||
| Фтористоводородная | в KJ | • | |||||||
| к-та.. | — | Известь гашеная. | Суспензия | • | • | ||||
| Молочная к-та. | — | в | Масла смазочные. | — | • | • | • | ||
| Малоновая ». | 50% при 100° | • | Магний хлористый. | 10% | 9 | ||||
| » ». | 5% при 15° И 100° | • | » сернокислый | 10% | 9 | ||||
| CMecbHN03+HoS04 | — | ❖ | Ртуть азотнокислая | 5% | • | 9 | |||
| Азотная к-та. | Уд. В. 1,42 | • | © | • | » хлорная. | 0,5-5% | 9 | ||
| » ». | » » 1,20 | • | • | » цианистая. | 5% | 9 | |||
| » ». | Ниже 11% | 9 | Молоко. | Свежзе или кис- | |||||
| Щавелевая к-та. | 1—10% при 15—1Q0” | 9 | лое | © | 9 | ||||
| » ». | 6-50% при 15—100° | m | Никель азотнокис- | ||||||
| •Фосфорная ». | 5—100% | о | 9 | лЫй.. | 5—10% | 9 | |||
| Пикриновая к-та. | Все концентр. | • | 9 | Нефть. | — | » | 9 | ||
| Пирогаллол. | » » | • | 9 | Калий бромистый. | 1—10% при 15—50° | 9 | |||
| Стеариновая к-та. | » » | • | 9 | » цианистым. | 5% насыщ. раств. | • | 9 | ||
| Серная к-та. | » » | » шелезосиые- | |||||||
| Сернистая к-та. | — | • | р о диеты й. | 5% » » | 9 | ||||
| Таннин. | 5% | • | 9 | Калий азотнокис- | |||||
| Уксусный ангид- | лый. .. | 10% | О | 9 | |||||
| рид.. | 100% | 9 | Калий щавелевокис- | ||||||
| Ацетон. | 100% | -0- | m | лый.. | 0,25—1% | • | 9 | ||
| ». | 5% | <> | 9 | Морская вода.. | 15° | ❖ | 9 | ||
| Алюминий сернокис- | » ». | 80° | 9 | ||||||
| лый.. | 10% | <> | © | » ». | В пост, движении | ❖ | 9 | ||
| Алюминий сернокис- | » ». | Периодич. обрыз- | |||||||
| лый.. | 1% | <С> | • | гивание | 9 | ||||
| Аммоний бромистый | 1—5% при 15—50° | • | Серебро азотнокис- | ||||||
| » углекислый | Насыщенный | • | • | • | лое.. | 1-5% | • | 9 | |
| » хлористый | 20% | ❖ | • | Натрий бромистый. | 5—10% | 9 | |||
| » » | 1% | ❖ | • | » хлористый. | 3—10% | ❖ | 9 | ||
| » » | 47%, кипящий | <> | » лимонноки- | ||||||
| Аммиак. | Все концентр. | • | © | 9 | слый.. | 3-5% | • | 9- | |
| Аммоний азотнокис- | Натр едкий. | 66% | • | 9 | 9 | ||||
| лый .. | 10% | <> | 9 | 9 | » ». | 33% | • | 9 | 9 |
| Аммоний сернокис- | Натрия гипохлорит | 0,2-5% | 9 | 9 | |||||
| лый.. | 50% | <> | 9 | Натрий азотнокис- | |||||
| Аммоний сернокис- | лый.. | 5% | 9 | 9 | |||||
| лый.. | 10% | <> | 9 | Натрия перекись. | 10-80° | 9 | |||
| . | • | 9 | Натрий кремнекис- | ||||||
| Бензол. | — | • | • | 9 | лык.. | 5% насыщ. | 9 | 9 | |
| Бром.. | 100% | Натрий сернокис- | |||||||
| Бромная вода. | 3,3% | 7 | ЛЫЙ.. | 10% насыщ. | 9 | 9 | |||
| » ». | 0,15% | ф | Натрия тиосульфат | 30% | 9 | • | |||
| Камфора. | • | • | 9 | Натрий сернистый. | 10% | 9 | • |
А — практически не действует на металл; — действует;. —быстро разрушает. получили также распространение специальные. бронзы: мунц-металл, кремнистая латунь, марганцевая бронза (закалка повышает антикоррозионные качества этого металла), Дюрана металл, марганцевая бронза Парсона (смотрите Спр. ТЭ, т. II). Против слабых кислот рекомендуется бронза Парсона и сплав: до 62% Си, 35—43% Zn, 0,2—
1,5% Si, 0,5—0,65% Sn. Латуни с высоким содержанием Ni (нейзильберы) в отношении антикоррозион. качеств превосходят обычные сорта латуней. Употребительны составы: 1) 60—50%Си, 15—40%Zn, 12—25%Ni,
2) 7—20% Си, 40—50% Zn, 35—40% Ni.
Медноникелевые сплавы. Из этого рода сплавов наиболее распространен монель-металл, обладающий наряду с высокими механическими качествами хорошей сопротивляемостью действию кислот, соляных растворов, загрязненного воздуха, рудничных и сточных вод и щелочей. Азотной к-те хорошо сопротивляется сплав Парра. Для к-т рекомендуются также сплавы Ирмана. В самое последнее время предложены также, медно-кремне-кобальтовые сплавы (4% Si,
4—8% Со, остальное Си), которые наряду с высокими механич. качествами оказывают хорошее сопротивление сравнительно сильным коррозионным агентам.
Свинец и свинцовые сплавы. Вода действует на свинец различно, в зависимости от того, какие соли в ней растворены. Жесткая вода не действует на свинец, тогда как мягкая довольно быстро разрушает последний. Присутствие в растворе хлоридов и нитратов усиливает коррозию; сульфаты же, напротив, действуют защищающим образом (образование пленки PbS04). Щелочные растворы также заметно действуют на свинец; по этой причине свинцовые трубы не должны прокладываться в цементе и вообще соприкасаться с материалами, содержащими известь и другие щелочи. Характер К. свинца в большинстве случаев ин-теркристаллитный. Лучше всего свинец противостоит действию H2S04; только при концентрациях H2S04 свыше 80% начинает обнаруживаться заметная К. Чистота металла играет большую роль. Так как чистый свинец обладает весьма низкими механич. качествами, в хим. промышленности получили распространение Pb-Sb сплавы (до 12%Sb), прочность которых уже значительно выше, чем чистого свинца; присутствие в этих сплавах As и Zn сильно уменьшает их антикоррозионные свойства. Свинец также удовлетворительно сопротивляется действию смешанной кислоты, если только содержание воды в ней не превосходит 25%.
Алюминий и легкие алюминиевые сплавы. В нейтральных соляных растворах, в особенности в присутствии Cl-иона, А1 и Al-сплавы подвергаются сильной интеркристаллитн. коррозии (вкл. л., 5 и 8). Сплавы алюминия даже при низком содержании примесей оказываются значительно менее- устойчивыми к К., чем совершенно чистый алюминий. Особенно вредно действуют структурно-свободные FeAl3 и Si. Термическая обработка играет поэтому весьма болыхгуюроль; в большинстве случаев закалка, сопровождаемая переводом составляющих в твердый раствор, увеличивает химич. устойчивость металла. Включения СиА1а играют роль добавочных катодов; однако переход значительных количеств меди в твердый раствор повидимому сильно уменьшает коррозию. Внутренние напряжения и деформации увеличивают К. Движение жидкости относительно металла, как показывают последние исследования ЦАГИ, тоже усиливают К. Контакты с Си,Ni,латунью, нержавеющей сталью действуют на металл весьма неблагоприятно, и их необходимо тщательно избегать в конструкциях. Контакты с железом и сталью почти не влияют на К. алюминия; цинк в контакте с алюминием и дуралюмином защищает последние.
Относительно влияния контакта с другими металлами пока еще нет достаточных данных. Щелочные растворы быстро разрушают алюминий и алюминиевые сплавы, и потому при работе с ними применение А1 совершенно недопустимо. Кислоты тоже действуют разрушающе, за исключением азотной и уксусной кислот высокой концентрации. В последнее время в Германии например получили распространение алюминиевые баки для перевозки крепкой азотной к-ты. Легкие сплавы с высокой сопротивляемостью К. пока еще не выработаны, хотя в нек-рых странах и предложены б. или м. удачные составы. Из последних можно упомянуть только германский сплав KS Seewasser (2,5% Μη, 2,25% Mg, 0,2%Sb, остальное Al); сплав обладает повышенной стойкостью по отношению к морской воде. Довольно широкое применение начинает получать чистый алюминий в пищевой, жировой и красочной промышленности как материал для химич. аппаратостроения.
Методы испытания металлов и сплавов на К.
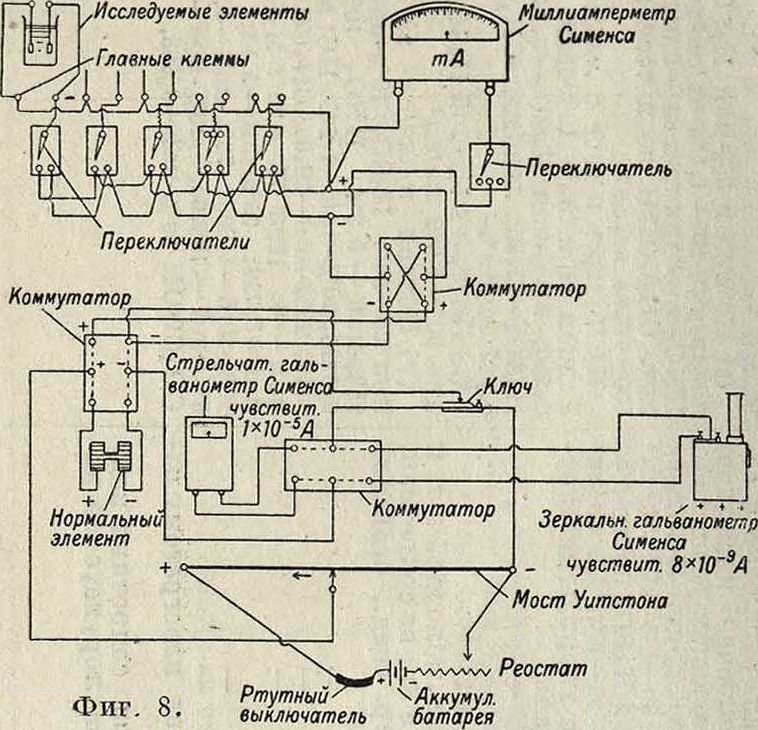
Методика испытания на коррозию представляет чрезвычайно важную проблему, так как при большом числе действующих факторов надежные результаты можно получить только при правильной постановке экспериментов. Ниже приведена схема методики испытаний с указанием, какие условия (внутренние и внешние) необходимо принимать во внимание, а также какими показателями можно пользоваться. В большинстве случаев однако нельзя слишком усложнять эксперименты и лучше пользоваться системой отдельных экспериментов, данные которых будут взаимно дополнять друг друга. Наиболее важные методы следующие. 1) Испытание в открытых сосудах: образец погружен в данную жидкость; производят внешние наблюдения, определяют потери в весе и иногда производят механические испытания. 2) Испытание в шпиндельном аппарате: жидкость находится в движении относительно образца (вращение образца или перемешивание жидкости) и одновременно производится аэрация жидкости; наблюдения те же. 3) Попеременная К.: образцы укрепляются в зажимах медленно движущегося колеса, так что образец то погружается в раствор то находится в воздухе. 4) Электрохимические методы: приборы в большинстве случаев представляют потенциометрические установки, причем возможно также одновременное измерение силы тока. На фигуре 8 изображена схема.установки, разработанная в лабораториях ЦАГИ. 5) Определение скорости К. по количеству выделяющегося газа—применимо главн. обр. при К. в к-тах. 6) Определение скорости К. по тепловому эффекту реакции—пока еще мало разработано. 7) Исследование процесса К. под микроскопом: один из новыхмето-дов, дающий чрезвычайно много ценного для уяснения деталей и механизма коррозионных процессов (разработан ЦАГИ). 8) Макросте-реоскопическое наблюдение прокорродиро-вавших образцов—дает хорошие результаты при выяснении характера и распределения продуктов К. и относительной глубины разрушения. 9) К. в подогреваемом шкафу
Схема методики исследования коррозии металлов в электролитах.

<t!PPQP



о в ° к «в
. ей Е
5* И1 3 а к о
sSJ in Oi E
о а о S
н S “ Йй
«i Я
3 СО
Е ей
g И 5 В
ft О
о
Го 1т<
Р<Й 2= о и 2 о “ ft о g
& к s «ea § Р-°
2*5®·
Wi4«:
E
И
!>»
н аз ей “Й
яй
2S
g И §
И со к Е © н
!>> Ч ·
Ο,ω и
Е · Я ей И a S£CJ m m © go Η E О О
g§*
* ·§ E К
E<! tt w
►»3
, E S © ! g 3
f g © A > ^ a cs i 2 a «j »a ρ η
~ ^ fo ^ e © ©
СЙО Д Ro
ей 3 © S*£H f fct© ° t
P

| ей | |
| Я | a |
| со | |
| b | |
| ft | о |
| О | Я |
| о | « |
| ©
a |
a
£ |
| a | |
| © | |
| к | a |
| a | ©
о |
| и | |
| о | |
| <N |
Mm 2 R-
и S5
>>2 P1 « <м г
Q Μ £7 g ^ —. г!
g3,a£W>.ooo!z; о a © ft^^ РйМ
<5 ww ft

g Ή м·©
§a
a »a a S tr
a ей
5 ft
Й
й 2 λ ? я • · ей ft gft ей И со ft со
•СОИ-ЦП!
И ^ CO ft ©
ь,м ей о ri со
g,© ч ®.
go О О ©о е“
a 22
СР ей о ^ ей о О ^©Н
a
Е о a ®
«а § δ
«5°
ag.
р ft ft *® со о
ft ей О м
§™g° иё ?И
ФЛ ей
Е
СО
о
3 ft н К В
2 · a
4 &н О —Л g Ч R н §·
a s © 5 о
*йеГяя
Ьр,и^«
a о ~ я я
i е |.S a
Я о ° a о a ей ° аз ft о ft« во
-ч,-ч О^^-ч
OHtShH

М ей то
<*МС
ft№3
© © ·· о о
© и ш
3 и о © Я о © ft
ig © н ^ и одоав в в и я я о со
КЦяю рэ
<Ά
Е т о >> н ft
© a
3 Г_ E © ί» ft
аз ©
ftH


з г
Я цн °
<υ SB « R ft 5 од ю о
« 05 И
Й ОнЕ Я От“
В, и I
О О Н Я О, £С О сЗ hOrtRg д в р, и а о·.
сь о30 И О

гЗ
о
Я
В
в о «
姧
§«§,
££н
“йг сЗ 6-я
?sks
w о о R л R
^ R Н й
,2 СЗ О θ3ον»ον
С*о
<5 w
« 2 « о Я О И § а .ми 2» 3 Я я у - Я -чРо-

. н й ·
•§а
3 о
Он я Я О о я а <υ
«£ О —
Ен Я
<U Он нн
<$н



5«
1 я в сз Р
я s £
S Осз
> a s ев Я.
ш « __
) О Н СЙО
*<и

2 я а
^ со я сЗ £
«р»?
S* I
s- СО -vC
*? я^
я я
О В
«®2л S* я
Я дно о О о а я в R я-?: в R »о g Й
О Si
я <υ в
°oSd
R&sa
SSgg
0 О 2 2 Он М Й Ь И I я Я
1 i ΗΉ
if’aSK

>a
а
er
к с И CQ Рн“ Чй

gw
сЗ
Он И О О с н
_, я а ^
м Я
Э и
Я О · Г
я й£;
3 2гс?
< пн
Ϊ2 Оц сЗ О г”*3
я · а
5 Е о
СО я -М
;*ga г 2 я а
ί^Χο

._. СО
}Я»а Я
я 3
а н
С0§
а тн
Я в
m °
а я
off
. ев г-.
R о о о α> «й>5В
3 2 Й w 5 я
3&
сЗ
рц н сз Он» я а а о я Η а
Д О Я О О а а 2 Он ο,
о о О о tu ь Я Я S s
СО^._СО
К СЗОИЙ сЗюН
<3 WW
я
Oroi) Он fcf В
Н со и Я сЗ О)
о Оно. ЗОщ СО о g со
Ю сз

сЗ
t=C
я
О
о
t£
а о о я а о a OR ^ Я о со о :3 В О Он 01C ·
Я о Я о О
<υ _; а я &я я в ·
κίν
о а я а ·
О я «ай
η о 2 о
S к gfK «
§„,§§§§
Sga^gS
!S со в о а о £2 сз я а« Он и рн^ ag в
<5 метров м

<!W W

а к сЗ Я Я Я
со 2? «й Я о. я о R о о. я а 2>
и «
о Я
2Я§
О сЗ
а я
1 Я О
§8
W м a S а 2
. <х> Я
Он СЗ О, μ^, OfflfHrt
о о о а о а о сз К«о к
< М
Issss
|gs§g
ШЦ
SIp-s^
о “i;00

<iMM
Таблица
И. О
В
В
стЗ
Еч
0>
Я
В
К
со о. ft ft О
К
о и
5S
в и
0$
и о п
(О
В
О
о
В
оЗ
ВТ
to
сЗ
Ε
Κ
сЗ
В
В
О
га
О
| Я
о |
ьч | ❖Ф | Ф | Ф | •О | Ф | ф | ❖❖ | ||||||||
| К
£ |
ьч | о® | Ф | Ф | •о | Θ | ф | фф | ||||||||
| и | 1—1 | ❖® | © | © | •о | © | ф | <ч> | ||||||||
| оЗ
га |
оЗ
я |
t—1 | ·· | Ф | ф | •о | Ф | ф | фф | |||||||
| Еч о
« |
но о: | д | • ❖· | Θ | ❖❖ | Ф | ф | S | ||||||||
| га о | •я о | - | фф | ❖ | ФФ | Ф | © | £ | фф | |||||||
| •Я
и |
ьч | <1 « | «< | <<<<] | <3 | о | (ш)
8 | |||||||||
| в о | юн | н | <3 « | <1 | <К><1 | < | <> | S | ❖❖ S | |||||||
| В
со |
ьч | < « | <1 | < | ❖ <> <> <1 | <1 | о | <*> | ||||||||
| ft
ft |
О X К |
ьч ьч | е ©8 | © | вфф | ф ф ф ф | © | © | £ | <>❖ 3 | ||||||
| о и | ьч | 1 ФФ | Ф | ФСФ | ф ф ф ф | е | 0 | £ | <Х> | |||||||
| ьч ьч | ❖ « | <1 | ❖❖❖ | < < < <1 | <> | ф | £ | ❖❖ ‘g | ||||||||
| Ϊ | о со | ьч ьч | <1 « | <1 | 0« | О О О < | < | ф | £ | фф § | ||||||
| я | ьч | V 0
V |
< | о« | О О О < | <3 | ф | С | ф® | |||||||
| Состоя ние | ή.
i i S по О to О |
Обр. | * * | **** | Λ Λ. ft 1 о | Обр.
Л. |
Обр. | К | * | ft Λ А Λ
о * * * * * О | ||||||
| <о | в о | ; 1.11 1 | 1 | 1 1 | 1111 | 1 1 1 Я | m | 0,04 | ||||||||
| га оЗ | в я | 0,50
0,50 0,50 |
га
Я |
о
Еч Сб А н о |
ОЗ
со |
Рч | _
0,16 |
2 | о о о о о о
if) О ιο о о о СО 00 СО 00 00 со | |||||||
| О
о о | со | 1 И 1 | 1 | 1 I | ю о о о моюю тЧ т-1 СО СО | 0,35
0,35 0,35 |
О | в я | 0,35 | |||||||
| ю
1 СО -чИ сГ о |
0,15
0,33 | ι> о о о
О Cl ^ о тч о о | Ю О о о СО- со о со О О тЧ О- | |||||||||||||
| «
в к о га в в |
О | 0,ЗС | О | 1 | о о" | |||||||||||
| га
Я |
Остат.
» 1 »> |
Λ | ** | * * * * | Λ * * * | 2 | ю ю
03 ©3 |
о со | га
Еч |
85,5 | со г“
00 |
6ч
О |
о о о о о о лоюо >л о | |||
| Я
X | еч
О |
14
20—30 14 9,5 |
13,0 | 13,0
14 |
17
17 8.25 3.25 |
ю со со о тч -тч ©з <м | со | иО
СО тЧ |
ко оз чт“ | |||||||
| Группа | Cr-Fe
» » » |
* | * * | * * * * | га · Я
2 |
* | Si-Fe | * | Cr-Ni
» >> » » | |||||||
| Производитель | Allegheny Steel Со.
Cutler Steel Со. |· Carpenter Steel Со·· |
1 Firth Starling 1 | со
>> о о О О 5 ® ° О -ч й° со га 5 га В га н СО Ό -ьз В % ί> ^ | о
О о « О га га со S й 2 в s S и сЗ О |
Driver Harris Со. | Λ | Pacific Foundry Со. | О
О и =1 и Q |
[Driver Harris Co.<J
1 Electrical Alloy f Co. 1 Hoskins Manuf. 1 Co. | |||||||
| Название сплава | Аеколей (Ascoley). Хромистое железо (Cimet).
Нержавеющая сталь Сталь, сопрот. коррозии. Нержавеющ, сталь (Stainless Steel). |
Нержавеющ, железо (Stainless Iron). Нержавеющ, сталь | Delhi Tough Iron.
» Hard ». Сильхром (Silehrome) » сорт F. | Нержавеющ, сталь низкоуглеродист. Нержавеющ, сталь среднеуглеродист. Нержавеющ, сталь высокоуглеродист. Нержавеющ, сталь Карпентера. | Цимет (Cimet). » ». | 30%-ная никелевая сталь. | Corrosion. | Duriron. | Нихром III (Ni-
chrome III). Нихром IV. Elalco Rayo. Karma. Хромель В (Chrome! В). Хромель A. | |||||||
| •don on | δΛΓ | т-< 03 СО Г* | Ю | со t> | СО 03 О тЧ <М со ю
И И И тЧ .4 тЧ | СО l> 00 | • аз | О
оз |
—ч ©Л СО ·4* ю со 03 03 OJ 03 03 03 | |||||||
| ·· | 5 | о | • | 99 | 9 | 9 | ❖О 9 | ||||
| ·· | , ft | g | о | ❖ | 9 | 9 | 99 | 9 | 9 | ❖О 9 | |
| ·· | • | ® | • | 9 | 9 | ❖ 99 | |||||
| ·· | • | О | • | 9 | 9 | 9
9 |
❖ 9 9 | ||||
| ❖❖ | 1 | • | ❖ | t/: +J | <<! | ❖ | ❖❖ 9 | ||||
| ❖❖ | 9 | ❖ | 9 | << | 9 | ❖❖ | |||||
| oo | ❖❖ | о | <1 | О | <У> < | ||||||
| ❖❖ | о | о | о | ❖ | ОО- <3 | ||||||
| <x> | g | ❖❖❖ | о | о | о | ❖ | > | ❖❖ | |||
| <3<1 | <f | <3 | <1 | 3 | <1 | ❖ | w | «<! 9 | |||
| OO | •Э | <3 | о | • | <3 | ·❖ · | g | <3<3 | |||
| ❖❖ | ft | « | ❖❖❖ | о | +ч | ❖ | g | <99 ❖ | |||
| ❖❖ | ft | g | ❖❖ | ❖ | ❖ | 9 | 3 | 99 О | |||
| ❖❖ | § | g | ❖❖ | ❖ | УТЛ | So | 9 | g | ❖99 |
| К. | R | К | |||||
| ft Ч. Л
о |
Н &.
А% Ч |
S | ήή%. | ft_; ft * fa * ft * ©Rio t=! ό | * А * fa ft * fa * ft Лйо~ Η о | ή | ft
ю |
| О | ftO
*о О |
ft
«О О |
о
О |
О О о | О О | О |
к
| C+Si | 2-1-1 i о- |
| Μη | Ξ- и i 3 |
| а>
fa |
о о
will ©ί |
| Си | о о о о о
СООЙЮ г-ИЮЛЮ СО |
| £ | о о о о о
МО Ю Ю 05 О Tf ri ©3 |
| Й | о | о | 1 ° ° |
| g | тЧ | fa | *ч со" |
| ю | ООО | ||
| 6 | м<
05 |
о | О 05 w 05 00 со |
| ю | ООО | ||
| со | о" о о" |
| Ми | 1 i I 1 1 1 1 1 II s-s-1 1 I I 1
о о |
| СО | 1.25
3.25 1,00 1,50 |
| о | 0,80
1,50 0,15 0,70 0,45 0,50 |
| £ | оооооо О 000^0000 θ ю" о" О ю" СО 1 сз 1 СО о" Ю ° О со" -гч о" 03 ©3 СО СО СО 03 СО ©3 ©3 О 50 ω О |
| о
fa |
66,0
55.0 Ост. » » 65.0 Ост. » 57,5 25.0 Ост. » » » |
| Сг | оооооо ю юоооооюо со" О 03 Ю Ю СО 1 Ю 1 К- О- ю" чН 03 СО СО СО ©J тчгЧ 03 НИИтЧИН |
ю о о гч ИЮ
о ©з
I ©а !
И
ооо и со со ю 0
" °_ И ю К « -Рч о о со со о ! со со о о
СО
О, <
& о _ fa
*ч
О
£
I
• й о
5ч о
N t>
£ * * О i о
О О
«5 О
.Но
© о О О с5
oooogd
о го 4)0
ca -2 ” 5 2
gfesgl^
|৻«2
t: Lii о ч к
ЙянКо
ЬС п5 д
Г*и
С Я
й ьЬ
й н
a

ci
Μ
St
ο,
s · * ifISI
R ^ ^ о ^
§g5£S
«,s и ® НО)
Us
ο-τ-α-ί о « 2
Я c-iHoSV
>
H
ίξίξ
«5
СО
и ло * ft
° о
sii
НН<1
5 «о О о о
ί’-* В
°<иад
«OTt<I>COr
Ό
.В
о
• 5н
.fa
О
ew
j|s ^
OHcTltf · “"рв·
fio ^ “ л „ е ^ с? л « с § ft
ssxa
gs
,^Ι
fafa
й
ci
bo
£:ri
5ч
SS" 4
S<*J
Mo’ I О I ό
£. га О О £ о С
3 -В. J ^ I га л ю ;
В О I ft СО о ·
V* <3 >о. ^ ~ С
2
в
ft
к
О о *нэ гигэ/ж> геэ а 0? -нхтшкон ибп
·ΗΪίθ3Ο(ίΠΟΚΠ0Λ *ΗΐΪ0(Ιθ
•exAtraoa θπΛχοοϊΤ -goao и(3п -BaadJBH *лиш1гойО(1п О о? *WHXOAnOtf ШЭРШИ-ВН
00 эийтвшйэйоэ ‘naej
•etioa BBHdoicx
2 · о о
В § _ —
га S В а ей с;. -
га - —
« ο
t, RUOw r- C H ей га £ 4)0 О
_ ^ азч- а м К К Н
1||!| о£^ и О В о № Я
ь ©
υ и о Н- й ΰ 3
О ё Η Ϊ S Й χ
а а £ « в2 2
О о « О g £ В
^ н О н о >>Н
дл Н
я 2 о л а «-> м х £
я и о i? 2 £ я 5! >» 3 § 5 метров £ ?IJSi 5 i •c^fOg^
о 2 га
03
В
В
w. I,
. g К аз
5двь g g и s
Braga
О) И Я Μ
«со О К га в a 2 PftsS га а, в з§;ё*в
ftgg3§
ОщкХдй ййя2ял
М 2 ° I * Н
ня
В р»» I. о Ч - i I ftio I ft ||— I.
В о М
К В В
• В м
ogoS
К В Я о й я «S
В га ^
~ ч ©
Я В « дч
gga-g-g
И о О В я й°о 3 © г. со в гаО
Р a ft„, н о в
«
о
РЗ
о
ft
В
2
ft
га в I
jlO ей
"о,ЙК
м о
^ga^ggSg g°gggaB®
м ooN
:M|Kg§g5g
sle^sg-g
о £ о ей ο έλ га га
В В « ft
2Б
к в о
g «
в×g a с·
§? и н в-m ο w
ftS
2
В 03 “-< И
>-o
Se
«.
ft ah
a 03 в аз ° „ В >ft0
Isaggi
в u i s§fg« uo.oggg ft В в i в я В5 ftB $о
Я 2 Г и к “ί о Т В В
<υ Jo га i g cN Ba=>
“is^So ° So°-S
I.
S О о“,-, eo
Β^20 1 S3 ”c/joi7 a о
*&gSS«eS3|iIsil
?s>S aS^j I ч°~
I2ofc0-!«S h?8
.“Kgo ^igfatSga
f.1а1°УФёФ
;i5iSSoSstsS“|”
ig-B^oSfc^SSSS
KWft Ю “Л ЬЛВ-В В 3
Й eo ft ft ·η ® ю""”^ a ft ft В τί< E- га o ft ftc<3 В В В
ft ?. В ft ей ft Н В
а в g и°г1 о 0 • ft.
В ей g 4) и Н
в я В ей м ейО
5 н в
Sgg.
2§о
. в s S ь · s
О В ей р ft В Н В в га В
О ей ft ей п-нр
^ П. И <п аз be в _ 2.
В ^ в · в в
• В В я
В и оё ft ей О 5 с В *
>е< в м · s
о « Я ft 2* о ей 2 в g
ea§§”
. л ей ^ р, аз В о S
B^gag
° в 2 о s “"SgA
2§HSg
в я л ft
о о в В о
§S?|G
*%й°П
>& В В
III!
>В н аз В a ° в о в о
Б П
a
В О К ft
в в н о о О ft
_О0.
ftO о « о J?g га
X К Ξ s ,ϋΗ
В!
°о 20 Воо
О «О
, SSS О о я в Μ
s » ft ы Я S ®? Э
ВО В g^pOK
0^дОД02д
Kft о Wft
В W аз о В Н
og
В
в S
Б ей g >.В м×н В В в g га В В м g о
«S? §
SssS
£g»|
« га о В
д4) Нгл
В и Ян5 о аз в“ я? ей В g. ftO • В Я g ft га ° _-В I oft g
О « “
I I
В ft о s н ей сз «
В В -В ft ^ га о ? Б В I
ё*?
ft в н
в и 2
- - с.
0“l,
ago.
gS°
ft о «-° - ^×μ ^
Λ < rt
В _ Й
щ и rt № В P.
OJB
I III
| «οτχΟοΟΟί—о ‘винэйиш -OBd -wdgj. -феон -нНэйо | <33 <33 <33 со со со
1 - 1 1 °- 1 1 1 1 ΐ: · < it ;· I 1 1 ®. 1 ”. 1 1 * Т-ι T-t О тМ СО тМ |
| ахэонхопп | Ю СО СО О CD о со о о Ю СО l> D- СО CD CD О t— CD О О О iО
^ Г» t> |I>j|D- Г^О (> ! 1 1 О* 1 СО 1> о со и |
| Оо з вин -эиатшп -BdAx-erlanwoi, | 1 493
До 1450 1 430 1 510 1 510 1 510 1 510 1 510 1430 До 1330 1 250 1 320 |
I I
I I I
❖ ·
❖
о
nHoa SHaoiHAdj
• ·
o-s
Β(Ϊ3φ00Κ1Β
g ‘ffiflatfoo ‘нинщЕкд
❖
90
вЯзфэоихв ввнштгд;
··
xAtfgoa ионэДои
• · ·
•9
«Ноя нднэЯощ
<>
❖
•О
ft
fra
fe
О
P=r
sy
. аз
.ай
<£> га • крк ^oS
U я га 03
a|a
2—2
| га «-s В +J | га ей | ейа ей |
| о В | а
& | Сталь розии
Перги (Stair) Нергк |
| ft—<
хЕ |
03
и |
Ό
ra
ей
ffi
raj
о
m
S
о
ft
X
га в
• Я.
„ ей га
^|е оэ|з ° S В S
аз В оз гагат ей >» ей лгг ай а
03 В О
МвД
га. га В eh В ·
, ей О ей. га в н rft «я ·
Л
га 03
>> га аз ей
S*
5»
S2&
ГГ 03 ь!
III
IO ftft м 03 ей
«ий
• В
-.2«
со С га О га
В га·-
2
В
В « - -- о -
ЕГ SSoQ
В оз
И£
s
го <я g
„“Is - .37*4
ГО c© s ,1 ГО « го·
в
ГО
„ „ Я И
и? о « S а I nt, а. g &S „ 68 р
и® v=a Ro.
g =>" ч § ° ° н
s“4h
№90
Ш^В -=2 С90 Ε§ο-ϊ5 sisSM &OS5 Μ®ϊ
g£SS
9S~Sg?"°-o
ни *o Η 05 2o о i
з ^ Ή 2 а иоаоио^а^Зко о,29.й2с. .дьЯй
=ξ
3 „
и о а о
ί ® °·
^ГОнаВГО-’мД^
«softSa ^ н " gSBacSaiOggS^ д8 .Д2ЯОД§«®
в S S. ^
" ^3ο“2
, - „ __ „ Jic° -ϊϊΉβо^акмм о. *—ол-Я w а° Й
•&о i gSS^s ggJ
nm ы ^тлм Η со C5
ss^8i“M3a"s
лот. Э оо 9qO <d щ«
И о о к в ?3°Ч go
Й1 „а&о?2ч ggj
“ “о д д2 ·-« И оо
KtrTgMsg^s
0®^лг ro.vPOwi ВЙ ~з со te O^rr I d^-CQ t=tro
5go^5K3 §ЯЙ
’-и? ,— М тН^ P- Ο.
§И^о® w I
=κλΜ2£ΚΧ555 э В д ^ В «5 О fef ж ?Й
к !оо
И о
_, -· А
5 о аз
oSSH
|Д ft « - 03 Ю 3
о а го о и о s - к к м д н · н 1 .·- 2 го „ 00
Й W KAJ I го > о -“ Д С_ а СО
^Й.Я.о1 B|j3§Hg.o ноо«нс5Йо ю В ю

О) ЯлП I
ΞΐΙ«1
йвИа?
К <ϋν.ο 14
|м
&я зг iW В « Д гоО о д з
^ egg
I OS
.Щ
H«^oOMS7
ч о Q го
««J Ρ
о ^ о са К<о®,
о а го 55-1 АЮ -
«TSg3 &s5o|
"яЧО 4 - о д тЯй
.Л .к „ОО
гвя^ёо Л
Е о“ «.од ИЗ
^ ?WS§

sr^*
К СТ5 ia Ο-d-· п2
gn^oSSoW
SM*_
оо~о® -з ^oWWsiog
-яГЗД^Т ?1^о«н1 sir о в M°!’g а»я®.^
w OJ Cd О ,го Ρ 05 © " дч
t(ga.0-a«a ®.g?“
Ci^fto, i нП .„Hr.
•^O Pm I ^ I I
I i «ggd"« Ig
^BoRog^S |„o|g
,3 3 5 t Э ssl S’* g аглщ о" a cSoosgSK
W
В >> И В В «
H сЗ О E-· 0,0 В -
§ >>
к S> и S Ии
I I
as
о о О В X
М м О В Д Д
О»
Л Го f- ~
в в К д о >,
|»5 Е-<
в а А В “ а и- о
1^1
gga
О В fn
tc Го го д и R d К В К
1 I
«Ад
Го А^1 О
s=r лв
nas®
О g.-f
Ssi
§Ja I «&g1
R - A to § η
в ro g
η £ о
О Го
AB g Β,Ο®
° о ·-
ϋ&3
к «
и
5 го
®« в
is
1=С д
§о°
“год
По“
р Д Н
Ё в о
В О
Ано
О ГО я ЮНО н о о о о го
I I
я
_. * **
’ · §а°о 5 £ 2 о.14* йН ГО Аю
>"§и&
0 а ад
0 В ГО
к
ГО м в g
>- S со Д ГО со он „ о И ИЙЯ ю
SsS -
gKg г
Sgo и
1 m м 03 §ДЧ у
5* го >» К
М ГО о о В—^ч-
I ч- з ГО d ГО *· ·
§§«"5ffi3&
„ и и Rg- а -2."
яЯоО»й»о
Ssii-.l-.s
Isplgsg. i^gelAwia-i
η a д s a? ga «
OmO OB vO P Й K. £гоЮо
Й S*o 000 P*®®
®32iBro rop.
О g SR дPQ я Я ro В В со <м ^
"Он
^ S

| п. со о II о | 1 1 | 0,065 | 0,06 | 1 1 ! | ю
3< О о |
1 | 1 1 1 | II 1 1 II | Mill 1 | 1 | 0,033
0,033 |
1 1 1 | 0,077
0,045 |
1 |
| N iC Ю СО СО СО | со со т-4 т-4 | J ет ” | ю | I 1 1 | 3
3 |
1,7 | 1.71
1.71 |
1 ®. 1 ». II | 1,61
1,61 1,61 1,68 |
1,6 | <м, 2-1 | о
3 со со |
1,65
1,48 |
СО
со |
| СО
ю м м со со со |
34 М
со" со" |
8,84
8,8 |
8,80 | о о <35 05 СО
СО 00 СО |
ю с“*
со |
ю
3 со |
7.45
7.45 7,71 |
ОСОЮ
(ЯМИМ СО СО со оо СО СО ос» |
со СО СО СО о ю |> 1> О 1> о со с·» 1> Г> 1> СО Г- | 8,26 | 8,15
8,06 |
8,0 1 8,15 18,3- | . со ююс-со 1 3 1> Ю 3 05 (35
·-· <м 00 СО СО 00 so | |
| 1410
1415 |
1400 1 430 | 1 430 1 420 | 1 300— 1 350 | 1210 | 1 340 | 1 050 | о о ю
СО СО С5 |
1 430
1480 1 480 1 480 |
о о о о со со со со
3 3 3 3. Μ М т-4 .т-4 1 j |
1 430 | 1 300 1 260 | 1 440 1 400 1 300 | 1 110
1 305 1 540 |
>1 230 |
| 1 150 1 100 1 100 | 1 100 1 150 | 425
650 650 |
о о со | о о о о
05 Ю |
Г | 1 | 1 1 1 | 600
600 700 1 150 |
о о, со ю
1“g 1 1 1 |
о о
о н |
о | 1 290 1 000 | 1 II 1 | 1 000 |
| • | ❖ | • | ||||||||||||
| оо | о | о | о | о< | <1 | о | ||||||||
| • | ❖ | • | • | • | ||||||||||
| • | • | О | • | • | о·· | о | ||||||||
| ·· | ·· | • | о | о | • · | в· | ·· | ·· | • | |||||
| ·· | ·· | • | • | о | • | м | « | |||||||
| ·· | ·· | • | ❖О· | о | • | «· | ❖· | •
. | ||||||
о я
>& · *
о о го й1-8
Й и Ь
ЙН«
СЗГ О gffl S 0^6 А. о А
!»
2 ‘g ’Я
3- - с - - и
.И, о ч
3 ·“ .gs
.го ,й2р
i .я
||121р
В d о ГО гг _
q^SShsS
| д | д | £ | |
| о | * * * * о | О А А | а аз |
| Й | т | < | О |
| • | го | Ω * |
я яй
Л 9“ ί
9
р Λ р
О οϋ
^ · в ·
го · Я ·
О о _ р · tf —I
ОМ ^ГО О * Гом д о _ е о ro«oroS
ГО А н Ό г— о 0.22
<:ноё ;>
%% s й со ω
В В о о. А А оо0*—1,—; о
S1
.л .л s
НН<5
я «»
^jpq
о о
%%%%%
• Л О
ГО
В св
5 ч “ t ОО В -д
ГО.2 л л ГО •нм. го В * * Н
О О А А
Вев Я
.,;;нс ГО ГО ^ ® й,
ХИ1оН о«. Йй S
Sg
о |о
Ла« SX б о о Aft И И В Д WM
. го
Ы) • Р
S5 Ί
.В
< о д ей
·-< о о
ЙЙЙ
ГО Го
РчНЯЯс5«
с постоянной влажностью и периодическим обрызгиванием образцов—дает хорошие результаты при массовых сравнительных ис
пытаниях. К стандартизации исследовательских методов пока еще не приступлено (за исключением нек-рых попыток в Америке).
Выбор металлов. В табл. 3 даны главнейшие результаты исследований (главн. обр. американских) наиболее важных сплавов. Из сказанного выше ясно, что материала, абсолютно устойчивого по отношению к всевозможным условиям коррозии, не существует. Поэтому при выборе материала необходимо в каждом отдельном случае учитывать все данные: наибольшую химическую и механическ. устойчивость, способы обработки, стоимость и другие факторы.
Коррозия металлов газовая [2].
Газовой К. называют химич. разрушение металлов под воздействием газов и паров при высоких Г,- Принципиальное отличие газовой К. от обычной К. в электролитах и парах при низких t° заключается в том, что первая не представляет специфически электрохимии, процесса, то есть не сопровождается обязательно переносом определенных количеств электричества в металле от одного участка металла к другому. Т. о. газовая К. является чисто химич. гетерогенным процессом, в к-ром участвуют по крайней мере три фазы: металл (твердая фаза), пограничный слой продуктов К. (твердая фаза) и газ (газообразная фаза). С точки зрения современной теоретич. химии газовая К. представляет весьма сложный случай гетерогенной химич. реакции (превращения решетки металла в решетку твердых продуктов К.—например окислов), часто сопровождаемой кроме того рядом побочных процессов (образование газообразных продуктов реакции, взаимодействие твердых продуктов реакции и др.). Практич. значение газовой К. весьма велико, так как сюда относятся многие случаи разрушения металла в условиях эксплоата-ции, например: газовая К. выхлопных клапанов авто- и авиамоторов, разрушение печной арматуры, соприкасающейся с раскаленными газами, газовая К. химич. аппаратуры, работающей при высокой t° и давлении (синтез аммиака), окисление проволоки, служащей для обмотки электрич. печей сопротивления, окисление металлов при различных процессах термообработки и горячей механич. обработки и т. д. Систематич. исследование газовой К. только еще начинается. Как с теоретической, так и с практич. точки зрения наибольший интерес представляют процессы окисления металлов при высоких ί°.
Все факторы, влияющие на процесс газовой К., могут быть разделены: 1) на внутренние (относящиеся к металлу)—природа атомов (ионов), входящих в состав металла, их взаимное расположение, структура металла при данных условиях, состояние поверхности и 2) внешние (относящиеся к внешней среде)—природа атомов, молекул, ионов газа или пара, физико-химич. его состояние, температура, давление, скорость газа относительно металла. В общем случае процесс коррозии можно выразить уравнением обратимой реакции
M + R£:MR,
где М—металл, a R—газ. Направление этой реакции зависит от физич. условий, в первую очередь от ί° и давления. Для случая, окисления металла окисление
М+О^МО
диссоциация окисление будет происходить только в том случае, если давление (или соответственно концентрация) газообразного кислорода будет превосходить упругость диссоциации окисла. После образования на металле в первый момент процесса пленки из продуктов К. (например окислы) скорость диффузии газа через эту пленку в зависимости от физико-химическ. свойств ее будет важнейшим фактором, определяющим общую скорость про- цесса. Возможность образования на металле-сплошной пленки определяется отношением
“, где W—мол. в окисла(или в общем случае продуктов К.), w—атомн. вес металла,. d—плотность окисла, D—плотность металла. Если отношение это больше 1, то слой окисла м. б. сплошным; если меньше 1, то· пленка не м. б. сплошной. На физич. состояние пленки, и в особенности на ее непрерывность, влияют также газы, образующиеся в процессе К. (например СО и С02при окислении стали) и ведущие часто к разрывам пленки, а также соответствие термич. коэф-тов расширения пленки и металла и сопутствующие механическ. влияния. Для чистых металлов Пиллинг и Бедвортс (1923) выводят теоретически следующую зависимость коррозии or времени, считая, что диффузия, а следовательно и коррозия, обратно пропорциональна толщине пленки:
W2=kt,
где W—мера К. (например количество израсходованного кислорода), к—константа скорости коррозионного процесса и t—время. Зависимость константы скорости коррозии от темп-ры выражается следующим ур-ием:
к=АТп,
где Т—абс. темп-pa, А и п—постоянные. Наконец скорость диффузии кислорода в дан ный момент D, а следовательно и скорость К., может быть выражена след, формулой:
7ι _ С (У 2 — V,)
“ ~ ~РГхГ ’
где с—коэф. пропорциональности, F,—концентрация (или соответствующее давление Рj) кислорода в реакционной зоне, то есть на границе металл—окисел, V2—концентрация (или соответствующее давление Р2 кислорода) в зоне адсорбции кислорода пленкой,
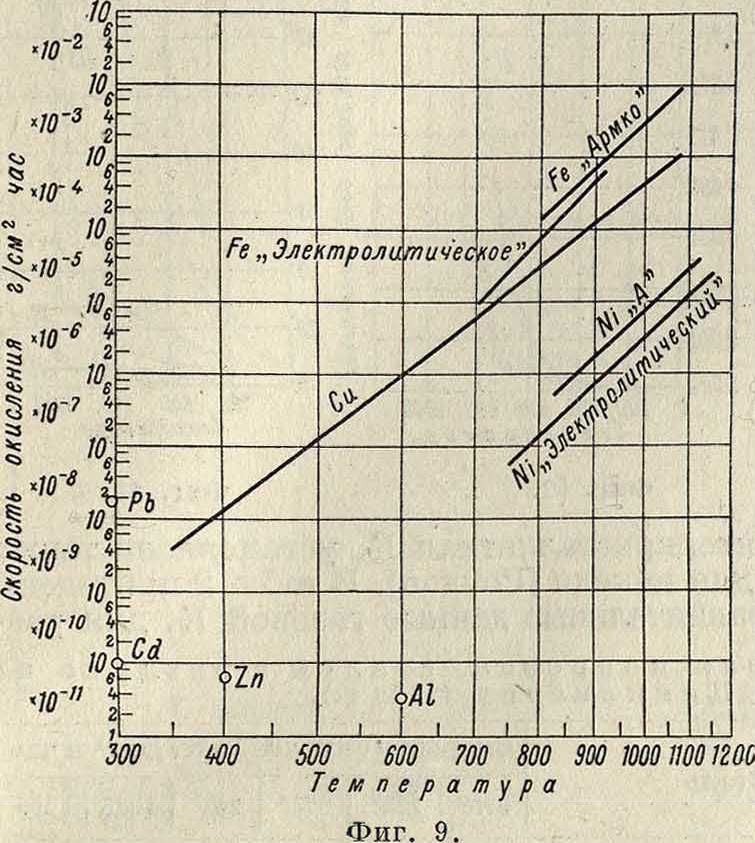
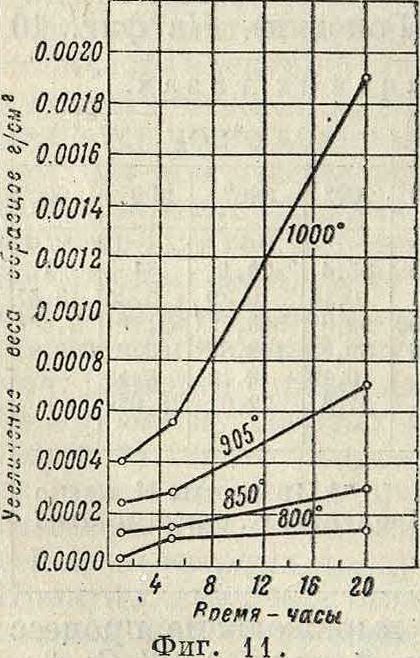
то есть на границе окисел—газ, U—удельная сопротивляемость пленки диффузии, II— толщина пленки. U ш. б. вычислена из экспериментальных данных. Процессы газовой К. металлов и сплавов в действительности лишь приблизительно следуют вышеприведенным уравнениям, в особенности если основному процессу К. сопутствуют усложняющие побочные реакции. На фигуре 9 изображены скорости окисления чистых металлов в зависимости от ί°, полученные Пиллингом и Бедвортсом, а в таблице 1—данные из работы ра, первый метод дает более удовлетворительные результаты.
Газовая К. сталей представляет особенный практич. интерес, т. к. стали (и никелевые сплавы) лучше других металлов сохраняют механическ. свойства при высоких t° и поэтому могут в этих условиях широко применяться. Скорость К. в очень большой степени зависит от химич. состава сталей. Вообще металлич. примеси, дающие с основным металлом твердые растворы, увеличивают стойкость последнего, в особенности если сами примеси способны давать хорошие защитные пленки. Наилучшее действие оказывает хром, затем никель. Добавки к высокохромистым или к высокохромоникелевым сталям кремния, вольфрама и нек-рых других металлов еще более увеличивают их стойкость. Сплавы с никелевой основой вместо железа сопротивляются окислению лучше сталей (нихромы). Железоалюминиевые сплавы и железокремнистые сплавы при высоком содержании алюминия и кремния хорошо сопротивляются окислению при не слишком высоких ί° вследствие образования прочных пленок окислов. Вообще каждый металл и сплав обнаруживает специфические свойства по отношению к различным газовым смесям и различным Г-ным условиям.
Структура сплава при данной 1° влияет на скорость К. Однородная структура (твердые растворы) благодаря равномерному распределению различных атомов (ионов), составляющих металл, образует в большинстве случаев однородные сплошные пленки; сложная структура, наоборот, на различных составляющих будет давать пленки разного состава с различными свойствами; возможность разрывов пленки поэтому увеличивается. По опытам Г. Акимова закалка углеродистой стали повышает ее способность сопротивляться окислению в интервале ί° 200—350°. Состояние поверхности (грубообработанная, полированная) не влияет на скорость окисления. Деформации увеличивают скорость окисления металла (Г. Акимов), в особенности же полученные в результате сильных ди-намич. воздействий (Головин). На фигуре 10
Таблица 1.—Газовая коррозия чистых металлов в различных газах.
| Металлы | о2 | Н20 | со2 | so2 | ||||||||||||
| 700° | 800° | 900° | 1000° | 700° | 800° | 900° i 1000° | 700° | 800° | 900° | 1000° | 700° | 800° | 900° | 1000° | ||
| Железо. Хром. Никель. Кобальт. Медь. Вольфрам | 51.1 0,47 0,96 3,72
12,0 46.2 |
59,5
0.97 1,15 4.39 19,0 275,4 |
124,3
2,24 2,82 93,1 44,0 376,2 *1 |
141,6
6,31 9,69 119,5 |
62,2
0,05 0,34 0,81 3,2 2,1 |
84.7 0,37 0,42 0,82
12.7 17.7 |
(?)
57,5 1,17 1,38 25,9 15,3 179,2 |
178,4
2,11 4,38 73,5 |
58,7
0,27 0,4 2,68 6,6 13,9 |
72.2 0,33 0,87 5,4 9,9
20.3 |
113,3
1,33 3,56 44.3 12.3 13,9*2 |
175,5
3,1 4,56 15,0 |
35,4
0,16 92,3 59,8 0,12 47,0 |
79,1
0,39 366,7*3 102,8 0,13 72,8 |
*1
3,25 83,7*4 163,3 0,19 29,0*2 |
*1
3,57 2,6*δ 289,8 |
*ι Образец прокорродирован нацело. *2 Часть продуктов К. улетучивается. *3 Продукты К. легко распадаются. ** Продукты К. удерживаются на поверхности образца. *δ Продукты К. очень плотно пристают к металлу.
В. Гадфильда, 1927 г. (числа показывают увеличение в весе образцов в мг/см2 за 24 часа). Практически газовая К. может быть выражена или относительным увеличением веса образца на единицу поверхности за определенное время (сохраняя продукты К. на образце) или соответственно уменьшением в весе (после удаления продуктов К.). По данным авто-
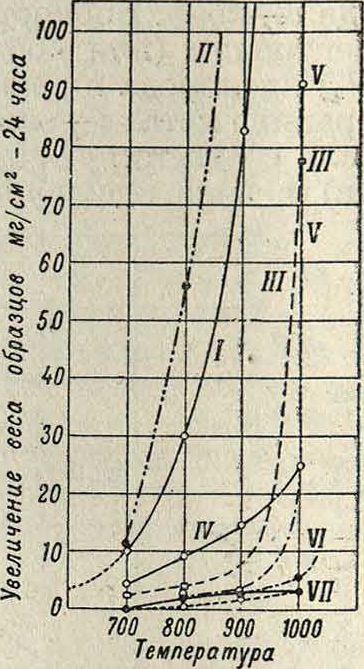
изображены кривые, выражающие процесс окисления углеродистой стали (0,6% С; t°== 800°), а на фигуре 11—сильхромовой стали (0,4% С; 9,5% Сг; 4,0% Si)—в сухом воздухе. Зависимость К. от темп-ры представлена на фигуре 12 и 13; на фигуре 12 даны кривые К; углеродистой стали (0,6% С) в воздухе (время—5 час.; I—сухой воздух; II—воздух, на сыщенный паром при комнатной темп-ре); на фигуре 13—К. сталей в кислороде [I—углеродистая сталь (0,17% С); II—чугун (3,2% С; 1,1 % Si); III—высококремнистое железо р.02
’0.01
з 0.00,
| 1> | ||||||||||
| у/. | "7 | |||||||||
10 § * с. is 3: =s
^ *5 0.6^ S;
>3 ^
* S 0А * 1
а ^
It,
«а
ί S
20 30
Время - часы
Фигура 10.
00
ί0
(0,8% С; 14,3% Si); IV—высоконикелевая сталь (0,24% С; 36,9% Ni); V—высокохромистая нержавеющая сталь (0,3% С; 13,1% Сг; 1,3% Si); VI—сталь V2A (0,12% С; 17,5% Сг; 8,0% Ni); VII—высокохромистая нержавеющая сталь (0,09% С; 18,5% Сг; 0,37% Si)]. Перегиб кривой для углеродистой стали в области t° 800—850° объясняется критическ. точкой стали. Т. о. переход всей структуры в аустенитную сопровождает- т а б л_ 2ся относительным увеличением стойкости против окисления.
Состав газовой фазы в очень значительной степени влияет на К. сталей. Сильными коррозионными свойствами обладают 02, С02, S02и Н20 (пар); СО и Н2, наоборот, восстанавливают окислы; N2 почти не действует на металл, NH3 производит нитрирование стали. Воздух, насыщенный парами воды при обычной температуре), в области температур 800—1 000° действует на углеродистую сталь в 5—8 раз сильнее, чем высушенный при помощи H2S04 и СаС12. Согласно теории газовой К., если давление корродирующего агента превосходит критическое (что в большинстве случаев имеет место в практи-ческ. условиях К.), то дальнейшее увеличение давления уже слабо повышает скорость К. Скорость газа весьма слабо влияет на К., исключая такие скорости, которые уже приводяткэро-зионным воздействиям на защитную пленку металла.
Механич. деформации в процессе газовой К. (напряженный металл) в большой степени увеличивают скорость К., что связано в пер-зую очередь с нарушением непрерывности защитных пленок. При этом весьма часто К. распространяется особенно сильно по грани цам зерен металла (интеркристаллитная К.). Последняя наблюдается также для стали при темп-ре свыше 1100°, что связано по-видимому с процессами выгорания углерода.
0.022
0.020
^ 0.018
§ 0.016 2S-
I ош
* 0.012
10.010
* 0008
I 0.006 >
1 от
f 0.002
о.ооо.
| V
1 1 |
||||
| !
1 1 |
||||
| 1
1 1 |
||||
| 1
| |
||||
| п | ||||
| ί | ||||
| м | ||||
| Ji | ||||
| т | ||||
200 W 600 800 1000 Температура
Фигура 12.
Фигура 13.
Интеркристаллитная К. установлена также и для никеля (Роудон). В табл. 2 приведены сравнительные данные газовой К. для раз-
коррозия сталей в воздухе по кк енсону (1922 год).
Газовая Д I
| 1
Марка | Сталь | Скорость окисления в г/дм.2 | в час | ||||
| 575° | 725° | 875° | 945° | 1025° | 1100° | ||
| МС | Углеродистая, 0,3% С. | 0,0027 | 0,018 | 0,100 | 0,160 | 0,37 | 0,55 |
| & | Хромоникелевая. | 0,0027 | 0,014 | 0.080 | 0,130 | 0,32 | 0,60 |
| N | Никелевая, 25% N1. | 0,0005 | 0,005 | 0,054 | 0,100 | 0,21 | 0,41 |
| HSO
ΝΒ |
Быстрорежущая. Высокохромистая, | 0,0011 | 0,006 | 0,054 | 0,095 | 0,25 | 0,47 |
| У iero | 14,7% Сг.. | — | о; 001 | 0,007 | 0,017 | 0,14 | 0,27 |
| Нихром, 12% Сг; 65% Ni | — | 0,0011 | 0,0014 | 0,002 | 0,008 | ||
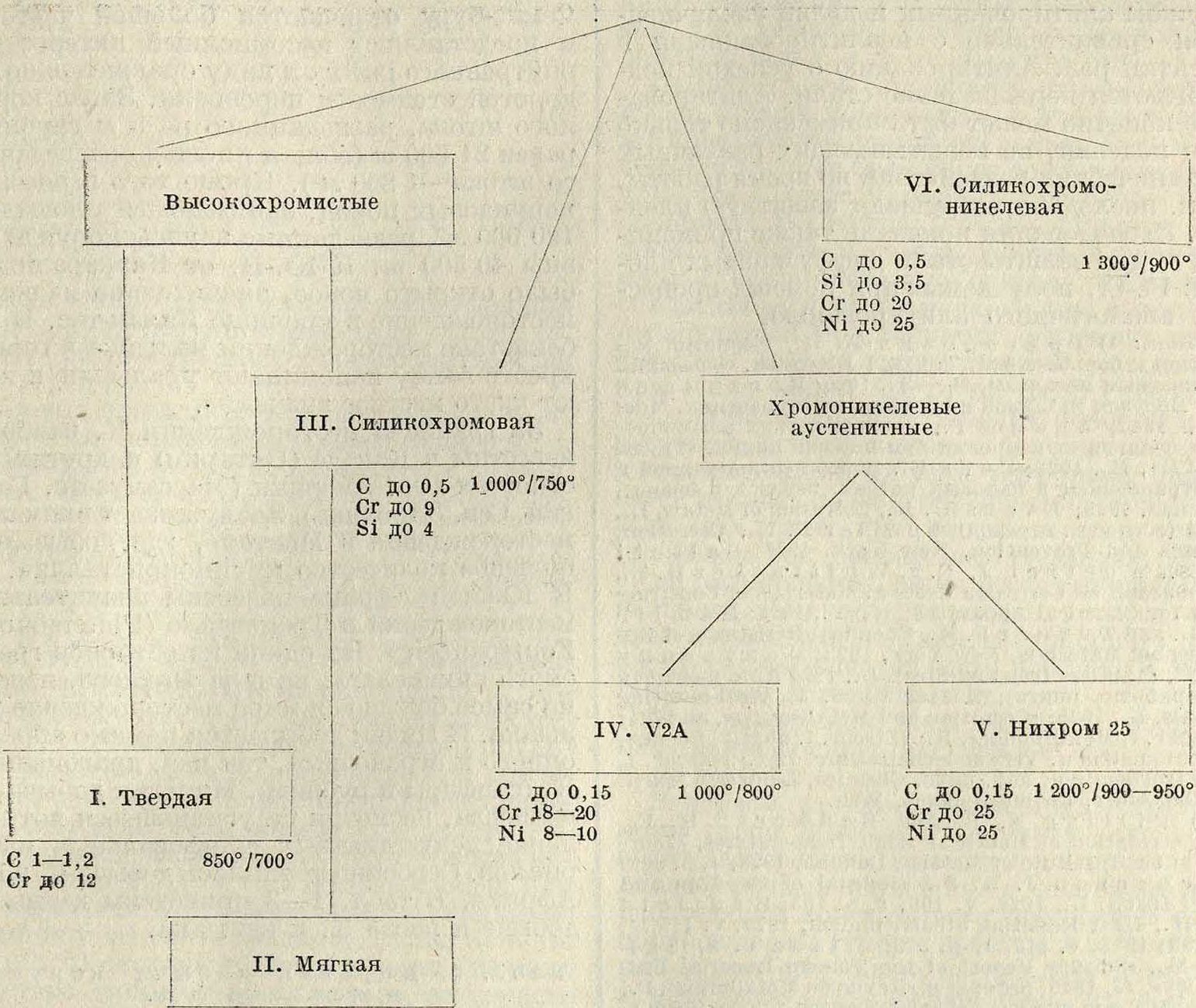
личных сплавов. На схеме показан сортимент нержавеющих жароупорных сталей, причем составы их в % указаны приближенно (подробнее см. Стали нержавеющие и Спр. ТЭ, т. И); цифры справа под прямоугольниками указывают приблизительные предельные 1° для каждого сорта стали: числитель дроби указывает допустимый для металла предел 1° в отношении газовой К., знаменатель—предельную темп-ру, выше которой механические свойства стали принимают весьма низкие значения. Пояснение к схеме—вид применяемых сталей и главнейшие изделия из них—приведено ниже.
Для защиты металлов от К. применяют различные жароупорные эмали (смотрите) и краски, но наилучшие результаты дает алитирование, или колоризация, состоящее в том, что на стальном изделии при помощи специальных процессов создают пленку из сплава железа с алюминием. В настоящее время имеется несколько способов алитирования. Наиболее распространен следующий: изделие помещают в ящик со смесью из порошкообразного алюминия и окиси алюминия и нагревают до темп-ры 950°. В ящике поддерживается восстановительная атмосфера; процесс ведется примерно 5 час. Алюминий диффундирует в сталь, и на поверхности изделия образуется пленка спла-
С ДО 0,15 1 250 7750—850° Сгдо 30
№ по схеме
Вид материала
Изделия
Полосы прокат., кованые детали
Детали механизмов, клапаны моторов
II
Литье, полосы прокат., кованые изделия
Химич. и печная арматура, детали механизмов, отжигательные ящики, тигли
III
Литье, полосы прокат., кованые изделия
Всевозможные литые детали, печная арматура, клапаны моторов, детали механизмов
IV
Прокатный сортимент, трубы, литье, кованые и штампов, детали, листы, проволока
Литые, сварные, кованые изделия, муфели, трубчатые аппараты, реторты, тигли, арматура
Прокатный сортимент, трубы, листы, кованые и штампов, изделия, проволока
Тигли, муфели, реторты, трубчатые аппараты, отжигательные ящики, трубки для пирометров, проволока сопротивления, сварные аппараты
VI
Прокатные полосы, кованые изделия, литье
Детали механизмов, клапаны моторов, химич. и печная арматура, отжигательные ящики и тигли ва. При работе такого изделия в окислительной атмосфере при высокой 4° внешний слой металла, богатый алюминием, образует прочную защитную пленку сложных окислов с высоким содержанием А1203. Так как между основным металлом и внешней пленкой, поз же переходящей в окислы, существует постепенный переход, то защитная пленка весьма прочно удерживается на металле. Алитирование широко применяется как в 3. Европе, так и в Америке для защиты от газовой К. печных решеток, тиглей, отжигательных ящиков, печной арматуры и т. и. Считают, что Г-ный предел применения алитированной углеродистой стали равен 950—1 000°. Срок службы алитированных изделий увеличивается сравнительно с неалитированными в десятки раз. Алитированию с успехом подвергаются нержавеющие стали. Алитирование конечно может быть применяемо только для изделий, не испытывающих различных механических воздействий во время работы, т. к. последние разрушают защитную пленку. Исследования показали также применимость для защиты стали диффузионных пленок Fe-Cr, получаемых при помощи процесса, аналогичного алитированию.
Лит.: i) Григорович К. П., Коррозия металлов и борьба с ней, Труды I Всесоюзн. совещания по цветным металлам, М.—Л., 1925; Изгарышев Н., Болезни металлов и средства их сохранения, Москва, 1922; Акимов Г., Защита легких алюминиевых сплавов от коррозии при помощи цинка, «Труды ЦАГИ», М., 1929; Г о е н Е., Борьба со ржавчиной и протравлением в паровых котлах, перевод с франк., Москва, 1925; Evans U. R., Corrosion of Metals, L., 1924 (есть нем. перевод); Speller F. N., Corrosion, Causes and Prevention, New York, 1926; Calco tt W. S., WheUe 1 J. C. a. W h i ttacter H. F., Monograph on Corrosion Tests a. Materials of Construction for Chemical Apparatus. N. Y., 1923; Hamlin M. L. and TurnerF. M., Chemical Resistance of Engineering Materials, New York, 1923; Monypenny T. H., Stainless Iron and Steel, L., 1926 (есть немецкая переработка книги); Tun gay S. J., Aeid-resisting Metals, L., 1925; «Corrosion and Me’tallschutz», ab 1924; «Ztschr. f. Metallkunde», B.; «Ztschr. f. physik. Cliem.», Stochiometrie u. Verwandschaftslehre, Lpz.; «Ztschr. f. Elektrochemie u. ang. phys. Cheinie», Leipzig; «Journ. ol the Amer. Chemical Soc.», Wsh.
2) Pilling N. B. and Bed worth R. E., The Oxidation of Metals at High Temperatures, «Journal of the Institute of Metals», London, 1923, 1, p. 529; Dickenson J. H. S., «Journal of the Iron and Steel Inst.», L. 1922, v. 106, 2, p. 103; Hadfield W. H., Heat Resisting Steels, ibidem, 1927, v. 115, 1. p. 483; 1928, v. 117, I, p. 573; Utida Y. a. S a i-d о M., «Science Report of the Tflhoku Imperial University», 13, 1925, реферат в «Revue de Metallurgies, P., 1920, 5; T a m m a n G., «Ztschr. f.anorg.u. allg. Chem.», Lpz., 1920. B. Ill, p. 78; 1922, B. 123, p. 196; T a m-man G., Lehrbuch d. Metallographie, 3 Aufl., p. 51, Lpz., 1923; Pfeil, The Oxidation of Iron a. Steel at High Temperatures, «.Journ. of Iron a. Steel Inst.», London, 1929, v. 119, 1, p. 501; Symposium on the Corrosion Resistant, Heat-Resistant a. Electrical Resistant Alloys, Philadelphia, Pa. 1924; R a w d ο n H. S., Protective Coatings, N. Y., 1928. Г. Акимов.