 > Техника, страница 55 > Криоскопия
> Техника, страница 55 > Криоскопия
Криоскопия
Криоскопия, учение об. определении мол. в растворенных веществ по понижению ими точки замерзания чистого растворителя. Вместе с эбул- Криоскопические свойства растворителей. лиоскопией (смотрите)—определением мол.в. по повышению точки кипения—К. является наиболее употребительным и точным методом определения мол. в веществ в растворенном состоянии. Понижение точки замерзания t раствора сравнительно с точкой замерзания t0 чистого растворителя—д е п p е с-сия At=t0-t, вызывается тем, что давление р пара раствора понижено по сравнению с давлением р0 пара чистого растворителя (Ар=р0- р>0), т. к. в точке замерзания давления ц и и; если же п < 1, то г=1= ~называется коэфициентом диссоциации; для электролитов, молекула которых образует v ионов, г= 1+(ν-1)α, где а — степень диссоциации. В пределе при полной диссоциации а->1, г-»г>; для бинарных электролитов г-> 2. Когда в растворе содержится не одно, а несколько растворенных веществ, концентрация которых в отдельности точно неизвестна, криоскопии, измерения применяются для определения суммарной (так называемым осмотической! концентрации раствора, вычисляемой по формуле с=—; с и обусловли-
«О
вает осмотич. давление раствора (P=RT с для слабых растворов). Так, К. применяется при физикохимич. анализе сложных растворов, например минеральных вод и биологич. жидкостей, например мочи. Измерение депрессии в концентрированных растворах позволяет определить в них термодинамическую активность а растворенного вещества; если эту величину подставить вместо концентрации с во все термодинамич. ур-ия для слабых растворов, получим ур-ия, справедливые и для растворов более концентрированных (исправленная концентрация). Для вычисления а концентрацию с умножают на коэф-т активности /, определяемый пара раствора и вымерзающего чистого растворителя должен быть одинаковыми. Термодинамически можно показать, что депрессия At, как и понижение давления пара Ар, для слабых растворов пропорциональна концентрации с в г-молекулах на 1 000 г растворителя:
Δί=fc„-c
(1)
[1-й закон (К. Рауля)]; при с=1, At — k0поэтому называется молекулярной депрессией;/с0 зависит только от свойств взятого растворителя. 2-й закон К. Вант-Гофф определяет величину к0:
_ яг?___1_ _ А1 го)
о„ i поо г·. О4!
cal
У >
Qо 1000 с
[R—газовая постоянная (= 1,987
L ’ моль град.;
Т0—абсолютная темп-pa замерзания чистого растворителя, Q0—его скрытая теплота плавления в cal /г]. Свойства часто применяемых в” криоскопии растворителей сопоставлены ниже в таблице.
Зная депрессию At для данного раствора, легко вычислить относительное понижение давления пара:
Др = Qо At _
Ро RTl
Легко вычисляется и осмотическое давление (смотрите) разбавленного раствора Р:
Q„, или p= 1 000ft"·^
1000 · ~ · 1 ·
т.
•е.
| Растворитель | 1°пл. | cal Q», s | ь Δί· ft0=- - | t°KUn. | Скрытая теплота кип.,
cal г |
M о лек.
ПОВЫШ. точки кипения, k9 |
| Вода, Н20. | 0 | 79,67 | 1,858 | 100 | 538 | 0,516 |
| Бензол, С6Нв(спец, очищенный без тиофена). | 5,5 | 80,4 | 5,12 | 80,3 | 95 | 2,65 |
| Нитробензол, C„H6N02. | 6 | 22,6 | 7,5 | _ | _ | _ |
| Уксусная кислота (ледяная), СНз-СООН. | 17 | 46,4 | 3.9 | 118 | 97 | 3.1 |
| Фенол,ΟβΗδΟΗ. | 41 | 29Д | 7,3 | —. | — | — |
| Нафталин, СюН8 | 80,1 | 35,6 | 6,9 | — | — | — |
| Камфора, СюЙЦО | 180 | — | 40 | ~ |
Измеряя At, легко определить мол. в М вещества в растворе; если в 1 000 з раство-рителя растворено G г вещества, то с= м и из (1) находим:
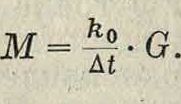
Найденный так. обр. из нескольких определений At (при разных навесках G) мол. в вещества часто не соответствует вычисленному из химич.ф-лы, т.к. вещество в растворе иногда находится либо в виде ассоциированных молекул (смотрите Ассоциация, Жидкости) либо-диссоциировано на ионы, иногда сольвати-рованные (смотрите Ионы, Сольватация) или ком-. плексные. Таким образом криоскопия, методом можно также пользоваться для определения молекулярного состояния вещества в растворе, степени его ассоциации или диссоциации. При этом~=и (если п> 1) называется коэфициентом а с с о ц и а-
из величины депрессии: ~=α= f с; f=;
при е^О, а-»е, /->1.
Методика измерений. Для нахождения Δί обычно применяют прибор Бекмана (смотрите фигура): во внутренний сосуд А, окруженный воздушной оболочкой В, наливают раствор или чистый растворитель, а во внешний С помещают холодильную смесь (ί° смеси должен быть на несколько градусов ниже темп-ры замерзания раствора). После переохлаждения основного раствора на 0,5—1° через боковую трубочку вносят при перемешивании затравку—кристаллик чистого растворителя, получаемый тут же в трубочке, погруженной в холодильн. смесь. Этим вызывается замерзание. Темп-pa замерзания измеряется обычно термометром Бекмана (смотрите Бекмана термометр). При этом Δί измеряется до 0,001° (смотрите Термометрия). Для устранения ошибки от вымерзания части растворителя и повышения концентрации с во время опыта, в случае водных растворов, берут большие объёмы растворителя (до 300 см3), помещая их в смеси с мелкими кусочками льда в сосуд Дьюара. После установления по •термометру Бекмана точки замерзания чистой воды в сосуд вливают из пипетки такой объём раствора, чтобы ί° понизилась на 0,1— 0,2°. После нескольких отсчетов из раствора берут пробу для анализа, а затем прибавляют еще порцию раствора для второго ряда измерений. Камфора, по Расту, удобный растворитель для криоскопич.измерений( t°nJl= 180°), так как дает большую молекулярную депрессию 1с0=40°=“; поэтому в случае камфоры можно пользоваться обыкновенными термометрами с делениями на 0,1—0,2°.
Лит.: Вознесенский С. А. и Ребин дер П. А., Руководство к лабораторным работам по физической химии, М.—Л., 1928; Arndt К., Phys,-«chem. Messtechnik, 2 Aufl., Stg., 1923; East, «В», 1922, В. 55, р. 1051; J e 1 1 i n e k К., Lehrhuch d. phys. Chemie, В. 1—2, Stg., 1914—1915; Handbuch d. Arbeitsmethoden in d. anorgan. Cbemie, hrsg. von A. Stabler, B. 1—4, В.—Lpz., 1913—1925; Η о u b e n J., Metlioden der organischen Chemie, В. 1—4, Leipzig, 1923—1925. П. Ребиндер.
НРИПТОСТЕГИЯ, каучук из мадагаскарской лианы Cryptostegia grandiflora или С. madagascariensis (называется также «lombi-по»), среднего сорта, мягкий, при растягивании становится серо-белого цвета. Содержание млечного сока в растении незначительно, едва 2%. М. Лурье.