 > Техника, страница 55 > Кристалл
> Техника, страница 55 > Кристалл
Кристалл
Кристалл, твердое химически однородное тело, обладающее анизотропией (смотрите) и б. ч. закономерной внешней формой. К. характе-
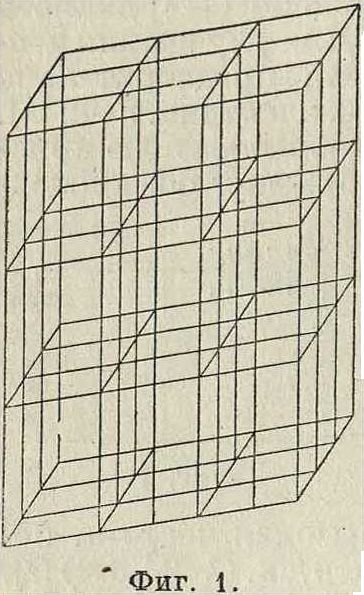
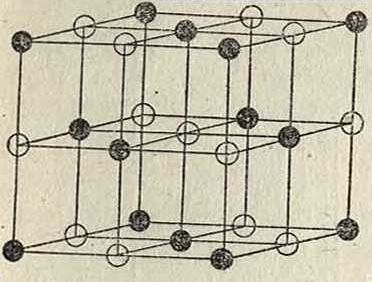
ризуется регулярным расположением молекул, помещенных в вершинах так называемым пространственной решетки, часть которой изображена на фигуре 1. Такая решетка получается при наличии трех взаимно пересекающихся систем плоскостей, причем в каждой системе плоскости параллельны друг другу и находятся на равных друг от друга расстояниях, неодинаковых в общем случае для трех систем плоскостей. Точки, в которых пересекаются плоскости, принадлежащие трем различным системам, называются узлами решетки (в них расположены молекулы). В общем случае все эти плоскости разделяют пространство на одинаковые клетки, которые имеют форму
&ΖΛ fer ferf feaf
fer fer fer
ϋ
a/V
Фигура 2.
параллелепипедов. Простейший же случай: три системы плоскостей взаимно перпендикулярны и расстояния плоскостей друг от друга во всех трех системах одинаковы (кубическая решетка).
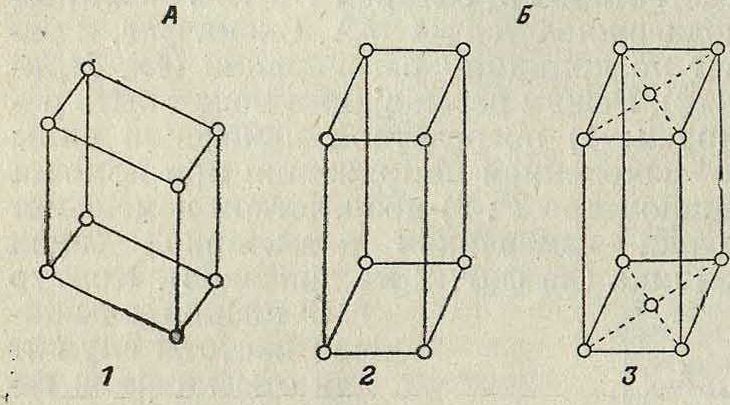
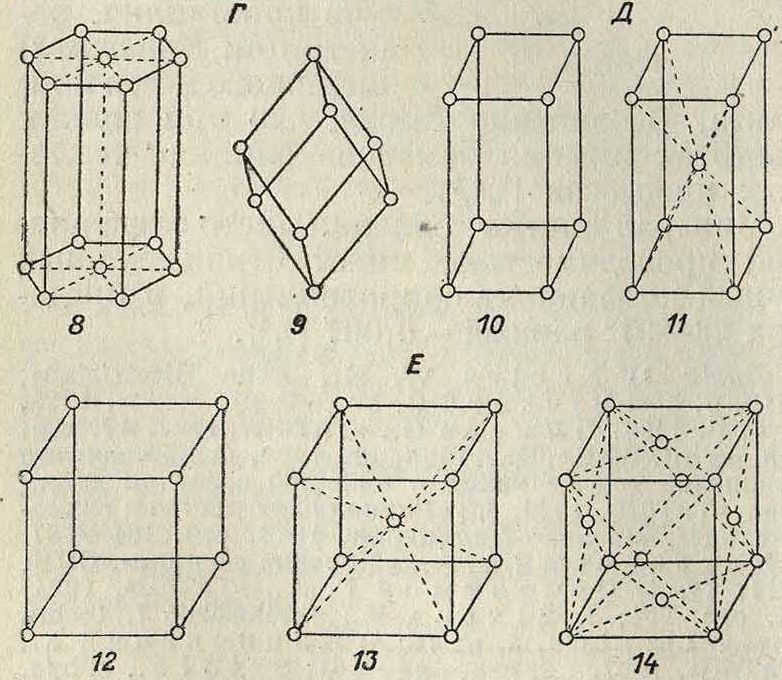
Теория пространственной решетки получила окончательное завершение в ряде работ Зонке, Шёнфлиса, Барлова и Федорова. Трудами названных ученых строго установлено, что в отношении правильного расположения молекул в пространстве имеют место 230 пространственных групп, которые в основном могут быть сведены к 14 пространственным решеткам (фигура 2), из которых одна (фигура 2, А)—т риклинная, две (фигура 2, Б)—м о н о к л и н н ы е, четыре ·—ромбические (фигура 2, В), две—г е к с а γόη а л ь н ы е, из которых одна ромбоэдрическая (фигура 2, Г), две—т е т paro нальные (фигура 2, Д) и три—к у б и-ч е с к и е (фигура 2, Е); среди кубических решеток следует отметить решетки простого-куба (фигура 2, Е, 12), центрированного куба (фигура 2, Е, 13) и куба с центрированными гранями (фигура 2, Е, 14). См. Кристаллография.
Теория кристаллич. решетки экспериментально подтвердилась в опытах с диффрак-цией рентгеновских лучей при их прохождении сквозь К. (Лауе, 1912 год). Если К. по-этой теории состоит из частиц, расположенных по пространственной решетке на расстояниях, немногим более отличающихся от размеров атома, то рентгеновские лучи (А=20-У1/ы А), пройдя через кристалл, дадут отчетливую картину диффракции в виде пятен, известным образом расположенных и отличающихся друг от друга своей интенсивностью. Дальнейшие исследования, в результате опытов Книппингена и Фридриха над пластинкой свинцового блеска, подтвердили результат, предполагавшийся теорией. Брагги (отец и сын), Терада и Вульф дали следующее толкование опытам Лауе: каждый из первичных пучков лучей, падающий на поверхность кристалла и разлагаемый им, можно рассматривать как отражение этого первичного пучка на одной из систем элементарных параллельных плоскостей, на которые можно разбить решетку К. Теория эффекта Лауе в общем сводится к следующему. Проходя через кристалл, рентгеновский луч (той или иной А) приводит в колебание электроны атомов, являющиеся структурными единицами К. Атомы при этом становятся источниками излучения, испуская волны с амплитудой,пропорциональной Z (атомному номеру). Волны, излучаемые всеми атомами решетки кристалла, интерферируют в окружающем К. пространстве, усиливая, ослабляя или даже уничтожая друг друга. Эти направления интерференции определяются ф-лой:
2d sin α= т А,
где d—расстояние друг от друга элементарных плоскостей (или, что то же, узлов), А— длина волны отраженного луча, а—угол падения луча на систему плоскостей, т—целое число (порядок отражения). Базируясь на методе рентгенографйческ. исследований структуры К. галоидных щелочных металлов, Брагги нашли в частности, что атомы металла и галоида не собраны в явственные пары и в узлах решетки (как и предполагал Браве). По их исследованиям оказалось,
что в узлах решетки находятся составные части молекул (отдельные атомы или определенные группы атомов), отделенные в К. хлористого натрия (NaCJ) равными промежутками (чередуясь в равных расстояниях на прямых, параллельных ребрам куба,— фигура 3). Это дало повод утверждать, что К., не являясь собранием (в узлах решетки) молекул, а будучи собранием атомов, представляет собой как бы одну молекулу. Впоследствии Дебай доказал, что структурными единицами К. служат не нейтральные· атомы, а ионы (и о н-ная решетка).На основе учения о строении атома (Бор), строении кристаллов хлористых щелочных металлов (Брагги), а также доказанной ионной природы структурн. единиц К. (Дебай), Борн вычислил теоретически размер решетки и механич. свойства К. Электрическая теория твердого тела дает следующие выражения для энергии кристаллической решетки гетерополярного (ионного) типа:
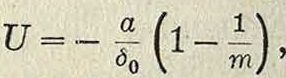
где U—энергия элементарного кубика, а— постоянная величина, <50—расстояние между одноименными ионами. Число т находится из коэф-та г сжимаемости К.
Фигура з.
Для решетки типа NaCl «=13,94е2 и т= 9 (е—заряд электрона). В дальнейшем Дебай и Шерер, исходя из наблюдений, что рентгеновские лучи отражаются как от внешних граней К., так и от внутренних его плоскостей, усеянных атомами (причем для моно-хроматич. лучей это отражение происходит лишь под определенными углами), пропускали узкий пучок лучей через маленький столбик порошка из кристалла и фотографировали действие столбика на прошедший пучок на пленке, свернутой в цилиндр (на оси этого цилиндра помещался столбик порошка). Оказалось, что получающиеся на пленке линии соответствуют пятнам лауе-граммы и что по этим линиям можно вывести структуру К. На основании изложенных методов была определена структура ряда веществ элементов и их соединений, причем этот способ позволил определить абсолютную величину междуатомных расстояний в кристалле (величину d в вышеприведенной ф-ле). Рентгенометрич. анализ строения К. приводит к следующим типам размещения атомов. Бблыная часть химических элементов кристаллизуется в кубич. и гексагональной системе (с преобладанием наиболее плотного расположения атомов). В кубич. системе наиболее плотное расположение атомов осуществляется в виде рг-шетки, параллелограмы которой имеют вид кубов с атомами в узлах и центрах граней. В гексагональной системе наиболее плотное расположение атомов получается при наслаивании перпендикулярно телесной диагонали куба. Кроме расположения по ку бу с центрированными гранями существует расположение по центрированному кубу с атомами и в вершинах кубических ячеек и в центре этих ячеек. К вышеизложенному нужно добавить, что величина d (расстояние атомов друг от друга) в К. каменной соли, структура которой точно выяснена, выражается соотношением^
d=2,814 А=Const.
Ниже приводятся характеристики структуры некоторых элементов.
1. По кубу с центрированными гранями.
| Элемент. | А1 | Са | Fey | Со | Ni | |
| Сторона кубич. в 10-8 СМ. | ячейки | 4,04 | 5,56 | 3,61 | 8,554 | 3,54 |
| Элемент. | Си | Ей | Pd | Ag | Ce | |
| Сторона кубич. в 10~8 см. | ячейки | 3,60 | 3,82 | 3,45 | 4,06 | 5,12 |
| Элемент. | 1г | Pt | Ан | РЬ | Th | |
| Сторона кубич. в ΙΟ*» СМ. | ячейки | 3,80 | 3,93 | 4,08 | 4,91 | 5,04 |
| 2. По | центрированному | кубу. | ||||
| Элемент. | Li | Na | Cr | Fe, | α,β,δ | |
| Сторона ячейки Элемент. Сторона ячейки | 3,50
Мо 3,14 |
4,30
Та 3,27 | 2,89 2 W К 3,15 5,20 | ,86
V 3,04 | ||
3. Наиболее плотное расположение гексагональной системы.
Элемент.. Be Mg Zn Cd Ti
a.. 2,29 3,22 2,670 2,960 2,97
c.. 3,62 5,23 4,940 5,600 4,72
da.. 1,58 1,624 1,860 1,890 1,50
Элемент.. Zr Ce Co Ru Os
a.. 3,23 3,65 2,514 2,686 2,714
c. 5,14 3,96 4,110 4,272 4,320·
da.. 1,59 1,63 1,633 1,590 1,590>
В последней табличке а обозначает размер ячейки по главной оси, с—по поперечной, с/а—отношение этих величин, равное отношению кристаллографии, осей. Элементы, относящиеся к одному столбцу периодич. системы, имеют вообще одинаковую структуру, наприм. одинаковое строение: 1) Li, Na, К, 2) Си, Ag,
Аи, 3) Zn, Cd, Hg и т. д. Наличие полиморфизма и другие причины вносят однако исключения в это простое правило. Элементы с металлоидным характером отличаются более сложной структурой. Важно отметить углерод. Алмаз имеет строение, элементарный объём которого изображен на фигуре 4. Нейтральные атомы в этом объёме расположены в кольца по шести, и каждый атом тетраэдрически окружен четырьмядру-гими (тип молекулярной, или гомеополяр-ной, решетки). Графит—другой структуры, гексагональной, еще не определенной точно. Сажа (аморфный углерод, по прежним воззрениям) оказалась кристаллическим телом графитовой структуры. Галоидные щелочные металлы и окислы щелочноземельных металлов построены по типу каменной соли за исключением CsCl, в котором атомы цезия занимают вершины кубической ячейки, а атом хлора—ее центр. Исследование структур кристалла сложного состава показало, что расположение атомов в кристалле может быть лучше всего согласовано с координационной теорией Вернера.
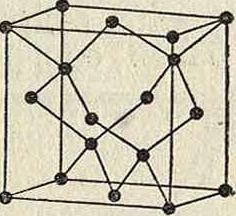
Фигура 4.
Лит.: By л ь ф Г. В., Кристаллы, их образование, вид и строение, Москва, 1926; Борн М., Строение материи, П., 1922; Иоффе А. Ф., Физика кристаллов, М.—Л., 1929; Френкель Я., Электрическая теория твердых тел, Л., 1924; Б per г В., Введение в анализ кристаллов, перевод с англ., М.—Л., 1930; В о г л М., Atom theorie des festen Zustandes, Lpz., 1923; Ewald P. P., Der mechanische Aufbau des festen KSrpers in atomistiseher Betrachtung, Miiller-Pouillets Lehrbuch der Physik, В. 1, T. 2, 11 Auflage, Braunschweig, 1929; GrothP., Elemente d. physik.u. ehem Krvstnllogranhie, Mch.—B., 1921. И. Мельников.