 > Техника, страница 56 > Критические явления
> Техника, страница 56 > Критические явления
Критические явления
Критические явления происходят при переходе двух сосуществующих фаз (однородных частей) системы веществ в одну фазу; при этом исчезает поверхность раздела, отделяющая фазу 1 от фазы 2, и гетерогенная (двухфазная) система становится физически гомогенной. Критическая точка, определяющая этот переход, характеризуется прежде всего критической температурой. При этой t° полярности обеих соприкасающихся фаз (смотрите Жидкости, Капиллярные явления, Полярность) сравниваются и поверхностное натяжение, σ1>2 на границе между ними обращается в 0. Менделеев (1861 г.) назвал Г
крит. Для случая жидкости и ее насыщенного пара температурой абсолютного кипения. Это—та наивысшая ί°, при которой может существовать еще жидкая фаза в равновесии со своим паром. При t°>l°Kpum. может существовать только ненасыщенный пар данной жидкости. Кроме t°Kplim, К. я. характеризуются еще критич. давлением рки критич. объёмом vk—объёмом, занимаемым 1 г (удельн. критич. объём) или 1 г-молеку-лой (молярный критич. объём) тела в критическом состоянии (tk, рк, см. Критическоесостоя-ние). рк есть наивысшее значение давления ps насыщен, пара (смотрите) данной жидкости, соответствующие t°Kpum. (фигура), то есть последней наивысшей точке кривой испарения р8=/(0-При t°<t°Kpum.ps зависит только от Г, а не от взятого количества жидкости т. При t°> t°Kpum. давление пара, ставшего ненасыщенным, зависит для данной 1°и от т, и кривые, полученные для разных т, совпадают до критическ. точки,а при t° > t°Kpum. расходятся веерообразно.На этом основан способ Нальете и Коллардо(СаШе1е1;
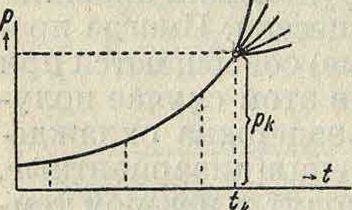
et Collardeau) для определения t°Kpum. и рк. С приближением 1° к ГКрит. разность удельн. объёмов сосуществующих пара и жидкости (г>2— Vj) стремится к 0, то есть прямолинейная часть реальной изотермы p=f(v)t (смотрите Газ) уменьшается до 0 при переходе от нижележащих изотерм к критической изотерме t°—Г крит.! на которой и обращается в точку (Эндрыос, 1869 г.). Т. о. критич. точка, точка перегиба на критич. изотерме, в которой касательная к кривой параллельна оси v, определяется условиями:
dv* др
dv
= о.
(1)
(2)
Отсюда термодинамически скрытая теплота испарения жидкости Q=T ~(v2-v1), как и внутренняя в 0 при ί°=ί°
Яг0,
dQi di
Qi=Q-P(.v2-Vi), обращаются крит. (Авенариус); при этом
Приняв ур-ие Ван-дер-Ваальса (смотрите Газ), легко выразить из условий (1) и (2) критич. величины через константы а, b и R:
vk=2> b;
гр _ а.
4 27 bR’
Рк 27 Ь2 ’
(3)
Обратно, определив из опыта Тк, рк, можно по (3) найти константы а, b. Величины —=со,
—=π, —=# называются приведенными
Рк Тк
величинами. Если ур-ие состояния заключает только 3 константы, то приведенное ур-ие, связывающее ω, π и &, не будет содержать никаких постоянных кроме числовых (смотрите Газ). Отсюда следует например, что для всех веществ s =
RTK
РкП
-=|=2,67 должен быть одинаковым; s называется критическим коэфициентом;в действительности он изменяется для нормальных (неассоциированных) жидкостей (смотрите) от 3,6 до 4, для ассоциированных же s>4 (до 5). Так как в критич. точке=оо, то критический об ем (плотность) не может быть определен со сколько-нибудь значительной точностью; поэтому vk определяют графически по закону прямолинейного диаметра Нальете и Матиа. Нанося в диаграмме (Т, d) плотности сосуществующих жидкости d1 и ее насыщенного пара, d2 (ортобарич, плотности), найдем, что точки со средними ординатами расположены по прямой, которая своим пересечением с кривой (d, Т) определит критич. плотность. Вблизи t°Hpum_ мениск, отделяющий-жидкость, заключенную в трубку, от ее: насыщенного пара или от 2-й жидкой фазы, исчезает, становясь плоским: избирательное-смачивание стенки В=cos Θ (где в—краевой угол мениска со стенкой трубки) обращается в 0; кроме того вблизи критич. точки появляется характерная опалесценция (критич. муть); все это и позволяет определять 1°крит. оптич. методами. Так. как Гкрит. смешения двух фаз (например двух жидкостей) определяется тем, что поверхностное натяя-сение на разделе между ними обращается в 0 и они становятся взаимна безгранично раство-
римыми, то вещества, понижающие поверхностное натяжение (поверхностно-активные вещества, см. Капиллярные явления), резко понижают 1°кРит., увеличивая взаимную растворимость обеих фаз. В таблице приведены
Критические величины для некоторых веществ.
| Вещества | Т°крит. | П в см?/мол | Рк в atm |
| Гелий. | 5,2 | 60 | 2,3 |
| водород. | 33,1 | 60 | 12,8 |
| Неон. | 44,75 | 44,3 | 26,9 |
| Азот. | 126 | 84 | 33,5 |
| Воздух. | 132,5 | 83 | 37,2 |
| Аргон. | 149,7 | 78 | 48 |
| Кислород. | 155 | 73,6 | 49,7 |
| Углекислый газ | 304 | 100 | 72,9 |
| Этиловый эфир | 466,5 | 285 | 36 |
критические величины для некоторых веществ. При смешении двух жидкостей в некоторых случаях кроме верхней 1°крит. наблюдают еще и нижнюю критич. точку; при ί°, лежащих между ними, смесь расслаивается на две фазы; вне этой области система гомогенна.
Лит.: Van der Walls J. D., Over de Conti-nuiteit van der Gas en Vloeistoftoestand, Leiden, 1873; van L a a r J. J., Zustandsgleichung von Gasen und Fliissigkeiten, Lpz., 1924; Kammerlingh-On-nes H. u. Keesom W., Die Zustandsgleiclmng, Enzyklop. d. matbem. Wissenschaften, B. 5, T. 1,H. 5, Leipzig, 1912; Van der Walls J. D., Lehrbuch d. Thermodynamik, 2 Aufl., Leipzig, 1928; Van der Waals J. D., Zustand d. gasformigen u. flilssigen Korper, Handbuch d. Physik, hrsg. v. H. Geiger u. K. Scheel, B. 10, p. 126, Berlin, 1926; Mathias E., Le point critique des corps purs, Paris, 1904; Joung S., «Philosophical Magazine», London, 1900, series 5, v. 50, p. 291. П. Ребкндер.