 > Техника, страница 56 > Критическое состояние
> Техника, страница 56 > Критическое состояние
Критическое состояние
Критическое состояние, состояние двухфазн. (замкнутой) системы веществ, при к-ром малое повышение ί° в системе вызывает исчезновение различия между фазами.
Однокомпонентная система с фазами: жидкость и пар. При нагревании жидкости в закрытой трубке в зависимости от отношения объёмов жидкости и сосуда возможны три случая: 1) вся жидкость превращается в пар, 2) вся трубка заполняется жидкостью, 3) при определенной критической темп-ре (Т°крит=1°криот.+ +273,2) м е н и с к, то есть поверхность раздела фаз, исчезает; этой темп-ре отвечают определенные критич. давление ркрит. и критич. уд. объём vKpum, (смотрите Критические явления); система находится при этом в К. с. При t° >1°хрит. система находится в газообразном состоянии и никаким давлением не м. б. превращена в жидкость. Теоретически К. с. может наступить при строго определенном количестве вещества в трубке, определяемом критич. уд. объёмом vKpum/, практически К. с. наблюдается и при значительных отклоне-. ниях объёма трубки от того, к-рый отвечал бы критич.объёму, причем если объём трубки меньше критического, то исчезновение мениска происходит выше середины трубки, и обратно. Объясняется это явление действием силы тяжести на систему в К. с. На изотерме, отвечающей /%Мт.(фигура 1) в крит. точке (р=РкРит. и »=v».), касательная к изотерме параллельна оси абсциссткрит на этом отрезке изотермы сжимаемость си стемы (fjj)r огромна, вследствие чего под влиянием силы тяжести критическое состояние может наступить на определенной высоте, между тем как выше этого места плотность заметно меньше, а нижд — заметно больше критич. плотности. Очевидно, что опытное осуществление К. с. возмсжно только благодаря силе тяжести.
Если нагревание трубки производить без перемешивания ее содержимого, то в месте исчезновения мениска наблюдается ненормальность в преломлении света, сохраняющаяся и при 1° на несколько градусов выше, чем t°Kpum.; при понижении t° до пачала конденсации образуется туман в том месте, где раньше был мениск; косвенными и прямыми опытами доказано, что после исчезновения мениска в однородной на вид системе плотность вещества там, где была раньше жидкость, значительно больше, чем там, где был пар; это различие не зависит от силы тяжести, так как наблюдается и в U-образной трубке. Эти ненормальности с течением времени сглаживаются, но полностью пе исчезают; очевидно, что момент исчезновения мениска не отвечает устойчивому К. с., которое наступает или по истечении длительного времени или при помешивании системы; отметим, что, чем чище вещество (отсутствие примеси постоянных газов), тем менее резко выражены эти ненормальности, однако полностью объяснить эти явления примесями едва ли возможно. В случае равновесного К. с. при t° немногим выше t°Kpum. наблюдается голубая, а при охлаждении белая опалесценция. Смо-луховский показал, что это явление объясняется неоднородностью газа, то есть флуктуациями (колебаниями) его плотности в критической области.
В К. с. системы жидкость—пар: 1) —
конечна, 2) (v2 — ν,)= Δυ=0; 3) полная и внутренняя скрытые теплоты испарения равны 0, то есть теплота перехода из жидкого в парообразное состояние равна нулю и не только объёмы, но также и энергия жидкости и пара равны. При 1°ктш. поверхностное натяжение σ жидкости обращается в нуль (Д. И. Менделеев).
Возможность существования перегретой жидкости и переохлажденного пара привела Джемса Томсона к мысли о теоретич. непрерывности изотермы системы жидкость— пар; простейшее выражение эта мысль нашла в теории, и в частности в ур-ии Ван-дер-Ваальса:
(р+Й. (»-Ь)=ЛТ,
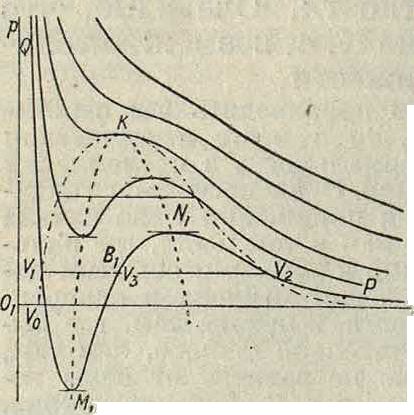
где а и Ь — индивидуальные постоянные вещества и R — газовая постоянная. На фигуре 1 изображены: практическая изотерма QViV2P (QVi—ветвь жидкости, V2P—ветвь пара, VXV2—разрыв сплошности) и теоретич. изотерма QV гВ,2V2Р, где ветвь V1M1
отвечает метастабильному состоянию жидкости (перегретая жидкость), ветвь V2N1— такому же состоянию пара (переохлажденный пар), ветвь M1B1N1—лабильному (нере-ализируемому) состоянию системы. Каждой ί° отвечают три уд. объёма: ν±—жидкости, ν2—пара и ν3—лабильного состояния. При повышении f° разрыв сплошности уменьшается и в критической точке сходит нанет; здесь все три уд. объёма сливаются.
К. с. характеризуется строго определенными значениями t° и давления; следовательно с точки зрения правила фаз такое состояние является нонвариантным, к-рое требует в однокомпонентной системе наличия трех фаз; здесь мы имеем предельный случай слияния трех фаз: жидкой, лабильной и парообразной; экспериментально лабильное состояние системы жидкость—
пар реализуется только в К. с. Факт существования К. с. как нонвариантного доказывает правильность концепции о теоре-тич. непрерывности изотермы системы жидкость—пар. С термодинамич. точки зрения вся ветвь QM1 (фигура 1) отвечает устойчивому равновесию, причем QV i—стабильная, V1M1—метаста-бильная часть с точки зрения опыта; то же относится к ветви пара jV^jP. Положение прямой ViVz, то есть точек разрыва, определяется правилом Максвелла (вытекающим из второ-Фигура 1. го начала термоди намики), по которому площадь УхМ^уз равна площади V3Геометрическое место точек, аналогичных точкам Fj и F2,—кривая V0KV3—носит наименование граничной, или б и иода л ь н о й, кривой (бинодаль). Точки,
аналогичные М1 и Nlt в которых (§f)T= О,
являются границами устойчивого и неустойчивого состояния системы; геометрическое место их—кривая M1KN1—для однокомпонентных систем является спинодаль-ной кривой (спинодаль). Бинодаль и спинодаль соприкасаются в критич. точке.
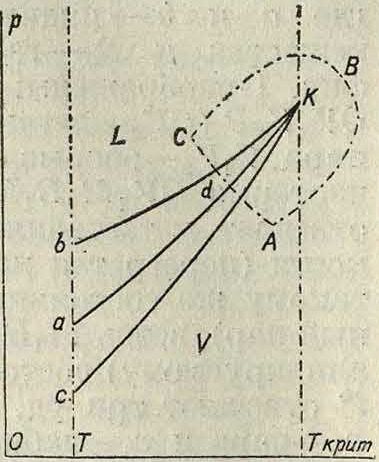
Непрерывный переход от жидкого к па-ро-(газо-)образному состоянию возможен не только теоретически по изотерме, но и опытным путем—путем обхода вокруг критич. точки: нагреваем пар в точке JP при постоянном объёме; при t° выше критической уменьшаем объём при давлениях, больших чем VKpum., придем в точку Q, где система находится в жидком состоянии; на этом пути от пара к жидкости нет разрывов сплошности в свойствах системы. Еще рельефнее это явление сказывается на диаграмме температура—давление (фигура 2). Здесь аК— кривая упругости пара данной жидкости (устойчивое стабильное равновесие жидкости и пара), ЬК— граничная кривая метастабильности пара, сК—то же жидкости.
В области V существует только пар, в области L—только жидкость. Выше Т°критсостояние системы— газообразное. Кривые оканчиваются в кри-тическ. точке К; с ма-тематич. точки зрения точка К есть особая точка, что вызывает ряд особенностей в свойствах ф-ий от р и Т, например многозначность термодинамической ф-ии ζ в области ЬКс. На фигуре 2 показаны два опытных перехода от пара к жидкости: прерывный АС и непрерывный АВС.
Однокомпонентная система с твердой (кристаллической) и жидкой фазами. По вопросу о существовании К. с. такой системы мнения расходятся. Пойнтинг, Планк, Оствальд, Ван-Лаар высказываются за существование такого состоянияв области очень высоких температур и давлений; Тамман и его школа—против. Тамман дал теорию максимума, согласно которой кривые взаимного превращения твердой и жидкой фаз должны быть замкнутыми кривыми, следовательно кривая плавления должна проходить через максимум. Опытные данные в пределах до <° 200° и до 10 000 к г/см2 давления не решают вопроса. С термодинамической точки зрения критич. теория основывается на допущении единой ^-поверхности для данного вещества; существование различных фаз — результат многозначности f-поверхности, геометрически—результат самопересечения поверхности. Теория Таммана основывается на допущении независимости f-поверхностей разных твердых фаз данного вещества. Одна термодинамика решить спора не может, так как обе теории ей не противоречат.
Двукомпонентная сист.ема сфазами: жидкост ь—п а р. С
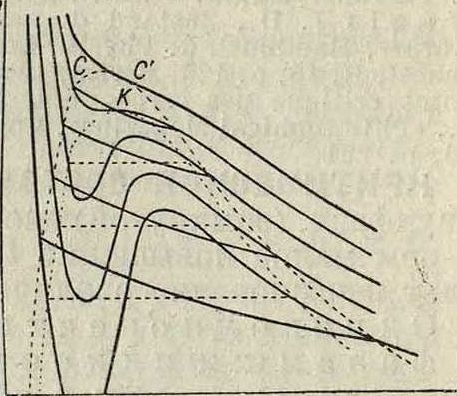
точки зрения правила фаз К. с. бинарных смесей моновариантно (два компонента и три слившихся фазы), откуда вытекают крупные отличия К. с. таких систем от К. с. индивидуального вещества. Фигура 3 показывает в диаграмме (р, υ) изотермы бинарной смеси; особенности здесь следующие. Кривые разрыва сплошности (переход от жидкости к пару) не горизонтальные прямые, а кривые высших порядков; это отвечает факту, что составы жидкости и пара бинарной смеси при данных темп-ре и р различны, при данной 1° жид-кость и пэ.р ОДИ- Фигура 3.
накового соста-
ва обладают разными давлениями. Критич. точек у бинарной смеси две. Первая критич. точка С, в ней состав и плотности обеих фаз совпадают, то есть обе фазы делаются идентичными, однако это происходит не при наивысшей ί°, при которой существуют двухфазные состояния. Крайняя изотерма, отвечающая ί°, выше которой существует только газообразное состояние, касается граничной кривой (бинодали) во второй критической точке С. Точечная кривая, проходящая через К, показывает изотермы мыслимого индивидуального вещества с теми же константами Ван-дер-Ваальса, которые свойственны данной смеси. В случае индивидуального вещества спинодальная кривая—граница устойчивых состояний—совпадает с кривой—геометрии. местом точек, где (|f)y=0; У бинарных смесей это две отдельные кривые. Спинодальная кривая, отделяющая устойчивые состояния от неустойчивых, соприкасается с би-нодальной в первой критич. точке; кривая
(H)y=0 у смесей полностью лежит внутри I спинодальной кривой.
На фигуре 4 показано, как изменяются уд. объёмы V с составом смеси (х—концентрация второго компонента смеси) при данной темп-ре t (р—переменно) в критич. области. Здесь взята Г, которая превышает t°Kpum. ряда смесей, богатых более летучим вторым компонентом. Прямые типа р,р2, q1q2, r1r2—т. н. н о д ы, или к о н н о д ы, соединяют составы и удельные объёмы жидкости и пара, находящиеся в равновесии: жидкости р, отвечает пар р2. При переходе к смесям, более богатым вторым компонентом, ноды сильно изменяют направ-
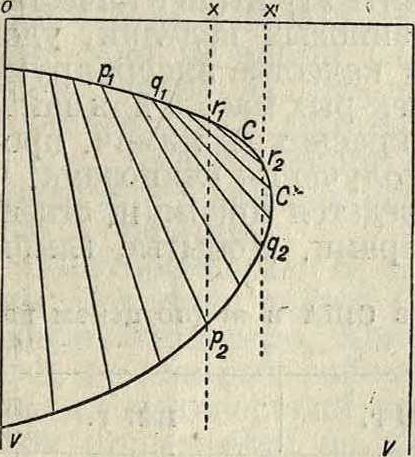
Фигура 4.
верхняя влево от ление, становятся все короче и схо-дят нанет в первой критической точке С. Вторая критич. точка С отвечает двухфазной смеси с максимальным содержанием второго компонента при данной темп-ре. Нижняя ветвь бинода-ли до С—граница стабильного пара,
__.. __ С—граница жидкости.
Раздвоение критической точки у бинарных смесей влечет за собой следующее следствие для смесей, состав которых лежит между составами, отвечающими точкам С и С. Возьмем пар смеси состава х в состоянии, отвечающем точке ниже q3, и подвергнем его изотермическому сжатию. Под влиянием давления объём пара станет уменьшаться, в точке qа появятся первые капли жидкости состава qt· по мере повышения давления (уменьшения объёма) количество ^жидкости сначала будет увеличиваться, пройдет через максимум, потом станет уменьшаться, и наконец в точке г2 жидкость исчезнет, так как г2 лежит на парообразной ветви бино-дали. Такого рода явление носит название обратной конденсации первого рода.
Пример. Смесь хлористого метила, СН,С1, и углекислоты, С02, (состава 41% С02; 69% СН2С1) при 105° (р—давление в atm, υ—объём жидкости, г·,— общий объём пара и жидкости в см3): р в atm.
Vl в см3
V в см3.
| 73,3 | 77,2 | 81,8 | 82,4 | 83,1 | 83,5 | 83,8 |
| 117,9 | 99,6 | 81,0 | 78,6 | 77,3 | 75,4 | 74,0 |
| 0 | 3,9 | 8,6 | 7,6 | 4,3 | 2,8 | 0 |
В тех случаях, когда вторая критическая точка G лежит выше первой С, у смесей между С и С наблюдается обратная конденсация второго род а: в результате изотермическ. повышения давления на жидкую смесь образуется пар, его количество проходит через максимум, потом он исчезает. Такие случаи более редки и труднее наблюдаемы (например: вода-(-пропил овый ).
Из ряда других особенностей отметим еще следующее баротропич. явление. Направление жидкой ветви бинодали и взаимное положение критическ. точек С и С м. б. таким, что точка C будет на диаграмме справа, но выше С; тогда крайние ноды будут наклонены вниз не слева направо, а обратно; это значит, что пар, находящийся в равновесии с жидкостью, удельно тяжелее жидкости и жидкость будет плавать на слое газа. При мер: в смеси водорода и гелия при —253° и 49 atm жидкая фаза плавает на газовой.
Для целей техники явления К. с. в области смесей (сжижение газов) более важны, чем такие же явления у индивидуальных веществ, так как с последними техника имеет дело крайне редко. Изучение, этой области требует знакомства с учением о термодина-мич. поверхностях. Явления К. с. в случае тройных смесей, где оно бивариантно, очень сложны; начало их изучения положено трудами Ван-дер-Ваальса. См. Газ.
Лит.: РаковскийА. В., Теоретические исследования по вопросу о взаимных превращениях фаз, «Вестник Ломоносовского физ.-хим. об-ва», М., 1926,т. 2, вып. 2; Van der WaalsJ.D. u. Kohnstamm Ph., Lehrbuch d. Thermostatik, В. 1, 2, Leipzig, 1927; К u e n e n J. P., Theorie d. Verdampfung u. Verfliis-sigung von Gemisehen u. d. fraktionierten Destination, Lpz., 1906. А. Раковский.