 > Техника, страница 59 > Магний
> Техника, страница 59 > Магний
Магний
Магний, Mg, химич. элемент; щелочноземельный легкий металл 2-й группы перио-дич. системы (аналог кальция, стронция и бария); ат. вес 24,32; порядковый номер 12. Массы изотопов 24, 25, 26; количественное соотношение их 6:1:1.
Свойства М. В чистом виде М. серебристо-белого цвета; уд. вес 1,74. В нагретом состоянии металлич. М. вытягивается в проволоку и раскатывается в ленту; 1°пл. 650°, г°К!га. около 1 100°, ат. объём 14,1; коэф. сжимаемости при 20° 2,8 -10~6 кг/см2; модуль Юнга 0,4· 106 кг/см2, коэф. линейного расширения (при ί°= 20-1-100°) 0,00002673; твердость по Мосу 2,6, по Бринелю 25. Сопротивление на разрыв 20 килограмм!мм2·, удельная теплоемкость при 100° 0,257; ат. теплоемкость при 100° 6,25; объёмное электрическое сопротивление 4,4·ΙΟ-6 Ω-см (при 0°), Г-ный коэф.(372-Η42)· 10-5. В химич."соединениях М. двувалентен. На воздухе он легко окисляется, покрываясь белой окисью М.; нагретый несколько выше М. загорается и горит ослепительно ярким белым пламенем. При соединении М. с кислородом выделяется значительное количество энергии
2Mg+ 02=2MgO + 288 Cal.
Образовавшаяся окись М., MgO, не плавится и слабо испаряется при процессе горения, что обусловливает высокую t° горения и излучение весьма активных в химич. отношении фиолетовых и ультрафиолетовых лучей. С азотом М. соединяется также с выделением тепла и образует при этом нитрид М., Mg3N2.
М. способен гореть в атмосфере углекислого газа, разлагая С02 с выделением свободного углерода. Такое же восстановительное действие М. оказывает и на окислы бора, кремния и титана, вследствие чего М. можно пользоваться для получения этих элементов в свободном виде. Воду при нагревании М. медленно разлагает; в присутствии NH4C1 выделение водорода становится энергичным вследствие растворения образующегося слоя гидрата окиси М. Так же ускоряется реакция М. с водой в присутствии хлорной платины. Крепкая серная кислотаисмесь крепкой серной и дымящей азотной к-т не реагируют на холоду с М. Едкие щелочи реагируют с М. только в присутствии солей аммония. При нагревании в атмосфере хлора и брома, а также в парах серы и иода магний воспламеняется.
В природе М.встречается в весьма значительных количествах (2,5% веса всей земной коры) в виде карбоната (магнезит MgC03) или вместе с карбонатом кальция (доломит MgC03· СаС03), образуя мощные пласты горных пород, а также в виде разнообразных силикатов: талька (смотрите Жировик), асбеста (смотрите), серпентина (смотрите Змеевик), морской пенки, пемзы, авгита, оливина, роговой обманки, борацита. Растворимые соли М. (хлористая и сернокислая) находятся в громадном количестве в морской воде, в отложениях калийных солей в Стассфурте, образуя так называется отбросовые соли, а также в Соликамских отложениях (смотрите Калийная промышленность); громадное количество солей М. содержится в Мертвом море (Палестина), где запасы их исчисляются в 22 млрд, те, и в СССР в Сакском озере (близ Евпатории). В зеленых растениях М. содержится в качестве необходимой составной части хлорофилла, участвуя в связывании пирро-ловых ядер последнего и играя весьма важную роль в процессе первоначального синтеза органич. веществ из углекислого газа и воды; кроме того в семенах растений М. содержится в виде фосфорнокислой соли.
Получение. Металлич. М. может быть получен из его соединений различными путями: а) действием паров натрия или калия на хлористый М. в вакууме, б) восстановлением MgCl2 в атмосфере газообразного водорода, в) восстановлением MgO действием металлического натрия, алюминия или кальция, г) из расплавленных галоидных солей Mg, смешанных с NaCl, действием металлич. калия или натрия и наконец д) электролизом Mg-солей или окиси М. (см .ниже—металлургия М.).
Восстановление окиси М. дейстгием угля было предложено еще в 1907 году Слейдом, к-рый рекомендовал проводить этот процесс в вакууме при ί° 1 700° или в атмосфере водорода. В 1915 г. Ковальке и Гревфель описали чрезвычайно энергично протекающую реакцию между ачесоновским графитом и окисью М. при 1° 2 030°. Вскоре после этого Блеккер и Мориесон предприняли попытки получить технически по этому методу металлич. М. В виду обратимости реакции восстановления MgO они проводили ее в вакууме и в токе водорода; при этом 20% М. получалось в виде сплавленного металла, а остальное в виде порошка. В1919 г. в США было испытано действие кремния при 1° 3 500° на смесь обожженных доломита и магнезита: при этом получаются металлич. М. и двойной силикат Са и Mg. Восстановление окиси М. химич.путем, применявшееся в Англии в 1915 г., не могло выдержать конкуренции с электрич. методом, т. к. исходило из сравни-
тедьно дорогого исходного продукта—жженой магнезии. Однако в 1921 году Вальдо вернулся к предложенному еще в 1913 году Матиньоном методу восстановления окиси М. при ί° 1 200° в вакууме действием металлич. алюминия; в виду технических затруднений, связанных с осуществлением высокотемпературного вакуума, этот метод не получил распространения. Наиболее употребительным методом получения М. является электролиз хлористого М. (смотрите ниже) с прибавлением или без прибавления хлоридов щелочных металлов.
В 1890 г. был впервые применен метод Фишера и Грецеля, основанный на электрохимич. разложении безводного сплавленного карналлита. Вплоть до1914 г. вся мировая потребность в металлич. М. удовлетворялась двумя герм, заводами в Гемелингене и Биттер-фельде, поблизости от Стассфуртеких месторождений карналлита, причем заводы хранили в тайне применяемые ими методы электролиза. В 1915 г. франц. об-во Society d ’EUectrochimie на заводе в Клаво стало также производить металлич. М. Первоначально электролизу подвергали сплавленную смесь MgCl? и Mgs,; в 1907 году Вебер показал, что более выгодной для электролиза является смесь, содержащая эквимолекулярное количество фтористых солей М. и бария, в которой растворена окись М. Согласно этому принципу аме-рик. об-во American Magnesium Согр. (завод на Ниагаре) сконструировало электролизер, работающий с нагрузкой 9 000—13 000 А при напряжении 9—16 V и дающий продукт с весьма незначительным содержанием примесей. Электролитом служит расплавленная смесь фтористого М. с MgO; эта смесь, растворяясь в незначительном количестве (0,1 %) в сплаве, является тем электролитом, к-рый и подвергается электролизу с выделением металлич. М.; последний очищают путем перегонки из небольших реторт. Полученный по этому методу М. обладает достаточной стойкостью к атмосферным воздействиям, действию горячих щелочей и плавиковой к-ты. Один из герм, типов электролизера состоит из ванны литой стали, обогреваемой извне голым огнем; стенки ванны играют роль катода; графитовый анод проходит вдоль оси ванны. В других системах, наоборот, анодом служат графитовые стенки электролизера, катод же расположен вдоль оси ванны и представляет собой либо «прикасающийся» электрод (способ заводавБиттерфельде), либо образует колокол, в к-ром собирается выделившийся металлич. М., либо наконец катод погружен в тигли, из которых металлич. М. вследствие своего низкого уд. в всплывает на поверхность смеси расплавленных солей. Опубликованы также патенты на применение жидких металлич. катодов из свинца (пат. Ашкрофта) и из меди (пат. Зе-варда); получаемый сплав М. поступает в другой электролизер, где он уже играет роль катода и где получается в чистом виде. Согласно Ам. П. 1258261 смесь хлористых М. и калия подвергают в сплавленном состоянии электролизу с угольным анодом при катоде из расплавленного олова или меди; из катодного сплава Л. выделяется, а основной металл катода снова пускается в дело. Во второй стадии сплав М. применяется уже в качестве анода в ванне прежнего же состава, но с прибавлением хлористого бария. При вторичном электролизе М. из анода переходит в раствор и отлагается затем на катоде, который устроен таким образом, что отделившийся М. всплывает на поверхность электролита. Б. Бериенгейм.
Применение М. Металлич. М. применяется в лабораторной практике в качестве восстановителя и для получения т. и. магний-органич. соединений, "играющих большую роль в органич. синтезе (смотрите Металлоорганические соединения и Грииъяра реакция). Кроме того М. применяется для магниевых вспышек при фотографировании, для изготовления ракет, для восстановления других металлов и вытеснения их из их соединений, а также в качестве раскислителя, для получения лучших отливок в цветной и черной металлургии. Главное применение М., к-рое в последнее время принимает все более возрастающие размеры, а в ближайшем будущем обещает внести громадные перемены в области авиационного и автомобильного строительства, состоит в использовании металлич. М. наравне с алюминием, а в последнее время и с бериллием для производства т. наз. легких сплавов (смотрите Спр. ТЭ, т. II).
Особо замечательным сплавом, применяемым для последних целей, является т. н.
«электрон» с содержанием М. до 96% (смотрите Магния сплавы). Чрезвычайно низкий уд. в этого сплава (ок. 1,8), наряду с достаточной механич. прочностью, обеспечивает этому материалу широкое поле применения. В настоящее время электрон выпускается на рынок в виде болванок·, брусьев, труб, профильного металла, листов. Из него изготовляют штампованные, кованые части, отливки, сделанные в изложницах, под давлением, или в песок. Наряду с легковыми машинами колеса из электрона применяются при постройке и более тяжелых автомобилей. Сравнение веса колес из электрона с колесами из стального литья дает следующие результаты в пользу электрона: скат (то есть все 4 колеса) омнибуса в случае применения электрона весит 128 килограмм, а в случае стали 364 килограмма. В типе автомобиля фирмы Адлер «6» и типе «8» электрон применяется также в целом ряде более мелких отливок, в результате чего вес автомобиля м. б. уменьшен на 100—140 килограмм, что позволяет соответственно увеличить полезную нагрузку. В авиастроительстве электрон используется для изготовления частей моторов летательных машин; так, при построении гидроплана фирмыхЧвоНаГгавМш» в Милане мощностью в 500 IP чрезвычайно широко было применено электронное литье-Па ряду с этим были произведены в Германии тщательные (длившиеся около 1 года) опыты для выяснения возможности применения листового электрона для изготовления других деталей аэроплана (кожухов, охладителей дисков, колес, подпорок ходовых частей). Испытания дали вполне удовлетворительные результаты.
Кроме указанных областей применения электрона необходимо указать на самые широкие возможности применения этого сплава в точном машиностроении, как то: при производстве текстильных, обувных, типографских, табачных и других машин.
Металлургия М. В настоящее время известны два промышленных способа получения металлич. Μ.: 1) электролиз расплавленного безводного хлористого магния и 2) электролиз окиси М., растворенной в расплавленной смеси фтористых солей М., бария и натрия. Электролитический процесс в слагав применения хлористой соли М. протекает очень гладко и трудностей не представляет; в противоположность этому электролиз окиси М., патентованный в США еще во время войны 1914—18 гг., несмотря на кажущиеся преимущества, обладает рядом недостатков, из которых главные—трудность работы при t° процесса, лежащих всего на 150—200° ниже точки кипения М., и высокий удельный расход электрич. энергии. Слабым местом первого способа является некоторая сложность изготовления безводного хлористого М. Продажный препарат, получаемый путем переработки находящегося в больших количествах в природе карналлита КС1 MgCl2-6 Н20 (смотрите Калийная промышленность), всегда содержит шесть частиц кристаллизационной воды (MgCI2-6 Н20), которая перед электролизом должен быть нацело удалена. Простое нагревание шестиводной соли не приводит к цели. При этом соответственно различным температурам имеют место следующие реакции:
MgClo · 6 H20-»MgCl2 · 2H20 при t° 150° (1)
MgCl2-2H20^MgCl2-H20 » » 225° (2)
MgCl2-H20->-2MgCl2-Mg0H20 » » 280° (3)
2MgCl2-Mg0-H20->Mg0-MgCl2 » » 465° (4)
В результате получается неплавкая хлорокись М., которая совершенно непригодна для электролиза.
В настоящее время обезвоживание хлористого магния производится следующими способами: 1) действием на него хлористого аммония, 2) действием сухого хлористого водорода и 3) действием хлора на смесь, состоящую из частично обезвоженного MgCl2 с углем или каким-нибудь углеродистым материалом. Все эти способы требуют наличия повышенной t° (350—600°), и какой бы из них ни применялся—полный цикл обыкновенно состоит из 3 последовательных стадий. Сначала шестиводный хлористый М., согласно реакции (1), превращают в двухводный продукт. Эту операцию производят прямым нагреванием материала на сковородах, в чренах или вращающихся сушилах, при t° не выше 180°. Иногда применяют продувание сухим воздухом при тех же Г-ных условиях. Дальнейшее удаление воды достигается различно в зависимости от принятого способа. В случае применения хлористого аммония смесь его с двухводным хлористым М. нагревают, постепенно повышая f°; при этом удаляется вода, и образующиеся согласно реакциям (3) и (4) хлорокиси действием хлористого аммония превращаются обратно в хлористый М. В результате получается безводный продукт, при дальнейшем повышении 1° до 711° (третья стадия обезвоживания) плавящийся в прозрачную легкоподвижную жидкость, которая и применяется в качестве электролита. Избыток взятого хлористого аммония улетучивается; он м. б. уловлен в соответствующем конденсаторе и вновь пущен в дело. Анализ MgCl2, полученного таким способом, показывает, что продукт является весьма чистым: он содержит 96,7% MgCl2, 0,8% СаС12, 0,5% NaCl; 0,8% КС1 и 0,8% нерастворимого остатка. В случае обезвоживания при помощи хлористого водорода последний пропускают через находящийся в соответствующей реторте нагретый MgCl2 · 2Н20. Применяется также и способ Hulin, согласно которому удаление воды производится совместным действием тепла и НС1, получаемого сжиганием в печи газообразной смеси хлора и водорода. Этот способ также дает весьма чистый хлористый М., ибо образующаяся в процессе обезвоживания хлорокись магния действием НС1 переводится обратно в хлористую соль. В случае применения хлора его пропускают через смешанный с углем двухводный хлористый М. при ί° до 600°. Возможность образования хлорокиси здесь устраняется наличием хлора и водяного пара (получаемого в процессе обезвоживания) в присутствии угля. Приготовленный двумя последними способами безводный хлористый М. представляет пористую кусковую массу, которая энергично поглощает влагу из воздуха; вследствие этого продукт до электролиза должен обязательно подвергаться плавлению. Безводный плавленый MgCl2 стараются получить в возможно больших кусках, чтобы при укупорке или вскрытии тары—во всех случаях, когда MgCl2 хотя бы на короткое-время соприкасается с воздухом,—влияние влаги было минимальным.
Нек-рые з-ды, в особенности германские, а в последнее время и американские, применяют в качестве электролита или безводный карналлит или двойную соль хлористого М. и хлористого натрия. Удаление кристаллизационной воды из указанных двойных солей достигается значительно легче, чем из чистого хлористого М. Здесь достаточно, после предварительного высушивания до двухводного продукта описанным выше способом, дальнейшее его нагревание при постепенном повышении температуры до 450° ; при этой ί° смесь безводных солей плавится, после чего некоторое время ее выдерживают в расплавленном состоянии, чтобы дать возможность взвешенным в расплавленной массе частицам окиси и хлорокиси М. осесть на дно.
Применяемые в качестве электролита хлористый М. или карналлит должны содержать возможно меньшее количество вредных примесей, как то: окиси и хлорокиси М., сульфатов, кремнекислоты и особенно соединений железа. Для разрушения сульфатов-после расплавления безводных солей в тигель засыпают некоторое количество угольного порошка. При перемешивании массы, например угольным стержнем, происходит восстановление сернокислых солей, в результате чего образуется окись М., которая осаждается на дно тигля; тогда совершенно прозрачный электролит осторожно сливают с осадка. К электролиту необходимо добавлять до 5% фтористого кальция, что способствует соединению отдельных капель М., получающихся в результате электролиза, в более крупные «болотца» и повышает уд. в электролита, облегчая всплывание металла на поверхность.
Приготовленный тем или иным способом безводный хлористый М. или карналлит подвергают электролизу. Процесс ведется в аппаратуре различного типа. Детали способов держатся предприятиями в строжайшем секрете. На фигуре 1 представлена ванна американского типа для электролиза двойной хлористой соли М.и натрия. Котел литой стали А диам. ок. 50 сантиметров помещен в небольшой печи В с угольным отоплением. Этот котел служит катодом—на его стенках во время электролиза осаждается М., всплывающий на поверхность. Верхняя часть котла накрыта колпаком С из огнеупорного материала. Нижней кромкой колпак лежит в кольцевом углублении, заполненном порошкообразным материалом (например NaCl), препятствующим прониканию хлора наружу. В центральной части колпака имеется отверстие, сквозь к-рое проходит в ванну графитовый анод D диам. 15 см. Труба Е соединяет колпак с магистралью и служит для отвода хлора. Через отверстие F, сбоку снабженное заслонкой, производится извлечение металла из ванны и добавление свежего MgCl2 по мере его израсходования. Вычерпывание магния из ванны производится при помощи перфорированной железной ложки (диам. дыр 0,8 миллиметров). Ванна работает при силе тока в 2 200 А; напряжение 6—9 V; наивыгоднейшая темп-ра 700—725°. Суточная производительность—18 килограммМ., что отвечает выходу по току в 75% и удельному расходу энергии 22— 23 kWh. Удельный расход MgCl2 6 Н20 составляет ок. 15 килограмм. Магний, полученный изкарналлитаили из двойной соли с хлористым натрием, со-держитнек-рую при-
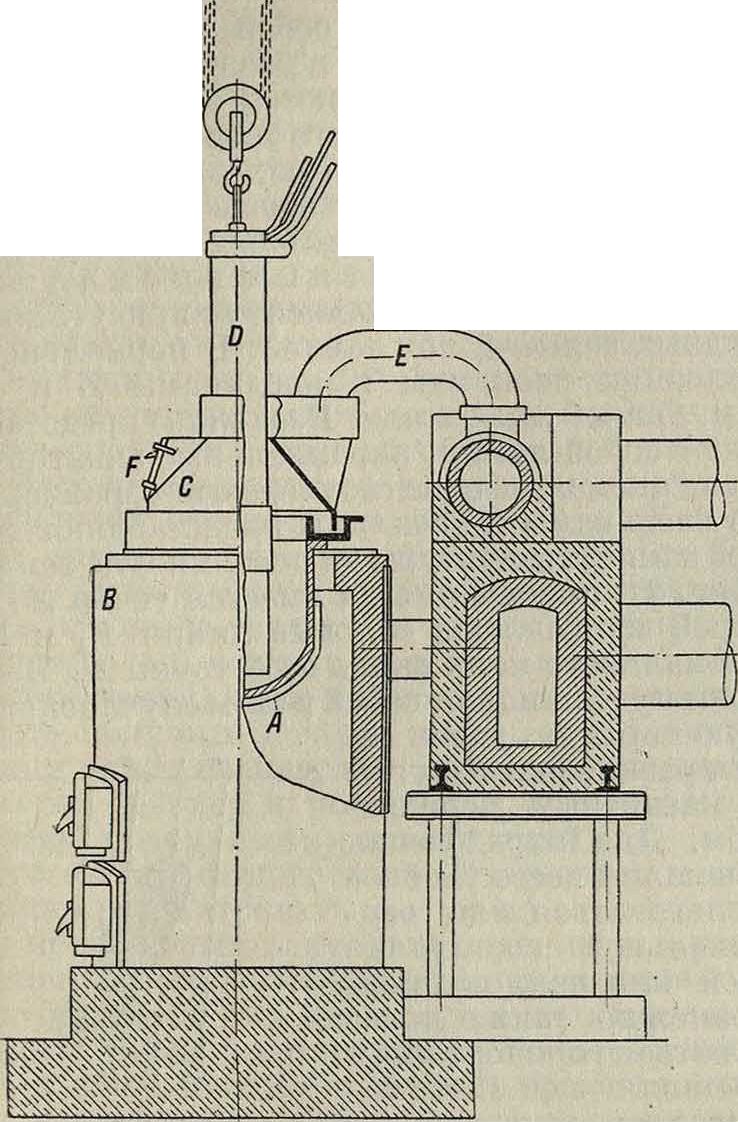
Фигура 1.
месь калия или натрия (0,1—1,15%), способствующую коррозии; поэтому металл подвергают рафинировке влажным воздухом с целью удаления щелочного металла и разложения включений электролита. Применение MgCl2 вместо карналлита дает М. очень высокой чистоты, не требующий переплавки. В состав металла, полученного прямо из ванны, входят: 0,04% Si, 0,02% Fe, 0,07% AI, 0,03.% Cl, остальное—Mg.
Другой метод электролитич. получения М.—электролиз окиси М., растворенной (и гл. обр. взвешенной) в расплавленной смеси фтористых солей магния, бария и натрия— представляет преимущества по сравнению с электролизом хлорида в том отношении, что здесь отпадает сложная и дорогая операция обезвоживания электролита. Углекислый магний (смотрите Магния соединения), встречающийся в природе в виде минерала магнезита в достаточно чистом состоянии, путем прокаливания легко превращается в окись магния. Растворимость MgO в указан, смеси крайне невелика—всего 0,1% при 950°; большая часть окиси находится в электролите во взвешенном состоянии. Поэтому электрический ток в первую очередь разлагает MgF2. Образующийся фтор, встречая MgO, реагирует с нею, выделяя кислород; при этом MgF2 регенерируется:
MgF2=Mg + F2; MgO + Fj-MgFs + O.
В результате получается магний и кислород, сжигающий угольные аноды, как и в
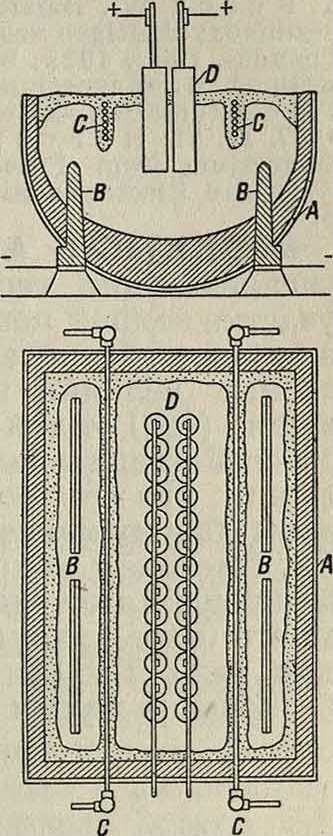
Фигура 2.
алюминиевом производстве (смотрите Алюминии). Ванна, применяемая в этом процессе, изображена на фигуре 2. Стальной котел в виде корыта А имеет проходящие сквозь его дно 4 стальных катода В. Аноды Ώ расположены в средней части ванны двумя рядами. Для разделения анодного пространства от катодного вдоль ванны проложены двумя параллельными рядами железные трубки С, охлаждаемые изнутри проточной водой. На них нарастает корка застывшего электролита, образующая своеобразную диафрагму. Равным образом подобной коркой покрываются изнутри и стенки ванны вследствие их охлаждения снаружи воздухом.
Получающийся, М., будучи легче электролита, всплывает на поверхность в пространстве между диафрагмами и стенками ванны, откуда он периодически извлекается. Ванны потребляют от 9 000 до 16 000 А и работают под напряжением 9—16 V.
Выход по току около 50%, удельный расход энергии около 40 kWh. Удельный расход окиси М. составляет 1,7 килограмм и электродов 0,5 килограмм (значительно выше теоретич цифры). Оптимальная f° процесса 900—950°. По имеющимся сведениям этот способ теперь оставлен вследствие его нерентабельности.
Из других возможных способов получения М., кроме электролитических, следует указать на методы, связанные с восстановлением окиси М. при высокой 1°. Работы Всесоюзного института металлов, проведенные в лабораторном масштабе, с применением в качестве восстановителя сплавов кремния с алюминием, дали весьма обнадеживающие результаты.
Производство металлич. М. в настоящее время имеется в Германии (ок. 80% мировой продукции), США, Франции, Англии и Швейцарии и исчисляется несколькими тыс. тонн в год при стоимости металла около 4 000 — 4 500 руб. за т. В СССР производства металлического М. не существует. Условия для организации этого дела ныне представляются особо благоприятными, так как страна.располагает неисчерпаемыми запасами сырья. Чрезвычайно мощные залежи карналлита (не содержащего сульфатов), несколько лет тому назад открытые в Пермском районе вблизи г. Соликамска, смогут дать миллионы т хлористого магния. Равным образом Сакское озеро, уже в течение около 10 лет являющееся поставщиком этой соли на внутреннем рынке, без труда может расширить свое производство до масштаба десятков тысяч тонн в год. Наличие другого фактора—электрической энергии—при ведущемся строительстве ряда мощных гидроцентралей можно считать обеспеченным.
Лит.: Федотьев П. ГГ., Электрометаллургия, ч. 2, Л., 1923; Антипин Π. Ф. и Моисеев А. А., О восстановлении окиси магния аммонием и кремнием, «Журнал прикладной химии», Л., 1925, т. 2, вып. 1—2, стр. 45; Lorenz R., Elektrolyse gesehmolzener Salze, T. 1—2, Monographien iiber angew. Elektrochemie, B. 20—21, Halle a/S., 1905; В 1 1 1 i-t e г J., Technische Elektrochemie, B. 3—Die Elektrolyse feuerfliissiger Schmelzen, Halle a/S., 1918; Ee-gelsberger P., Chemische Technologie d. Leieht-metalle u. ihrer Legierungen, Lpz., 1926; Eull 0. u. Busch W., Darstellung d. Magnesiums aus Mag-neslumoxydhaltigen Schmelzen, «Ztsehr. f. anorg. u. allg. Chemie», Lpz., 1925, B. 144, p. 87; Grube G., Darstellung d. Magnesiums aus Magnesiumoxydhaltigen Fluoridschmelzen, «Zeitschrift der Elektrochemie»,Lpz., 1927, H. 11; Harvej W. C., Production of Metallic Magnesium from Fused Salts, «Transactions of the American Electrochemical Society», N. Y., 1925, v. 47, p. 327. П. Антипин.