 > Техника, страница 59 > Магния соединения
> Техника, страница 59 > Магния соединения
Магния соединения
Магния соединения. Являясь весьма активным металлом, Mg легко вступает в химич. соединения с разнообразными элементами, выделяя при этом значительное количество тепла, а также легко взаимодействует с к-тами, образуя соли. Во всех соединениях Mg его валегтность равна 2. Большинство солей Mg, за исключением углекислой и фосфорнокислой, растворимо в воде. От других металлов II группы Mg отличается тем, что в присутствии избытка солей аммония он не осаждается аммиаком и карбонатами. Аналитическое определение Mg •производят обычно весовым путем, осаждая из растворимой Mg-соли фосфат, состава NH.1M2PO4 6Н20, и прокаливанием переводя последний в пирофосфорномагниевую соль MgvPvO,. Техническое значение имеют окись магния и некоторые его соли.
Окись магния, MgO, встречается в природе в виде минерала периклаза. Она образуется при горении на воздухе метал-лич. Mg, а также при прокаливании магнезита (углекислого Mg) до 750°, хлористого
Mg и других солей его при доступе воздуха; полученный т. о. рыночный продукт называется жженой магнезией; MgO— рыхлый легкий порошок, уд. вес 3,4,
~ 2 600°, t°Kvn, ~ 2 800°. MgO, полученная при невысоких <°, легко растворяется в кислотах с образованием солей и вступает в соединение с водой с образованием гидрата, Mg(OH)2, но, будучи сильно прокалена, она приобретает значительную твердость (царапает стекло) и стойкость по отношению к к-там и воде.
Технич. получение MgO основано на обжиге магнезита. На фигуре 1 изображена печь, применяемая для этой цели фирмой Ceramic Society. Вертикальная камера не имеет сужения в зоне обжига. Наиболее горячая зона выложена кирпичом из магнезита, остальные зоны—наилучшим огнеупорным кирпичом; кроме того по всей высоте печи имеется вторичная обкладка из огнеупорного
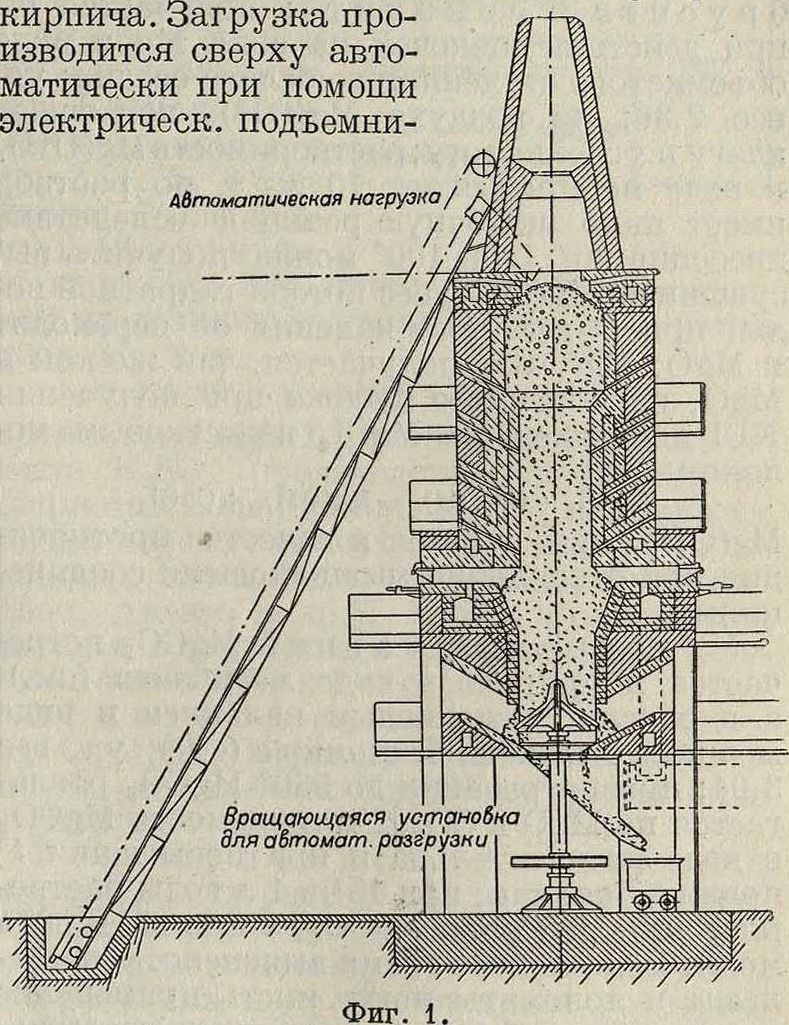
ка. Загружаемый магнезит постепенно спускается и проходит через зону полного обжига, доходя до зоны охлаждения у основания печи; отсюда MgO автоматически выгружается в вагонетки. Весь процесс продолжается 40 ч.; из них в зоне обжига магнезит находится 3 ч. Воздух засасывается через отверстия внизу, в поду печи; в зоне обжига он приобретает весьма высокую t°; кроме этого воздух подается через кирпичную обкладку, причем он предварительно нагревается. Газ поступает из особого газогенератора и нагревается перед поступлением в печь. Темп-pa обжига доходит до 1 700°. Отходящие газы выходят из печи нагретыми до 150°. MgO м. б. также получен как побочный продукт при получении КС1 из карналлита (смотрите Калийная промышленность); для этого «конечный щелок» подвергают нагреванию и при f° в пределах от 100 до 500° MgCl2 разлагается по ур-ию:
MgCl2 + Н20=MgO + 2НС1.
MgO имеет разнообразное применение в технике. При получении металлич. Mg путем электролиза MgO служит электролитом, подвергающимся разложению (смотрите Магний)MgO служит для получения некоторых цементов (например магнезиального цемента Сореля), искусственных камней и пластич. масс, в частности ксилолита (смотрите), для вмазывания платиновых и других тиглей, для изготовления огнеупорных тиглей и кирпичей, для обкладки пламенных печей и бессемеровских конвертеров, в качестве обкладки печей при томасовском процессе, в аммиачносодовом производстве, при конструировании известковоцементных и стронцианитовых печей и для выработки магнезиальных кирпичей (из магнезита и из магнезиальных отходов стае-сфуртских солей).
Гидрат окиси магния, Mg(OH)2, встречается в природе в виде минералов брусита и немалита; получается он при действии щелочей на соли Mg в виде объёмистого студенистого белого осадка; уд. вес 2,36; из воздуха Mg(OH)2 поглощает влагу и углекислоту; растворимостьMg(OH)2в воде не превышает 10 мг/л, но раствор имеет явно щелочную реакцию вследствие диссоциации. При 100° можно получить высушенный Mg(OH)2 без потери гидратной воды; при t° красного каления он переходит в MgO. Mg(OH)2 получается, так же как и MgO, из конечного щелока при получении КС1 действием на MgCl2 известковым молоком:
MgCl2 + Са(ОН)2=Mg(OH)2 + СаС12. Mg(OH)2 применяется в качестве противоядия при отравлении овыми соединениями.
Углекислый магний, MgC03, встречается в природе в виде магнезита (смотрите), а в смеси с углекислым кальцием в виде мощных отложений доломита (смотрите); уд. вес 3,04; при нагревании до 550° MgC03 разлагается на MgO и С02. Растворимость MgC03в воде незначительна и при повышении <° понижается: так, при 15° в 1 л воды растворяется 0,0095 моля MgC03, а при 35° 0,0071 моля. В последнее время выяснено, что магнезит и доломиты могут иметь применение в с. х-ве для целей, аналогичных известкованию почвы. Внесение MgO (в отношении 1:2 к СаО) содействует повышению урожая и уменьшает кислотность почв, усиливая тем самым действие СаО при известковании. Поэтому содержание MgO в известняках является благоприятным при применении их для известкования. MgC03 применяется также для внутренней обкладки бессемеровских конвертеров и для набойки печей при томасовском процессе. При кипячении водного раствора MgC03 образуется основная углемагниевая сольв виде белой пористой массы, к-рую можно рассматривать так же, как смесь MgC03 и Mg(OH)2; под названием белоймагнезии она применяется в медицине.
Хлористый магний, MgCl2,получается при нагревании MgO с углем в токе хлора, при нагревании водной двойной соли хлористого аммония и Mg в токе НС1 или при прокаливании безводной соли в виде бесцветных кристаллов; уд.в. 1,61; f°n4. 718°;
в присутствии следов Н20 дымит на воздухе и разлагается на НС1 и MgO; в токе водорода MgCl2 при i° красного каления возгоняется. В природе чаще всего встречаются гидраты хлористого Mg с 6 молекулами кристаллизационной воды (бишоффит) и двойная соль с хлористым калием (карналлит); из них состоят отложения MgCl2 в Стассфуртских, а также Соликамских месторождениях. Среди солей Mg, образующих Стассфуртские отложения, следует назвать следующие: карналлит KCl-MgCl2-6H20 (ок. 55—65% всей массы), каинит KClMgS04-3H20 (1—2%), кизерит MgS04-H20 (10—20%), тахгидрит 2MgCl2-CaCl212H20 (2—4%). Известны также гидраты MgCl2 с 2,4, 8 и 12 молекулами воды. Кроме того в значительном количестве MgCl2 содержится в морской воде и в воде многих соляных озер. Особенно велики запасы MgCl2 в Мертвом море (Палестина); они исчисляются в 12 млрд. т. Для калийной промышленности соли магния представляют отброс (смотрите Калийная промышленность, п е-реработка карналлита). Выделение калиевых солей производится главн. обр. из карналлита и каинита; перекристаллизацию их нельзя производить из воды, ибо чистый КС1 мог бы выкристаллизовываться лишь при значительном избытке MgCl2. Поэтому перекристаллизацию производят из концентрированного раствора MgCl2, полученного в качестве отхода при предыдущей кристаллизации.
Вант-Гофф подробно изучил условия кристаллизации солей Mg при различных t° в присутствии и в отсутствии NaCl. На фигуре 2 представлена схема кристаллизации при t° — 83°. Стрелками указана после-
| 106 | ||||
| МдС1г-6Нг0 | 101,8 | |||
| 105 | < 192 | |||
| , Кизерит | 184 | Карналлит | ||
| 255 | С 186 | |||
| 266 | 216 | |||
| i Левеит | Лангбейнит | |||
| 265 | ||||
| 284 276 | КС1 | |||
| Вантгоффигг - | Гпазерит | |||
| Na2S04 | ||||
297 283 271 273
Фигура 2.
довательность кристаллизации двойных солей, конечной стадией которой является выделение MgCl2-6H20 (точки, обведенные кружками). Приведенные на фигуре 2 числа соответствуют упругости растворения данного раствора в начале и в конце кристаллизации соответствующих солей. Взаимное расположение отдельных соприкасающихся прямоугольников в схеме дает указание относительно того, какие соли могут выделяться одновременно в виде кристаллов. При других ί?3ΤΗ соотношения меняются; они изображены схемами фигура 3—6. В то время как при 25° в схеме еще присутствует соль MgS04*7H20, которая оказывается способной к кристаллизации одновременно с гексагидри-том, каинитом, леонитом, шёнитом и астраханитом,— при 27,5° эта соль уже не может находиться в твердом виде наряду с каинитом, а также наряду с гекса-
гидритом, леонитом и астраханитом; шёнит же вообще не может существовать при этой ί°; при более высокой t° появляются новые соли: так, при 61,5° выкристаллизовывается вантгоффит, который при более низких распадается. MgCl2 выпадает из маточного раствора последним.
MgClj в технике в последнее время приобретает громадное значение. 1) Действием перегретого пара на MgCl 2 получается высокосортная соляная кислота, не содержащая примеси а и серной к-ты; при. этом наступает гидролиз с образованием НС1 и MgO.2) При нагревании CaS (отброса при производстве соды по методу Леблана) с MgCl2образуется MgS, тотчас же подвергающийся гидролизу с образованием H2S:
CaS -f- MgCl2 + 2 Ы20=СаС12 4· Mg(OH)2 + H2Sj
сероводород м. б. переработан на S02,H2S04или свободную серу. 3) При прокаливании MgCl2 до ί° красного каления кислород воздуха вытесняет из него свободный хлор: 2 MgCl2 + 02 =2MgO + 2С12.
4) При действии MgO на конц. раствор MgCl2 образуется основная хлористоводородная соль, имеющая большое применение в строительной и аппаратурной технике в качестве связующего материала (цемент Со-реля, магнезиальная замазка); в смеси с древесными и пробковыми опилками эта соль образует ксилолит; при обработке хлористым магнием целлюлозы образуется пластическая масса с твердостью слоновой кости; измельченный кремень или наждак в смеси с магнезитом при обработке крепким раствором MgCl2дает материал для искусственных жерновов, производство которых является довольно крупной отраслью промышленности. Кроме того растворы MgCl2 имеют применение в холодильном деле, а также для составления шлихты в ткацком деле, для аппретуры. За последние годы потребность в MgCl2 сильно возрастает в связи с использованием его в качестве сырья для получения металлического магния (смотрите), приобретающего исключительное значение в технологии легких сплавов. До последнего времени главным экспортером MgCl2 была Германия. В настоящее время Deutsches Chlormagnesium Syndikat строит крупный завод MgCl2B Бит-терфельде, вблизи Стассфуртских месторождений. В США в 1926 году производством MgCl2были заняты 4 завода с общей производительностью (впоследствии значительно понизившейся) 23 800mMgCl2Haсумму ок.ТООтыс. долл. В Канаде фирма Canadian Industries Ltd приступила к постройке большого завода MgCl2 в 1929 г. Неограниченные перспективы производства MgCl2 открываются перед кон
27,5°
| МдС1г | |||
| Кизерит | Карналлит | ||
| Мд SO г,-
^Ζ·6Η20 ·7//2θ | Каинит | КС1 | |
|
деонит | |||
|
Глазерит | |||
| Тенардит | |||
Фигура 4.
25°
| МдС12 | |||
| Кизерит | Карналлит | ||
| MgS0if6H20 | |||
| MgSO«7HzO | |||
| Астраханит | Леонит | КС1 | |
| Шенит | |||
| Тенардит | Гпазерит | ||
цессией,предпринявшей эксплуатю Мертвого моря; для кристаллизации MgCl2 здесь предположено использовать энергию солнечных лучей. Мировая торговля MgCl2 в 1929 г. доходила до 35—40 тыс. т.
Сернокислый магний, MgS04, встречается в природе в виде минерала кизерита, MgS04-H20, в Стассфуртских отложениях и выкристаллизовывается (также в виде одноводных кристаллов) из горячих растворов (точка перехода 68°). В холодной воде MgS04 мало растворим, почему и м. б. легко отделен путем кристаллизации. Кроме того при низких 1° (24-48°) из растворов выделяется семиводная форма, так наз .горькая соль. При t° 150° эта соль переходит в кизерит и при 200°—в безводную соль.Кроме тогоиз-.вестны гидраты с V-U, 2, 4, 5, 6 (две формы), 7 (двеформы) и 12 молекулами воды. Технич. применение MgS04 основано на реакции восстановления его в окись магния углем:
2MgS04 “Ь С=2MgO -f- С02 2S02.
Кроме того MgS04 применяется для получения K2S04 (производство удобрений) из хлористых солей калия. MgS04 содержится в воде морей, соляных озер и многих минеральных источников (Карлсбад, Гунияди-Янос, Апента и др.). MgS04 применяется также и в медицине в качестве слабительного (английская соль).
Основной сульфит магния, MgSO з · 2 Mg(OH) 2, получается при пропускании SO г в суспензию Mg(OH)2 и применяется в сахарном производстве.
Фосфорнокислый магний, Mg3-(P04)2, содержится в виде примеси в при-родныхфосфоритах.По опытам Врангеля фосфат магния усваивается растениями лучше, чем фосфат кальция. Двойная соль фосфорнокислого Mg и аммонияMgNH4P04· 6 Н20 имеет большое значение в химии, анализе вследствие весьма малой растворимости вводе и в слабом аммиачном растворе (при 15° 1 ч. MgNH4PO 4 6Н20 растворяется в 13 500 частях воды и в 52 400 частях 21/г%-н°г0 раствора NH4OH); соль эта служит для определения ионов Mg и фосфорной кислоты.
Фосфид магния, Mg3P, получается при нагревании Mg с красным фосфором и образует при разложении водой фосфористый водород.
Бромистый магний, MgBra-6H20, бесцветные кристаллы уд. в 3,72, 1°пл_ 711°; содержится в морской водеивомногих источниках встречается в отбросных солях Калий-
67,5
| МдС1г | ||
| Кизерит | Карналлит | |
| Каинит |
КС1 | |
| Лангбейнит | ||
| Левеит | ||
| Гпазерит | ||
| Вантгоффит | ||
| Тенардит | ||
Фигура 6.
4Г
| МдС12 | |||
|
Кизерит | Карналлит | ||
| Каи нит | КС1 | ||
| Леве-
^ ит Астраханит |
Ланг бейнит | ||
| Леонит | |||
|
Глазерит | |||
| Вантгоффит | |||
Фигура 5.
Т. Э. т. XII.
15
ной промышленности и используется для получения брома. овокислый магний, Mg3(As04)2, образует с аммонийными солями кристаллич. двойную соль MgNH4As04, аналогичную фосфорноаммонийномагнезиальной соли, весьма слабо растворимую в воде; уд. вес 1,74, ί°ω.=650° и t°Kun.=1120°.
Карбид магния, MgC2, образуется при нагревании смеси порошка MgC с углем в парах бензола или ацетилена; водой он разлагается с образованием ацетилена.
С кремнием Mg образует соединение состава SiMg2, силицид магния, при разложении которого образуются водородные соединения кремния—силаны (от SiH4 до SieH14).
Силикаты магния встречаются в природе в виде разнообразных минералов: форстерита (Mg2Si04), оливина (nMg2Si04·
• FeSi04), талька (смотрите Жировгт), серпентина (смотрите Змеевик) и др.; кроме того Mg входит в состав столь распространенных пород, как авгититы.
Нитрид магния, Mg3N2, образуется при нагревании Mg в закрытом тигле (при умеренном доступе воздуха) с значительным выделением тепла. При разложении Mg3N3водой образуется NH3 по реакции:
Mg3N3 + 6 Н20=3 Mg(OH)2 + 2 Nils.
Эта реакция является одним из путей связывания атмосферного азота.
Азотнокислый магний, Mg(N03)2, уд. веса 1,464, находится в маточных растворах при кристаллизации чилийской селитры.
Бораты Mg находятся в виде различных форм (орто-, пиро-, метабораты) в Стасс-фуртских месторождениях и в виде отдельных минералов (борацит, калиборит); их получают также синтетически, сплавляя вместе борную к-ту, MgO, MgCl2 и НС1.
С другими металлами Mg образует ряд соединений, определенного стехиометрического состава, например: Mg2Cu. MgCu2, Zn2Mg, Al3Mg4, SnMg2, PbMg2, Sb2Mg3, Bi2Mg3, NiMg, NiMg2 и др. (смотрите Магния сплавы, а также Спр. ТЭ, т. II).
Уксуснокислый магний, Mg(C2H302)2· •4Н20, получается растворением MgC03 в уксусной кислоте; он кристаллизуется в моноклинных крист, растворимых в воде и е; удельн. вес 1,45, безводного—1 1,42; применяется в медицине как слабительное, в крашении служит для закрепления на ткани черного анилина; основной ацетат магния, получаемый растворением MgO в уксуснокислом магнии, служит анти-септич. и дезинфицирующим средством.
Магний органические соединения, см. Металлоорганические соединения, Гриньяра реакция.
Лит.: Менделеев Д. И., Основы химии, т. 1—2, М.—Л., 1927—28; Федотьев Π. П., Крупная минеральная химия. и электрохимия, про- _ мышленность за последнее десятилетие, Л., 1925; К е д р о в-3 и i м а н О. К., Записки Белор. с.-х. академии, т. 4, Горки, 1927; Ephraim F., Anorga-nische Chemie, 4 Aufl., Dresden—Leipzig, 1929; О p-penheimer C., Kurzes Lehrbuch d. Chemie in Matur and Wirtsehaft, Leipzig, 1923; Thorpe E., Dictionary of Applied Chemistry, 2 ed., L. 1928, t. 4; Dix amides d’efforts seientifiques et industriels, P. 1925, t. 1, p. 351; Ullm. Ellz., B. 7. Б. Беркенгейм.