 > Техника, страница 61 > Металлография
> Техника, страница 61 > Металлография
Металлография
Металлография, наука, изучающая зависимость между физическ. свойствами металлов и сплавов и их строением (структура). М. является частью физической химии (смотрите), рассматривающей сплавы как особый класс растворов и основывающей все выводы на законах термодинамики. В настоящее время установлено, что все металлы являются телами кристаллическими, то есть атомы металла располагаются в определенном порядке по отношению друг к другу. Однако только в редких случаях в массе металла можно наблюдать правильные формы кристаллов; обычно кристаллы металла бывают деформированы и при рассмотрении полированной поверхности (шлифа) под микроскопом можно наблюдать лишь нек-рую сетку (Деформация металлов, вкл. л., 8), на основании которой как будто нельзя сделать никаких выводов. Однако это не так. При сравнении 2 структур одного и того же металла из наблюдений найдено, что механич. свойства (например прочность) будут выше у того образца, кристаллы которого мельче. Другие физич. свойства, например потери на гистерезис в трансформаторном железе, тем меньше, чем крупнее сетка кристаллов. В М. применяются и другие методы исследо-
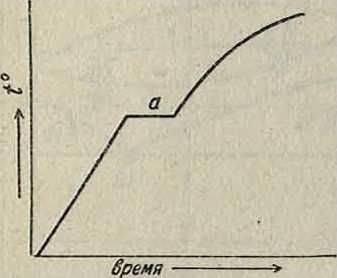
вания. Главнейший из них термический. Изменение свойств металлов и их сплавов зависит от изменения кристаллографических форм или, как выражаются в физич. химии, от изменения состояния материи. Напр. железо при t° до 768° находится в одной кристаллической форме (а), в интервале 768— 906° в другой форме (β), в интервале 906— 1 401°—в ‘форме у, выше 1 401° до t°nJl.—в форме 6; α-железо притягивается магнитом, а ^-железо теряет магнитные свойства, у-же-лезо способно поглощать углерод, то есть науглероживается. Другой металл, олово, при обычной <° вязок и имеет уд. вес 7.23; при ί° ниже 20° (особенно быстро при —20°) переходит в другуюкристаллич. форму,хрупкую, обладающую уд. весом 5,7 («чума» олова). Наблюдения показывают, что всякий переход материи из одного состояния в другое сопровождается выделением или поглощением некоторого количества тепла, то есть при нагреве металла ί° его будет плавно повышаться до некоторой точки а, называемой критической (смотрите фигура 1); тогда t° металла остановится на одной и той же точке, хотя приток тепла будет непрерывен; в эти моменты притекающее тепло будет расходоваться на «перестройку» формы кристалла; после перекристаллизации повышение пойдет опять плавно.
На примере железа или олова было показано, что у одного и того же металла м. б. несколько переходов из одного кристаллич. состояния в другое и наконец может иметь место изменение агрегатного состояния, например переход из твердого в жидкое, затем в газообразное состояние. М. изучает главн. обр. переходы из жидкого состояния в твердое и превращения в твердом состоянии. Переход из жидкого в твердое состояние важен
Фигура i.
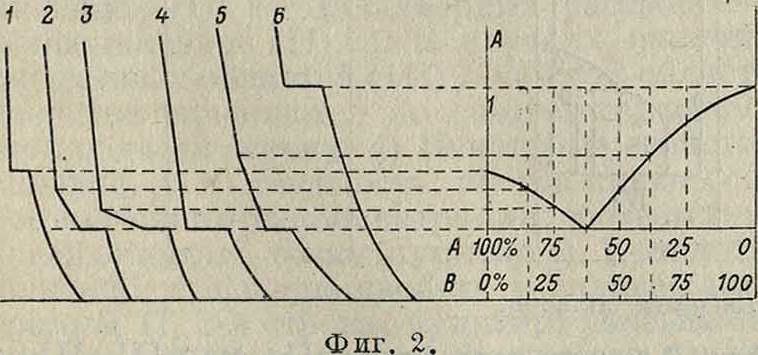
для технологии, процесса литья, так как часто первоначальная кристаллическая структура определяет все качества изделия (смотрите Макроструктура). Не менее важны превращения и в твердом состоянии, как это видно из вышеприведенных примеров. Эти процессы имеют место при технологич. процессах ковки и термич. обработки. Чистые металлы обладают невысокими механич. качествами, и потому для повышения этих качеств применяются сплавы двух, трех и больше металлов. Для изучения свойств сплавов термич. анализ получил очень большое значение. Обычно определяют критич. точки перехода из жидкого состояния в твердое и превращений в твердом состоянии. Мето дика изучения заключается в наблюдении над сплавами из 2 металлов,затем из 3. Систематическое изучение сплавов из большего (чем 2) числа металлов очень затруднительно и обычно производится от случая к случаю. На основании критич. точек, полученных для сплавов разного состава данных 2 металлов, составляется диаграмма плавкости. На фигуре 2 произведено построение такой диаграммы, где по оси абсцисс отложено %-ное содержание каждого металла в сплаве, а по оси ординат t°; т. о. получена например диаграмма сплава нек-рых 2 металлов АиВ (смотрите Спр. ТЭ, т. II, стр. 173, диаграмма Pb-Ag). Совокупность всех металлов, входящих в сплав в различных комбинациях, составляет систему. Составляющие металлы системы называются компонентами, а однородная часть в системе—фазой. Можно говорить об одной жидкой фазе системы Pb-Ag, например при 1 000°, т. к. при этой t° расплавленные РЬ и Ag смешиваются вполне между собой и образуют одну однородную массу—жидкую фазу. Количественное соотношение фаз и компонентов в данной системе при состоянии равновесия определяется т. н. правилом Гиббса (Gibbs), имеющим такое математическое выражение: ч + ф=к + 2, где ч—число возможностей (свобод) изменять физич. условия системы. без того, чтобы в системе происходили из- менения (например изменение ί°, концентрации, числа компонентов и тому подобное.), к—число компонентов системы, ф—фаз системы. Цифра 2 обозначает две физич. независимых переменных: t° и давление. Т. к. для сплавов давление можно принять постоянным (объёмы жидкостей и твердых тел изменяются очень мало от изменения давления), то для сплавов правило Гиббса примет такой вид: ч+ф==к+.1. Пользуясь этим правилом, можно заранее предвидеть, сколько фаз можно иметь при тех или иных физич. условиях. Напр. пусть для системы Pb-Ag имеется наличие 1 фазы—жидкость, тогда имеем ч+1=2+1; ч=2, то есть имеются две возможности одновременно изменять физич. условия системы: 1) t° и 2) концентрацию сплава, и все же сплав остается в жидком состоянии. Напр. при 1 000° сплав 50% РЬ и 50% Ag находится в жидком состоянии; 20% РЬ и 80% Ag— тоже жидкость при этой же ί° i т. д. (изменение концентрации—1-я возможность или свобода); при 900° (изменение t°—2-я возможность или свобода) эти концентрации с 50% РЬ или с 80% РЬ тоже жидкие. Если будет необходимо иметь в этом сплаве 3 фазы, то ч+3=2 + 1; 4=0, то есть для такого состояния невозможно ничего изменять, и на диаграмме будет только одна точка: определенная темп-pa и концентрация. Это так называемым эвтектическая точка, когда для расплавливаемого сплава 1-я фаза — кристаллы серебра, 2-я фаза—кристаллы свинца и 3-я фаза—их жидкий сплав. Такое состояние соответствует концентрации 2,5% Ag и 97,5,% РЬ при ί°=304°. При всякой иной концентрации или при иной t° будет наличие не трех, а меньшего числа фаз. Из приведенного примера ясно выступает закономерность соотношений числа структурных составляющих в сплавах. Выше в определении было указано, что сплавы рассматриваются как особый класс растворов. Особенность сплавов заключается в том, что в них может происходить взаимное растворение компонентов даже в твердом состоянии, причем образуется твердая фаза, называемая твер дым растворои. К этой фазе приложимы все те физич. законы, которые имеют место для жидких растворов: из них могут выделяться кристаллы растворенныхкомпонен-тов при понижении t°, и обратно, кристаллы могут переходить в раствор при повышении t° и т. д. Так как состояние этих растворов (метал л) легко фиксируется на шлифе (запись—г рафия, металлография), то т. о. создается возможность длительного и подробного изучения каждого состояния. Поэтому изучение твердых растворов облегчает работу общей физич. химии, вследствие чего металлография играет большую роль в теории растворов.
Приведенная на фигуре 2 диаграмма является одной из типовых диаграмм плавкости.
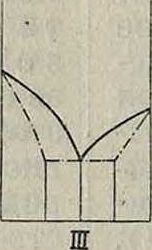
! На фпг. 3 приводятся разные типы диаграмм (их различия указаны в заголовках каждого типа, построение их произведено по образцу, указанному на фигуре 2). Эти типы диаграмм могут образовывать нек-рые отклонения от приведенных форм, например форма II диагр. фигура 3 может дать форму Па, или ИЫПа и т. д. В этих случаях они являются только разновидностями общих типов и могут иметь место как в жидких, так и твердых растворах, особенно при образовании хим. соединений между компонентами. Изучение диаграмм таких сложных сплавов, как Cu-Zn или Cu-Sn (латунь, бронза), показывает, что часто в одной диаграмме соединены многие простые типы диаграмм (смотрите Спр. ТЭ, т. II). Особенное внимание обращает на себя возможность легкого фиксирования химич. соединений для 2-компонентных сплавов, например • диагр. IVa (фигура 3) определенно указывает наличие двух химич. соединений. Эти точки диаграммы называются сингулярны-м и (особенными). В таких точках, то есть при
Типы диаграмм
В жидком состоянии:
смешиваются без образования химич. соединений смешиваются с образов, химич. соединений
| В твердом состоянии: | ||||
| не растворяются | раство ряются | частично раство ряются | не смешиваются | частично смешива ются |
Не смешиваются совсем
Смешива ются частично
Основной вид диаграммы
Диаграммы свойств (Е) сплава в зависимости от концентрации (я),т
Видоизмененные типы основпых диаграмм
Яо
Жа
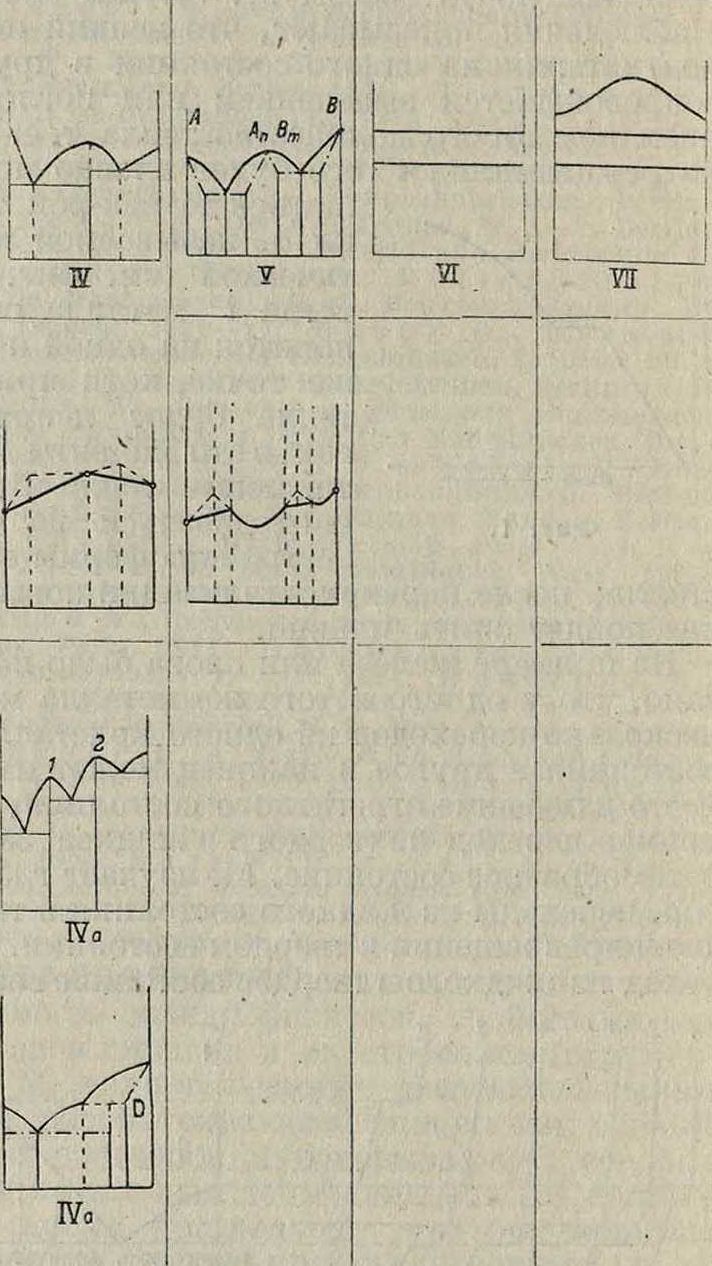
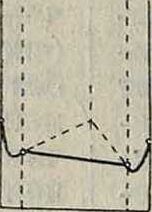
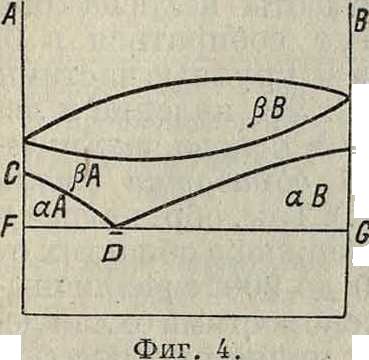
Фигура 3. Разные типы диаграмм сплавов. определенном %-ном составе одного и другого элементов, резко изменяются свойства сплавов. Напр. (смотрите Спр. ТЭ, т. II, стр. 188) сплавыСе (ί°„Λ.= + 885°) и Βί (t°njl=+ 215°). образуют химии, соединения с ί°„. выше + 1 680°, также Bi и Na (t°nM= + 95°) образуют хим. соединения с t°njt =+ 775°. Таким методом пользуются для определения огнеупорных материалов, шлаков и прочие,например i°WA.SiO2=1760°, A-]203s2000°, соедине ние из 90% Si02 и 10% А1203 плавится при ~ 1 600°. Методом плавкости широко пользуются в настоящее время в физ. химии; этот метод был разработан и изучен гл. обр. на основании работ М. Хотя диаграммы фигура 3 построены для жидких систем, однако они остаются неизменными и для твердых. Часто изм енения в жидких сплавах сопровождаются превращениями в твердых фазах. Напр. на фигуре 4 изображены превращения в сплаве металлов А я В, образующих при застывании смешанные кри-f сталлы; по мере охлаждения металл А переходит из состояния βΑ в состояние а А, а βΒΒαΒ, которые уже не образуют смешанных кристаллов, то есть взаимно не растворяются, а потому начинают раз-деляться, образуя, при некоторой ί° и концентрации в точке D, эвтектоидную (в отличие от эвтектической, где совершается переход из жидкого состояния в твердое) смесь. На фигуре 3 приведены разные типы диаграмм плавкости. Во втором ряду под каждым типом диаграмм приведена функциональная зависимость физических свойств сплава от изменения концентрации. Не вдаваясь в подробности, можно отметить следующее. 1) Для сплавов, не образующих хим. соединений, а также не смешивающихся в твердом состоянии, изменение свойств линейное (I). 2) Для твердых растворов— криволинейное (II). 3) В случаях наличия смешанных областей (III) в каждой области свойства изменяются по соответствующему этой области закону. 4) Некоторые свойства сплавов, например твердость, иногда имеют особое значение при концентрации, соответствующей эвтектич. точке (пунктир I). В этом отношении изменение свойств в сплаве (диаграммы II, 2-я строка, пунктир) указывает, что данный сплав не только образует непрерывный твердый раствор, но для концентрации С в его состав входят также химич. соединения. Если изменение свойств происходит плавно, то в точке С сплав представляет только твердый раствор. 5) Химич. соединения (IV) могут обладать особыми свойствами (сингулярная точка), характеристику которых можно получить лишь из прямого наблюдения. Напр. система Ce-Bi образует химич. соединения Ce4Bi3, то есть должна иметь по диаграмме сингулярную точку при составе: 52% Се, 48% Bi; однако без опыта сказать, какая будет характеристика ее в этой точке, нельзя. Только опыт показал, что при такой концентрации имеет место трудноплавкое состояние с 1 680°.
Во всех перечисленных диаграммах была указана связь-вида диаграммы со свойствами сплава. Эти диаграммы для многих сплавов уже составлены (смотрите Спр. ТЭ, т. II), и т. о. свойства сплавов м. б. предугаданы. В технике однако часто приходится давать заключение о свойствах сплава на основании его структуры, б. ч. микроструктуры (смотрите); поэтому необходимо диаграмму связать со структурой или, вернее, указать, как отражаются на строении сплава переходы его из одного состояния в другое. Для этой цели рассмотрим переход сплава из жидкого состояния в твердое по диаграмме I (фигура 3). Выше было указано, что чистые металлы обладают структурой вида сетки (вкл. л., 48*), петли которой соответствуют границам неправильной формы кристаллов. Структура сплава с концентрацией, соответствующей сплаву (фигура 3, I) доэвтектич. концентрации, очевидно будгт иная. Наблюдения показывают, что при t°, соответствующей верхней кри-тич. точке, выделяются чистые кристаллы компонента А; далее сплавы с заэвтектич. концентрацией выделяют чист, компонент В. Т. о. линия АС (фигура 3, I) соответствует температурам (для соответств. концентраций) начала выделения фазы А, а линия ВС— фазе В. Структура сплава концентрации С очевидно должна соответствовать одновременному выпадению металлов А и В, что на самом деле и имеет место: все структуры эвтектич. сплавов представляют собой поле неправильной формы кристаллов, равномерно наполненное или полосками или палочками (вкл. л., 1—6); поэтому структуры до-эвтектоидного сплава или заэвтектоидного должен быть сходны; разница будет заключаться лишь в том, какой вид будут иметь структурно свободные металлыАиВ. Если рассмотреть структуры, соответствующие разным концентрациям (фигура 3, диагр. II), то есть структуры твердых растворов,.то в виду того, что металлы в твердом состоянии не разделяются, под микроскопом нельзя будет отличить структуры чистых металлов от твердых растворов: во всех случаях будет иметь место сетчатая структура. Итак в структуре твердых растворов отсутствует какой-либо рисунок кроме сетки.
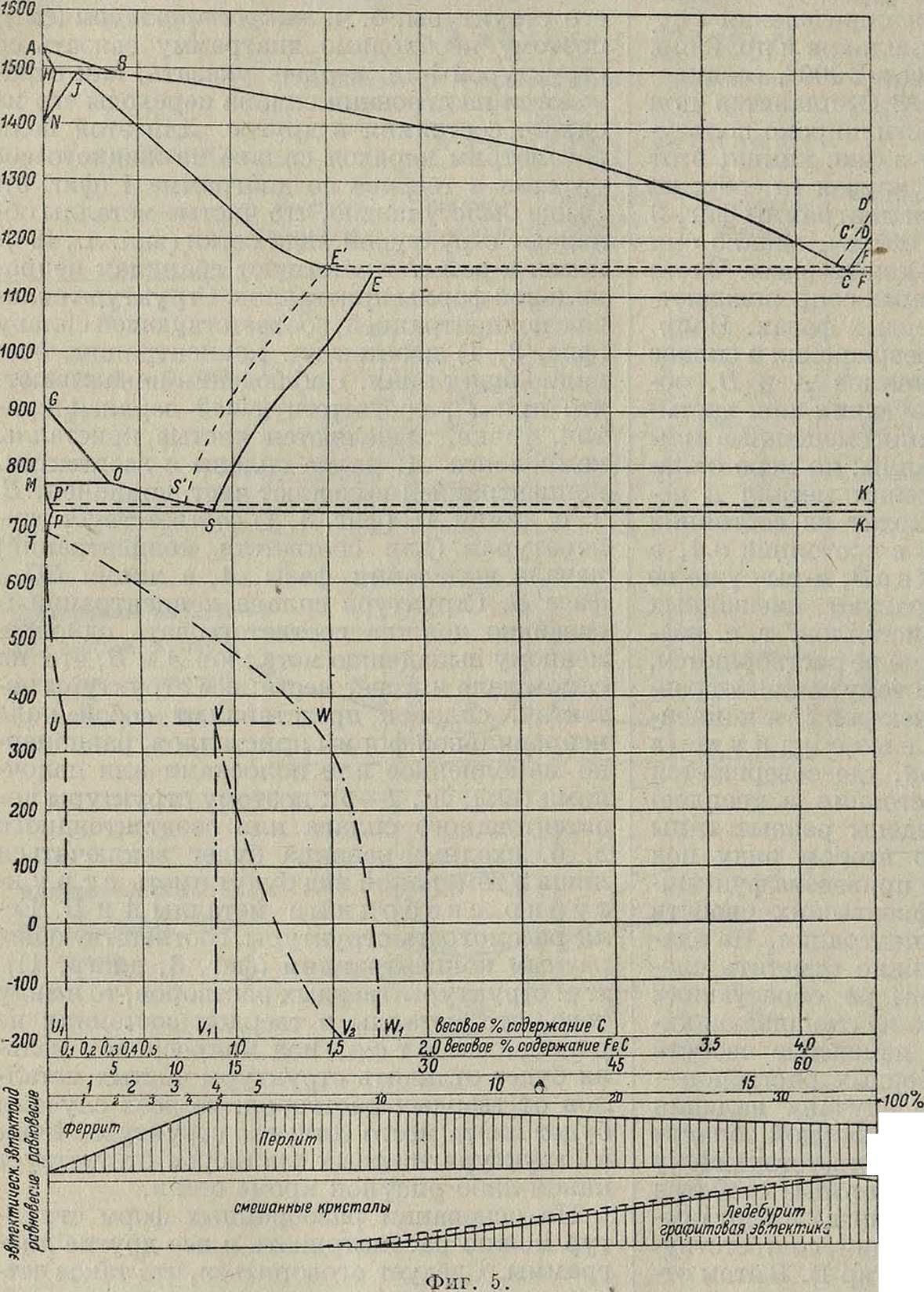
На основании разобранных форм структур можно рассматривать и все другие диаграммы. Следует оговориться, что такое чет-.кое разделение структур имеет место при полном равновес и"и, к-рое в нек-рых сплавах бывает трудно достижимо, например в бронзах. Т. о. в образовании структуры участвует еще один фактор кроме концентрации—время. Скорость охлаждения после нагрева до t°%rnmu значительно влияет на структуру сплава, -а тем самым и на свойства его. Рассмотрим в качестве примера одну из диаграмм железо-углерода, имеющую большое значение в технике. Диаграмма (фигура 5) этой системы очень сложная. Железо-углерод может .образовать: 1) или химич. соединение (карбид железа Fe3C), и тогда получится диаграмма (сплошная линия) неустойчивой (метастабильной) системы
* Фотографии микрошлифов см. вкладной лист при статье Микроструктура.
Fe-Fe3C; 2) или устойчивую (стабильную) систему Fe-C, где С вступаетв структуру в виде графита (пунктирная линия). Эта часть диаграммы относится к равновесию 2 фаз— жидкой и твердой. Ниже £° 1 528—ί 146° происходят в железе аллотропические пре вращения (δ^γ^β^-ά), как было указано выше, и соответственно этим изменениям в кристаллич. форме железа происходят изменения в твердом растворе, что выражено второй нижней ветвью при t°~ 900—700°. Так как железо при охлаждении переходит из состояния γ в состояние а, обладающее иными химии, свойствами, выражающимися в том, что α-Fe не растворяет Fe3C, то последний выделяется из твердого раствора. Фиксация при атмосферной ί° твердого раствора называется закй (смотрите). В процессе закалки должен был бы фиксироваться в углеродистой стали раствор Fe3C в Fe в форме γ, однако скорость перехода кристаллической формы y-Fe в a-Fe больше возможных скоростей охлаждения, поэтому в обычных условиях получается твердый раствор не в y-Fe, а в a-Fe, что как будто несогласно с вышесказанным утверждением нерастворимости Fe3C в a-Fe. Это представляет одну из загадок системы Fe-Fe3C. Задача эта рентгенографически решается таким образом, что раздробленные до атомного размера частицы Fe3C, благодаря быстрому охлаждению и перекристаллизации, не успевают выделиться из кристаллической решетки a-Fe и остаются в таком неустойчивом состоянии. Малейший нагрев (отпуск) уже облегчает собирание (коагулирование) частиц Fe3C; в зависимости от времени выдержки при нагреве и высоты нагрева они могут собираться в б. или м. крупные частицы Fe3C. Это явление и лежит в основе термической обработки стали (смотрите). Так. обр. нагрев и выдержка в областях от 700 до 900° с различными скоростями охлаждения является способом получения разных размеров величины кристалла металла и его составляющих a-Fe и Fe3C, а т. к. выше было указано, что размеры кристалла и его составляющих влияют на ме-ханич. и физич. свойства технич. металла, то связь между структурой и физич. свойствами сплава так. образом получает свое обоснование. Кривые в нижней части диаграммы фигура 5 (тире с точками) соот-ветствуют превращениям в мартенсите согласно исследованиям Гане-0 мана (Напетапп).
Рассматривая превращения в системе Fe-C в твердом состоянии, мы имеем 2 линии выделения избыточных компонентов—одну для чистого железа (феррита), другую для цементита (Fe3C). Надо отметить, что феррит легко растворяется и легко выделяется из твердого раствора, тогда как цементит, наоборот, очень трудно и растворяется и выделяется, особенно при высоких концентрациях углерода. Поэтому структура сплава железо-углерод с содержанием до 0,9% С будет указывать избыток феррита на фоне эвтектоида перлита (вкл. л., 7—11), а при содержании выше 0,9% С—избыток цементита (вкл. л., 12—14). Избыточный феррит на шлифе очень похож на цементит, поэтому для различения употребляют особую протраву—пикрат натрия, окрашивающий Fe3C и не окрашивающий Fe. Кроме того долгое
травление в кислоте разъедает Fe, образуя· фигуры травления, тогда как FesC их не образует. При 0.9% С будет структура перлита (вкл. л., 15—20). Приведенные структуры характеризуют металл в равновесии, то есть когда скорость остывания при распадении твердого раствора была такая, что обе составляющие успели разделиться. Такая структура соответствует структуре ото ж-женной стали. Если дать стали остывать очень медленно, то отдельные полоски це ментита в перлите начинают обособляться и образовывать сперва шарики (сфероидизи-рование)—такая структура называется зернистым перлито м—и наконец происходит обособление цементита от феррита— структура перлита распадается (вкл. л., 21—26). Наоборот, очень быстрое охлаждение твердого раствора образует структуру закаленной (смотрите Закалка) стали, называемую мартенситом (смотрите) (вкл. л., 27). В этой структуре, можно сказать, имеется наиболее мелкое раздробление (дисперсность) цементита в феррите, т. к. это состояние соответствует раствору, то есть молекулярному раздроблению. По мере нагревания зака ленной стали молекулярно раздробленный цементит начинает коагулироваться (собираться), образуя переходные структуры из мартенсита в тпоостит (вкл. лист, 28) -> сорбит (вкл. лист, 29) -> перлит. Все типы вышеперечисленных структур можно получить в одной и той же стали; естественно возникает вопрос—какие свойства соответствуют каждой перечисленной структуре? На основании практич. наблюдений можно провести зависимость, указанную в таблице 1.
За единицу принято максимальное число, соответствующее какой-либо структуре одного и того же материала, например Zmaxбудет максим шьным для стали, имеющей мартенситовую структуру, но в то же время вязкие свойства будут очень низкие, т. к. удлинение (А), сжатие (S) и ударное сопротивление (ΰ) равны 0; та же сталь, обладающая сорбитовой структурой, то есть наиболее мелкой структурой перлита, обладает в то нее время наиболее высокой вязкостью, наиболее высоким сопротивлением на сжатие, а также на удар. Из указанных данных следует правильность вышесказанного положения, что структура- определяет качество
Таблица 1С во йоте а структур.
| -^^^Структуры | Аустенит -> | Мартенсит -> | Тр О остит -»
. | Сорбит -> | Перлит | |
| Свойства " | пластинчатый | зернистый | ||||
| Дисперсность | Невидимые в микроскоп. Молекулярный раствор в: | На границе разрешения микроскопом, | Видимые и разделяемые в микроскоп | |||
| (размер частиц) | 7-железе 10-8 см | а-железе 10~8 см | но еще не видимый Ю-5 -г-10-е см | 10-4—10"5 СМ | Ю-3 см | ю-2 см |
| Различаемость под микроскопом и необходимое увеличение | Не м. б. различены | Темное пятно | Увелич.
1000—1500 |
Увелич.
500 |
Увелич.
150 | |
| х Врем. сопр. на я разрыв,/тах | 0,5 | 1,0 (макс.) | 0,8 | 0,7 | 0,5 | 0,4 |
| я Предел упругости, Ze | ~0 | 1,0 | 0,4 | 0,54 | 0,23 | 0,1 |
| 2 : Предел текучести, Zs | од | 1,0 | 0,7 | 0,6 | 0,25 | 0,15 |
| Z Удлинение, А | 1,0 (макс.) | 0 | 0,3 | 0,7 | 0,8 | 0,9 |
| °
" Сжатие, S 1 о : |
0,3 | 0 | 0,5 | 1,0 | 0,6 | 0,4 |
| Сопротивление « удару, <5 | 0,6 | 0 | 0,7 | 1,0 | 0,6 | 0,2 |
Нвг I Параллельна %тах
| 1
Вид разрывной диаграммы для стали (С ^ 0,4%) |
Г | г | ||||||||||||||||
| i
Механическая обрабатываемость | ~0 | о
! О | 0,5 | 0,8; очень чистая поверхность | 1,0 (макс.) | 1,0; но плохая поверхность | ||||||||||||
металла, применяемого для изделий. Вышеописанные свойства, зависящие от структуры, присущи одному и тому же ме--таллу, например содержащему 0,4% С, и обусловливаются термической обработкой. Можно рассматривать связь между сталями и разного химии, состава, но имеющими одно и то же структурное состояние, например стали с разным содержанием углерода, но в одинаковом отожженном состоянии. Такой металл, как уже было сказано, имеет перлитовую (пластинчатую) основу, в которой находится тот или иной избыточный компонент в количестве, соответствующем его химйч. составу. В этом случае можно пользоваться приблизительными данными табл. 2.
Таблица 2.—М еханические свойства структурных составляющих (одной и той же __стали). _
| Структурная составляющая | Врем, сопротивление на разрыв, Zmaxв кг/мм2 | Удлинение А в % * |
| Перлит сорбитовый. | 105 | 10 |
| » нормальный | ||
| пластинчатый. | 85 | 15 |
| Перлит грубый. | 50 | 5 |
| Феррит. | 30 | 40 |
| * Длина образца L=kd. | ||
По этой таблице можно подсчитать сопротивление Zmax и удлинение А; если сталь имеет например Р% перлита и F% феррита, то приблизительно будет:
σ, 30F + 85P.
^max 100 ’
α= 4№+25Р. I
100
В этом случае не приняты во внимание могущие быть в этом металле пороки или состояние металла иное, чем отожженное.
Кроме влияния t° нагрева и скорости охлаждения структура изменяется и от меха-нич. обработки, горячей и холодной (ковка, прокатка, холодная протяжка и тому подобное.). На вкл. л., 30—33, показаны изменения структуры в результате холодной протяжки и последующих отжигов; в этом случае холодная протяжка дает те же результаты, что и закалка, раздробляющая зерна цементита. Такая механич. обработка имеет особенно большое значение для заэвтектоидных сталей (инструментальных), т. к. нагрева выше 750° для этих сталей для термин, обработки стараются избегать (смотрите Термическая обработка). В табл. 1 приведена для сравнения аустенитовая структура, но получить ее в углеродной стали с 0,4% С почтиневозможно, так как скорость трансформации у-же-леза в α-железо больше скорости охлаждения стали; поэтому аустенит можно полу-чиФь только в сталях, содержащих нек-рые примеси (Mn, Ni, Cr, W) в значительных количествах при наличии большого количества углерода. На вкл. л., 34, приведена аустенитовая структура в стали с 24% Ni. Чтобы доказать,что всякая сталь при f° выше t°Kpum-имеет такую Hie структуру, А. А. Байков приготовил шлиф стали и, нагрев его r струе азота без доступа киСлородадоГвышеГк2,гш-,
протравил газообразным НС1, после чего шлиф был охлажден в струе азота. Шлиф показал, что действительно структура в этих условиях аустенитовая. Позднее с применением рентгенографического анализа (Вест-грен, Селяков и др.) было доказано, что при переходе критической темп-ры (Л3) происходит трансформация y-Fe в α-Fe. Выше было указано, что трансформ щия перлита в интервале критических ί° сопровождается обособлением цементита в значительные массы, а дальнейшая выдержка при этих темп-рах ведет к распадению карбида железа (Fe3C== 3Fe-fC).T.e.K выделению С в элементарном виде. Нек-рые примеси в стали (Si, Ni) ускоряют этот процесс, другие (Мя, Cr, W, Мо), наоборот, задерживают его;на вкл. л., 35. 36, показан такой распад цементита в инструментальной стали благодаря долгому (72 часа) нагреву при ί°=800°. Из этих наблюдений можно сделать след, вывод: закаленная сталь является в наиболее неустойчивом состоянии; с течением времени [при атмосферной ί° очень долго—сотни лет, при повышенной—тем скорее, чем ί° нагрева ближе к критической (А^), когда скорость распадения измеряется секундами] частицы Fe3C стремятся к равновесному состоянию (наиболее устойчивому), образуя структуру перлита, затем обособленного цементита и наконец распадаясь на элементарные Fe и С. Построение диаграммы (фигура 5) произведено при помощи кривых, на которых при Крит. ί° имеются остановки, соответствующие выделению тепла при охлаждении. Из этого можно сделать заключение, что закаленная сталь, сохраняя структуру, свойственную состоянию стали при высокой ί°, обладает в потенциальном состоянии Сблыним количеством энергии, нежели отожженная; поэтому переход одной структуры в другую представляет не что иное, как постепенное выделение энергии, то есть переход от высшего потенциала энергии к низшему-. Это ясно указывает на то, что все металлографич. наблюдения стоят в тесной связи с законами термодинамики.
Диаграмма, изображенная на фигуре 5, имеет кроме эвтектоидной еще 2 эвтектич. точки. Первая эвтектич. точка, лежащая на пересечении сплошных линий, соответствующая переходу из жидкого состояния в твердое, имеет существенное значение для макроструктуры чугуна. Та структура литого материала, которая получена при застывании, нем. б. изменена никакими нагревами ниже 4°ил. и называется первичной. При рассмотрении превращений на эвтектоидной линии выявлено, что время выдержки влияет на дисперсность составляющих; то же можно сказать и о превращениях на эвтектич. линии. Поэтому отливки в металлические, быстро остуживающие металл, формы имеют иную макроструктуру, чем отливки в формовочную землю. В первом случае эвтектика (называемая ледебурит) будет мелкая, во втором—крупная. Ледебурит, как эвтектич. смесь (образуется при 1146°), состоит (диагр. фигура 5) из 2 фаз: цементита (Fe3C), называемого первичным, и аустенита, содержащего в твердом растворе 16.7% Fo3C (что соответствует содержанию 1,7% С). По мере понижения t° способность растворения цементита в аустените понижается до содержания при 720° 0,9% С (по ветви ES диагр. 5), при этом выделяется избыточный цементит, называемый вторичным, располагающийся в виде сетки по границам кристалла. При ί°=721° к первичному цементиту бывшей ледебуритной структуры добавится вторичный цементит, и наконец аустенит с 0,9% С распадается при этой ί° на эвтектоид-перлит. Цементит перлита называется тр е-т и ч н ы метров.
Итак, во всех железоуглеродистых сплавах, образующих метастабильное равновесие, находятся 2 составляющих—феррит и цементит. Они обладают разными физич. качествами: феррит является очень мягкой и вязкой составляющей, а цементит очень хрупкой и твердой; феррит легко, а цементит очень трудно переходят в твердый раствор; под действием к-т на феррите образуются фигуры травления, он разделяется на зерна (кристаллы), цементит же не дает фигур травления и не делится на отдельные кристаллы; α-Fe образует твердые растворы с Mn, Ni и другими элементами и может растворить при Цв721°(см.диагр.5)неболыпеО,5%Ре3С (то есть0,035%С),а при атмосферной t°—небольше 0,006% Fe3C; С образует двойные карбиды с Мп, Сг и другими элементами; y-Fe может растворить Fe3C до 16,7%, то есть 1,7% С, а в расплавленном состоянии свыше 4% С, причем при затвердевании, как было выше сказано, этот углерод выделяется в виде химия. соединения Fe3C, образуя ледебурит. Однако присутствие значительных количеств кремния в Fe понижает его способность растворять С и образовывать Fe3C, вследствие чего технич. сорта чугуна, обычно содержащие большое количество кремния, при остывании выделяют С в виде графита; при этом химически связанного С остается не больше 0,4—0,5 %. Таким образом в структуру сплава Fe с С, при содержании С выше 3%, вместо ожидаемого цементита входит выделенный графит, немного перлита (соответственно 0,4% С) и структурносвободпый феррит, заключающий в растворе весь кремний чугуна (вкл. л., 37).
Цементит—непрочное химия, соединение, распадается в углеродистых сплавах при ί° выше 800° по ур-ию Fe3C=3Fe +С. Эта реакция облегчается присутствием Si или Ni; присутствие Mn, Cr, W, Mo, V, образующих двойные карбиды, наоборот, задерживает распадение. Вследствие этого различают 2 типа чугунов: серые (углерод в виде графита) и белые (углерод в виде цементита). Составляющие структуры серого чугуна (феррит, перлит) могут легко обрабатываться реясущими инструментами, тогда как структурносвободный цементит белого чугуна очень трудно обрабатывать; поэтому серый чугун применяется в машиностроении для отливок, тогда как белый —в редких случаях для специальных изделий, где используется высокая твердость цементита. Т. к. цементит—непрочная составляющая, то в белых чугунах его моя-жо разлояжть соответствующей термич. обработкой, после чего белый чугун можно механически обрабатывать, т. к. цементит будет разрушен.
Вторая эвтектическая точка образования перечисленных пунктирных линий соответствует эвтектике Fe-C (вкл. лист, 38, 39). Как видно из диаграммы, положение этой точки выше и левее (то есть температура выше и концентрация сплава меньше) цементито-вой эвтектич. точки и соответствует темп-ре 1153° и концентрации 4,2% С. Это устойчивое равновесное состояние получается при очень малой скорости охлаждения в интервале эвтектич. t°. В чугунах. содержащих более 4,2% С, кроме эвтектич. графита м. б. избыточный первичный графит (вкл. л., 40), структура первичного графита, как и первичного цементита, не м. б. изменена никакими операциями (кроме плавления). Уд. в феррита равняется 7,876, цементита 7,82, а графита около 2; поэтому белый чугун, переходя в серый, должен увеличиваться в объёме. Наличие эвтектоидной линии в области чугунов указывает, что при t° 721° третичный цементит перлита образует твердый раствор с y-Fe, в к-ром может постепенно растворяться вторичный цементит или графит. Надо заметить, что это образование твердого раствора происходит очень медленно; однако не подлежит никакому сомнению, что термическая обработка чугунов, аналогично термич. обработке стали, может иметь место, что было фактически доказано еще в 1917 году работами русского исследователя проф. Бочвара. В настоящее время с 1922 г. термич. обработка чугунов введена в практику и в заграничной технике. Выше было упомянуто, что в обычных условиях получается графито-перлито-ферритовая структура чугуна. Но т. к. феррит обладает очень низкими механич. качествами, то наиболее высокими свойствами будет обладать чугун, имеющий графито-перлитовую структуру (вкл. л., 41—44). Такой чугун получил название перлитного чугу-н а. Его называют неправильно с т а -л и с-т ы м чугуном. Это название произошло от того, что перлитовую структуру чугуна удобнее получать в чугуне, содерягащем 2,5— 3% углерода, а такое содержание углерода при плавке в вагранке удавалось получать лишь введением стали в шихту вагранки. Очевидно, при правильном подборе термич. обработки перлитный чугун можно получить и при большем содержании углерода (что доказано работами проф. Бочвара), причем. обработке будут подвергаться гл. обр. третичный и отчасти вторичный, но не первичный цементит.
Из подробного рассмотрения диаграммы Fe-C явно выступает закономерная связь между физическими свойствами, диаграммой плавкости и структурой. В этой диаграмме каждая фаза носила название имени исследователя, изучавшего этот сплав. Такое обозначение очень неудобно, особенно при большом числе фаз, и поэтому в дальнейшем в М. каждая фаза диаграммы носит порядковую букву греческого алфавита (смотрите Спр. ТЭ, т. II). Для того чтобы рассматривать структуры сплавов, из них предварительно изготовляют шлифы. Для этой цели из исследуемого изделия вырезают кусок, обычно квадратного или прямоугольного сечения со стороной от 10 до 20 миллиметров, и такой толщины, чтобы его удобно было держать в руках (5—10 миллиметров). Грань, на которой надо изготовить шлиф, сперва обрабатывают подпилком, а затем подвергают шлифовке наждачной бумагой, начиная от грубых и доходя до самых мелких номеров (бумага Hubert, Fortin, французская Emery 0-000000). Переходя при Шлифовке с одного номера на другой, направление движения полировки изменяют на 90° и шлифуют до тех пор, пока штрихи предыдущего номера не будут стерты более мелким; на вкл. л., 45, показана при увеличении в 100 раз поверхность шлифа. С наждачной бумаги шлиф переносят на поли-ровальную бумагу (Potee), которая имеет шесть номеров зерна, после чего полировку заканчивают на полировальном станке; на диск последнего при этом надевают сукно, смачиваемое вр время полировки водой с взболтанной в ней мутью глинозема; номера этого полировочного порошка носят названия: «получасовой», «суточный» и т. д. (муть падает во время отстоя на дно в течение 30 мин., 1 дня и т. д.).
На вкл. л., 46—48, показаны микрофотографии (увелич. в 100 раз) шлифов: 46—плохо подготовленный, 47—тот ___
же шлиф с проявленной структурой, 48—тот же шлиф хороню при- _
готовленный. Проявле- 1 1
ние структуры заключается в том, что поверхность шлифа обычно погружается в очень сла
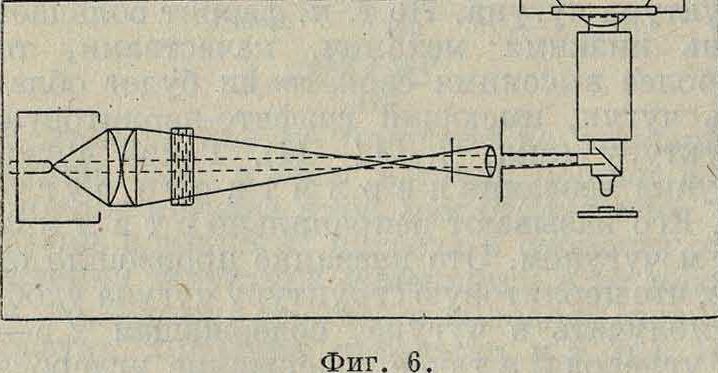
бый раствор кислоты (1—2%-ный). Имеются и другие травители (смотрите Микроструктура). В результате получаются картины, образцы которых приведены на приложенных снимках. В хорошо оборудованных лабораториях шлифовка и полировка производятся на станках, и время, потребное для изготовления шлифа, у опытных работников равняется 15—30 мин. Шлиф рассматривают под микроскопом. Так как сплавы непрозрачны, то рассмотрение шлифа возможно только в отраженном свете. Освещение бывает или боковое (фигура 6) или нормальное к поверхности шлифа. Первое применяется для малых (менее 50), а второе для больших увеличений. Металлографический микроскоп устроен т. о., что возможно как рассматривание шлифа, так и фотографирование его. Увеличения, применяемые для этой цели, обусловливаются типом рассматриваемой структуры: для мартенсита и сорбита берется увеличение 1 000, для зернистого или крупнослойного перлита от 100 до 300. При таких увеличениях малейшее дрожание не дает возможности ясно наблюдать картину, и снимок при выдержке в несколько секунд получается^ размытым и неясным; поэтому микроскоп должен быть установлен на прочном фундаменте. Освещение применяется большей частью искусственное—от лампочки накаливания или от дугового фонаря. Как при рассматривании, так и при фотографировании пользуются светофильтрами. Объективы применяются апохроматические и ахроматические. У первых все лучи сведены в одну точку, а у вторых только частично. В этом отношении для ахроматов очень выгодно применение светофильтра, так как апохроматы, не давая окрашенных изображений, больше искривляют края их, чем ахроматы. Поэтому о качестве объективов лучше всего судить по микрофотографиям. Для рассматривания применяются компенсационные окуляры, которые корректируют изображения объективов; для проектирования (фотографирования) применяются проекционные окуляры. Фотографирование лучше всего производить на ортохроматич. пластинках с применением светофильтра. При больших металлографических микроскопах прилагается специальн. кассета, открывающаяся по частям; поэтому для определения времени выдержки очень полезно предварительно снять пробную пластинку с разновременными выдержками; проявив ее, можно выбрать наиболее подходящую выдержку. Для увеличений пользуются разными величинами. Американское об-во (American Society of Steel Treating) предлагает следующие стандартные увеличения: 10, 50,100, 150, 200, 500, 1000, причем применяется соответственное обозначение: например хЮО означает, что применено увеличение в 100 линейных единиц. Наилучшая глубина и тонкость изображения получаются от применения большой силы увеличения объектива, а не окуляра, хотя общий размер увеличения равен увеличению окуляра, умноженному на увеличение объектива. Увеличение или, как оптики говорят, «разрешение» объектива зависит от апертуры (смотрите) объектива, являющейся функцией коэфици-энта преломления среды. Поэтому для более сильного увеличения применяются иммерсионные объективы. В М. применяют водяную или масляную иммерсию; в последнем случае на поверхность шлифа наносят каплю кедрового масла с коэф-том преломления 1,4 (одинаковым с коэф-том преломления стекла объектива). После работы объектив обтирают мягкой тряпочкой, смоченной ксилолом, но ни в коем случае нельзя смачивать ом, эфиром или бензином, растворяющими лак, склеивающий линзы объектива. Максимальное увеличение микроскопа м. б. 5 000; предел этому увеличению кладет длина световой волны. Рентгеновский анализ, применяющий волны в 1 000 раз короче световых, дает возможность получать на фотографии снимки порядка атомных расстояний, но в этом случае получаются отпечатки не структурных составляющих, а порядок расположения атомов в крист. На вкл. л., 49—54. приведены рентгенограммы: а) крупно- и б) мелкокристаллических структур. При помощи
рентгенографич. анализа показано, что a-Fe отличается от y-Fe иными размерами молекулы кристалла, и т. о. выяснена существенная разница в аустенитовой и мартенсито-вой структурах; кройе того можно наблюдать деформацию кристаллической решетки сплава, размеры кристаллов (вкл. л., 55, 56) и их ориентацию при холодной обработке· (вкл. л., 57, 58). Металломикрос.коп является одним из важнейших приборов металлография. лаборатории, однако во многих случаях по одним только микрографиям нельзя построить диаграммы плавкости; для этой цели пользуются, как основанием, термин, анализом, результаты которого проверяются не только микроструктурой, но и другими методами. Из них особенно широкое применение в последнее время получил метод объёмных изменений—д илатометриче-с к и й; кроме того для железных сплавов применяют метод магнитных изменений, для цветных сплавов—э лектри-ч е с к и х изменений и др. Не вполне точным, но достаточным в первом приближении, является метод твердости по Бринелю (Роквеллу) или по склероскопу Шора. Это видно из диаграммы, изображенной на фигуре 3,
и охлаждающей среды, б0—первоначальную -разность t° образца и охлаждающей среды, t—время, С—удельную теплоту образца и К—константу, зависящую от природы вещества и охлаждающей среды; тогда потеря άθ тепла, с одной стороны, пропорциональна Θ и времени, а с другой—равна произведению теплоемкости С, умноженной па повышение ί° среды άθ:
άθ=ΚΘΜ=-Οάθ: = — > dt;
и О
-К I
In0-ln0o=-f ί; б=б0е с ; (1)
отсюда следует, что где через m обозначено — с,
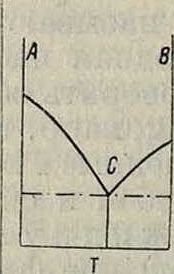
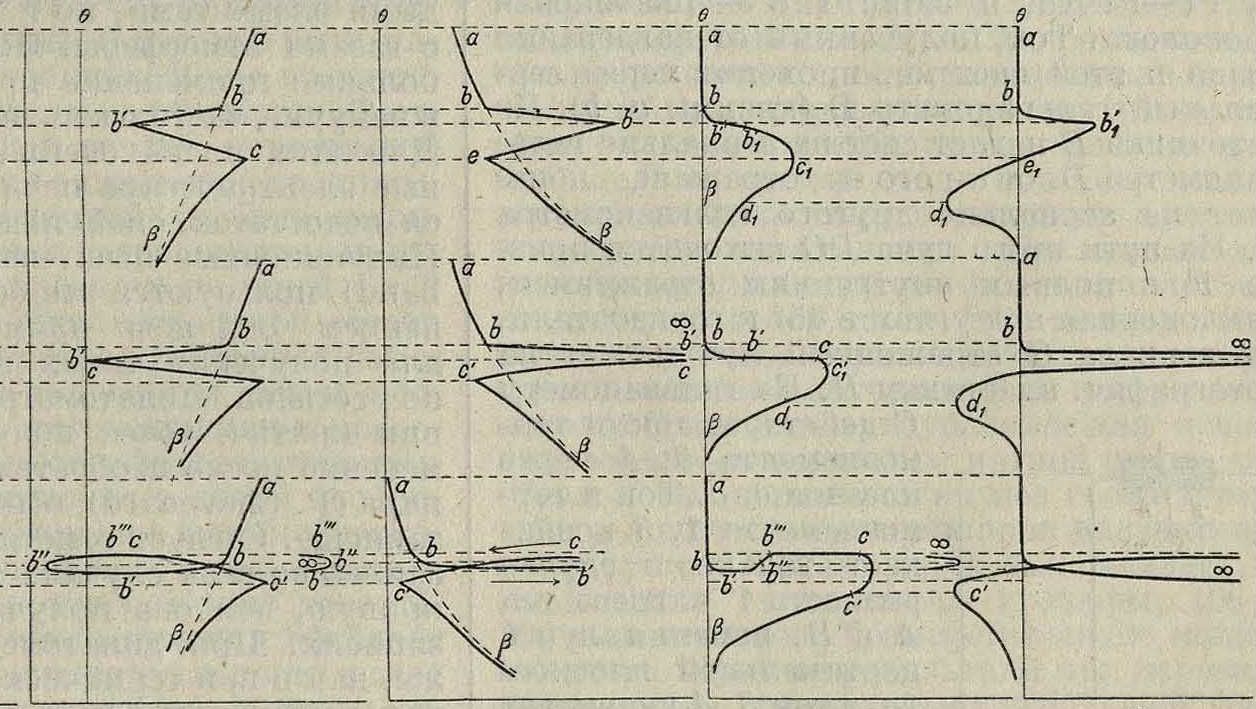
Для построения кривой пользуются прямоугольными координатами, где на оси×откладываются величины t, а на оси Y — Θ. Мы имеем по формуле (1) форму показательной кривой, имеющей асимптотой ось X. Если металл будет иметь превращение при какой-либо ί°, то голучится не плавная кривая (1), а показанная на фигуре 7, А, I, II и III [
Фиг.
7.
строка 2. Наиболее чувствительным и точным методом для построения диаграмм является термич. способ, причем измерение и запись <° производятся при помощи очень чувствительных термопар и гальванометров (ίθ~9Α). Формы кривых охлаждения м. б. различны (фигура 7):
1) Кривая—’температура (б). время (£): ί(θ. <)=0 (фигура 7, А).
2) Кривая—температура (в), скорость остывания f(d, ~ 0 (фигура 7, Б).
3) Кривая f(d, -~^=0 (фигура 7, В).
4) » /(б, б— б)=0 (фигура 7. Г).
5) » /(б, di°;P)= 0 (фигура 7, Д).
Для тел, не имеющих критич. точек^ при охлаждении, кривую функциональной зависимости можно получать следующим путем: обозначим через б разность t° образца соответствует замедлению выделения тепла,
II—остановке и 1II—переохлаждению (гистерезис)]. Построенная кривая на основании 2-го способа определения и на основании ф-лы (2) представляет прямую=тб^;
соответствующее изменение ее вследствие поевращений металла указано на фигуре 7, Б. Кривая, построенная по 3-му способу, будет равносторонняя гипербола yj=~, ее-
ли б=у, а х=х=-* 1-, ху=,*).Изменения, производимые превращениями металла, показаны на фигуре 7, В. При способе 4-м t° исдытуемогообразцасравнивают с эталоном, не имеющим превращений. Очевидно, если образец не имеет превращений, то б — б0 =0, поэтому кривая совпадает с осью У; превращения, имеющиеся в теле, изменяют ее, придавая форму, указанную на фигуре 7, Г. Способ 5-й указан на фиг, 7, Д. Из сравнения всех этих способов видно, что способ 5-й,
дифрренциальный, является наиболее чувствительным.
Из приборов, записывающих все эти кривые, остановимся на одном из наиболее чувствительных, на двойном диференциалыюм гальванометре .Саладен-Лешателье. На фигуре 8 приведена запись, полученная на фотографии. пластинке, а на фигуре 9—самый прибор, где А—материал, не обладающий превращениями в пределах исследуемых ί°, В— исследуемый м ггери-ал. Между А и В находится кусочек 2 проволочки из Сила-
V.
""
J/
ί I
I I I ! i I i
20 100 200 300 U00 500 600
800 900
1000
Фиг. ва Pt—Pt-Rh, а ветви 1 и 3—платиновая проволока. Ток, полученный от нагревания спаев в этой системе, проходит через зеркальный гальванометр D (клеммы а, Ь). Из источника Е падает свет на зеркальце гальванометра D, от которого он, отражаясь, попадает на зеркальце другого гальванометра О. На пути этого луча BG находится призма F с полным внутренним отражением, наклоненная под углом в 45° к горизонтали. От зеркала G отраженный луч падает на фотографии, пластинку Ы. На гальванометр G действует ток от термоэлемента 3, 4 через клеммы с d. Ток в термоэлементе 1, 3 возникает только в случае разности ί° нагрева тел А и В, изменяя луч в вертикальной плоскости, а ток 3, 4 указывает t° нагрева тела А, изменяя луч в горизонтальной плоскости. На фигуре 8—при нагреве до ί°=750° (точки о) нагрев обоих тел А и В был одинаков. В точке о тело В продолжало нагреваться, а А оставалось при той же так что получилась разница ор ~ 20°; после превращения ACi нагрев Е и продолжался ’ едина ко-
Фигура 9. во как для А, так и для
В. Затем во время охлаждения получилась остановка при температуре 710° с разницей 35°. Следует заметить, что превращения при нагревании и охлаждении происходят при разных ί°. Эта разница 750 — 710^40° называется гистерезис о м и особенно велика в присутствии Ni в стали, достигая 200-г300-у500°. При содержании 25—30% Ni сталь не имеет
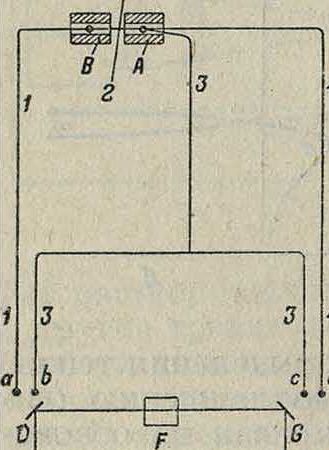
превращений при атмосферной ί°. Этим пользуются для получения необходимых структур, а следовательно и изучения соответствующих им свойств.
Для нагревания и плавления металлов применяются нагревательные печи, газовые или б. ч. электрические. Для лабораторных целей (главным обр. для исследований превращений в твердом состоянии) применяют трубчатые печи; для плавления при низких темп-pax (до 1 000°) можно пользоваться тигельными печами. Как первые, так и вторые обычно нагреваются обмоткой из нихро-мовой или платиновой проволоки или фольги. Для более высоких <° применяют печи Таммана (до 3 000°). Нагревателем служит цилиндрич. трубка из специального материала (углеродистою), концы которой замыкают первичную обмотку трансформатора накоротко. В этот нагреватель вставляется специальная пробирка, в которой производят плавление. Температура выше 2 0*00° в печах этого типа получается легко и быстро. Недостатком является то, что через стенки пробирки сплав легко науглероживается.
В настоящее время выяснилось, что металлы образуют сплавы не только с твердыми элементами, но и с газами, например с газами атмосферы. Поэтому получает все большее применение производство сплавов в вакууме, часто очень высоком (10~4 миллиметров Hg). Для этих целей очень удобны индукционные электрические печи, в которых избегается недостаток, свойственный печи Таммана. Индукционные печи, например печь Рибо (Ri-baud), пользуются все большимраспространением. Эти печи применяют во Франции для получения таких сплавов, как aciers de pr6cision. Дилатометрии, метод определения критич. точек получил широкое применение после изобретения аппарата Шеве-нара (Р. Chevenard), особенно с фотографии, записью. Следует отметить, что фотографии, запись во всех случаях дает более плавную кривую, чем она получается при механич. записях. При дилатометрии, анализе, так же, как и при термическом, м. б. применены диференциальпые методы определений. Оказалось, что для фиксации многих превращений дилатометрии, метод дает очень чувствительные показания.
Явления превращений свойственны не только сплавам чистых металлов, но и их химии, соединениям. На этом основании все правила и методы М. широко применяются там, где имеют место растворы—жидкие (водные) или твердые, например силикаты.
Лит.: Витторф Η. М., Теория сплавов,
СПБ, 1909; Евангулов М. Г. и Вологдин С. П., Металлография, 19D5; Б а б о ш и н А. Л., Металлография и термин, обработка железа, стали и чугуна, т. 1—4, П., 1916—18; его же, Термин, обработка обыкновенных и специальных сортов стали, Москва, 1926; Бартельс Н. А., Металлография и термин, обработка металлов, М.—Л., 1930;«ЖРМО», 1910—28; «Металлург», Л., ab 1926; «Известия Ин-та физ.-хпм. анализа», Л.; Т а га m a η n G., Lehrbucii d. Metallographie, 3 Aufl., Lpz., 1923; Schwarz M., Metallphxsik, Leipzig, 1925; Czocliralski J., Moderne Metallkunde in Theorie u. Praxis, B., 1924; Goerens P., Einfiihrung in d. Metallographie, 5 Aufl., Halle a/S., 1926; G u i 1 1 e t, L., Les mttliodes d’dtude des alliages mitalliques, P., 1923; Guil-letL. etPortevin A., Prdcis de mitallographie et de macrograpbie, Paris, 1 924; D e s c h С. H., Metallography, 3 ed., Londi n, 1922; Desch С. H., Metallographie, Handbuch d. angew. physikal. Chemie, hrsg. v.
Ст. Bredig, В. 12, Lpz., 1914: Rosenhain W., An Introduction to tl>e Study of Physical Metallurgy, 2 ed., London, 1910; S a u v e u r A., The Metallography a. Heat Treatment of Iron a. Steel, N. Y., 1926; В e n e-dies C., Metallographic Researches, N. Y., 1926; Greaves R. a. Wrighton H., Pract. Microscopical Metallography, L., 1924; HeynE. u.BanerO·, Metallograpliie, 3 AuiI., В., 1—2,.B., 1926; Ruer R., Metallographie in elementarer Darstellung, Hamburg— Lpz., 1922; Guertler W., Metallographie, В. 1, B., 1909—12, B. 2, B., 1913—26, B. 3 (не закончен); C h a t e 1 i e r H., Introduction 4 l’6tude de la mbtal-lurgie, Paris, 1912; Hanemann H. u. Schrader A., Atlas Metallographicus, Lfg. 1—7, Berlin, 1927—29 (изд. продолжается); «Ztschr. fiir Metall-kimde», B.; «Ztschr. fiir anorgan. u. allgemeine Chemie», Lpz.; «The Journal of the Inst, of Metal», L.; «Rdvue de Metallurgies, P.; «Heat Treating a. Forging», Pittsburg; «Handbook ASST», Cleveland, Ohio, 1929; Werkstoff-Handb., Stahl u. Eisen, Diisseldorf, 1927; Werkstoff-Handb., Nichteisenmetalle, B., 1927. К. Грачев.