 > Техника, страница 62 > Молекула
> Техника, страница 62 > Молекула
Молекула
Молекула, минимальная частица вещества, способная к самостоятельному существованию при Д! иных условиях темп-ры и давления и обладающая основными химическими свойствами, присущими данному веществу в большом количестве. Свойства тела обусловлены свойствами и расположением его молекул. Физически М. представляет собою агрегат атомов большей или меньшей степени сложности, от простейших одноатомных JVL, какими являются М. благородных газов (смотрите) и М. большинства ме-
таллов (в состоянии пара), двух-, трехатомных (М. большинства простых газов) и до более сложных М., содержащих десятки и сотни атомов (М. орган, bi щгств). Обычно различают М. гоме о полярные, или атомные,и гетерополярные, или ионные. Первые построены из электрически нейтральных атомов, вторые—из ионов (смотрите),то есть заряженных атомов или групп атомов (радикалов). Вещества, состоящие из атомных М., отличаются отсутствием электролитич. проводимости, малой диэлектрической постоянной, заметной летучестью и т. д. Характерным признаком ионных М. являются, наоборот, электролитич. диссоциация соответствующих веществ в жидком состоянии или в растворе, большая диэлек-трич. постоянная, склонность к образованию молекулярных комплексов—ассоциации (смотрите). Элементами кристаллических pi шеток этих веществ являются ионы. Гомеополярными веществами являются большинство газов, иапр. Н2, 02, Nj, и большая часть органич. соединений. Гетерополярны большинство к-т и их солей, в особенности галоидные соли щелочных элементов, а также вода, аммиак и т. д. Однако разделение веществ на гомео- и гетерополярные не всегда м. б. строго проведено. Целый ряд веществ помещается между этими классами, по одним признакам примыкая к гомеополярным веществам и по другим—к гетерополярным.
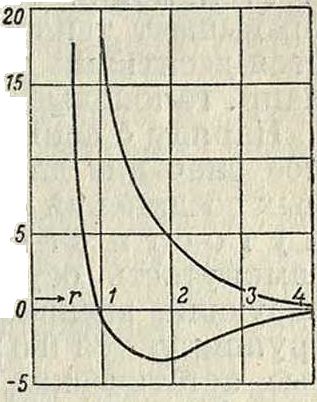
Внутреннее строение М. в основном напоминает строение атомов. Главной особенностью М. является наличие двух или нескольких ядер (если не рассматривать одноатомные М.). Благодаря этой особенности М. приобретает ряд новых свойств, отличных от свойств, присущих атому. На основании модельных представлений, развитых в теории строения атома (смотрите Атомная теория), можно трактовать всякую М. как некоторую пространственную конфигурацию положительно Заряженных ядер, окруженных отрицательными зарядами—электронами. В атомных М. электроны располагаются симметрично относительно всех ядер. Асимметричное распределение электронов в ионной молекуле приводит к тому, что различные части ее получают противоположные заряды и М. оказывается полярной. При образовании М.из атомов происходит перераспределение атомных электронов соответственно новому образованию—моле куле. В этом перераспределении принимают участие только внешние, или валентные, электроны атомов, которые образуют внешнюю эле ктронную оболочку М., определяющую бблыную часть ее свойств и прежде всего оптич., химич. и электрич. свойства. Структура внешней электронной оболочки М. в основном аналогична структуре оболочек атомов. Этим и объясняется тот факт, что многие М. во многих отношениях аналогичны соответствующим атомам. Так, молекула СО аналогична Mg (ср. соединения С02 и MgO, и т. д.), молекула CN аналогична атому С1 (соединения C2N2 и С12, HCN и НС1); способность органич. радикалов замещать соответствующие атомы также свидетельствует об аналогичной структуре их электронных оболочек. Количественный расчет той электрической системы, которую мы называем М., представляет однако пока непреодолимые матема-тич. затруднения. Лишь в случае простейших М. оказалось возможным решение задачи, и то в первом приближении. На помещенной диаграмме приводится результат этого решения для случая М. водорода. Здесь на оси абсцисс отложено расстояние г между ядрами водорода, а на оси ординат—потенциальная энергия Е молекулы (в V). Нижняя кривая, обладающая минимумом энергии, отвечает устойчивому образованию, то есть нормальной М. Н2, верхняя же кривая соответствует упругому столкновению атомов (Е > 0). Заметим, что подобные расчеты основаны на методах, развитых в волновой механике, и только благодаря последней стали возможными. Впрочем это не относится к ионным М., представляющим в отношении их матема-2Мтич. расчета значительные преимущества, пос-1^
. кольку главная часть их t энергии обусловлена кулоновским притяжением образующих их ионов. В случае простейших М.— двухатомных—здесь оказалось возможным вычислить целый ряд молекулярных к о н-стант (смотрите ниже); в случае же более сложных М. удалось установить их размеры и форму. Так, в М. воды Н20 ионы Н‘, Н и О" располагаются в вершинах равнобедренного тр-ка, а в ионе С03" углеродный ион С”” помещается на перпендикуляре, восставленном из центра правильного тр-ка, в вершинах которого сидят ионы О", и т. д.
В непосредственной связи со степенью асимметрии электронной оболочки М. стоит склонность М. к образованию б. или м. сложных молекулярных комплексов (ассоциация и комплексообразование). Степень асимметрии М. количественно, характеризуется дипольным моментом (смотрите Диполь молекулярный). Полярные М., отличающиеся большим дипольн. моментом, взаимодействуют как магнитики. Поэтому именно этот класс М. должен обладать наибольшей склонностью к ассоциации (и вообще к комплексообразойанию). Действительно известно, что такие вещества, как вода, ы, кислоты и т. д., принадлежат к классу сильно ассоциирующихся веществ. Эта ассоциация проявляется в отклонении от газовых законов, от правила Трутона, в сильной адсорбируемое™—поверхностной активности (смотрите Капиллярные явления, Адсорбция). Громадное значение для ассоциации и комплексообразования имеет п о-ляризация (или деформация) электронных оболочек молекул, имеющая место при их сближении. Возникающий в результате поляризации индуцированный электрический момент и способствует ассоциации. Поляризация особенно сильна в случае ионов, которые при нормальном давлении газа или в растворах являются сложными комплексами, возникшими в результате притяжения ионом им же поляризованных окружающих его М. Энергия, связанная с поля-

ризационными силами и с силами взаимодействия диполей, составляет обычно несколько тысяч cal на моль. Эта энергия имеет следовательно тот же порядок величины, что и теплота испарения. Это показывает, что силы, связывающие молекулы данного вещества в твердом и жидком состоянии, имеют одинаковое происхождение с силами, которые обусловливают ассоциацию. Сказанное однако имеет место лишь в случае веществ, кристаллизующихся в молекулярные решетки. В случае же веществ, образующих ионные кристаллические решетки, силы взаимодействия между конденсированными М. настолько велики, что М. теряют свою индивидуальность. В связи с этим теплота испарения и сублимации таких веществ значительно превышает теплоту ассоциации и выражается десятками тысяч cal на моль. Таковы например галоидные соли щелочных элементов.
Наряду с асимметрией весьма существенное знач ние для образования молекулярных соединений имеет степень замкнутости электронной оболочки М. Эта замкнутость осуществляется тем, что образующие внешнюю оболочку М., электроны группируются попарно, образуя замкнутые астатические системы (ряд фактов заставляет приписать электрону магнитный момент), не принимающие участия в валентной связи. Именно отсутствием замкнутости электронной оболочки М. объясняется тот факт, что все М. с нечетным числом электронов (т. наз. «нечетные» М.) являются химически ненасыщ! иными и особ· нно склонны к ассоциации. Таковыми являются Μ.: N02, ассоциирующиеся в (N02)2; CN, существующие в обычных условиях в виде М. (CN)2, HgCl—Hg2Cl2, Na—Na2 и т. д. В связи с незамкнутостью электронной оболочки М. 02, S2, Р2 и т. д. стоит и факт существования М. 03, 04, Se, S8, Р4 и т. д. Впрочем М., ассоциированные вследствие незамкнутости электронных оболочек (N204. C2N2, Р4 и т. д.), должны быть скорее рассматриваемы как обыкновенные химич. соединения (характеризующиеся определенными стехиометрии. соотнош. ниями); однако часто очень трудно провести грань между молекулярным и обычным соединением. Особенно разительный пример такой неопределенности имеем в М. 04, теплота диссоциации которой на 2 02составляет всего 130 cal на моль.
Одним из главных свойств М., отличающих ее от атома, является наличие (наряду с поступательным движением М. как целого) вращательного движения М. и колебательного движения ее частей. Колебательное и вращательное движение М. проявляется прежде всего в теплоемкости (смотрите) последней. Теплоемкость многоатомных газов всегда больше теплоемкости одноатомных, так как при нагревании первых нек-рая дополнительная часть энергии идет на возбуждение колебания и вращения. Согласно теории квантов на каждую степень свободы этих родов движения приходится количество энергии W (отнесенное к молю), равное
1 N0hv NqIiv ’ п hi
W =
(1)
где v — частота колебаний (оборотов) вращающейся Μ., Т—абс. температура, R— газовая постоянная, N0—число Авогадро и h—постоянная Планка, равная 6,55 -10-27 эрг/ск. При малых значениях v (1) переходит в -g RT. Так как частоты вращения М.
как правило малы, то величина ’ RT с достаточной точностью может выражать соответствующую часть вращательной энергии М. Доля теплоемкости, отвечающая (1) или более простому выражению * RT, получается диференцированием по Т. Что касается числа степеней свободы, то оно для вращательного движения равно числу г осей, вокруг которых М. может вращаться, и для колебательного— числу j частот собственных колебаний Μ. Т. о. для молярной теплоемкости (при постоянном объёме) получается следующее выражение:
N0hvj
NqIiv j
(~)
Во (2) vj обозначает одну из частот собственных колебаний М. Заметим, что для двухатомной М. г=2 и j=1.
Другой областью, где проявляются внутренние движения М., является область молекулярной спектроскопии. Благодаря наличию колебаний и вращения М. спектры последних (линейчато-полосатые) представляются значительно более сложными, чем сравнительно простые (линейчатые) спектры атомов. Анализ линейчато-полосатых молекулярных спектров позволяет с большой точностью определить такие важные величины, как частоты соб-ств( иных колебаний г, момент инерции 1 и теплоту диссоциации молекулы Ώ. Две первых величины входят в химическую константу М. Кроме этих величин константами, характеризующими каждую данную М., можно считать ее диаметр (размеры), расстояние г между атомами в М., углы, определяющие форму М. и электрич. момент р М. Диаметр М. определяется из коэф-тов внутреннего трения или диффузии (газы), при помощи рентгеновского анализа (твердые тела) или из тонких мономолекулярных пленок на поверхности жидкостей, и имеет значения, колеблющиеся для разных веществ в пределах от 2 до 10 А. Диаметр большинства М. неорганических веществ выражается числом, близким к 3 А. Расстояние между атомами или отдельными группами атомов М. с большой степенью точности вычисляется из моментов инерции, определяемых оптич. путем, или из рентгенографических иссл. дований. Так, для расстояния между атомами Н в М. Н20 получается число 1,09 А, а для расстояния м жду атомами О и Н—0,87 А. В М. С02для расстояния между атомами О получается число 1,95 А, а для расстояния между атомами С и О—0,96 А, почти ровно вдвое меньше. На основании этих чисел заключают, что М. Н20 имеет форму тр-ка со сторонами 1,09 и 0,87 А (две одинаковые стороны, ср. выше), а в М. С02 все три атома располагаются почти точно на одной прямой. Повидимому в связи с этим обстоятельством находится ничтожно малый электрич. момент М. С02. Аналогичные исследования внутримолекулярных расстояний в случае сложных органич. М. показывают, что атомы С здесь нередко располагаются на зигзагообразной линии, сохраняющей постоянные углы. Одним из методов определения электрического момента М. является метод, основанный на изучении зависимости д и-электри ческой постоянной от ί°. Электрич. моменты μ большинства полярных молекул имеют значения, близкие к 1 -10“18 абсолютных электростатич. единиц, достигая однако в случае особенно асимметричных молекул величины от 4 10-ls до 6· Ю-ι* LCeH6N02, C6H4(N02)2, CH3C6H2(N02)3] и падая до нуля в случае симметричных М. Влияние асимметрии М. на ее дипольный момент ясно обнаруживается при последовательном замещении хлором атомов водорода в метане (СН4),что видно из следующего: Молекула. СН4 СН3С1 СН2С12 СНС13 СС14μ -ИГ18. О 1,97 1,59 0,95 О
Лит.: Кондратьев В. Н., Семеновы. Н. и Харитон Ю. Б., Электронная химия, М.—Л., 1927; Кондратьев В. Н., Физич. и химич. свойства молекул, М.—Л., 1928; Лондон Ф., Теория квантов и химич. связь, «УФЫ», 1929, 9, вып. 2, стр. 167; Lewis G., Valence a. the Structure of Atoms a. Molecules, N. Y., 1925; M e c k e R., Bandenspektra u. ihre Bedeutung f. die Chemie, B., 1929; DeoyeP., Polar Molecules, N. Y., 1929. В. Кондратьев.