 > Техника, страница 62 > Молекулярный вес
> Техника, страница 62 > Молекулярный вес
Молекулярный вес
Молекулярный вес, относительная масса (вес) молекулы данного вещества (смотрите Молекула) по отношению к массе атома кислорода, принятой за 16,000. При этом М. в водорода—относительная масса наиболее легкой молекулы—Н2= 2,016. Понятие М. в можно обобщить, распространив его на любую частицу, способную существовать отдельно; совокупность таких частиц характеризует физико-химическое состояние вещества. Так, многие вещества в жидком состоянии содержат двойные, тройные и т. д. (ассоциированные) молекулы (смотрите Жидкости). Такие же ассоциированные молекулы содержатся иногда и в парах. Отдельные частицы—мицеллы—в коллоидных растворах являются агрегатами, состоящими из большого числа молекул. Простейшими молекулами данного вещества являются при этом наименьшие из возможных составляющих его частиц, отвечающие его наиболее простой структурной ф-ле; наличие этих простейших молекул обнаруживается одним из методов определения М. в (смотрите ниже), иногда при специально выбранных физич. условиях (например при высокой ί°). Простейшие молекулы простых веществ одноатомны; таковы например молекулы металлов в парообразном состоянии и благородных газов. Молекулы других простых веществ, газообразных при обычных условиях, б. ч. двухатомны (Н2, 02, Ν2, С12), но при высоких 1° диссоциируют на одноатомные. Реальные тела (жидкости, пары) следует рассматривать как систему из нескольких видов молекул, находящихся между собою в подвижном равновесии (смотрите Равновесие физико-химическое).
Методы определения М. в можно разделить на суммарные, которые дают М. в тела, то есть средний вес отдельных образующих тело частиц (часто различных), и элементарные, дающие М. в каждого вида частиц, содержащихся в теле. Только элементарные методы дают колич. представление о характере различи, частиц, образующих тело. В физико-химич. практике наиболее распространены суммарные методы определения М. в.; они вполне достаточны для тех случаев, когда тело практически содержит молекулы только одного вида; нек-рые из этих методов отличаются высокой точностью, позволяющей определять из полученных данных и точные атомные веса (физич. методы определения ат. в.). К суммарным методам относятся: 1) методы определения М. в газообразном (парообразном) состоянии, основанные на законе Авогадро (смотрите Газ); 2) осмотич. методы, дающие М. в растворенных веществ и основанные на термо-динамич. законах учения о разбавленных растворах; 3) кинетич. методы определения М. в.; к ним относятся измерения скорости истечения газов (т. н. эффузии), определение коэф-та диффузии (смотрите Диффузия) и метод ультрацентрифугирования, имеющий особенно большое значение для тяжелых молекул и коллоидных частиц; 4) определение среднего М. в жидкости по изменению поверхностного натяжения с t° (смотрите Поверхностное натяжение, Капиллярные явления, Жидкости).
1. Зная плотность пара вещества по отношению к водороду (Ds) или к воздуху (DB) при данных условиях (ί°, р) и считая пар идеальным газом, находим его М. в (М) по формуле:
М=2,016DH (или M s 2Dц). (1)
Т. к. плотность воздуха по отношению к водороду=14,4, то
М — 28,9511b (или М а 29_Од); (2)
зная число Авогадро N= 6,06 -1023 (число молекул в 1 г-мол.), находим абсолютную массу молекулы в г:
и _ м
т ~ N ~ 6,06 -Тог3
Из основной постоянной закона Авогадро— нормального молярного объёма идеального газа vm=22,416 л/г-мол. (смотрите Газ) можно найти М. в., измерив объём v, занимаемый данной произвольной массой газа (пара) Р при нормальных условиях:
М=~ Р ^ —4 · Р; (3)
V V’ 4
р
-=g—вес 1 л газа при нормальных условиях. Т. к. условия «идеальности» газа или пара удовлетворяются далеко не строго, то ф-лы (1), (2), (3) дают, вообще говоря, только грубо приближенный М. в.; однако в большинстве случаев это оказывается достаточным, т. к. точный М. в вычисляется затем по химич. формуле; предварительное же физическое определение необходимо чтобы решить, соответствует ли молекуле простейшая или кратная (двойная, тройная и т. д.) ф-ла. В случаях весьма точных измерений М. в газов, например когда ими пользуются для определения основных ат. в (О, N, Н и др.—
работы Гюи, Ледюка, Морлея и др.),—во все ф-лы вводятся поправки на уклонение газа от идеально-газовых законов; например вместо ф-лы (3) получаем:
22.416 _
^ ~ i + л 9
(т. к. 22,416 л данного реального газа содержат при нормальных условиях не 1, а 1 + λ г-мол.; поправка Я определяется из уклонений от идеально-газовых законов). Т. о. определение М. в паров сводится к решению газометрической задачи и осуществляется одним из следующих способов (при f=Const): а) Р определяется взвешиванием данного объёма пара v под данным давлением р (метод Дюма, точное определение веса 1 л газа при нормальных условиях),
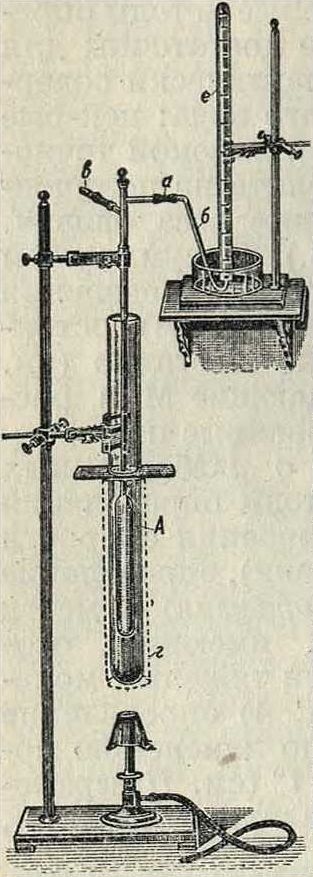
б) Даны р, Р, определяется v—наиболее общепринятый метод определения плотности паров В. Мейера; v измеряется по объёму вытесненного воздуха, см. фигура Главную часть прибора составляет стеклянный сосуд А, имеющий вверху отверстие для введения ампулы с испытуемым веществом, газоотводную трубку аб и приспособление в для опускания ампулы на дно сосуда (стеклянная палочка, укрепленная подвижно); нижняя часть сосуда окружена обогревательной оболочкой г. Навеска испытуемого вещества в ампуле помещается на палочку; сосуд А нагревают до постоянной ί°, после чего выдвиганием палочки за,-стапляют ампулу упасть на дно сосуда, где она разбивается. Вещество, испаряясь, вытесняет равный объём воздуха через трубку б в сосуд е, где его и измеряют, в) Даны υ, Р, определяется р (метод Гей-Люссака—Гофмана); для этой цели очень удобен прибор Блек-мана, в к-ром в стеклянную трубку с навеской данного вещества запаивается градуированный капилляр, закрытый с одного конца находящимся в нем ртутным столбиком. При помещении трубки в термостат вещество переходит в пар при данной ί°, и давление, производимое им, легко вычисляется прямо по перемещению ртутного столбика в капилляре, то есть по сжатью объёма воздуха, заключенного в капилляре.
2. Осмотические методы основаны на том, что, как показывает термодинамич. теория растворов, понижение t°3ame. и повышение ί°κ„«. в слабых растворах пропорциональны концентрации, то есть числу отдельных частиц (молекул, ионов) в единице объёма; при расчете на 1 молекулу (т. e. 1 г-мол.) они не зависят от природы растворенного вещества и характерны для данного растворителя (смотрите Криоскопия). Для коллоидных растворов например осмотич. давление и вели-чйны депрессии очень малы, что указывает на весьма высокий М. в их частиц (доходящий до 10 000—100 000).
3. М. в газов и паров, как и плотность их, можно определять по скорости V истечения газа из малого отверстия в тонкой пластинке, так к; к скорость эта обратно пропорциональна ΫΏ или ΫΜ (Бунзен):
ЙА = V*.
М 2 V]
На этом принципе основан аппарат Шиллинга для определения плотности светильного газа. Таким же образом меняется с М. в и скорость диффузии газов, на чем основан метод разделения изотопов в газообразном состоянии [напримерхлора—Гаркинс (Harkins)]. Интересным новым кинетич. методом определения М. в коллоидно растворенных веществ является метод ультра центрифугирован и я, введенный Сведбергом и его учениками (1924). Центрифугируемая со значительной скоростью плоскопараллельная кювета кинематографируется при прохождении через определенное положение на окружности вращения. Полученный фильм, дающий ряд последовательных состояний седиментирующего под действием центробежной силы коллоидного раствора через одинаковые промежутки времени, микрофотоме-трируется, что дает концентрацию коллоидных частиц на любой высоте сосудика. Определяя отношение этих концентраций Сх, С2для любых двух высот ftj, h2, получаемое после долгого центрифугирования в результате достижения седиментационного равновесия, то есть равновесия между центробежной силой и диффузионными силами, находим М. в по формуле:
М =
д. кт
- Во 0)2
In
Ci
!ϋι
2
где со — угловая скорость вращения, а П, и Х>2 — соответственно плотности коллоидных частиц и растворителя. Аналогично можно определять М. в также и по диффузионным измерениям.
Основным «микрометодом» — элементарным методом определения М. в., позволяю щим измерять массы отдельных заряженных частиц (атомов и их групп), является метод Дж. Дж. Томсона, усовершенствованный Астоном в форме массового спектрографа, дающего возможность с большой точностью определять ~ (отношение заряда к массе), а следовательно и массу т положительно заряженных частиц, образующих каналовые (анодные) лучи; см. Изотопы. Этим методом были определены ат. в отдельных изотопов. Для водорода т. о. были измерены массы молекул Н2=2,012-^2,018 и Б3=3,025-1-3,027 (считая С”=6).
Лит.: Менделеев Д. И., Основы химии,. 9 изд., т. 1—2, М.—Л., 1927—28; Смит А., Введение в неоргапич. химию, пер. с 3 нем. изд., под ред. с доб. А. В. Таковского, вып. 1—2, М.—Л., 1929; Вознесенский С. А. и Ребиндер П.А., Руководство к лабор. работам по физич. химии, М.—Л., 1928; РебиндерП. А., Об ультрацентрифуге Сведберга, «УФН», 1926, т. 6, вып. 4—5, стр. 397; Бирон Е. В., Учение о газах и жидкостях, М.—П., 1923; А с т о н В. Ф., Изотопы, пер. с англ.,. М.—П., 1923; Handb. d. Arbeitsmethoden in d. anor-gan. Cbcime, lirsg. v. A. Stahler, B. 3, Halfte 1, B.—Lpz. 1913; Houben J.—Wey] T., Die Methoden d. organ. Chemie, 3 Aufl., В. 1, Lpz., 1926; Arndt K. Handb. d. phys.-chem. Technik, 2 Aufl., Stg., 1923,-
Svedberg Т., «Kolloid-Ztschr.», Dresden, 1930, В, 51; Alexander J. Colloid Chemistry, v. 1 — Theory a. Methods, N. Y., 1926; M о r 1 e у ’ «Ztsc.hr. fur phys. Chem.», Lpz., 1896, B. 20, p. 1, 68’. 242, 417; Suye Ph. A., «Journ. de Chimie phys.», Peris. 1907, t. 5, p. 203, 1908, t. 6. p. 769, 1910. t. 8, p. 222; Berthelot D., «CR», 1907, t. 144, p. 76, 194, 269, 145, 317; Beckmann, «Ztschr. fiir phys. Che-. mie», Leipzig, 1888, B. 2, p. 638, 715, 1901, B. 51, p. 337, B. 53, p. 130; Blackmann Ph., ibid., 1908, B. 63, p.48,381, 635, 1909, B. 65. p.549; Th о m s ο n J. J., Rays of Positive Electricity a. Their Application to Chemical Analysis, 2 ed., L., 1921; Aston, «Nature». L.—N. Y., y. 104, p. 334—393. П. Ребиндер.