 > Техника, страница 63 > Муравьиная кислота
> Техника, страница 63 > Муравьиная кислота
Муравьиная кислота
Муравьиная кислота, НСООН, простейшая из карбоновых к-т жирного ряда (смотрите Кислоты). В природе встречается в различных частях и органах животных и растений; образуется при неполном сгорании органич. веществ и в результате разнообразных био-химич. реакций, например в процессах брожения. М. к. является одним из давно известных органич. веществ; впервые она была обнаружена в муравьях, откуда и получила свое название.
Свойства. М. к.—жидкость с едким запахом, сильно раздражающая слизистые оболочки; при попадании на кожу вызывает долго не заживающие болезненные ожоги; Гпл. М. к. +8,3°; i°Kun. 100,8° при 760 миллиметров, 30,5° при 50 миллиметров и 21,8° при 25 миллиметров; уд. вес 1,2201; теплоемкость 0,522 (от 18 до 56°), 0,552 (от 84 до 150); теплота испарения на 1 з-моль 4,8 cal. М. к. легко растворяется в е и эфире; с водой М. к. смешивается в любом отношении. Смесь М. к. с водой, содержащая 22,5% воды, имеет постоянную ί°—., равную 107,1°, и отвечает составу 4 ПСООН+З Н20. Уд. в водных растворов М. к.—смотрите ниже. Являясь первым членом гомологического ряда жирных к-т, М.к. резко отличается от своих гомологов наличием
Удельные веса водных растворов М. к.
| Крепость раство- | Г) 20 | Крепость раство- | Г) 20 |
| pa М. к. в % | pa М. к. в % | ||
| 10.. | 1,0247 | 60. | 1,1425 |
| 20.. | 1,0489 | 70. | 1,1656 |
| 30.. | 1,0730 | 80 .. | 1,1861 |
| 40.. | 1,0964 | 90. | 1,2045 |
| 50.. | 1,1208 | 100. | 1,2201 |
восстановительной способности, которою остальные жирные кислоты не обладают: нсоон + о=н2о + со2.
Поэтому М. к. осаждает при нагревании из водных растворов солей серебра металлич. Ag; окись ртути она восстанавливает в Hg; HgCl2 превращает сначала в HgCl, а затем— в металлическую Hg. Причиной восстановительных свойств М. к. является наличие в ней альдегидной группы —С^ °. Другим характерным свойством М. к. является распад по уравнению:
НСООН=СО+ Н20,
совершающийся под влиянием водоотщепляющих веществ (например конц. серной к-ты); эта реакция служит удобным приемом для получения чистой окиси углерода в лабораториях. В присутствии мелко раздробленного родия (аналогично влияют 1г и Ru) М. к. каталитически распадается на С02 и Н2. М. к. принадлежит к числу очень сильных к-т: константа ее диссоциации в 12 раз больше соответствующей константы для уксусной к-ты. Соли М. к. — формиат ы—
б. ч. устойчивы и хорошо кристаллизуются (обычно без кристаллизационной воды), но с некоторыми тяжелыми металлами, например Ag, Au и Hg", М. к. солей не образует.
Получение М. к. Для получения М к. могут быть применены весьма разнообразные методы, из которых только немногие представляют технич. интерес. Окисление метилового а, омыление синильной кислоты или хлороформа, разложение хлорала щелочами ит. н. реакции приводят к образованию М. к., но практич. значения не имеют. Прежде для получения М. к. пользовались почти исключительно реакцией, открытой Вертело и заключающейся в термич. разложении двухводной щавелевой кислоты в присутствии глицерина:
С2Н»04· 2Н»0=НС00Н +2Н20 +С02.
щавелевая кислота
Роль глицерина состоит в том, что он образует с отщепляющейся от щавелевой кислоты М. к. сложный эфир, который в следующей стадии процесса разлагается кристаллизационной водой щавелевой кислоты на М. к. и глицерин:
I. НСООН + С3Н5(ОН)3=СзН5{ОН)2· О · СНО + Н20;
глицерин
II. С3Н5(0Н)2*0 · СНО +Н20=С3Нв(0Н)з + НСООН.
Несмотря на то, что этот способ не требует сложной аппаратуры и дает весьма хороший выход, он оказался нерентабельным, вследствие высокой стоимости исходного продукта (щавелевой кислоты). Только после того как был разработан дешевый способ получения формиатов, а из них—свободной к-ты, получение М. к. получило надежную экономии. базу. В виду того, что щелочные соли М. к. при нагревании превращаются в оксалаты, они в настоящее время применяются как исходный продукт для приготовления щавелевой кислоты. Все современные способы производства М. к. исходят из формиатов, получение которых основано на реакции между окисью углерода и щелочами. В качестве последних пригодны не только гидраты окисей щелочных или щелочноземельных металлов, но и аммиак и органические основания. Несмотря на то, что в патентной литературе встречаются· самые разнообразные видоизменения этой общей реакции как по способу проведения, так и по характеру щелочного компонента, в технике в настоящее время применяются только три способа, пользующиеся в качестве исходного продукта либо едким натром, либо известью, либо солевыми смесями, в водных растворах которых образуется едкий натр.
1. Получение формиата из едкого натра. При действии СО на NaOH получается формиат натрия:
NaOH + СО=HCOONa,
из которого действием минеральной кислоты может быть приготовлена М. к. Однако это-превращение при обыкновенной темп-ре и даже при 100° протекает чрезвычайно медленно. Для ускорения реакции Мерц и Тиби-риса (Tibiriija) [г] в 1880 г. предложили пользоваться вместо NaOH натронной известью. Этим путем 80% NaOH, находящегося в натронной извести, превращается в формиат; однако и в этом случае реакция протекала весьма медленно и требовала нагревания до 170—200°. Только в 1894 г. Гольдшмидт [2] улучшил способ настолько, что· он стал служить способом технич. приготовления формиатов. Видоизменение, внесенное Гольдшмидтом, заключалось главным обр. в том, что реакция производилась при повышенном давлении. Вместо натронной извести он пользовался смесью измельченного NaOH с известью или углем. По этому способу нек-рое время приготовлялись формиаты для восстановления селитры в азотистокислые соли.
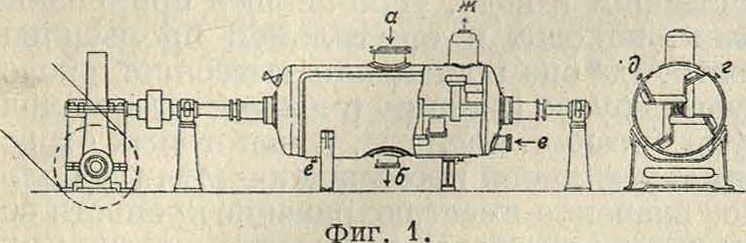
Существенное изменение в способ Гольдшмидта было внесено электрохимии, з-дом в Биттерфельде [*]. Согласно патентных сообщений, сделанных этим з-дом, формиаты приготовляются действием СО при нагревании и повышенном давлении на твердый кусковой NaOH, к-рый в течение всей операции сильно размешивается особо мощными мешалками. Этим дано.было разрешение проблемы получения дешевых формиатов и следовательно дешевой М. к. В настоящее время для проведения реакции между СО и NaOH применяются автоклавы емкостью от 3 ж3 и больше, рассчитанные на рабочее давление в 8 atm. Они снабжены мощными мешалками специальной конструкции, кожухом для подогревания паром и различными эксплуатонными и измерительными приспособлениями (фигура 1, а— отверстие для наполнения, б—выход продукта, в—впуск охлаждающей воды, г—выпуск ее, д·—впуск пара, е—выпуск конденсационной воды и ж—выпуск газов). Для суточного производства 3 000 килограмм формиата, натрия из 2 000 килограмм NaOH необходимо два рабочих автоклава и один запасный. Каж-
дый автоклав (3 м3) вмещает 1 000 килограмм NaOH и дает 1 500—1 600 килограмм формиата. После загрузки (едкий натр должен содержать не менее 95% чистого NaOH и предварительно измельчается в куски величиной с кулак) автоклав нагревают и пропускают генераторный газ (смотрите) под давлением в 8 atm. Вследствие экзотармичноети процесс вначале протекает чрезвычайно энергично, температура в автоклаве поднимается; выходящий газ
состоит гл. обр. из азота (и других составных частей генераторного газа) и только небольшой примеси СО; тогда нагревание прекращают и в кожух пропускают воду, поддерживая необходимую ί°. Для устранения спекания массы перемешивание не прекращают до самого конца реакции и охлаждения реакционной смеси. Генераторный газ, применяемый для получения формиата, должен содержать ок. 30% СО и должен быть хорошо очищен от серы, в присутствии которой образуются окрашенные соединения с запахом меркаптанов, сильно затрудняющие дальнейшее получение чистой М. к. Присутствие воды (в большинстве случаев достаточно влаги генераторного газа) повидимому способствует реакции, т. к. совершенно сухие СО и NaOH не реагируют. После того как реакция заканчивается (понижение ί°), автоклав охлаждают и СО перед выгрузкой формиата выдувают воздухом. При нормальной работе полученный продукт представляет собою слабо окрашенный в желтый цвет гигроскопич. порошок, содержащий 90—95% формиата натрия.
Мокрый способ получения-формиата. По этому способу, запатентованному фирмой R. Коерр Со. [4], вместо твердого NaOH применяются его водные растворы. Целесообразность работы с растворами объясняется тем, что при этом сокращаются весьма значительные расходы, связанные с выпаркой щелоков при приготовлении NaOH. Эта операция, выполняемая при высокой ί°, в мокром способе заменяется упариванием водных растворов формиата, что требует только небольших затрат. Преимущества мокрого способа становятся еще более очевидными, если принять во внимание, что вместо растворов NaOH можно пользоваться Na2S04 и Са(ОН)2, которые вводном растворе образуют равновесную систему: Са(ОН)2 + Na2S04;±2Na0H + CaS04.
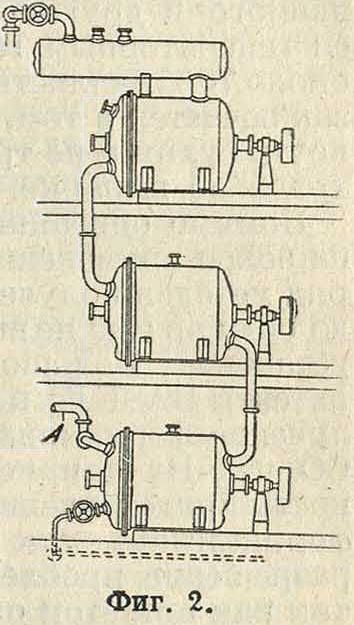
При действии СО на эту систему при нагревании и повышенном давлении NaOH быстро связывается в формиат, и нарушенное равновесие восстанавливается за счет превращения Na2S04 и Са(ОН)2 в NaOH; т. о. весь Na сульфата превращается в формиат. Для непрерывной работы по этому способу применяют аппараты, состоящие из трех автоклавов (фигура 2) в виде цилиндров из кованой стали, снабженных мешалками (А—
впуск пара). В этих цилиндрах, которые расположены друг над другом и соединены между собой трубами, находится смесь известкового молока и сульфата натрия. Реакцию ведут с генераторным газом при 200° и давлении 15—20 atm. По мер,е использования NaS04 и Са(ОН)2 в автоклавы накачивают свежую реакционную смесь, которая сначала поступает в последний цилиндр, откуда выходит отработанный газ. Этим путем осуществляется противоток, обеспечивающий возможность непрерывного ведения процесса. Для компенсации воды, увлекаемой отработанным газом, автоклавы связывают с паропроводом. Так. обр. генераторный газ, насыщенный парами воды, упругость которых отвечает давлению, существующему в абсорберах, проходит через всю систему и в конечном итоге может быть применен для питания паровых машин, причем используется не только энергия пара, но и энергия компримированного азота, который остается после реакции. Продукт реакции выпускается в отстойники, где освобождается от главной массы CaS04, затем отфильтровывается и выпаривается в вакууме. Формиат натрия, к-рый получен по мокрому способу, содержит небольшое количество Са, которое на получение М.
к. вредно не отражается. Для получения же оксалатов формиат необходимо предварительно освободить от Са,— лишняя операция по сравнению со способом, применяющим твердый едкий натр, и дающим продукт, непосредственно пригодный для превращения в оксалат.
Приготовление формиата кальция. Экономии, смысл этого способа, предложенного BASF, заключается в стремлении заменить сравнительно дорогой NaOH дешевой известью. Получающийся формиат кальция вполне пригоден для приготовления М. к. Для получения же оксалатов его подвергают обменному разложению в водном растворе с Na2S04 (на 12 молей формиата берут 10 молей Na2S04). Необходимым условием проведения реакции по этому способу является применение высокопроцентной окиси углерода (90% СО), которая получается в газогенераторах с кислородным дутьем. Работа по приготовлению формиата кальция производится в аппаратах, сходных с автоклавами, применяемыми для получения формиата натрия из твердого NaOH. Согласно патентам BASF [®], реакция между влажным Са(ОН)2 и высокопроцентным СО-газом протекает при 1° 200° и давлении 60 atm. В виду того, что по мере использования СО в автоклаве накапливаются посторонние примеси (N2,C02,H2и другие), а газ с низким содержанием СО (<50%) дает несравненно худшие результаты,—степень использования СО тут меньше, чем в других способах. Отработанный
газ, содержащий еще значительные количества СО, может быть применен в качестве топлива. Необходимость примепения газа с высоким содержанием СО значительно ограничивает распространение этого способа. Устройство специальных установок (Линде, Клода и т. д.) для получения кислорода при заводах муравьиной кислоты не может быть выгодным. Применение этого способа дает экономический эффект повидимому только в том случае, если производство М. к. организуется при каких-либо других производствах, при которых кислород получается в качестве побочного продукта (например при получении электролитнч. водорода для синтеза аммиака, метанола и т. п). Второй недостаток этого способа заключается в том, что СО подвергается сильному компримированию. Это отчасти компенсируется тем обстоятельством, что компримированию и всем дальнейшим операциям—очистке и т. д. подвергается только Vs объёма газа, применяемого в других способах, пользующихся генераторным газом, который содержит около 70% балластного азота. Преимущество заключается в том, что формиат получается почти сухим и не требует значительных расходов по выпарке.
Помимо описанных способов, нашедших широкое применение в технике, существует ряд методов получения формиатов, которые до сих пор еще не вышли из стадии опытных установок. Большой интерес представляют патенты BASF [®], в которых описывается получение формамида и формиата аммония из СО и NH3 в присутствии воды. Возможность приготовления М. к. из формамида и формиата аммония обещает дать наилучшее разрешение проблемы производства М. к., так как при этом одновременно достигается получение двух ценных продуктов: М. к. и сульфата аммония—одного из наиболее употребительных удобрительных туков.
В технике концентрированную М. к. приготовляют разложением формиатов, полученных тем либо иным способом, минеральными кислотами, гл. образом концентр, серной к-той. Эта на первый взгляд простая операция осложняется тем, что конц. серная кислота даже при обыкновенной 1° разлагает М. к. на СО и Н20. Применение же разбавленной кислоты невыгодно, т. к. при этом получается 60—65%-ная М. к., непригодная для многих целей. Концентрирование М. к. в колонных аппаратах невозможно, ибо минимум давления паров системы М. к.-у вода отвечает растворам с содержанием 75% М. к. Разрешение проблемы получения конц. М. к. было дано М. Гамелем [’], который разработал способ разложения формиатов, заключающийся в том, что формиат сначала разбавляется конц. М. к., а затем к этой смеси приливается конц. H2S04. Например к 100 килограмм сухого формиата натрия и 100 килограмм 90%-ной М. к. постепенно при охлаждении и сильном перемешивании приливают 75 килограмм серной кислоты (66°Вё). Затем к смеси снова добавляют 100 килограмм фюрмиата и 75 килограмм серной кислоты и повторяют эту операцию столько раз, сколько позволяет емкость сосуда. Отгон М. к. из реакционной смеси ведут в чугунных вакуум-аппаратах,
снабженных мешалками; дистиллат собирают в керамиковых приемниках. Этим путем получается 90%-ная М. к. Возможно приготовление М. к. высшей концентрации, если для первой смеси воспользоваться 99— 100%-ной М. к. и разложение вести моногидратом H2S04 или слабо дымящей H2S04.
Применение М. к. В кожевенной промышленности М. к. служит для удаления кальция из кожи, т. к. формиат кальция хорошо растворим в воде. Наибольшее применение М. к. находит в текстильной промышленности, где она постепенно вытесняет уксусную и другие (например щавелевую, молочную) ор ганич. кислоты. В некоторых отраслях текстильной промышленности, где большое значение имеет сохранение крепости волокна или ткани, М. к. успешно конкурирует даже с серной кислотой. Главная область применения М. к.—в технологии крашения шерсти, т. к. она медленнее и полнее восстанавливает хромовую кислоту, чем винная, щавелевая или молочная кислоты. При крашении полушерстяных товаров выгоднее также пользоваться М. к. вместо серной, так как первая совершенно не действует на растительное волокно. В последнее время встал вопрос о возможности приготовления формиатов целлюлозы в промышленности искусственного волокна. В (фармацевтической промышленности М. к. применяется для приготовления муравьинокислых эфиров глицерина (д и ф о р м и н а), которые служат заменой (щетина (смотрите). Наконец М. к. пользуются для приготовления жидких клеевых масс, сложных эфиров М. к., для восстановления ор ганич. соединений, для коагуляции каучука и в качестве консервирующего и дезинфицирующего средства в различных отраслях промышленности (консервном деле, варении, винокурении и т. д.).
Эфиры М. к. Из эфиров М. к. наибольшее значение имеют следующие: метиловый эфир, метилформиат, НСООСН3, —жидкость с (°кии. 32,3°; при хлорировании из него получается ряд эфиров хлоругольной к-ты, которые применяются как боевые вещества (смотрите) и как инсектисиды (смотрите). Этиловый эфир М.к., этилформиат, НСОО-С2Ы6, легко подвижная, горючая жидкость, пахнущая ромом, смешивающаяся со ом и эфиром, с t° замерзания -80,5°; t°Kim_ 54,5°; £>£5=0,9298; получается нагреванием щавелевой кислоты с глицерином и этиловым ом; легче- его получать нагреванием молекулярных количеств М.к. и а в присутствии 1—2% (объёмных) серной к-ты. BASF получает его из абсолютного а действием СО в присутствии голята натрия; реакция протекает при 1° 60—100° и давлении в 200 atm. Этот эфир применяют для приготовления фруктовых эссенций (искусственный ром), также для денатурации а, в медицине и ветеринарии; кроме того он служит растворителем целлюлоида и коллодионного хлопка; в ор-ганич. синтезе им пользуются для получения альдегидов (при действии на магний-ор ганич. соединения). Изоамиловый эфир М. к., НСОО · С5Ни, жидкость с фруктовым запахом, i°,(!i„. 123,5°, 0,8773,
получается длительным нагреванием изо амилового а (176ч.)с106ч. 86,4%-ной муравьиной кислоты и с 28,5 ч. 70%-ного раствора СаС12; применяется для приготовления фруктовых эссенций, а также и в качестве растворителя целлюлоида и коллодионного хлопка.
Лит.: 1) «В», 1880, В. 13, р. 23; 2) г. П. 86419; >) Г. П. 179515; >) Г. П. 209417, 212641; 5) г. П. 383538; «) Г. П. 390798, 392409, 414257; ’) Г. П. 169730.—Ч пчибабин А. Е., Основные начала органический химии. 2 изд., М.—Л., 1929; Meyer
V. u. Jacobson Р., Lehrbuch d. organ. Chemie, 2 АиП., В. 1, p. 509, В.—Leipzig, 1922; UUra. Enz., 2 Aufl., В. 1, T. 1, p. 330. С. Медведев.