 > Техника, страница 64 > Ненасыщенные соединения
> Техника, страница 64 > Ненасыщенные соединения
Ненасыщенные соединения
Ненасыщенные соединения ,вобщем смысле—вещества, способные к присоединению тех или иных атомов или молекул в стехиометрия, отношениях (следовательно· из определения Н. с. исключаются вещества, образующиет.наз. бертоллиды (т.е. соединения, не подчиняющиеся закону постоянства состава, в отличие от веществ обычного типа—д альтонидо в;примером бертолли-дов являются пермутиты). Присоединение к Н. с. идет лишь до известного предела; поэтому Н. с. часто называют непредельными соединен и я м и. Ненасыщен-
ность может иметь место лишь в том случае, если в составе молекулы вещества имеются атомы, сохранившие часть своего химич. сродства. Т. о. ненасыщенность молекулы· сводится к ненасыщенности тех или других составляющих ее атомов. Известное представление о наличии п даже о степени ненасыщенности молекулы дают обычные структурные формулы, соответствующие классической теории строения, в большинстве случаев не противоречащие ни координационным схемам Вернера ни более новым электронным воззрениям. Затруднение заключается только в определении максимальной (т. наз. предельной) валентпостм (смотрите) для каждого атома данной молекулы. Формально ее нетрудно определить но положению элемента в периодич. системе Менделеева, но далеко не всеми допускается, например шестива-лентность или хотя бы четырехвалентность кислорода; однако многие атомы повидимому способны проявлять более высокую валентность, чем это обычно принимается. Способность многих веществ, например неорганич. солей, давать сольваты, в частности—кри-сталлосольваты (наир, кристаллогидраты, кристаллоголяты и т. и.), в огромном-большинстве случаев подчиняющиеся стехиометрия. закономерностям, позволяет причислять и эти сольватообразующио вещества)
к Η. с. В них возможно допустить повышение валентности отдельных атомов, например галоидов в галоидных солях, дающих пристал лосольваты, или кислорода в различных гидратах (а м. б. и в капельножидкой воде), или наконец многих металлов.
Принципиально для связи многовалентного атома с каким-нибудь другим достаточно затраты одной единицы валентности. Поэтому наличие в структурной формуле к р а τη ы х (двойных или тройных) связей указывает на возможность реакций присоединения именно в этих местах молекулы, то есть на ее непредельность (в тем большей степени, чем большее число единиц валентности затрачивается на связь между соседними атомами). Наличие кольчатой структуры также указывает на возможность реакций присоединения с размыканием кольца. Все эти данные строения молекулы указывают лишь на максимальное количество единицва-лентности, могущих насыщаться, но не говорят еще об относительной легкости протекания той или иной реакции присоединения. На последнее обстоятельство влияюги характер отдельных атомов в соединяющихся веществах, и их положение в молекуле, и условия реакции—особенно темп-pa среды. Все эти влияния могут иногда свести к нулю способность Н. с. к той либо иной реакции присоединения, а иногда даже и обусловить большую прочность Н. с. в данных условиях и самопроизвольное образование его из соответствующего насыщенного соединения.
Представление о Н. с. имеет наибольшее значение для органич. химии. Здесь особенно важны случаи непредельности, обусловленные присутствием атомов углерода с валентностью меньшей чем 4, или кратных связей с участием атомов углерода, или наконец циклов из углеродных атомов.
А. Присутствие трех валентного, а тем более двухвалентного у г л е р одного атома обычно делает соединение столь ненасыщенным, что лишь небольшое число подобных веществ способно к существованию в обычных (°-ных условиях. Таковы например содержащие С11 триарилмети-
R R yR з лы Hi ;С—, пентаарилэтилы Ri >-С— С( н2 r2 Мл металлкетилы ч>С</0Мс и тому подобное. Эти соедини-
К]
ния (называемые свободными радикалами) существуют обычно лишь в растворах, но некоторые из них выделены и в чистом виде. Они интенсивно окрашены и характеризуются чрезвычайной склонностью к присоединению главн. обр. кислорода и галоидов. К соединениям, содержащим двухвалентный углерод, принадлежат например окись углерода (смотрите) )С О, ее имид, нзоформа синильной кислоты, С NH, ее оксим — гремучая кислота ;С N · ОН, ее ацетали ^>C QR, изонитрилы )0 N R и производные изоацетилена )C С<"Х‘. Все эти вещества присоединяют кислород, галоиды, галоидоводородные кислоты и тому подобное., но с весьма различной энергией и обычно ме дленнее, чем соединения с (Ж Некоторые из веществ с С11 в обычных условиях довольно прочны и даже находят практич. применение (СО, HCN, соли гремучей кислоты). Свободные радикалы с С11 и Сш являются по-видимому промежуточными продуктами при очень многих реакциях.
Б. Соединения, содержащие кратные связи между каким и-л ибо атомам и (одним из которых м. б. и атом углерода), чрезвычайно многочисленны, широко распространены в природе и играют огромную роль в технике. Наличие подобных связей в молекуле является например необходимым условием создания многих красящих, пахучих, фармацевтических или отравляющих веществ. Сюда относятся например такие тины веществ, как альдегиды R ·, кетоны
R/C О, карбоновые кислоты R · С ^, нитросоединения R ·, ннтрозосоединения
R N- О, нитрилы R C Ν, азосоединения R · N N · R, арсеносоединения R As As · R и многие производные этих и подобных им классов. Для всех таких веществ характерна способность к присоединению водорода (восстановлению) по месту кратной связи. Часто также возможно присоединение воды, ов, второй молекулы того же вещества (полимеризация) и даже более сложных молекул. Электроотрицательные элементы — кислород, галоиды — обычно не присоединяются по кратным связям подобного рода.
В. Вещества, содержащие кратные связи между углеродными атома-м и,—Н. с. в узком смысле слова—играют не менее важную роль в природе и в технике; их реакции присоединения изучены наиболее подробно. Так, производные этилена Н2С СИ г и вообще все соединения с одной или несколькими двойными связями (часто обозначаемыми значком f=) между С-атома-ми, характеризуются следующими главнейшими реакциями: 1) галоиды дают насыщение Х2
ные двугалоидопроизводные |, где×2 и
>с-х2
Х2—атомы галоида; 2) окисление в отсутст вии воды -* окиси
/|
О; 3)окисление в при-
ус он сутствии воды -*· гликоля I как пер-
_)с он вал ступень окисления; 4) озон-* озоннди
/с °
/О, которые легко распадаются при
>с-О,
гидролизе, с разрывом углеродной связи;
5) восстановление -*· насыщенные соединения г
С Н
С—н
; 6) галоидоводородные кислоты -» од-
^с—н ногатоидопроизводные ; 7) хлорнова-
с х ус ci
тистая кислота -*хлоргидрины ; 8) во-
_>с он
^>с- н да -» одноатомные ых ; 9) кроме он того имеют место реакции конденсации (смотрите) как с молекулами того же самого Н.с., так и с другими, главн. обр. тоже непредельными веществами. Качественными реакциями на соединения с [= являются: а) обесцвечивание раствора брома (реакция 1); б) обесцвечивание и выделение бурого осадка перекиси марганца из слабого щелочного раствора КМп04 (реакция 3); в) быстрое почернение растворов осмиевого ангидрида 0s04 (реакция 3); г) красное или желтое окрашивание растворов тетраннтрометана C(N02)4 (реакция 9). Методы количественного определения числа двойных связей основаны на реакциях 1, 2, 4 и 5. Необходимо иметь в виду, что реакции иногда не останавливаются на образовании перечисленных продуктов присоединения, и наоборот— в некоторых случаях присоединение идет с большим трудом или даже совсем не происходит. Последнее явление обычно объясняется с т е р и ч е с к и м и препятствиями, то есть пространственными затруднениями, возникающими в результате накопления близ кратной связи групп, имеющих большой объём и мешающих воздействию данного реагента. Пространственные затруднения отмечены также и при реакциях некоторых веществ типа Б.
Соединения с одной (производные ацетилена НС СН) или несколькими тройными (р) связями между С-атомами—еще более ненасыщены и реагируют с большей легкостью, чем этиленовые производные. В частности реакции 1, 5 и 6 идут в этом случае в две фазы, с промежуточным образованием этиленовых соединений, содержащих р, например:
—С —С—Вг —СВг?
4* ВГ2 J- Вг 2
—С — С— Вг — СВг2
Реакции 2, 3, 4 и 7 приводят обычно к распаду молекулы по месту р. Реакция 8 приводит к образованию альдегида или кетона: —С —С—О
i! +нгО I н легко происходит при дей-с сн2
ствии воды на продукт присоединения к р солей окиси ртути. Реакция 9 также имеет место для вещества с р. Для соединений, содержащих несколько кратных связей, часто наблюдается анормальное течение многих реакций в том случае, если эти связи являются сопряженными, то есть разделены только одной простой связью. Примером сопряженных связей являются системы СН? СН-СН СН2;СН2 СН-СН О и тому подобное.
Г. Циклические соединения, именно содержащие трех- и четырехчленные углеродные циклы, способны довольно легко присоединять галоиды, водород и галоидоводородные кислоты с разрывом кольца, например:
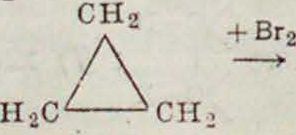
сн2
/СНоВг
ХСН2Вг
Эта ненасыщенность объясняется большим запасом энергии в малых циклах (особенно в трехчленном), что характерно и для обычных кратных связей (смотрите ниже). Наоборот, пяти- (или более) членные циклы обычно не обнаруживают способности к реакциям присоединения. Вещества, имеющие р или р в боковых цепях, или р в цикле (соединения с р в цикле еще неизвестны), имеют все свойства обычных Н.с. Ароматич. соединения, содержащие в шестичленном цикле три со-пряженных р, отличаются от обычных Н. с. своей стойкостью по отношению к окислителям (кроме озона) и неспособностью к реакциям 6 и 8 (смотрите выше); наоборот, реакции 1 (в отсутствии кислорода), 4, 5 и 7 протекают легко. Характерные для ароматич. соединений реакции замещения водородов ядра (на-прим. нитрование и сульфирование) заключается повидимому в первоначальном присоединении реагента по р бензольного ядра с последующим отщеплением воды. Присутствие в молекуле кратных связей или ненасыщенных атомов всегда отражается и на физич. свойствах вещества. Так, соединения с ненасыщенными атомами имеют больший молекулярный объём и более низкую t°Kun, чем их изомеры, содержащие тот же атом с высшей валентностью, например: СН3-С N,
t°KU„. 82°, и СН j-N С, t°Kun. 60°; CH3-N^
t°Kun. 101°, И СН з · О—N О, t°Kun-12°. В ряде случаев удается также выявить количественные закономерности. Так, нек-рые физические величины, зависящие от состава и строения вещества и вычисляемые по известным формулам—например рефракция молекулярная (смотрите) или парахор (смотрите) повышаются при наличии тех или иных видов ненасыщенности на определенную величину (инкремент), находимую путем опыта. Т. о. исследование физических свойств часто позволяет делать суждение о наличии р, р, циклов или других видов ненасыщенности. Однако численные величины соответствующих инкрементов не вполне постоянны и изменяются (обычно повышаются—«экзальтируют») при сопряженности кратных связей.
Термохимия, данные показывают, что Н. с. заключают в себе значительный запас энергии. При образовании из элементов простой связи С—С выделяется 71 cal; для других типов связи соответствующие цифры будут: С—Н 92 cal; С С 125 cal (а не 142 cal. как можно было бы ожидать) и С С 1G6 cal (а не 213 cal). Эти цифры повидимому еще не вполне точны; из них однако видно наличие у связанных кратными связями атомов запаса потенциальной химической энергии. Это обусловливает легкость реакций присоединения, идущих обычно с выделением тепла; это же обстоятельство делает понятным и необходимость затраты энергии для превращения насыщенных веществ в Н. с. Количественно выражать степень ненасыщенности любой более или менее сложной молекулы пока еще не представляется возможным.
Лит.: ОстромыслевскяП И. И. К теории бензольного ядра и этиленовой связи, М., 1910; Werner A., Beitrag zur Tbeorie d. Affinitat nud Va-lenz, «Vierteljalirschrift der Naturforsclienden Gesell-scliaft In Ziirich», Ziirich, 1891, Jg. 36; Werner A., Lehrbuch der Steroochemle, Jena, 1904; Werner A.,
Neuere Anschauungcn auf d. Gcbicte d. anorgan. Che-mle, 5 Aufl., Braunschweig, 1923; Bloch E., Werners Theorie d. Kohlenstoffatoms u. die Stereochemle d. karbozyklischen Verblndungen, W.—Ljiz., 1903; W a 1-d e η P., Die Cheinie der frelen Uadlkalc, Leipzig, 1924; Elsenlollr F., Spektrocheinio organischer Verblndungen, Molekular-Refraktion uud Dispersion, Ghemle in Einzeldarstellungen, hrsg. v. J. Schmidt, B. 3, Stuttgart, 1913; S m 1 1 e s S., Chemlsche Kon-stitution u. physikalische Eigenschaften, Dresden— Leipzig, 1914; Kaufmann H., Beziehungen zwi-schen physikalischen Eigenschaften u. chemlscher Kon-Stitution, Stuttgart, 1927; Meyer II., Lehrbuch d. organisch-chemischen Methodik, B. i — Analyse und Konstitutionsermittelung organischer Verblndungen, 4 Auflage, Berlin, 1922; Sugden S., I’arachor and Valency,L., 1930; Grimm II. G., Atombau und Che-inie (Atomchemie), Handbuch der Pliyslk, hrsg. v. Geiger H.u. Scheel К., B. 24, B., 1927.