 > Техника, страница 65 > Нитроцеллюлоза
> Техника, страница 65 > Нитроцеллюлоза
Нитроцеллюлоза
Нитроцеллюлоза ,или нитро клетчатка, неправильное, но общепринятое название азотнокислых эфиров целлюлозы. Образование этих эфиров происходит при действии азотной кислоты на целлюлозу за счет отщепления воды из овых гидроксилов целлюлозы и гидроксила азотной кислоты н он + hono2 -»н
-U-
-no2+h2o
по общей реакции
C24H4c,O20 + nHNO2=.C24HJ0.nO20_n(ONO2)n -t- нН20.
Обыкновенно процесс этерификации («нитрацию») целлюлозы ведут в присутствии серной к-ты. Число вводимых при этом групп 0N02 колеблется от 4 до 12 (в расчете на формулу клетчатки С21Н10О20); существование Н. с числом групп меньшим 4 является спорным. Химии, состав Н. зависит от условий нитрации, то есть от состава кислотной смеси, ί°, продолжительности нитрации и свойств самой исходной целлюлозы. Реакция не останавливается на каком-либо определенном продукте: практически всегда получается смесь нескольких Н., содержащих различное· число групп ΟΝΟ2, с преобладанием одного или двух видов. Благодаря различному отношению к растворителям и нек-рмм химии. реагентам из смеси различных Н. можно выделить отдельные виды их. Всего различают, в зависимости от числа групп ΟΝΟ», 8 разновидностей Н., отношение которых к растворителям и нек-рые числовые характеристики приведены ниже в таблице.
Для характеристики применяемых в технике Н. указывают содержание азота и отношение к приведенным в таблице растворителям. К хорошим растворителям Н. помимо приведенных относят: уксусноэтиловый
Отношение Н. различного состава к растворителям, теоретический расход исходных материалов и выход Η. (Н.—не растворим; Т.—трудно растворим; Р.—растворим).
| Наименование Н. | Содержание азота в % | Содержание азота в см“ На 1 ? Н, | Растворимость | Количество, | Выход Н. на 100 г целлюлозы | |||||||
| Формула | Мол. вес | й>
О. я се |
к о ьн о | »—<
о и о |
•
я о о 2 о е |
в ацетоне | образо цел люло зы | в. loo г Н.
азотн. кислоты (мо-погидр.) | ||||
| Чотырехазотная. | ^24^36^1 β(ΟΝΟ о):1 | 828,32 | 6,76 | 108,09 | т. | Р. | Р. | Р. | Р. | 78,27 | 30,43 | 127,8| |
| Питинзотная. | 873,32 | 8,02 | 128,24 | Т. | Р. | Р. | р. | Р. | 74.24 | 36,07 | 134,7 | |
| Шестиазотная. | С2аПз4О,4<ОХ!О;)0 | 918,32 | 9,15 | 146,30 | и. | Р. | Р. | Р. | Р. | 70,60 | 41,17 | 141,6 |
| Се.мпазотнал. | C.aHs30lS(0N02), | 963,32 | 10,18 | 162,77 | II. | Р. | Р. | Р. | Р. | 67,30 | 45,79 | 148.6 |
| Восьмиазотпая. | Ο.,ΙΠ.Ο,ΗΟΝΟ.ίβ | 1008,32 | 11,11 | 177,64 | н. | Р. | Р. | Р. | Р. | 64.30 | 50,00 | 155.6 |
| Девнтиазотная. | C2alb,On(ONO.,)9 | 1053,32 | 11,97 | 191,38 | н. | Р. | н. | н. | Р. | 61,65 | 53,84 | 162,5 |
| Цесятиазотная. | ^24il3oOio(ON02)io | 1098,32 | 12,75 | 203,86 | н. | II. | н. | н. | Р. | 69.03 | 57,37 | 1611,4 |
| Одпннадцатиазотпая | Сг4Н2,0»(0. 02), | 1143,32 | 13,48 | 215,53 | II. | н. | н. | н. | Р. | 56.71 | 60,63 | 176.3 |
| Двенадцатиазотяая | C24H2s08(0N02)l2 | 1188,32 | 14,15 | 226,24 | н. | н. | н. | н. | Р. | 54,56 | 63,64 | 183,2 |
•Г а с эфиром 1 : 2.
и уксусноизоамиловый эфиры, низшие кетоны, овые растворы камфоры, нитроглицерин и многие нитропроизводные ароматического ряда. Н. с содержанием азота от 11 до 12%, сполна растворимые в оэфирной смеси, в технике носят название коллодионной ваты. Н. с содержанием азота в 12% и выше носят название п и-р о к с и л и н о в и преимущественно применяются для изготовления бездымного а (смотрите). Пироксилины, содержащие азота ок. 12.5% и (несмотря на высокое содержание Ν) растворимые на 95—99,5% в о-эфирном растворителе, введены в практику по-роходелия Д. И. Менделеевым и носят название пироколлодия.
Физические свойства. По внешнему виду II. не отличается от .материала, взятого для нитрации. Нод микроскопом в поляризованном свете обнаруживается изменение окраски—тем в большей степени, чем больше введено групп 0Ν02; это свойство м. б. применено для приблизительного определения содержания азота в Н. Истинный уд. вес II. колеблется от 1,65 до 1,67. Гигроскопичность Н. зависит от числа групп 0Ν02 и при 15° м. б. приближенно выражена ф-лой Н=20—1,3 Ν, где Н—содержание влаги в %, а N—содержание азота в %. Сухая Н. легко электризуется, что в случае образования искр может повести к ее воспламенению и у. Вязкость растворов Н. имеет существенное значение при производствах: шелка Шардонне, нитролаков, кинопленки и тому подобное. Для определения вязкости чаще всего применяют 1—2%-ный раствор Н. в ацетоне. Вязкость увеличивается с увеличением содержания азота и очень сильно зависит от условий нитрации и качеств исходной целлюлозы. Увеличение содержания окспнел-люлоз вызывает значительное понижение вязкости. В последнее время для получения Н. определенных качеств в отношении вязкости применяют определенные сорта целлюлозы, рассортированные по вязкости их растворов в фелинговой жидкости. Вязкость растворов Н. можно понизить предварительным нагреванием Н. в автоклаве с водой (чистой или с добавкой различных веществ). В присутствии растворителей, особенно легко под давлением, Н. переходит в коллоидальное состояние, сохраняющееся и после удаления почти всего растворителя. Именно в таком «коллоидированном» виде Н. и имеет промышленное применение.
Химические свойства. В химич. отношении Н. обладает всеми свойствами сложных эфиров. При действии растворов едких щелочей, особенно при нагревании, она омыляется, распадаясь на первоначальные компоненты; при этом одновременно происходит окисление регенерируемой целлюлозы, в результате которого последняя дает разнообразные оксикислоты и кислоты до щавелевой кислоты и угольного ангидрида включительно. При не очень продолжительном нагревании со слабыми растворами углекислых щелочей, неорганич. к-т или бисульфита натрия (0,5—1%) происходит разрушение преимущественно побочных продуктов нитрации, на чем основаны процессы стабилизации Н. Крепкая H2SO, переводит азотные эфиры целлюлозы в сернокислые, что сопровождается переходом их в раствор. Крепкая HN03 окисляет Н., медленно на холоду и быстро при нагревании, до С02, на чем основано определение золы. Восстановители FeClj-fHCl и 2Hg + H;,SO< количественно переводят группу 0М02 в окись азота N0, на чем основано количественное определение азота в Н.; сама клетчатка при этом разрушается. Восстановление Н. с получением целлюлозы в почти неизмененном виде м. б. произведено сульфгидратами натрия,калия и кальция [NaSH, KSH,Ca(SH)2]; процесс этот носит название денитрации и применяется для получения искусственного шелка по способу Шардонне. При медленном нагревании Н. разлагается с выделением газообразных продуктов: N0, СО, С02 и Н20, причем содержание азота в Н. постепенно падает и появляются разнообразные продукты окисления целлюлозы. Реакция разложения Н.происходит и при комнатной ί°, но чрезвычайно медленно. Если нагревание вести, быстро повышая 1°, то при 180—210° происходит вспышка.
Испытание Н. Стойкость Н. характеризуется скоростью разложения ее в условиях проведения опыта. Это свойство имеет чрезвычайно важное значение для Н., применяемых для изготовления бездымного а и ов, т. к. позволяет судить о способности их к длительному хранению. Так, известны а, изготовленные из вполне стойкого пироксилина, хранящиеся без утраты своих свойств более 35 лет; в то же время а, изготовленные из нестойкого пироксилина, теряют свои свойства через несколько лет и при неблагоприятных условиях иногда сами собою загораются. Способов определения стойкости Н. известно очень много. Все они основаны: 1) на измерении времени, в течение которого выделяется определенное количество продуктов разложения, или 2) на определении количества продуктов разложения, выделившихся за определенный промежуток времени, или же 3) на периодич. определении количества продуктов разложения, что позволяет выявить самый характер разложения Н. Наименее совершенными, но зато и наиболее простыми, являются способы первой группы: а) проба Абеля —нагревание навески пироксилина (1,3 г) в пробирке на водяной бане при 65° до появления слабого бурого окрашивания нодокрахмальной бумажки определенной чувствительности, смоченной 50%-ным водным раствором глицерина и подвешенной в верхней части пробирки. Проба дает очень непостоянные показания и в большинстве государств вышла из употребления; б) проба Вьеля заключается в нагревании навески пироксилина (2,5 г) в герметически закрытом стеклянном цилиндре, с вложенной внутрь синей лакмусовой бумажкой постоянной чувствительности, в специальном термостате при 106,5° до появления красного окрашивания бумажки или до выделения бурых паров;в) проба с метнлвиолетовой бумажкой при 135° до ее покраснения и т. д. Более совершенными, но н более сложными являются пробы второй группы: а) проба Бергмана-Юнка, заключающаяся в нагревании навески пироксилина (2 г) в специальной стеклянной пробирке, закрытой водяным запором и помешенной на 2 ч. в особо сконструированную баню при 132°. Выделившиеся за время нагревания окислы азота переводятся в аммиак и количественно определяются отгонкой в титрованный раствор к-ты; б) проба Обермюллера, заключающаяся в нагревании 2 г влажного пироксилина в вакууме в пробирке, соединенной с ртутным манометром. Пробирка помещается в баню при 140°. Отмечается увеличение давления за 1 ч. нагревания. К третьей группе относится проба Билля: определяется объём газообразного азота, полученного нагреванием 2,5 г влажного пироксилина при 135° в атмосфере С02 и пропусканием газообразных продуктов разложения над раскаленной медной спиралью; азот собирается в газовой бюретке; отсчеты делаются каждые 15 минут, и результат изображается в виде диаграммы. Хороший пироксилин за каждый ^-минутный период выделяет одинаковые количества азота и носит название пределы! о-промытого. Пироксилин, из которого при -стабилизации удалены не все побочные продукты нитрации,дает в первые периодыббль-шие количества азота, чем в последующие. Испытание плохих иироксилинов нередко заканчивается ом, и скорость разложения их значительно больше. Чем меньше содержание азота в Н., тем меньше скорость ее разложения, определяемая пробами на стойкость, и тем меньше надо применять промы вок при стабилизации для получения предельно промытых Н. Обычно для Н., идущих на изготовление различных изделий, по пробам настойкостьустанавливаются определенные нормы. Так. для ового пироксилина по пробе Вьеля красное окрашивание должно появляться не ранее 6 ч.; по пробе Бергмана количество выделенной N0 на 1 г не должен быть более 2,5 см“. При несоблюдении установленных норм стойкости Н. в производство не допускаются и подвергаются дополнительным промывкам. Как результат нарушения этих норм известны случаи самовозгорания целлюлоида, изготовленного из нестойкой II. Для безопасного хранения Н. должна иметь определенную влажность. Н с 2—3% влаги легко загорается и сгорает чрезвычайно быстро; в случае больших масс горение оканчивается ом. При влажности в 7—10% горение идет медленно и с трудом; при 25—30% влаги Н. уже совершенно безопасна. Теплота разложения для II. с содержанием азота 13% равна 1 100 Cal на кг и при 12% азота равна 730 Cal. Теплота образования молекулы С21Н30010 (ΟΝΟ2),0равна 658 Cal, теплота образования молекулы C^HmO^ONOj,)!!—639 Cal.
Производство Н. Основными исходными материалами для изготовления II. являются: целлюлоза (клетчатка) разнообразного происхождения, азотная и серная кислоты и олеум. В отношении к-т и олеума особых требований не предъявляется. Крепость к-т должна быть такова, чтобы можно было составить кислотную смесь с заданным содержанием воды, колеблющимся от 9 до 20%. Состав кислотных смесей для нитрации очень сильно отражается на свойствах получаемой Н.; кроме того он варьирует в зависимости от качества самой целлюлозы, применяемой для нитрации; поэтому дать точную рецептуру кислотной смеси не представляется возможным. Для приблизительных соображений можно пользоваться формулой, данной Менделеевым для пироколлодия:
2HNO, + XH.SO, + (X + 1)Н20.
При применении кислотной смеси подобного состава получается Н. с содержанием азота ок. 12,5% и с высокой растворимостью. При меньшем содержании воды в кислотной смеси получаются более высокоазотные II., мало растворимые в о-эфирной смеси; при большем содержании воды—коллодионная вата. Более подробные сведения о кислотных смесях для нитрации см. [1]. При (° 15—20° основной процесс нитрации заканчивается почти полностью в несколько минут; далее происходит лишь медленное повышение содержания азота, не превосходящее обычно 0,5%. При повышении ί° реакция идет значительно скорее; поднимать <° выше 40° нецелесообразно, так как при этом усиливается течение побочных реакций. Продолжительность реакции колеблется от 30 до 90 м., в зависимости от способа нитрации, и в редких случаях доходит до нескольких часов. Материал для нитрации берется или в виде клетчатки волокнистого происхождения(лин-тер, делинт, концы, льняная кудель) или в виде древесной целлюлозы (алигнин, рыхлый картон). Основные требования, предъявляемые к материалу для нитрации: воз-
можно большее содержание чистой клетчатки и отсутствие примесей (жира,золы и т.п.). Технические условия, предъявляемые к нитруемому материалу, зависят от назначения Н. Более строгие требования для материала, идущего на изготовление ового пироксилина, таковы: влажности > 12%, жиров <1%, золы <0,75%.хлора <0,05%, медное число <2,5. Предварительная подготовка волокнистого материала заключается в его разрыхлении на волчках и кардовых машинах; если надо, производят предварительный отбор вручную не поддающихся разрыхлению частей и сушат до содержания влаги >1%. Для сушки применяют любые сушильные устройства, действующие периодически либо непрерывно. Темп-pa сушки—около 100°. Высушенный материал развешивают на навески, равные одной закладке нитрационного аппарата (10—20 килограмм) и оставляют для охлаждения в герметически закрываемых сосудах. Для производства нитрации нитруемый материал погружают небольшими порциями в кислотную смесь, взятую в количестве в 30—50 раз большем по весу, чем навеска этого материала. По окончании нитрации, для чего практически достаточно 30—90 м., спускают к-ту, отжимают избыток ее до содержания, равного весу полученной Н., выбрасывают последнюю вилами и переносят в избыток холодной воды. В настоящее время для нитрации наиболее часто применяются аппараты следующих трех видов. 1) Ванны с мешй и с двойными стенками для регулирования t° во время нитрации; после нитрации вся смесь самотеком поступает в центрифугу для отжатия. 2) Специальные н и-трационные центрифуги с сетчатым барабаном а (фигура 1). Кожух цснтрнфугй
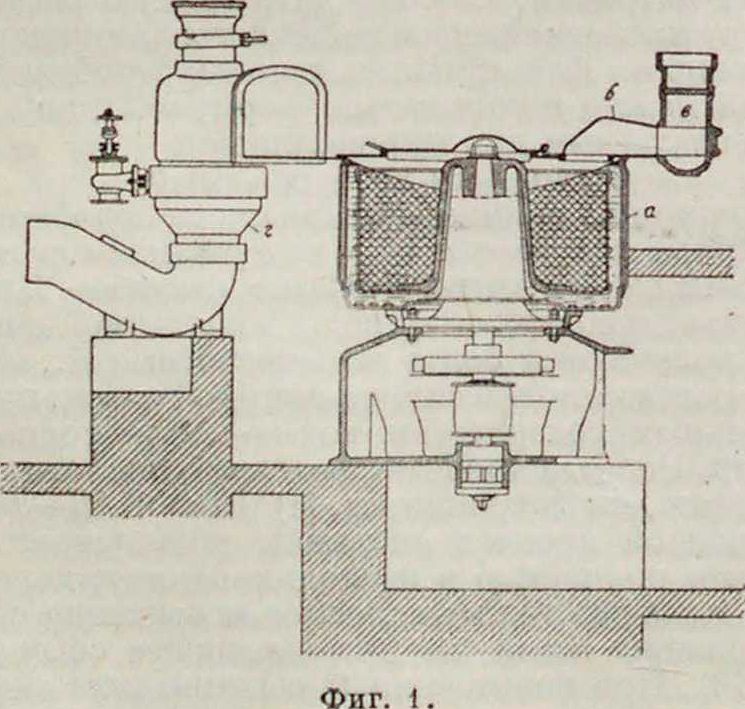
имеет двойные стенки для охлаждения водой и в верхней части вытяжку (б, в) для кислотных паров. Рядом с центрифугой устанавливается керамиковая воронка г, служащая для приема Н., отжатой в струю воды. По наполнении центрифуги кислотной смесью в сетчатый барабан загружают целлюлозу, крышку закрывают и барабану дают «тихий ход» (50—80 об/м.)для циркуляции кислотной смеси. После окончания нитрования эту смесь спускают и, придав барабану скорость
Вытяжка кислотных ларов

Фнг. 2.
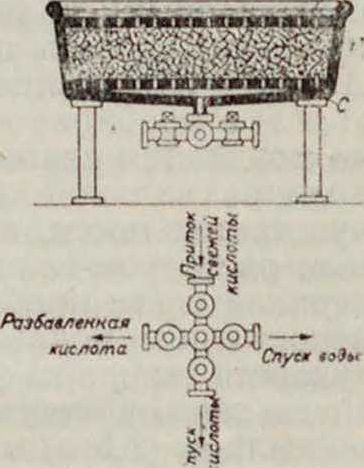
800—1 200 об/м., производят отжатие к-ты. Отжатую Н. алюминиевыми вилами выбрасывают в керамиковую воронку, орошаемую струей воды 3) Ч а ш а Томсона (фигура 2> представляет собой низкий цилиндрнч сосуд Р с слегка конич. дном. Па дне сосуда расположена сетка С, на к-рую загружают в ранее налитую кислоту нитруемый материал. Сверху накладывают вторую сетку Сг, представляющую продырявленные пластинки. Поверх сетки С1 наливают тонкий слой воды и сверху чаши надвигаюткрышку Н. По окончании нитрации, на что необходимо 2—
4 часа, медленно спускают к-ту, одновременно наливая сверху через сетчатую воронку с той же скоростью воду. Крепкую и слабую кислоты собирают отдельно и в той же чаше производят промывку Н. холодной водой. Т. о. в этом аппарате вместо отжатия кислоты происходит вытеснение ее водой .Первые два способа дают более однородную по своим качествам Н., и все количество отработанной кислоты после ее «скрепления» (добавки свежих к-т в нужном соотношении) м. б. вновь использовано для нитрации, но они имеют следующие недостатки: 1) они требуют большего расхода к-т, вследствие потери их в количестве, равном весу Н., при выбрасывании последней в воду, и потери азотной кислоты путем испарения за время нитрации; 2) во время выгрузки из центрифуг отжатой Н. иногда происходит ее саморазложение (без а)—т. наз. «горение центрифуг». В жаркое летнее время количество сгоревших центрифуг, при плохом материале для нитрации, достигает 1 %. Главные недостатки способа Томсона: 1) получается менее однородная Н. и 2) только около 80% отработанных к-т возвращается в неразбавленном виде, пригодном для скрепления и использования для нитрации следующих порций сырья. Однако, если учесть и слабую к-ту, получаемую при способе Томсона, то фактический расход кислот будет значительно меньше, чем в первых двух способах.
После нитрации Н. подвергают промывке в холодной воде и процессам стабилизации; последние имеют целью удалить оставшиеся после нитрации кислоты, разрушить нестойкие побочные продукты и отмыть их. и производятся с различной тщательностью в зависимости от назначения Н. Наиболее полной стабилизации подвергаются пироксилины, идущие на изготовление бездымных ов. С этой целью пироксилин загружают в деревянные чаны с ложным дном в 6—8-кратное количество воды и подвергают кипячению открытым паром в течение 10—40 часов, с несколькими переменами воды. Во время кипячения побочные продукты нитрации (сульфоцеллюлоза, азотнокислые эфиры окси- и гндроцеллюлозы,
нитросахара, азотистокислые эфиры), разлагаются, переходят в раствор и удаляются при сменах воды. Для ускорения процессов стабилизации кипячение ведут в очень слабых растворах соды. Однако для получения предельно промытых нироксилинов необходимо Н. подвергнуть еще измельчению в гол-ландерах обычного типа для получения волоконец длиной ок. 2 миллиметров, без чего полное удаление продуктов разложения невозможно. После измельчения, промывки в кипящей воде или слабых содовых растворах продолжают промывку в железных чанах с мешалками до получения надлежащей стойкости Н. Заканчивают изготовление II. просеванием через сита, пропусканием через желоба с электромагнитами для удаления железных опилок, образовавшихся во время измельчения в голландерах, и отжатием воды в центрифугах до содержания ее 28—32%. С таким содержанием воды Н. можно безопасно перевозить по железным дорогам и хранить в складах.
Применение. Н. имеет большое промышленное значение для получения не только бездымных ов и нек-рых чатых веществ, но и целого ряда продуктов мирного назначения, как коллодий, искусственный шелк, кинопленка, целлюлоид, нитролаки и т. д., для производства которых Н. расходуется в значительно больших количествах, чем для а и чатых веществ (подробности см. в соответствующих статьях!. В зависимости от назначения Н. изготовляется с ббльшим или меньшим содержанием азота, причем для мирных производств оно в большинстве случаев колеблется от 9,5 до 11%, а для ов и ч. веществ—около 12,5%.
Лит.: ») М а ш к и а А., Нитрация клетчатки, Москва, 1926,—В runswlg Н., Beitrag zur Frage nacb U. Natur v. Nitrocellulose, «Zeitsrhrift fiir d. gesamte Schiess- u. Sprengstoftwesen». Munehen, 1928. H.10; BerlE.und Borkenfeld E., «Ztschr. f.ang.Cb.», B., 1928, δ: Солонина А. А., Курс технологии а и варывч. веществ, ч. 1—Пироксилин, СПБ, 1914; Н и к и т и н Н., Коллоидные растворы и эфиры целлюлозы, Л., 1929; Schrimpff A., Nitrocellulose aus Baumwolle und Holzzellulosenstoffe, Μ., 1919; Ullm. Εηζ. В. 5 u, 7; Eckcll J.u. 8as-sncr O., Projektirungen u. Apparaturen fiir d. che-mische Industrie, I Gruppe: Nitrocellulose, Synthe-tischer Campher, Pulver, Lpz., 1926. В. Тихонович.