 > Техника, страница 66 > Окись углерода
> Техника, страница 66 > Окись углерода
Окись углерода
Окись углерода. СО, в обычных условиях газ, пе обладающий цветом, запахом и вкусом. Как показывает химическая ф-ла, молекула О. у. состоит из двух атомов: одного углерода и одного кислорода. Класснч. теория валентности (смотрите) до сих пор не дала удовлетворительного ответа на природу химия. связи между этими атомами. Если принять валентность углерода нормальной, то следует считать кислород в молекуле О. у. четырехвалентным, в противном случае нужно признать углерод в этой молекуле двухвалентным вопреки положению классич. теории; последний взгляд является в настоящее время более распространенным, тем более что он согласуется с химическими свойствами О. у. Впервые О. у. описана в 1776 г. Лассоном, который получил ее при восстановлении окиси цинка углем. О. у. долго причисляли к числу т. н. несжижаемых газов, пока в 1877 г. Кайете не удалось получить ее в жидком виде. Твердая О. у. получена Врублевским в 1885 г. О. у. встречается в свободном состоянии довольно часто: в топочных газах при неполном сгорании топлива. в светильном газе до 10% и в дыме табака. При вулканич. извержениях О. у. содержится в выделяющихся газах; Муас-сан определил содержание ее там до 2%. Небольшие количества О. у. часто бывают включены в горных породах, в металлическом железе и особенно часто в каменном угле; наконец включения О. у. найдены также в метеоритах.
Физические свойства. По физич. свойствам О. у. повторяет свойства азота. Мол. вес О. у. и N равен 28; такое совпадение свойств обоих газов простирается и на ряд других физич. констант. Средний диаметр молекулы О. у. равен 3,76· 10~® сантиметров средняя длина пробега при нормальных условиях 5,8 10_® см; частота столкновений при нормальных условиях 4 800 · 10е в ск.; средняя арифметич. скорость молекулы=454 м/ск. Константы Ван-дер-Ваальса: а — 1 064 и 6=0,061. Плотность О. у. по отношению к воздуху при 0° и 760 миллиметров давления составляет 0,9673. 1 л О. у. при нормальных условиях весит 1,2506 г; 1 килограмм О. у. занимает при нормальных условиях объём в 800 л. Коэфици“ нт расширения, как у идеальных газов, равен 0,0036667. Коэф. диффузии О. у. в другие газы при 0°, выраженные в см3/ск, составляют: в водород — 0,6488, в кислород—0,2312, в этилен—0,101; при повышенных температурах (600—800°) О. у. диффундирует через обычное стекло и железо. Вязкость О. у. при 0° составляет 0,0001630, при 20° составляет 0,0001840. Сжимаемость
О. у., а также отклонение ее от закона Бойля-Мариотта видны из следующих данных (по Наттереру).
Давление в atm. 77 408 515 1 133 2 790
.. 1,000 0,900 0,810 0,500 0,261
ро
Растворимость О. у. в воде (по объёму) при разных температурах характеризуется следующими цифрами:
0° 10° 20°
0,032874 0,026353 0,023110
растворяет О. у. примерно в 10 раз больше воды. При температурах 0—25° один объём а растворяет0,20443 объёма О. у. Практич. значение имеет большая растворимость О. у. (особенно под давлением) в растворах хлористой меди, солянокислом и аммиачном; 1°крит. О. у. 139,5°, критическое давление 35,5 aim; критическая плотность 0,3110; степень полимеризации в критич. состоянии (Мюллер) составляет 1,328; t°Kun, жидкой О. у. под нормальным давлением -190°. Поверхностное натяжение жидкой О. у. при —193° составляет~ 8,2 D/см и при -203°~ 10,53 D/cjit; при еще более глубоком охлаждении О. у. превращается в твердое снегоподобное вещество с t°„- 207°. Твердая О. у. бывает в двух модификациях с 1° перехода при -213° и теплотой перехода модификации а в модификацию β, равной 144 cal на моль (Эйкен):
-190° -207° -213°
СОгаз «— С Оде. 7^ СОтв. β 7^ СОтв.а Молекулярная теплота плавления твердой О. у. составляет 224 cal, а молекулярная теплота испарения жидкой О. у. равна 1 414са1. Плотность жидкой О. у. 1ГГ= 0,7676. Уд. теплоемкость газообразной окиси углерода при <°23—99° составляет0,2479 при постоянном давлении и 0,2399 при постоянном объёме. Теплопроводность О. у. при 0° и нормальном давлении составляет 0,000053. Теплота образования О. у. из элементов составляет 29 000 cal на г-мол. Теплота сгорания при постоянном давлении равна 67 700 cal на г-мол. Молекулярная энтропия при 25° составляет 45,6 cal на градус. Химия, константа равна 1,205 (Партингтон). Диэлек-трич. постоянная О. у. при 0° и нормальном давлении равна 1,000695. Электрич. момент О. у. равен (0,1180±0,0016)· 10~18. В качестве потенциалов ионизации О. у. указываются следующие: 10,1; 14,1; 15,6 V. Рефракция О. у. для разных лучей:
Длина волны, λ. 334,2 m* 546,2 w* 867,8;*/*
Рефракция. 1,0003412 1,0003361 1,00033255
Дисперсия О. у. равна 0,0075.
Химические свойства. О. у. способна к ряду реакций присоединения. Так, с кислородом она соединяется очень жадно (иногда со ом), давая углекислоту. Непосредственное соединение О. у. с кислородом при обыкновенной (° не протекает, но м. б. вызвано соответствующим катализатором, наир, гопкалитом (смотрите). Пламя горящей О. у.—характерного синего цвета. О. у. соединяется с серой (парообразной), давая сероокись углерода COS. Смесь хлора и О. у. в темноте не изменяется, но воздействие света либо катализатора (активный уголь) ведет к интенсивному образованию а
COCK. О. у. соединяется подобно водороду с некоторыми металлами, давая т. наз. карбонилы (смотрите ниже). Вследствие большого сродства к кислороду О. у. является, особенно при повышенной ί° сильным восстановителем. Нек-рые окиси металлов, наир, окись меди, а также соединения серебра, палладия и др. восстанавливаются О. у. до металла. При высокой t° О. у. отнимает кислород от воды по ур-ию:
со+н2о ;±С02 + н2.
Эта реакция используется в технике для получения водорода; она обратима, и константа (К) ее равновесия в значительной степени зависит от Г, как это видно из приводимых данных:
| 1° | К | 1° | К | Г | К |
| 786 | 0,81 | 1 105 | 1,68 | 1 205 | 2,10 |
| 886 | 1,19 | 1 086 | 1,95 | 1 405 | 2,49 |
О. у. непосредственно соединяется с едкими щелочами и голятами; реакции эти применяются в технике. С едким натром (особенно легко под давлением) образуется муравьинокислый натрий:
СО + NaOH - HCOONa,
из которого м. б. получена свободная муравьиная к-та. С голятами образуются соли высших к-т—уксуснокислый и пропионово-кислый натрий:
СО + CH3ONa=CHvCOONa,
СО + C2HsONa=C2H5-COONa.
Аналогично реакции с едкими щелочами О.у. реагирует с гидратом окиси кальция и с карбидом кальция:
Са(ОН)2 + СО=СаСОэ + Н2,
СаС2 + ЗСО ·=» СаС03 + 4С.
Последние две реакции иногда применяются для удаления О. у. из технич. газов, наир, при получении чистого водорода из водяного газа. О. у. в присутствии различных катализаторов и при повышенной Г может реагировать с аммиаком, причем, в зависимости от характера выбранного катализатора, реакция идет в том или другом направлении. Так, над платиной образуется изо-циановокислый аммоний, изомеризующийся частично в мочевину:
СО +2 Nil·, ll2+CONNITiitCO(NH2)2.
Над рядом дегидратирующих катализаторов образуется цианистый аммоний ивода(Мель, 1’одон, Бредиг и др.):
СО + 2NHj »- NII4CN +HjO.
Последняя реакция находит в новейшее время техническое применение и на ее основе заявлено много патентов (фирма I. G. и др.). При нагревании О. у. с аммиаком иод увели-ченным давлением (до 100 atm) в присутствии катализаторов образуется формамид СО + NHa=HCONH2,
легко с отщеплением воды переходящий в синильную к-ту:
HCONHa - Н20=HCN.
Получение синильной кислоты по этому последнему пути также рекомендуется многими патентами (Ламбилли, Гольд-Зильберс, Анштальс и др.). Если под увеличенным давлением нагревать смесь О. у. с аммиаком в присутствии водяного пара, то образуется муравьинокислый аммоний:
СО + NHs + II20 => HCOONHj,
также могущий переходить в синильную кислоту:
HCOONHi - 2 Н20 - HCN.
Смесь О. у. и водорода непосредственно не реагирует даже при повышенной <°, но в присутствии катализаторов реакция между ними протекает уже при сравнительно небольшом нагревании (200—300°), причем, в зависимости от условий проведения реакции (давление, t° и прочие) и особенно в зависимости от природы и строения взятого катализатора, направление реакции и конечные продукты ее варьируют очень широко. При нормальном давлении на металлическом никеле при 250—350° единственными продуктами реакции являются метан и вода (Сабатье, Шуфтан):
со + зн2=сн4 + н20.
На железном катализаторе с примесью окисей щелочных металлов в присутствии большого избытка водорода и под небольшим давлением (до 10 atm) протекает процесс одновременного гидрирования и конденсации О. у., так что в продуктах реакции можно найти углеводороды парафинового ряда с числом углеродных атомов в молекуле до 70 и выше (Ф. Фишер и Тропш). При меньшем избытке водорода и более значительном давлении (до 100 atm и выше), на ряде смешанных катализаторов в продуктах гидрирования О. у. содержится много горючих кислородсодержащих соединений кетонно-го и ового ряда. Такие продукты, полученные Ф. Фишером, применялись некоторое время в качестве горючего для двигателей внутреннего сгорания под названиями си нто л и синтин. При надлежащем катализаторе и при соответствующих условиях, гидрирование О. у. под давлением м. б. проведено так, что продуктом реакции является метиловый :
СО +2Н*-СН,ОН.
Процесс этот в настоящее время осуществлен уже в промышленном масштабе (Патар, BASF,Американская компания по производству растворителей), и синтетический метиловый поступает на рынок в больших количествах под названием метанола (смотрите Метиловый голь). Кроме метанола гидрированием О. у. (иногда в присутствии воды) можно получать и другие ценные ор-ганич. соединения, как формальдегид, муравьиную и уксусную к-ты, этиловый и высшие ы,альдегиды и кетоны. Термически О. у. очень устойчива, при нагревании до 1 200° она не изменяется; только при еще более высоких температурах начинается медленный распад ее па уголь и С02. Такой же распад О. у. наблюдается и при более низких температурах—при пропускании через нее электрического разряда, при рдировке α-частицами или при действии катализаторов.
Физиологическое действие. О. у. очень ядовита; отравление ей в жилых помещениях известно под именем угара, и сама О. у. в этом смысле часто называется угарным г а з о м; ее же присутствием обусловлена ядовитость светильного, генераторного и водяного газов. Констатировать отравление О. у. легко путем спектроскопия, исследования отравленной крови, которая ме няет при этом свою нормальную окраску и приобретает несколько резко выраженных спектральных линий. Этот же метод, при пользовании препаратом дефибринирован-ной крови, м. б. с успехом применен для обнаружения присутствия О. у. в воздухе или другом газе.
Аналитическое о пре д е л е н и е О.у. Для качественного обнаружения О. у. кроме метода спектроскопического исследования крови, насыщенной исследуемым газом, можно воспользоваться сильной восстанавливающей способностью О. у. Исследуемый газ встряхивают с аммиачным раствором хлористой меди, а этот последний взбалтывают с разбавленным раствором хлористого палладия; в случае присутствия О. у. образуется коллоидный раствор или черный осадок металлич. палладия
СО + PdCl2 + Н20=С02 + 2 НС1 + Pd.
Можно взбалтывать исследуемый газ с аммиачным раствором окиси серебра, которая при этом также восстанавливается. В последнее время для качественного обнаружения присутствия О. у. в воздухе, употребляется специальный реактив г у л а м и т (пемза, пропитанная раствором J205 в дымящей серной кислоте), к-рый в случае положительной реакции меняет свою окраску. Для количественного определения окиси углерода употребляются в основном 2 метода: эвдиометрический и метод поглощения. По первому методу исследуемый газ в смеси с кислородом ают в специальной бюретке—эвдиометре и затем определяют количество образовавшейся углекислоты. В качестве поглотительной жидкости для определения О. у. берется аммиачный или солянокислый раствор хлористой меди либо раствор закиси меди в серной к-те, иногда с добавкою /3-нафтола (реактив Лебо). При взбалтывании испытуемого газа с одним из таких растворов в пипетке Гемпеля или в аппарате Орса О. у. количественно поглощается и содержание ее м. б. определено по изменению объёма. Очень небольшие количества О. у. могут быть определены путем пропускания содержащего ее газа над пя-тиокисыо иода (J205) при темп-ре около 70°, с последующим поглощением образовавшейся СО» раствором гидрата окиси бария.
Получение О. у. В лаборатории О. у. удобно получать постепенным приливанием муравьиной кислоты к умеренно нагретой конц. серной кислоте:
нсоон=н2о + со.
Для очистки выделяющегося газа от примесей его пропускают через промывалки со щелочью и с серной кислотой. Можно получать О. у. нагреванием смеси 1 ч. желтой кровяной соли с δ ч. конц. серной кислоты:
K4Fe(CN)06II2O + 6H2SO4 =
= 6 СО + 2K2S04 +FeS04 + 3(NH4)2S04.
Нагревание хлороформа с едкой щелочью также ведет к образованию окиси углерода по ур-ию:
СНС13 + ЗКОН=СО + ЗКС1 +2Н20. Щавелевая кислота, нагретая с серной, дает равные объёмы О. у. и С02:
(СООН)2=Н20 + СО + С02.
Получение О. у. в технике. Все чаще, особенно в западной технике, О. у. получается при фракционировании сжиженных технич. газов по способу Линде-Франка-Каро [*] (смотрите Водород). Особенно удобным является водяной газ, в к-ром содержится около 40% О. у. Однако широко распространены и методы прямого получения О. у. Для прямого получения б. или м. чистой О. у. пользуются способностью углекислого газа при повышенной t° реагировать с углем по реакции:
С02 + С;±2С 0 - 39000 cal.
Реакция эта обратима, и положение равновесия ее сильно зависит от температуры (Будуар и Стансфильд):
1°. 415 550 650 800 925 1 100
СО (в %). 0,0 11,1 38,5 93,5 96 99,3
Практически этот процесс осуществляется в специальных газогенераторах и в зависимости от характера газового дутья в них м. б. отнесен к какому-либо из следующих типов генераторного процесса: 1) воздушное дутье (обычный генераторный процесс); 2) дутье воздуха с углекислотой; 3) кислородное дутье; 4) дутье кислорода с углекислотой. Дутье одной углекислоты практически нецелесообразно и не практикуется, так как реакция ее с углем сильно эндотермич-на и потребовала бы большой затраты добавочного тепла на нагревание (подробнее обуказанных типах газового дутья смотрите ниже). В каждом генераторном процессе основным сырьем является уголь. Из разновидностей его м. б. применены древесный уголь, кокс и антрацит. Выбор того или другого вида сырья зависит от местных условий. Антрацит имеет то преимущество, что непосредственно (после дробления) м. б. загружен в генератор. Древесный уголь берется почти исключительно березовый, однако прямо загружать его в генератор нельзя, т. к. в нем еще содержится значительное количество водородистых соединений и влаги, что повлекло бы к снижению процентности О. у. в газе и примешиванию к нему водорода. Для освобождения древесного угля от влаги и углеводородов его подвергают предварительному нагреванию до высокой <° (700—800°) в закрытых ретортных печах. После такой прокалки уголь содержит в себе еще небольшие количества влаги и углеводородов, однако освобождение от последних следов их представляется экономически нецелесообразным, в виду незначительного влияния их на конечный состав газов. Прокаленный уголь перед загрузкой его в генератор освобождается от пыли и мелочи на специальных ситах-грохотах. Величина загружаемых кусков 1,5—5 сантиметров в диам. Кокс и антрацит перед загрузкой в генератор никакой предварительной обработке не подвергаются кроме отсева на грохоте и иногда дробления. Другой компонент генераторного процесса — продуваемый газ—должен быть возможно однороден и во всяком случае сух. Осушка вдуваемого газа производится обычным путем—пропусканием через колонку с орошением серной кислотой и колонку с хлористым кальцием.
Общая схема генераторной установки приведена на чертеже. Основным аппаратом является газогенератор а, представляющий собой шахту, сложенную из огнеупорного материала, к-рый выбирается в соответствии с характером процесса. Размер генераторов м. б. самым различным, но отношение высоты их к диам. почти всегда бывает 2:1. Загрузка угля производится сверху.равно как и отбор газа.Дутье подводится в нижнюю часть генератора обычно сбоку его, причем в зависимости от размеров генератора локализуется или в одном или в нескольких местах его окружности.
Уголь в генераторе лежит или на специальных колосниках в том случае, если t° зоны горения генератора не очень высока (воздушное дутье), или чаще прямо на огнеупорном поду; внизу генератора имеется или лаз для выгрузки золы (древесный уголь) или спускное отверстие для жидкого шлака. Выходящий генераторный газ прежде всего очищается от увлекаемой угольной пыли в специальном пылеуловителе в и скруббере б, а затем проходит через ряд промывных щелочных скрубберов г для очистки от углекислоты. После скрубберов ставится спец, брызгоуловитель д для удержания увлекаемых газом частичек воды из скрубберов. Очищенный газ подсасывается насосом с и направляется в газгольдер. Газовое дутье осуществляется с помощью воздуходувки ою или компрессора, в зависимости от требуемой скорости продувания и от соответствующего давления продуваемого газа. Разжигание генератора в начале процесса осуществляется путем загрузки в него раскаленного угля с последующим продуванием. Загрузка угля в генератор производится или периодически или непрерывно; таким же бывает и сам процесс в соответствии с другими обусловливающими его факторами.
1) Воздушное дутье применяется в простейшем случае генераторного процесса с целью получения обычного генераторного газа. Вдуваемый воздуходувкой сухой воздух сжигает нижние слои угли до углекислоты, выделяя при этом большое количество тепла (96 000 cal на г-мол.); раскаленные газы, проходя через последующие слон угля, нагревают его до б. или м. высоких 1°, образуя разные 1°-ныс воны. Правильное расположение этих 1°-пых зон в генераторе и является основным требованием рационального ведения генераторного процесса. Зона горения при воздушном дутье занимает сравнительно большой объём около точки вдувания (10—15 л), но имеет сравнительно невысокую 1° — не выше 1 200°, так что это позволяет пользоваться для кладки генератора обычным огнеупорным материалом, например шамотным кирпичом, и употреблять чугуппые колосники. Образовавшаяся в зоне горения углекислота в последующих угольпых слоях генератора разлагается углем и дает О. у. Вдувание воздуха в генератор должен быть таким, чтобы правильно установить |°-ные зоны его; практический контроль скорости вдувания м. б. осуществлен путем анализа выходящего газа. Слишком слабое вдувание может «посадить» генератор, то есть потушить его; скорость же вдувания устанавливается кроме данных аналиаа газа также и в соот ветствии с требуемым количеством снятия с генератора окиси углерода Для правильности работы генератора кроме дутья очень важна также рациональная загрузка его углем. Последняя осуществляется чаще всего периодически, т.е. после выгорания одной, процесс останавливается, генератор очищается от золы или шлака и затем загружается следующей порцией угля. Для более удобного сливания щлака нередко к загружаемому углю прибавляют флюсы, которые способствуют плавлению шлака. Иногда процесс ведут длительное время непрерывно, и тогда загрузка угля в генератор осуществляется также непрерывно, равно как и выгрузка шлака. При воздушном дутье процесс в общем идет гладко, и поэтому генератор может непрерывно работать продолжительное время. Генераторный газ теоретически может содержат;, не более 34,6% О. у., а на практике дает до 33%. 2) Дутье воздуха с углекислотой. Основной недостаток вышеописанного генераторного процесса—низкий % окиси углерода вполучаемом газе. С целью несколько повысить этот % к вдуваемому воздуху примешивают углекислоту, однако следя за тем,чтобы избыточным количеством последней не потушить генератор. Таким смешанным дутьем воздуха с углекислотой удается получать газ с содержанием О. у. до 45%. В остальном процесс мало отличается от простого генераторного. 3) Кислородное дутье. Для получения высокопроцентной О. у. применяют дутье в генератор чистого сухого кислорода. Таким путем можно получать газ содержанием окиси углерода в 98% и выше. Однако здесь встречаются и серьезные недостатки, являющиеся следствием высокой 1°, при этом развивающейся в генераторе. Зона горепия при кислородном дутье бывает очень небольшой (немного больше л), но Г ее выше 2 000°. Такая 1°, локализуясь у места подвода кислорода, очень быстро разрушает футеровку генератора, т. к. шлак сплавляется с кирпичом. В этом случае футеровоч-ным материалом служит уже пе шамотный кирпич, а например тальковый камень. Но и такая футеровка очень быстро изнашивается в местах вдувания кислорода и требует довольно частой смены ее. Одним из средств борьбы против этого недостатка является отодвигание золы горения от стенок генератора вглубь его, что отчасти достигается увеличением скорости вдувания кислорода; с этой целью кислород вдувается в генератор с помощью сильного компрессора под давлением до 1 aim и выше. Другой метод борьбы с быстрым изнашиванием стенок генератора осуществила фирма Пинч путем подвода кислорода в генератор по специальной трубке непосредственно в середину ннжпей части его. Естественно, что сильному накаливанию подвергается при этом кислородподво-дящая трубка, которая выполняется из особого огнеупорного материала, состав которого держится фирмой в секрете. Однако и такие трубки от времени до
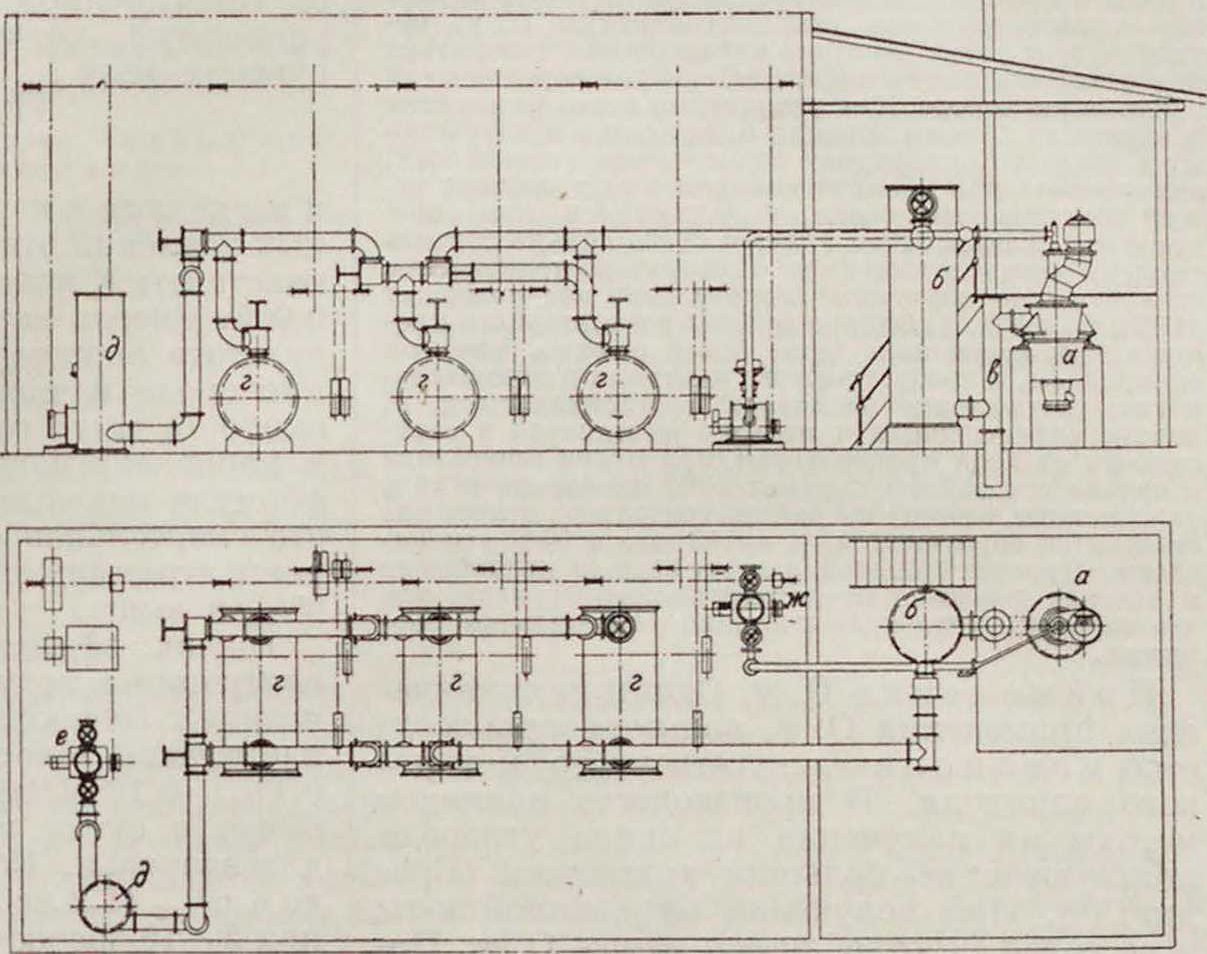
времени приходится заменять повымп. Нижняя часть генератора, на κ-poft собирается расплавлепный шлак, выложена огнеупорным материалом и посыпана песком. Работа генераторов — периодическая; продолжительность периода обусловлена быстротой износа футеровки или подводящей кислород трубки. 4) С м е-шанное дутье кислорода н углекислоты. Чисто кислородное дутье, хотя и дает возможность получать высокопроцентную О. у., неудобно вследствие быстрого изнашивания генератора от развивающейся высокой темп-ры при горении угля в чистом кислороде. Для устранения этого недостатка п снижения 10 воны горения предложено к вдуваемому в генератор кислороду подмешивать углекислоту, эндотермическая реакция которой с раскаленным углем компенсирует тепло, выделяющееся при горении угля. Таким путем удается очень сильно снизить тсмп-ру 80ны горения п износ генератора практически сделать мало заметным; получаемый газ содержит 98% и более О. у. Однако ведение генераторного процесса при смешанном дутье более сложно, чем при однородном, и требует частого контроля и внимательности; соотношение кислорода и углекислоты должен быть вполне определенным и нередко изменяется в зависимости от хода процесса: так, при пуске генератора в начале его работы вдувают 60% кислорода и 40% углекислоты, к концу же работы генератора отношение становится обратным: 40% кислорода и 60% углекислоты. Процесс большей частью ведется непрерывно в течение довольно продолжительного времени, так что эагрузка угля идет постоянно небольшими порциями.
Применение О. у. Одним из технических применений О. у. является производство метанол а—искусственного метилового голя. В производстве цианидов методы их получения из окиси углерода пользуются все большим вниманием (Вре-диг) [2J. При получении муравьиной кислоты и ее солей, употребляется также О. у. Получение карбонилов металлов, находящих себе все более обширное применение в технике, исходит из О. у. В последнее время имеется ряд технич. предложений, частично уже используемых в промышленности, для употребления О. у. в целях синтеза ряда сложных органич. соединений, как высшие ы, к-ты, кетоны, углеводороды и прочие Красочная, фармацевтическая, военная промышленности пользуются О. у. для получения а (смотрите). Наконец кроме применения в синтетических целях О. у. как составная часть водяного и коксовального газов широко применяется в качестве газообразного топлива.
Лит.: 1) Г. И. 254043; а) Ф. П. 574220, Ап. II. 617953, 269166.—Менделеев Д., Основы химии, 9 изд., т. 1, стр. 176 п 386, М.—Л., 1927 (Общие сведения); Фишер Ф., Искусственное получение жидкого топлива, пер. с нем., Л., 1927 (О переработке О. у. в жидкие горючпе производные—синтол и сип-тин); 3 и м а к о в II., «ЖХП», Москва, 1928, стр. 771 и 1072 (О реакциях О. у. с аммиаком и водородом); Roscoe Η. Е. an il SchorlemmerC., A Treatise on Chemistry, t. 1, p.796, L., 1920; Handbuch <1. anorganischen Chemie, herausgegeben v. R, Abegg u. Fr. Auerbach, B. 3, Abt. 2, p. 136, Leipzig, 1919; G m c-I i n-K r a u t, Handbuch d. anorganischen Cbemie, B. !, A bl. 3, p.549. Heidelberg, 1911; Ullm.Enz., B. 7, p. 33; Fro 11 c h K. u. C ry d e г D., «I. Eng. Chem.», 1930, 22, p. 1051 (О применении О. у. для синтеза высших ов). П. Зимаков.
0. у. как промышленная и бытовая вредность. О. у. типичный кровяной яд общего действия с кумулятивными свойствами. Ток-сич. действие О. у. основано на ее способности образовывать устойчивое соединение с гемоглобином крови (условно обозначенным НЬ) — т. наз. карбоксигемоглобин (НЬ СО). Последний образуется при взаимодействии О. у. как со свободным гемоглобином, так и с оксигемоглобином (НЬ02), то есть имеют место две обратимые реакции: Hb + СОтЩЬСО и НЬОг + СОт±НЬ-СО + ог.
Эти реакции наряду с нормально протекающим в организме процессом
НЬ +02£НЬОг,
также обратимым, обусловливают между обоими газами (СО и 02) и связывающим их гемоглобином определенное химическое равновесие, подчиняющееся закону действующих масс
CllbOj · ("со _
СцЬСО Со2 ~ v
и зависящее в первую очередь от парциальных давлений этих газов. Средние значения константы К колеблются в пределах 0,003— 0,005. Смерть наступает от асфиксии (в результате аноксэмии—недостаточной подачи кислорода к тканям) в том случае, когда около */» всего гемоглобина крови перейдет в карбоксигемоглобин. Приведенная выше формула показывает (для К равного 0,05), что смертельное отравление возможно при концентрациях окиси углерода в воздухе от 2°/00 и выше.
Токсич. эффект О. у. зависит от ее концентрации в водухе и от длительности экспозиции (периода действия). Большинство наблюдений говорит за то, что концентрация 0,1°/оо (0,12 мг/л) О. у. при экспозиции до 6 час. в сутки не представляет опасности для здоровья. Концентрации выше 0,1°/оо и до 1,0%0 (1,2 мг/л) дают легкое отравление при 5—10-часовом воздействии. Максимальной допустимой концентрацией О. у. в отдельных производствах считают обычно 0,2°/оо (0,25 мг/л); на срок не более 1 часа допускается содержание 0,3—0,4°/оо (0,37— 0,5 мг/л) О. у. Концентрации О. у. выше 0.4° оо (0,5 мг/л) представляют безусловную опасность; концентрации порядка 2—3°/00(2,5—3,7 мг/л) при экспозиции в 30—60 мин. вызывают длительное заболевание, а при 4—5-часовом воздействии—смерть. Концентрация 4°/оо (5 мг/л) смертельна уже при экспозиции в 1 час, концентрация 0,5—1,0% окиси углерода (6,2 —12,5 мг/л)—при 30-минутной. Смертельная доза окиси углерода равна 0,5—0,6 г.
Отравление невысокими концентрациями О. у. выражается в постепенно нарастающем комплексе симптомов, известном под названием угара: оно характеризуется тяжестью, болыо и шумом в голове, притуплением сознания, ощущением жара в лице,мышечной слабостью, головокружением и тошнотой; при продолжающемся действии О. у. наблюдается расстройство движений, потеря двигательной способности, резкое покраснение кожи (особенно лица), рвота и длительный глубокий обморок. При действии высоких концентраций О. у. (>0,5%)—бессознательное состояние, синюха, судороги и быстро наступающая смерть. Отравления являются обычно результатом вдыхания содержащего О. у. воздуха, что может иметь место как в ряде производственных процессов (смотрите Спр. ТЭ, т. IV, стр. 85), так и в жилищных условиях (при неправильной топке печей, утечках светильного газа и тому подобное.). Благодаря отсутствию у О. у. запаха и раздражающих свойств, отравления ей часто происходят незаметно, что делает О. у. особенно опасной вредностью. В Германии например отравления
О. у. составляют до 28% общего числа зарегистрированных непроизвольных отравлений, а в больших городах (Берлин)—до 36%. Массовые отравления О. у. наблюдались при пожарах в угольных шахтах и при различных горных разработках, производимых под землей с помощью ов. Таблица 1 указы вает максимальное содержание О. у., допускаемое в различного рода помещениях.
Т а б л. 1Д опускаемое со д е р ж а н и е О. у. в помете н и я х.
| Род помещений | Концентрация СО | |
| в % | в мг/л | |
| Жилые комнаты с газовым | 1 | |
| освещением (США). | 0,03 | 0,035 |
| Кухни с газовыми плитами (США).. | 0,1 | 0,12 |
| Литейные цехи, в среднем | 0,025-0,04, | 0,03—0,05 |
| » временно (при отливках) до. | 0,16 —0,25 | 0,2 —0,3 |
| Автогаранш (США), в среднем .. | 0,10 —0,16 | 0,12—0,20 |
| Автогаражи временно до. | 0,85 | 1 |
В интересах здравоохранения подобные нормы для промышленности должен быть значительно снижены, так как в настоящее время доказана возможность хронич. отравлений, вызываемых повторным действием очень малых концентраций О. у. и проявляющихся в развитии малокровия и различных нервных заболеваний (в СССР Ин-том охраны труда предложена норма в 0,02 мг/л). С другой стороны, практика показала,что в отдельные производственные моменты содержание О. у. в воздухе может значительно превышать допустимые нормы, доходя, например при отливке чугуна в опоки, до 0,5—0,7%, а при ремонте повреждений газовых сетей—даже до 3%; в этих случаях является необходимым применение индивидуальных защитных средств в виде специальных противогазов.
Меры первой помощи при отравлениях О. у.: немедленное удаление из опасной атмосферы на чистый воздух, растирание конечностей и согревание тела, вдыхание кислорода или лучше смеси кислорода с 5% С02; при обмороке—искусственное дыхание, пока не восстановится нормальная работа легких; рекомендуется также внутривенная инъекция кислорода и некоторых возбуждающих средств, например α-лобелина. Про-филактич. мерами защиты от О. у. на производствах кроме вентиляции и возможного устранения проникания О. у. в атмосферу являются: периодический или непрерывный контроль воздуха рабочих помещений, осуществляемый с помощью химич. реактивов (смотрите выше) или специальных газоанализаторов (смотрите Анализ газов и Г азоопределители), и применение, где это нужно, противогазовых аппаратов (смотрите Противогазы). Последние м. б. изолирующими (наир, кислородные аппараты Дрегера и других) или фильтрующими. Действие фильтрующих противогазов основано на окислении СО в С02 каким-либо химич. окислителем, например J206 (франц. и англ, «гуламитовые» противогазы), или кислородом воздуха в присутствии катализатора типа гопкалита (герм, противогаз Degea, америк. «универсальный» противогаз и др.).
В военном деле токсич. свойств О. у. не нашли прямого применения в смысле использования ее как боевого отравляющего вещества, т. к. этому препятствует ее малая плотность и несжижаемость при обычных 1°. Тем не менее в обстановке современной войны нередко создается возможность накопления значительных концентраций О. у., угрожающих здоровью и даже жизни людей: при минно-подрывных работах, при орудийной и пулеметной стрельбе из закрытых и полузакрытых помещений, на подводных судах, на морских судах при разрыве снарядов в подпалубных пространствах и т. д. Во всех этих случаях О. у. образуется как продукт разложения чатых веществ и ов, являясь главной составной частью ных газов (табл. 2).
Таблица 2.—С о д е р ж а н и е О. у. в продуктах разложен и я чатых материалов.
| чатый материал | % СО в газах |
| Черный .. | 3,6—9,3 |
| . | 34 |
| Пироксилин .. | 46,8 |
| Тротил..·. | 57 |
| Мелинит.. | 61 |
Указанное обстоятельство распространяет проблему защиты от О. у. и на область военной техники. Здесь имеются разработанные в нек-рых армиях специальные конструкции противогазов (главным образом для морского флота), которые однако еще не могут считаться вполне удовлетворительными.
Кроме токсич. действия на человеческий организм О. у. играет роль промышленной вредности также и в том смысле, что она является каталитическим ядром для ряда производственных химич. процессов, а именно для гетерогенных реакций каталитич. гидрирования и восстановления веществ на метал-лич. катализаторах (см .Катализ, каталитические процессы в технике). В целях борьбы с этим явлением приходится прибегать к весьма тщательной предварительной очистке реагирующих газов (обычно водорода) от О. у., что и м. б. достигнуто различными путями: промыванием газа аммиачными или солянокислыми растворами солей меди, превращением О. у. в С02 (действием водяного пара при высокой t°), восстановлением ее в метан СИ4 (водородом), или окислением в СО2 воздухом на катализаторах типа гопкалита. При пользовании для синтезов технич. водородом, получаемым из газа коксовых печей, П2 освобождают от последних следов О. у. промыванием его сжиженным азотом. Отравление катализаторов О. у.—процесс практически обратимый; при обработке отравленного катализатора чистой газовой смесью, не содержащей СО, его активность постепенно восстанавливается, обычно достигая своего первоначального значения.
Лит.: О. у. как вредпость: Robert R., Lehrbuch d. Intoxic,ationen, Stg., 1906; id, Kompen-dium d. praktischen Toxikologie. 5 Aufl., Stg., 1912; Foster C.L. a. HaldaneJ. S., The Investigation of the Mine Air, L., 1905; Nicloux M.,L’oxyde de carbone et 1’intoxication oxycarbonique, P., 1925· Katz S- Η., «I. Eng. Chem.», 1925, v. 17, p. 555·
Henderson Y., «.Tourn. of the American Medical Association», Chicago. 1916, vol. 67, p. 580; Van· da veer F., «Gas Age Record», New York, 1927, v, 59, p. 37.— Определение О. у.: 3 а пади н с к и ft М. и Леонов С., «ЖХП», 1929, т. 6, стр. 1273; Hoover С. R., «I. Eng. Chem.», 1921, v. 13, p. 770; Lebeau et Bedel, «CR», 1924, v. 179, p. 108; «Journ. des usines и gaz», P.,
1928, v. 52, 3, p. 49; S c h 1 a e p f e r M. et Hof
mann E., ibid., 1929, v. 53, 1, p. 4; W e 11 0 n N. a. Drake N. «I. Eng. Chem.», Anil. Edition,
1929, v. 21, 1, p. 20; Am. Π. 1644014/27, 1684587/28,—
Защита от О. у.: К ап пел ев ич Е., «Война и технина», Москва, 1925, 194, стр. 18; Field-n er А. С., Katz S. II. and Kinney S. P., Gas masks for gases met in fighting fires, Washington, 1921; G u i 1 1 e m a r d H. e t L ii h r m a η n A., «Chimie et Industrie», Paris, 1925, v. 14, 14, p. 29; Bunte K., «Gas- u. Wasserfach“, Miinchen, 1926, •Tg. 69, 815; Woliin K., ibid., 1929, Jg. 72, p. 210. В. Янковский.
Карбонильные соединения металлов. Металлы VIII и VI групп периодич. системы (Fe, Со, Ni, Ru, Cr, Mo, W) в определенных условиях способны непосредственно соединяться с О. у., образуя т. наз. карбонилы м е т а л л о в—летучие жидкости либо кристаллические вещества, содержащие 2—6 СО-групп на 1 атом металла. Помимо чисто научного интереса карбонилы металлов сыграли важную роль при проверке и уточнении ат. в металлов, а нек-рые из них, особенно карбонил железа, приобрели уже и технич. значение. Общим способом получения карбонилов является действие О. у. на свежевосстановленный, тонко раздробленный металл при повышенной темн-ре и давлениях от нормального (для Ni) до 400 atm (для Ru). Реакция образования карбонилов—процесс обратимый; в условиях, отвечающих достаточной скорости реакции, равновесие сдвинуто в сторону почти полной диссоциации образующегося продукта; поэтому для получения заметных количеств карбонила необходимо быстро удалять его из реакционной зоны и тотчас же подвергать глубокому охлаждению. Указанным путем получаются непосредственно лишь высшие (наиболее богатые СО) карбонилы, остальные могут быть получены из первых путем термического или фотохимического разложения.
Вопрос о строении карбонилов до настоящего времени не решен. Первое из полученных соединений этого рода — никелькарбо-нил, Ni(CO)4, открытый в 1890 г. Л. Мон-дом,—рассматривалось вначале как производное восьмивалентного никеля Ni( С:0)4, однако разнообразие типов карбонилов при чрезвычайной близости их физикохимич. свойств заставило отказаться от этого взгляда. В настоящее время карбонилам часто приписывают циклическое строение, изображая например Ni(CO)4 и Со2(СО)3 следующими ф-лами (Монд):
N1
со—со I ; со—со
.СО /СОч
СО( >Со—СО—СО —Со( )СО.
чСО/ СОХ
Другие исследователи (Рейлен) рассматривают карбонилы как солеобразные производные,отвечающие моногидрату недокиси углерода (С302), что однако не позволяет построить все существующие типы карбонилов. Наиболее вероятным является допущение, что карбонилы металлов образованы за счет побочных валентностей (пли ковалентностей) молекул О. у. и тем самым суще ственно отличаются от производных CIV; за это говорят например реакции Ni(CO)4 (с бромом, серой, кислородом), аналогичные реакциям свободного Ni, причем О. у. полностью отщепляется. Повидимому вопрос о строении карбонилов м. б. разрешен лишь в связи с вопросом о природе химич. связей в нейтральной молекуле О. у., которая и по ряду химич. свойств и по электронной структуре обнаруживает большое сходство с CN-ионом (изостеризм, по Лангмюру).
Карбонилы металлов нерастворимы в воде, но растворяются в большинстве органических растворителей; исключением является Ru(CO)2, растворяющийся в воде и нерастворимый в бензоле. Все карбонилы—непрочные соединения, при нагревании легко диссоциирующие на металл и О. у. (иногда со ом). При поджигании сгорают коптящим (от выделения окиси металла) пламенем; пары их в смеси с воздухом чаты. Вода, щелочи и слабые кислоты не разлагают карбонилов; к другим веществам карбонилы относятся как восстановители, например выделяют металлич. медь и серебро из их солей; при действии хлора на карбонилы образуется хлорид соответствующего металла и СОС12. Группы СО в карбонилах м. б. частично замещены молекулами N0, аммиака, органич. аминов или галоидов, причем в получающихся соединениях содержится еще не менее двух групп СО на 1 атом металла.
Тетракарбонил никеля, никель-карбонил, Ni(CO)4,—бесцветная,сильно преломляющая свет летучая жидкость с неприятным запахом; ί° 43,3°, t°nA— 25°; уд. в D°=l,356, В17=1,318; плотность пара (по воздуху) Δ =6,01 соответствует вышеприведенной ф-ле. Вещество растворимо в е и бензоле, в запаянном сосуде сохраняется без изменения, на воздухе легко окисляется, отщепляя О. у.; количественно разлагается на Ni и СО при t° 180°; смесь паров Ni(CO)4 с воздухом ает уже при 60°. Пары Ni(CO)4 действуют как сильный яд при концентрациях от 0,5%. Токсическое действие по своему характеру заметно отличается от действия О. у. и выражается гл. обр. в параличе нервных центров, понижении обмена веществ и выделении сахара с мочой (глюкозурия); смертельная доза около 30 мг на 1 килограмм живого веса. Для получения Ni(CO)4 берут порошкообразный или губчатый никель, восстановленный водородом или водяным газом при 250—300°, и нагревают его в струе чистой О.у. до 50—100° под обыкновенным или повышенным давлением; пары Ni(CO)4 конденсируют в приемнике, охлаждаемом смесыо твердой С02 с эфиром или ацетоном. В настоящее время никелькар-бонил служит в технике промежуточным продуктом при получении химически чистого никеля: для этого через восстановленную Ni-руду пропускают ток окиси углерода при i°80°; Ni отгоняется со струей газа в виде Ni(CO)4 и пропускается затем над кусками обожженной глины, нагретыми до 200°, где и происходит регенерация никеля, а О. у. снова возвращается в процесс. Подобным же осаждением Ni на асбесте или кизельгуре м. б. получен активный никелевый катали затор для реакций гидрирования. Осаждение Ni на поверхности нагретого стекла дает плотную, ровную пленку металла, а потому предложено как способ получения зеркал, никелирования сосудов Дыоара, термосов и тому подобное. Наконец имеются предложения применять Ni(CO)4 как анти (смотрите) в двигателях внутрейнего сгорания.
Пента карбон и л железа, феррокарбонил, Fe(CO)5,—жидкость желтого цвета с Гк„„. 102,7° и — 20° (при 1° жидкого воздуха вещество бесцветно). Удельный вес D°= 1,4937, Dli= 1,4664, Х>21= 1,457 и D°= 1,4330; молекулярная теплоемкость (жидкого карбонила) равна 57 cal; теплота плавления 3,25 cal/моль; теплота образования из Fe и СО равна 54 cal/моль; теплота горения 384,5 cal/моль. Fe(CO)6 растворим почти во всех органических растворителях; растворы бурого цвета, на воздухе постепенно разлагаются. Диссоциация Fe(CO)6 на Fe и СО становится заметной уже при Г=60°, а выше 150° она делается полной. При сгорании Fe(CO)6 дает Fe303 и С02; перекисями он бурно окисляется, с конц. серной к-той дает FeS04, СО и Н2, а с СС14 реагирует с образованием FeCl2,CO и COCI2. С водным раствором сулемы Fe(CO)5 реагирует по следующему уравнению:
Fe(CO)3 + 2HgCl3 + Н20 =Fe(CO)4-2HgCl + СО+2НС1. Эта реакция используется для количественного определения Fe(CO)5 в моторном топливе, для чего анализируемую пробу горючего отмывают от могущей содержаться в нем щелочи, затем обрабатывают раствором HgCl2 и титруют выделившуюся НС1 щелочью (с метилоранжем). Другой способ определения Ке(СО)5 заключается в окислении его с помощью Н202, причем все железо переходит в Fe,03. От действия света Fe(CO)6разлагается по ур-ию
2 Fe(CO)s - Fe2(CO), + СО,
образуя нонакарбонил железа, Fe^CO),—оранжевые кристаллы уд. веса 2,085, нерастворимые в эфире и хлороформе. Это вещество при нагревании до 100° распадается, образуя вновь пентакарбонил по следующему уравнению:
2Fe2(CO),=3Fe(CO)6 + Fe + ЗСО.
В качестве промежуточного соединения здесь образуется тетракарбонил Fe(CO)4—зеленые кристаллы,разлагающиеся при 140°. Получение Fe(CO)5 требует применения значительных давлений. Образование небольших количеств Fe(CO)6 было обнаружено при хранении сжатого водорода в стальных баллонах. С 1924 г. Fe(CO)s вырабатывается в технич. размерах (BASF, Германия). Для его получения служит губчатое железо, восстановленное водородом при ί°2= 500°, которое дробится на куски в атмосфере С02 и затем обрабатывается током О. у. при Г 1504-200° и давлении 100—200 aim. Содержащий О. у. газ (водяной или генераторный) проходит через печь сверху вниз; из реакционной зоны газ поступает в расположенный непосредственно под ней конденсатор, сильно охлаждаемый снаружи и находящийся также под давлением; здесь пары Fe(CO)6 сжижаются, а остальная масса газа возвращается в процесс путем непрерыв ной циркуляции. Содержание в газе водорода и аммиака благоприятствует образованию карбонила, присутствие же кислорода препятствует реакции; к железу рекомендуется прибавлять окислы Ni, Bi я А1 в качестве катализаторов. В настоящее время Fe(CO)5под названием мотил, изготовляет германский концерн «I. G.» для применения в качестве антиа. Сила действия карбонилов железа и никеля, по сравнению с наиболее употребительным антиом—тетраэтилсвинцом, выражается следующим отношением
Fc(CO)5 : Pb(C2H5)4 : Ni (СО),=6 :4 : 1.6. Моторный бензин с добавкой ~ 0,2% Fe(CO)5выпускают на рынок под названием мота-л и н; обычно в него вводят нек-рые стабилизирующие вещества (например ди-и-толу-идоантрахинон или другие азотсодержащие ароматич. соединения). Термин. разложение Fe(CO)5 представляет большой технич. интерес как удобный способ получения наиболее чистого железа. Такое железо содержит лишь около 0,1% С и абсолютно свободно от других примесей; оно ппрофорично, обладает высокой каталитической активностью и может служить для получения чистых препаратов солей: путем пореплавления из не-ю м. б. получено нержавеющее литое железо для поделок и электромагнитных приборов. В химич. технологии Fe(CO)5 предложен как восстановитель, переводящий (в присутствии щелочей) нитросоединения в амины, органические красители—в лейкосоединения и тому подобное.
Кобальт карбонил, Со(СО)4 или Со2(СО)8— оранжевые кристаллы, уд. веса 1,73; IV». 51°; выше 52° раалагается, переходя в карбонильное соединение низшего типа Со(СО)3 или Со2(СО)в—черные кристаллы, диссоциирующие при (°>60°. Для получения Со(СО), требуется 1° 150ч-200° и давление 40—160 aim.
X р о м к а р б о н и л, Сг(СО)в, получен Жобом (Job) из СгС13 и О. у. в присутствии алнил-магний-бромидов RMgBr. Бесцветные кристаллы, очень летучие, слегка растворимые только в СНС13 и СС14. В запаянном сосуде вещество плавится при 150°, разлагается выше 200°. Вода, бром и иод не действуют, серная кислота реагирует очень медленно, дымящая азотная к-та энергично окисляет.
М о л и б д е н к а р б о п и л, Мо(СО)в,—бесцветные кристаллы, легко возгоняющиеся, уд. в 1,96; разлагается выше 150°. Получен из Мо и О. у. при 1°^200° и давлении-130 aim. Известны также карбонил вольфрама и два карбонила рутения—Ilu(CO), и Ru(CO)i. Технич. значения эти вещества пока не имеют.
Лит.: Dewar J. a. Jones, «Proceedings of the Royal Society», London, 1907, v. 79 (A), p. 66; Μ ο n d L., «Zeitschrift fur anorganische Chemie», Hamburg— Leipzig, 1910, B. 68, p. 207; «Journ. of the Chemical Society“, L., 1910, v. 97, p. 798, 1922, v. 121, p. 29; «Chimie et Industrie», P., 1928, t. 21, p. 681; В I a n-chard A. a. Gilliland W., «Journal of the American Chemical Society», New York, 1926, v. 48, p. 410, 872; Laird F., «L’Industrie chimique», Paris, 1928, p. 367; King J. and Sutcliff J., «J. Ch. I.», 1928, v. 47, p. 351; Mittasch A., «Z. ang. Ch.», 1928, B. 41, p. 827; R e i h 1 e n u. a. «Liebigs Annalen d. Chemie», Lpz., 1928, B. 465, p. 72, 1929, В. 472, p. 268; H ieber W. und a n-dere, «В», 1928, B. 61, p. 558, 1717, 2426, 1929, B. 62, p. 422, 1930, B. 63, p. 973; P i n c a s s N. «Ch.-Ztg», 1929, В. 53, p. 525; Φ. Π. 592438/25, 597517/25, 598751/25, 605669/25; Г. Π. 441 179/25; Ан.П. 269625/25, 301778/27, 319356/28,323021/28, 323332/28, 324382/28; Ам. Π. 1725619/29. В. Янкойский.