 > Техника, страница 68 > Осмотическое давление
> Техника, страница 68 > Осмотическое давление
Осмотическое давление
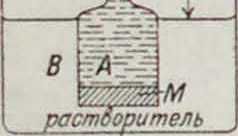
Осмотическое давление. Если раствор концентрации с наполняющий сосуд А (смотрите фигура), отделен от растворителя, налитого снаружи (в сосуд В), полупроницаемой перегородкой М, которая пропускает только растворитель и не-g проницаема для молекул и ионов растворенного вещества (смотрите Осмос), то чистый § н растворитель из В будет диффундировать в А сквозь перегородку до тех пор, пока возникающий при этом избыток J гидростатического давления
Р с внутренней стороны перегородки Μ (Р определяется высотой столба Я) не воспрепятствует диффузии. При установлении равновесия (когда Я достигло постоянного значения) величину Р определяют как осмотическое давление данного раствора конечной концентрации с.
Система из раствора и чистого растворителя, разделенных полупроницаемой перегородкой, м. б. в равновесии только при условии, что гидростатич. давление на перегородку М со стороны раствора (р) больше, чем со стороны растворителя (р")· В состоянии равновесия эта разность
Р-р-р" (1)
и определяет О. (д. Наличие этой разности давлений характерно для термодинамики таких систем, разделенных полупроницаемыми перегородками (смотрите Термодинамика, Растворы). Если р>р"+Р, растворитель выжимается через перегородку из раствора; при p<р"+Р происходит обратное.
По Вант Гоффу, растворенные частицы вполне аналогичны газовым молекулам и стремятся равномерно распределиться по всему объёму V растворителя. Причиной такой диффузии является неравенство О. д. в разных местах раствора. О. д. при этом вполне аналогично газовому (парциальному) давлению. Прямые измерения О. д. воз можны только при наличии полупроницаемой перегородки, отделяющей раствор от чистого растворителя и позволяющей уравновесить О. д. измеряемым избытком гидростатич. давления. Строго полупроницаемые перегородки железистоцианнстой меди были изготовлены Морсе электролитич. методом (смотрите Осмос). О. д. зависит от с раствора и от абсолютной темп-ры (Т), и ур-ие
P = f (.СуТ) (°=у)
называется уравнением состояния раствора (п—число г-мол. растворенного вещества в V л раствора). Аналогия между растворами и газами заставляет принять, что слабые растворы подчиняются тому же уравнению состояния, что и идеальные газы:
P=RTc (2>
(Вант Гофф, 1885 г.). При этом R имеет то же значение (Д=1,987), что у идеального газа, т. e. 1 г-мол. любого вещества, содержащаяся в 22,41 л раствора (в любом растворителе), вызывает при Т =273,2 (ί°= 0°) О. д. Р= 1 atm.(закон Авогадро для слабых растворов) и Р определяется только числом частиц растворенного вещества в 1 л раствора независимо от их природы. Т. обр. изотермы О. д. для слабых растворов являются прямыми линиями, т. e. Р линейно зависит от с. При дальнейшем же увеличении с (при с >0,2 г-мол /л, что отвечает О. д. в 4,5 atm при 0°) изотермы искривляются, причем отклонения от закона Вант Гоффа обусловлены молекулярными и ионными взаимодействиями растворенного вещества и растворителя. Линейность изотермы однако сохраняется, если вместо с ввести термодинамич. активность Лыоиса-Бренштедта: a=fc; тогда
P - RTa - RTfc, (3)
где /—коэф. активности, являющийся ф-ией от с (смотрите Криоскопия).
В случае растворов электролитов, при. вычислении О. д. надо учитывать как молекулы, так и свободные ионы, т. к. все растворенные частицы принимают одинаковое участие в создании О. д. В разведенных растворах слабых электролитов диссоциация на ионы, то есть увеличение числа частиц, учитывается, как и при диссоциирующем идеальном газе (смотрите Диссоциация) введением коэф-та Вант Гоффа г=тга + (1 — а) в ур-ие (2). Тогда будем иметь:
Р=г RTc (4)
г показывает, сколько частиц получается из 1 молекулы, если она диссоциирует на п ионов при степени диссоциации а. Прямые измерения О. д. весьма затруднительны гл. обр. в виду медленности установления равновесия и трудности получения действительна полупроницаемой мембраны. По этой же причине не имеют практич. значения предлагавшиеся многими двигатели, основанные на явлениях О. д. Обычно для количественного суждения об О. д. определяют экспериментально одну из величин (осмотич. свойств), тесно связанных с О. д. раствора и легко измеримых (понижение t° замерзания или повышение t°Kun. или понижение упругости пара раствора). Производя эти
измерения при разных с можно определить вид изотермы P=F(c), а следовательно и зависимость активности а или коэф-та растворителя от концентрации с раствора.
Термодинамически легко вывести ур-ие, связывающее О. д. с понижением давления насыщенного пара растворителя вызванным растворенным веществом:
(5)
Экспериментальные данные для О. д. концентрированных растворов хорошо согласуются с этой формулой, как показывают следующие данные О. д. концентрированных растворов Ca2Fe(CN)e, вычисленного (Рь) и измеренного "(Ре) по давлению насыщенного пара:
| Конц. г Ca2Fe(CN)« в l 000 a H20 | Плотность раствора, D | Конц. В г-мол/л | (Wr | Οι
О И о к со О *4 О. А |
Рь в
aim |
Ре В atm |
| 313,9 | 1,224 | 1,00 | 0,195 | 1,033 | 40,7 | 41,22 |
| 395,0 | 1,270 | 1,23 | 0,190 | 1,057 | 70,8 | 70,84 |
| 428,9 | 1,287 | 1,32 | 0,183 | 1,070 | 86.2 | 87,09 |
| 472,2 | 1,309 | 1,41 | 0,181 | 1,092 | 114 | 112,84 |
| 499,7 | 1,322 | 1,51 | — | 1,107 | 131 | 130,66 |
В достаточно разбавленных растворах можно принимать, что плотность раствора D—линейная ф-ия от с : D=D0 + кс; тогда
D-c=D0 и вместо (5) имеем:
Р=1 .°.00 D0RT In,. (6)
где М0— молекулярный вес растворителя. Подставляя Р= НТс,приходим к ур-ию £ау-ля (когда р0 — рс—понижение давления пара мало, можно положить: In Рп —
Рс Ро )
Ро-Ре е Ро «о
Ур-ие (5) или для слабых растворов ур-ие DBRT (7)
р_ С000
1 М О
Ро дают возможность определить О. д. раствора по измерениям р„ и рс—тонометрия, методом (смотрите Тонометрия).
Ур-ие (7) позволяет вычислять О. д. слабого раствора или по понижению его точки замерзания (смотрите Криоскопия) ΔΤ0 или по повышению t°K„n. (смотрите Эбуллиоскопия) ΔΤ,; обе эти величины тесно связаны с понижением давления пара :
Ро рТ -Qo^; PrrQsTf ·, здесь Qo, Qa—теплота плавления и теплота испарения 1 л растворителя. В случае более концентрированных растворов приходится вводить слагаемыми при Q„, Q, тепло разбавления раствора Qv. О. д. концентрированных растворов сахара было с большой точностью измерено Морсе, Фрезером и Беркли и Гар-тлеем. Оказалось, что изотерма Вапт Гоффа р
- Const справедлива до значительно больших с если с измерять не в а-мол. на 1 л раствора, а в а-мол. на 1 килограмм чистого раство рителя. Кроме обычного метода измерения О.д., принцип которого уже описан, применяют измерения избыточного гидростатич. давления р—р", как раз необходимого, чтобы препятствовать проникновению растворителя в раствор. Динамически О. д. измеряется по скорости проникания растворителя в раствор измеряемой по перемещению жидкости в капилляре, замыкающем сосуд с раствором. Для калибрирования прибора применяют повышение гидростатич. давления, вызывающее такую же скорость проникания жидкости (Беркли и Гартлей). Такими же методами были измерены весьма высокие О. д., до 28 atm и даже до 269 atm (в пересыщенных сахарных растворах) при разных температурах.
Растворы, обладающие одинаковыми О. д., называются изотоническими, или же и з о о с м о т и ч е с к и м и. Изотонию растворов можно определять нулевым методом де-Фриса-Гамбургера—микроскопически: в исследуемый раствор помещают например клетки водоросли Tradescantia discolor. Если О. д. раствора больше, чем внутриклеточное О. д., то клетка будет увеличиваться в объёме, в обратном же случае—сжиматься. Т. о. можно подобрать так с раствора, что он будет изотоничен с клеткой; делая эти опыты с разными растворами, можно определить их изотонич. концентрации. Подобными же индикаторами одинаковости О. д. могут служить кровяные шарики. В растворах, содержащих большое число растворенных веществ(какнапримерв минеральных водах), О. д. обусловлено всеми ими, и, исходя из величины любого осмотич. свойства такого сложного раствора, можно вычислить суммарную, или «осмотическую» концентрацию раствора, то есть ту с какую должен иметь однокомпонентный раствор с тем же О. д.
Непроницаемые для коллоидов коллодийные и другие мембраны применяются для измерения О. д. водных растворов коллоидов—гидрозолей (Бильц, Дюкло). Эти О. д., как и соответствующие понижения точки замерзания и повышения точки кипения, весьма малы, т. к. частичный вес—мол. в коллоидных частиц—очень велик, а следовательно малы молярные концентрации (даже при большом %-ном содержании растворенного вещества). См. Коллоиды.
‘ Лит.: ВальдевП. И., Теории растворов в их история, последовательности, пер. с пем., II., 1921; Вознесенский С. А. и Р е б и н д e р П. А., Руководство к Лабораторпым работам по фпэпч. химии, гл. 4, Осмотические свойства растворов, М.—Л., 1928; F i n d I а у A., Der osmotlsche Druck, Dresden—Lpz., 1914; J el 11 nek K., Lehrbuch d. phys. Chemte, 2 Aufl., B. 2, p. 647, Stg., 1928; Sackur O., Thermo-cliemle und Thermodynamlk, 2 Aufl., Berlin, 1928; N e r n s t W., Theoret. Chemie, 15 Aufl., Stg., 1926; О s t w a I d W. u. Luther R., Hand- und IHlfs-buch zur Ausfilhrung physikochemischer Messungen, 4 Aufl., p. 90, Leipzig, 1925; LewisO.und Randall M., Thermodynamlk, W., 1927; V a n’t Hoff J. H., «Archives Nierlandaises», La Haye, 1886, v. 20 (1885), p. 239; Ostwalds Klassiker d.exaklen Wlssen-schaft, Leipzig, 1900, U0 «Ztschr. f. phys. Chem.», Lpz., 1887, B. 1, p. 481; Pfeffer W., Osmotlsche Untersuchungen, Leipzig, 1877; Ramsay W., «The Philosophical Magazine a. Journal of Science», London, 1894, series 5, v. 36, p. 206; M О г s e Η. N. a. others, «American Chemical Journal», Baltimore, 1901—(например 1911, v. 45, p. 91, 554, 1912, v. 48, p. 29); F r a s e r J. G. W. and others, «Journal of the American Chemical Society», Easton, Pa, 1916, v. 38. p. 1912, 1921, V. 43, p. 102, 2497, 1923, V. 45, p. 1710,
*9
2930; Earl of Berkeley a. Hartley, «Philosophical Trans, of the Roy. Soc. of London», L., 1906, V. 206 A, p. 481, 1909, v. 209 A. p. 177, 319, 1919, v. 218, p. 295; «Proc. of the Roy. Soc. of London», L., 1909, v. 82, p. 271; Vegard L., «The Philosophical Magazine a. Journal of Sciences», L., 1908, series 6, v. 16, p. 247, 396; Vries IL, «Ztschr. f. phys. Chemie», Leipzig, 1888, B. 2, p. 415, 1889, B. 3, p. 103; T a m-m a η n G., «Ann. d. Physik», Lpz., 1888, B. 34, p. 299; «Ztschr. f. phys. Chemie», Leipzig, 1892, B. 9, p.97; R а о u 1 t F. M., Tonomitrie, «Scientia», Sirie phys.-math., P., 1900, 8; Cryoscopie, ibid., 1901, 13; В e ck-m an n E., «Ztschr. f. phys. Chem.»,Lpz., 1889—1914 (напрпмер 1914, В. 88, p. 13, 23); SI everts A., Handbuch d. Arbeitmethoden in d. anorganischen Chemie, hrsg. v. A. Stabler, B. 3, Hilfte 1, p. 100—131, Berlin, 1913. П. Ребиндер.