 > Техника, страница 2 > Основные продукты химической технологии
> Техника, страница 2 > Основные продукты химической технологии
Основные продукты химической технологии
Особая группа разнообразных химических веществ, вырабатываемых на химических заводах подчас в колоссальных количествах и потребляемых во многих отраслях промышленности вообще, носит название основных химических продуктов, и вырабатывается на заводах основной химической промышленности. Выработка этой группы веществ, изготовляемых из разнообразных минералов, добываемых из недр земли, носит массовый характер. Какие же вещества относятся к этой важной в человеческой жизни группе химических веществ?
Прежде всего к ним относятся серная кислота и известная всем „сода“, в обыденной жизни называемая бельевой содой. Затем азотная и соляная кислоты, каустик, который иногда применяется и в домашнем хозяйстве (для варки мыла), поташ, хлорная известь, железный и медный купорос, хлористый цинк, хромпики и прочие.
Если мы возьмем какую-либо отрасль промышленности, например красочную или текстильную, и проследим, какие вещества она употребляет, то увидим, что текстильная промышленность, с целью получения из хлопка, льна, шелка-сырца, шерсти и так далее, готовых для употребления, отбеленных или окрашенных тканей, применяет в громадных количествах и серную кислоту, и соду, и другие вещества, которые принадлежат к этой группе. Точно также и красочная промышленность, занятая изготовлением красок для крашения пряжи и тканей, в громадных количествах применяет вещества этой группы. Очистка керосина, приготовление смазочных масел из нефти, приготовление искусственных удобрений, взрывчатых веществ и многие другие производства немыслимо осуществить без продуктов, изготовляемых на заводах основной химической промышленности.
По масштабу производства основная химическая промышленность занимает одно из первых мест: потребление этой группы веществ выражается числами в несколько миллионов тонн в год. Так, например, размер производства одной толькой серной кислоты в мирное время в нашей стране, где основная химическая промышленность развита слабее, чем в других странах, достигал 300 000 тонн в год.
В Соединенных Штатах, в Англии, Франции, Германии, Японии и даже в маленькой Бельгии на заводах основной химической промышленности ежегодно вырабатываются в колоссальных количествах химические вещества этой группы, которые почти целиком расходуются внутри страны для собственных нужд и лишь в незначительной части экспортируются за границу.
Для изготовления химических веществ этой группы, как мы указывали выше, применяется разнообразное сырье, извлекаемое из недр земли. Это так называемое минеральное сырье применяется или в том виде, в каком оно добывается из земли, или после соответствующей его переработки на металлургических заводах — в виде металлов: железа, меди, свинца и прочие. Иногда полезные ископаемые, прежде чем отправить их на заводы основной химической промышленности, обогащают, то есть отделяют от них посторонние загрязняющие примеси. Из руд и полезных ископаемых в громадных количествах применяется серный (или железный) колчедан, необходимый для фабрикации серной кислоты, поваренная соль—для изготовления соды, каустика, хлорной извести, соляной кислоты и прочие, всем известный камень известняк, глина, селитра, сера и прочие. Добыча всего этого минерального сырья составляет задачу так называемой добывающей промышленности, а свойства этих ископаемых, их месторождения и прочие изучаются наукой, называемой минералогией. Все же в этой главе мы познакомимся с этим минеральным сырьем и будем рассматривать его с точки зрения его применения для нужд основной химической промышленности; мы познакомимся с составом этого сырья, с его месторождениями, представляющими практический интерес, и с общими методами его добычи.
Обширность группы рассматриваемых в этой главе химических веществ не позволит нам рассмотреть их все; нам придется ограничиться лишь теми, которые представляют исключительный интерес и имеют обширное применение в технике и в жизни.
Серная кислота
Серную кислоту справедливо называют „матерью всех химических производств“, в виду разнообразнейшего применения, какое она находит во многих отраслях химической промышленности. В настоящее время серная кислота вырабатывается на многочисленных заводах в громадных количествах и находит широкое применение во многих отраслях промышленности вообще.
Серная кислота представляет собою едкую, причиняющую сильные ожоги, прозрачную, бесцветную жидкость; она состоит из серы, водорода и кислорода.
Серная кислота была известна еще в X веке. Еще в первой половине прошлого столетия она изготовлялась почти исключительно из серы, а в настоящее время она готовится, по преимуществу, из минерала — серного колчедана. Сера как сырье для фабрикации серной кислоты сохранила свое значение лишь в тех странах, которые располагают ее богатыми месторождениями (Соединенные Штаты, Италия и отчасти Япония). В последние 10—15 лет серную кислоту начали изготовлять из газов, выделяющихся из металлургических печей, а в Германии, во время последней империалистической войны, ее готовили из минерала гипса (смотрите ниже).
Сера
Сера встречается в природе как в виде химических соединений, (например серного колчедана, гипса и прочие), так и в виде самородной серы. Последнюю всегда сопровождают землистые примеси, гипс, поваренная соль и прочие, содержание которых достигает 50—60%. От этих примесей серу очищают, пользуясь ее способностью легко плавиться. С этой целью серу нагревают, для чего либо пользуются паром, либо, чаще всего, нагревание производится в особых печах, в которых в качестве горючего материала применяется сама сера. Такой метод очистки серы применяется в Сицилии (Италия), где ежегодно добываются колоссальные количества ее.
В Соединенных Штатах (Луизиана) серу добывают непосредственно из недр земли в расплавленном виде, для чего применяют следующий оригинальный метод, предложенный американцем Фришем. Прокладывают в земле буровую скважину до пластов серы (рисунок 113), которые в Луизиане расположены на глубине в 150—240 метров. В трубу буровой скважины вставляют трубу меньшего диаметра, а в эту последнюю — еще трубу. В трубу самого большого диаметра (вернее—в пространство, образованное внутренней поверхностью большой трубы и внешней поверхностью меньшей трубы) впускают сильно нагретую воду. Эту воду нагревают в паровых котлах под давлением и впускают
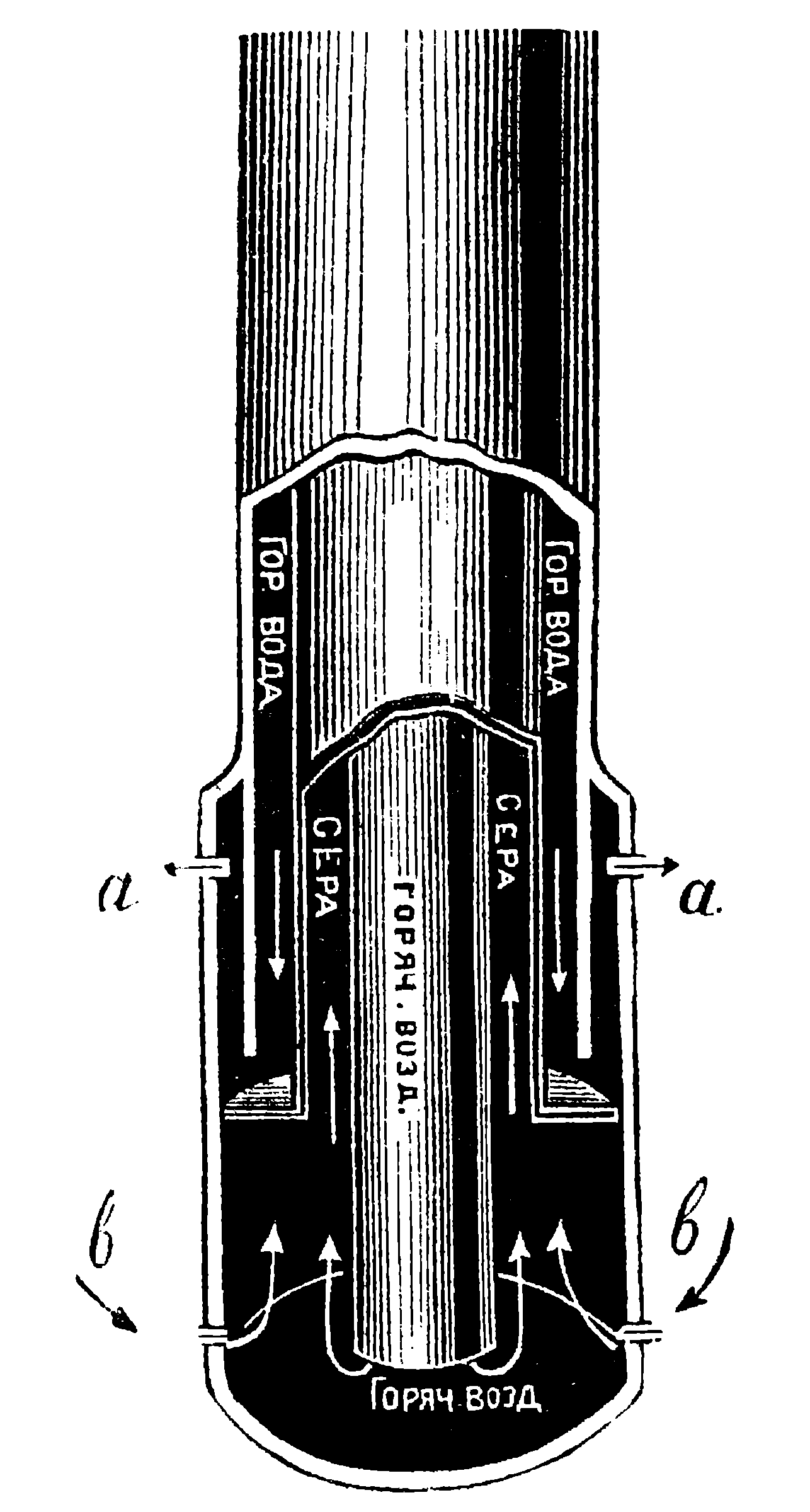
Рисунок 113. Приспособление для добывания серы из буровых скважин.
ее в трубу с температурой в 170° Ц, которая необходима для расплавления серы. Вода, достигнув слоев серы, выходит через отверстия а и под землей расплавляет серу. В среднюю трубу под сильным давлением впускают воздух, который выдавливает поступившую через отверстия b расплавленную серу на поверхность земли по направлению, указанному стрелками. Этот гениальный по своему замыслу способ дает возможность дешево добывать серу высокой чистоты, не затрачивая громадных средств на сооружение шахт, как это обычно делается при добыче каменного угля и руд.
Громадные залежи серы в Луизиане и простота ее добычи были причиной сильной конкуренции между сицилийской и луизианской серой. Добыча луизианской серы повышается с каждым годом, в то время как добыча серы сицилийской с каждым годом уменьшается, что видно из следующей таблицы, содержащей данные о добыче серы в двух указанных месторождениях, в процентах от всей добычи серы на земном шаре:
| Страны | 1900 год | 1905 год | 1909 год | 1917 год |
| Америка | 1% | 26% | 37% | 77% |
| Италия | 92,5% | 68,5% | 53% | 14% |
| Прочие страны | 6,5% | 5,5% | 10% | 9% |
Мировая добыча серы за ряд лет составляла:
| в 1900 г | 582 870 тонн |
| „ 1910 „ | 785 000 „ |
| „ 1913 „ | 825 000 „ |
| „ 1920 „ | 1 600 000 „ |
| „ 1923 „ | 2 300 000 „ |
В СССР хотя и имеются мощные месторождения серы (в Закаспийском крае — в Каракумской степи), но они не разрабатываются ввиду отдаленности их от путей сообщения и отсутствия на месте топлива, необходимого для отделения серы от примесей. Сера как сырье для фабрикации серной кислоты у нас, в СССР, не применяется. Она идет у нас для фабрикации сероуглерода, в резиновой промышленности (для вулканизации каучука — смотрите ниже), для осыпки виноградных лоз с целью предохранения их от вредителей и прочие. У нас потребление серы до войны в среднем составляло 20 000 тонн в год.
Серный колчедан
Основным сырьем для получения серной кислоты почти во всех странах служит минерал серный или железный колчедан, который представляет собою химическое соединение железа с серой, содержащее последнюю в количестве 45—50%. Месторождения серного колчедана встречаются во многих странах, но особенно мощные имеются в Соединенных Штатах, Норвегии, Испании, Португалии, Франции и у нас в СССР — на Урале.
Серный колчедан добывается из недр земли с помощью горных работ в шахтах и штольнях, и лишь как исключение встречаются открытые (поверхностные) разработки.
В мирное время потребление серного колчедана у нас в два раза превышало его добычу, хотя наши уральские месторождения, доставляющие 90% всей добычи серного колчедана в стране, с успехом могли бы удовлетворить всю нашу потребность. Недостающее количество серного колчедана ввозилось из-за границы (по преимуществу из Испании и Норвегии) на заводы, расположенные вблизи портов (Южный район и Ленинград). Колчедан, доставляемый на эти заводы морем, обходился дешевле уральского, который приходилось транспортировать по железной дороге за несколько тысяч километров.
Размер добычи серного колчедана в различных странах за ряд лет дан в следующей таблице (в тоннах):
| Страны | 1913 год | 1914 год | 1915 год |
| Испания | 2 903 500 | 2 171 000 | 2 325 000 |
| Португалия | 377 500 | 113 500 | 172 000 |
| Соединенные Штаты | 336 000 | 337 000 | 394 000 |
| Россия | 66 300 | 146 000 | 260 000 |
| Прочие страны | 1 756 000 | 1 693 000 | 2 002 000 |
Получение серной кислоты
Серная кислота в промышленности готовится двумя способами: камерным и контактным. Для осуществления этих двух способов прежде всего необходимо получить так называемый сернистый газ, который получается в особых печах сжиганием серы или серного колчедана. Полученный сернистый газ очищается в особых пыльных камерах, а при контактном способе (смотрите ниже) еще и в особых аппаратах, и затем перерабатывается в серную кислоту методами, изложенными ниже. Прежде всего мы познакомимся с методами получения сернистого газа, а затем перейдем к описанию производства из него серной кислоты.
Сернистый газ представляет собою химическое соединение серы с кислородом; при обыкновенной температуре это — бесцветный газ с неприятным, удушливым запахом. Этот газ получается при сжигании серы или серного колчедана в присутствии воздуха. У нас, в СССР, серную кислоту изготовляют из серного колчедана, который сжигают в особых, так называемых колчеданных, печах — ручных или механических. Ручные печи требуют применения тяжелого ручного труда, почему постепенно вытесняются механическими. За границей применяются, по преимуществу, механические печи.
Механическая печь для сжигания серного колчедана, часто встречающаяся на русских и заграничных заводах, изображена на рисунке 114;
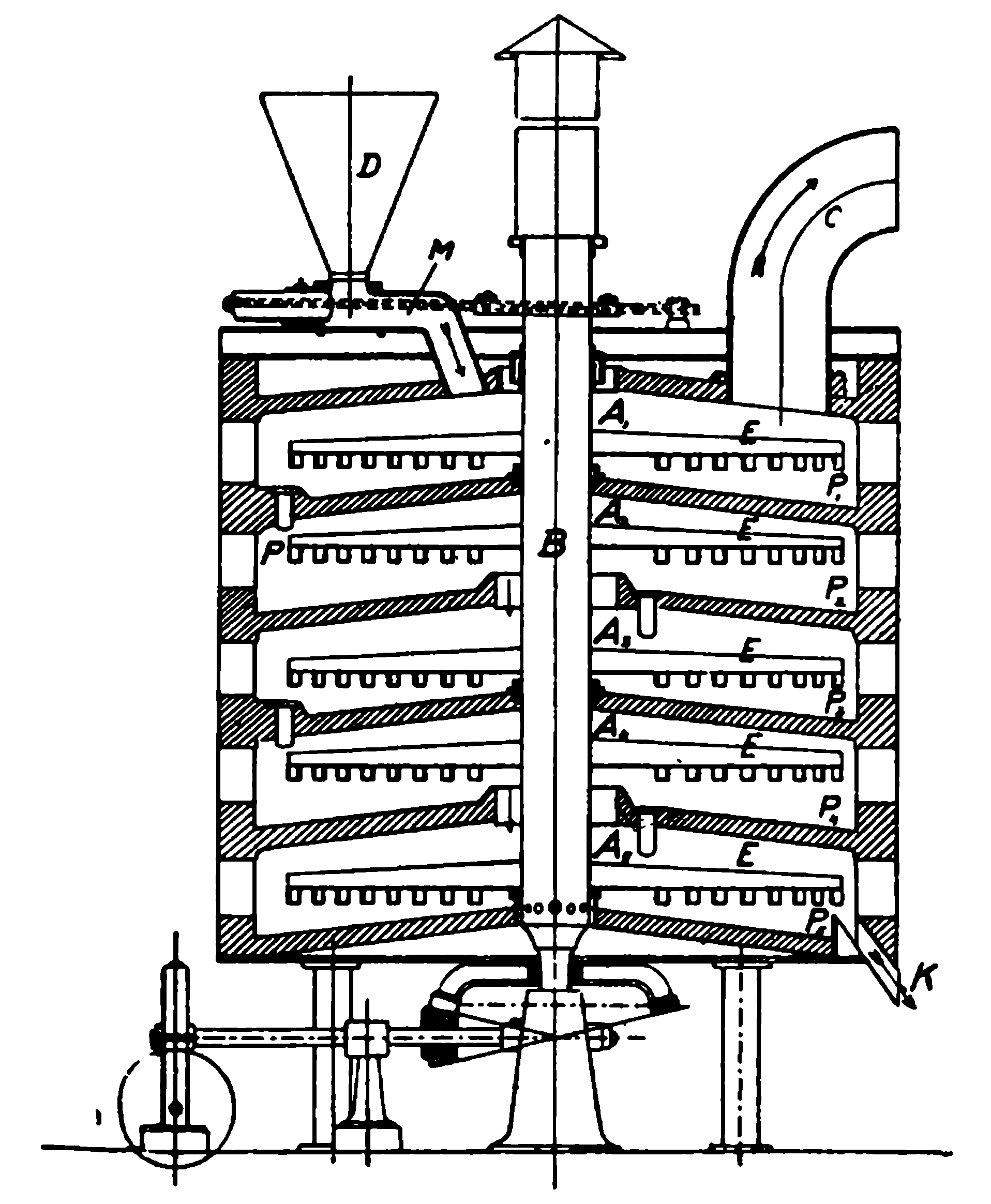
Рисунок 114. Механическая печь для сжигания колчедана.
Она представляет собою вертикальную цилиндрическую печь, разделенную сводами на несколько этажей (на чертеже их 5, помеченных буквами А1—А5). Внутри печи помещается вращающийся вал В, на который насажены гребки Е—Е с зубьями, передвигающими колчедан по сводам. Колчедан загружается в воронку D и через канал M поступает в верхний этаж в котором гребками Е—Е он передвигается от вала печи к ее внутренней поверхности.
Для осуществления такого передвижения насаженные на гребки Е зубья имеют определенный уклон и направление. Дойдя до внутренней стенки печи, колчедан через отверстие Р проваливается в нижележащий этаж А2, где передвигается по направлению к валу и сваливается через кольцевое отверстие в третью камеру А3. Перемещаясь таким образом, колчедан в конце концов достигает нижнего этажа А5и ссыпается из печи через канал К в виде обожженного колчедана, уже почти не содержащего серы и называемого на сернокислотных заводах огарком. Этот огарок представляет собою соединение железа с кислородом; у нас, в СССР, он является отбросом производства, хотя на заграничных заводах из него получают в доменных печах чугун.
В такую механическую печь, нагретую однажды, колчедан через воронку D поступает непрерывно и сгорает, не требуя топлива; колчедан сгорает, как каменный уголь. При его сгорании получается сернистый газ, который смешивается с избытком впущенного в печь воздуха и выходит из печи по трубе С. Колчедан в описанной печи сжигается в измельченном виде, поэтому до загрузки в печь его размалывают в особых мельницах на кусочки величиною с крупинки пшена и несколько более. В одной печи в сутки можно сжечь от 3 до 20 тонн серного колчедана.
Во время процесса обжига колчедана образуется пыль, которая летит вместе с газами, выходящими из печи. Большую часть этой пыли, состоящей из колчедана, частью сгоревшего, выделяют в особых пыльных камерах, и лишь после такой очистки газы применяют для фабрикации серной кислоты.
Кроме серного колчедана и серы, для фабрикации серной кислоты применяют газы, выделяющиеся из металлургических печей, например из печей для получения меди (ватер-жакетные печи—смотрите выше), цинка и прочие. Эти газы содержат достаточный для осуществления процесса получения серной кислоты процент сернистого газа в сантиметрахеси с другими газами. В прежнее время эти газы не утилизировались, выпускались в атмосферу и крайне пагубно действовали на людей и растительность в окрестностях завода.
Использование газов металлургических печей с целью получения из них серной кислоты в некоторых странах применяется в широком размере. В Америке, например, 25% всей серной кислоты добывается из этих газов. В Бельгии добыча кислоты из этих газов достигает 65% всей выработки ее в стране, в Германии — около 25% и так далее. В СССР, несмотря на развитую металлургическую промышленность и, следовательно, возможность получения колоссальных количеств серной кислоты из газов металлургических печей, последние для производства серной кислоты пока не применяются.
В Германии во время войны, вследствие острого недостатка там серы и колчедана, серную кислоту стали изготовлять из гипса, накаливая его в сантиметрахеси с песком, глиной и углем во вращающихся печах, похожих на цементные печи (смотрите ниже). При таком нагревании выделяется сернистый газ, а в остатке получается прекрасного качества строительный цемент. Способ этот в Германии сохранил свое значение и после войны.
Камерный способ
Способ, в котором для получения серной кислоты применяются большой емкости камеры (комнаты), сделанные из спаянных между собою свинцовых листов (толщиною около 2—3 миллиметров), носит название „камерного способа“. Образование серной кислоты совершается в свинцовых камерах, куда впускается по трубам сернистый газ, содержащий по выходе из колчеданных печей большой %воздуха и всего лишь около 7 % (по объёму) чистого сернистого газа. Кроме сернистого газа в камеры впускается водяной пар и окислы азота1).
1) Окислы азота представляют собою химическое соединение газов кислорода и азота, то есть газов, из которых состоит воздух. Последний же представляет собою „смесь“ кислорода и азота.
Последние представляют собою газ и в процессе образования серной кислоты являются „катализаторами„ , то есть веществами, которые способствуют образованию серной кислоты, а сами в конечном итоге не изменяются. „Катализаторы„ очень часто применяются в химической промышленности, и те процессы, в которых они применяются, носят название „контактных„ процессов.
Теоретически катализатор не расходуется; практически же во время процесса происходят некоторые небольшие потери катализатора (в нашем случае окислов азота), которые нужно постоянно и в небольшом количестве пополнять.
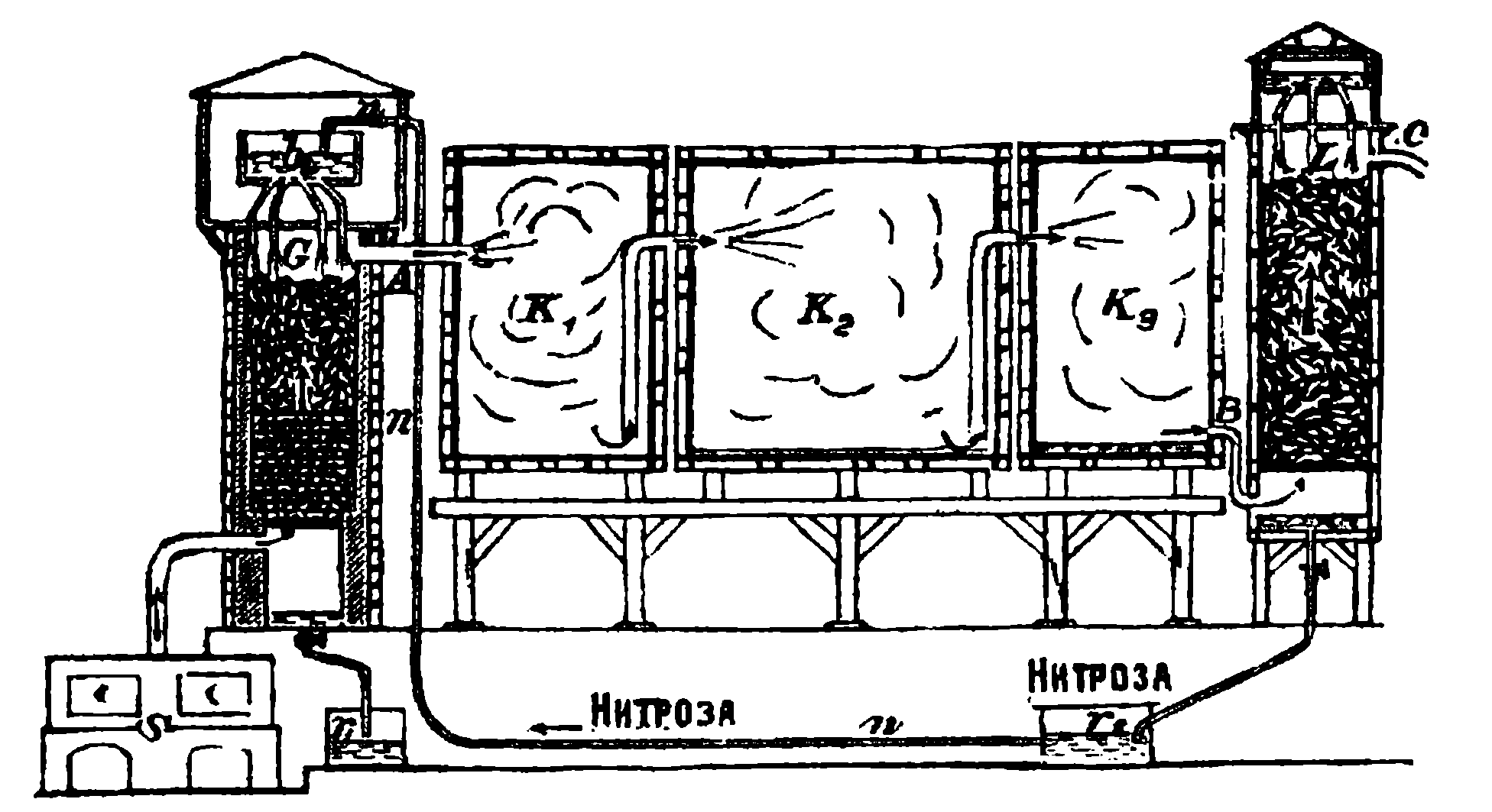
Рисунок 115. Схема завода серной кислоты.
Процесс образования серной кислоты в камерах протекает в следующей последовательности. Газы из печей S, в которых сжигается серный колчедан (рисунок 115), очищаются в пыльной камере и, имея температуру около 450—550° Цельсия, поступают в башню Гловера 1) G, которая снабжает газы необходимыми для течения процесса окислами азота. Как это происходит и как устроена башня, — мы объясним ниже.
Из башни Гловера газы, содержащие сернистый газ в сантиметрахеси с воздухом и окислами азота, по трубе А поступают последовательно в ряд свинцовых прямоугольных камер К1, К2, К3. Через потолок этих камер в них впускается водяной пар, и внутри камер образуется серная кислота, которая собирается на дне камер.
1) Башня эта носит имя изобретателя.
Из последней камеры К3 газы, не содержащие уже сернистого газа, но содержащие окисли азота и воздух, по трубе В поступают в свинцовую башню Гей-Люссака L. Башня эта так же, как и камеры, сделана из листового свинца и наполнена коксом, которой сверху орошается серной кислотой. Эта кислота, орошая кокс и двигаясь навстречу газу, содержащему окислы азота, поглощает их, образуя так называемую „нитрозу„.
Отработанные газы из башни L, содержащие главным образом воздух в сантиметрахеси с азотом, поступают через трубу С в атмосферу, а нитроза стекает в ящик r2, откуда она по трубе n с помощью особых кислотоподъемников поднимается на верх башни Гловера G в ящик b1, из которого поступает в башню. Башня Гловера также сделана из свинца и заполнена цилиндриками, сделанными из кислотоупорной глины. По этим цилиндрикам стекает нитроза, а снизу, навстречу ей, движется из колчеданных печей горячий газ. Под влиянием высокой температуры газов и сернистого газа из нитрозы обратно выделяются окислы азота, которые смешиваются с газами из колчеданных печей и по трубе А поступают в камеры. Вытекающая из башни Гловера серная кислота, освобожденная теперь от окис-лов азота, поступает в ящик r1 и накачивается в ящик b2, находящийся над башней Гей-Люссака L. Из ящика b2 кислота стекает в башню Гей-Люссака для поглощения из газов окислов азота.
Камерный процесс протекает непрерывно; как поступление газов из колчеданных печей в башню Гловера, в камеры и затем в башню Гей-Люссака, так и орошение башен кислотой и нитрозой и впуск в камеры пара происходит постоянно.
Одна свинцовая камера в разрезе показана на рисунке 116. Снаружи камера заключена в деревянный (или железный) каркас, который поддерживает свинцовые стенки и потолок камер. На рисунке показаны трубы для впуска и выпуска газов и для впуска водяного пара.
Сама камера представляет собою как бы громадный колпак в виде коробки, опущенной в противень; в этом противне находится кислота, которая не позволяет газам из камеры выходить в атмосферу (то есть получается так называемым „гидравлический запор“). Постоянно образующаяся в камерах серная кислота падает в этот противень, откуда периодически извлекается, для чего служат спускные трубы, на рисунке не изображенные.
Камеры бывают различной емкости, в зависимости от производительности камерного завода.
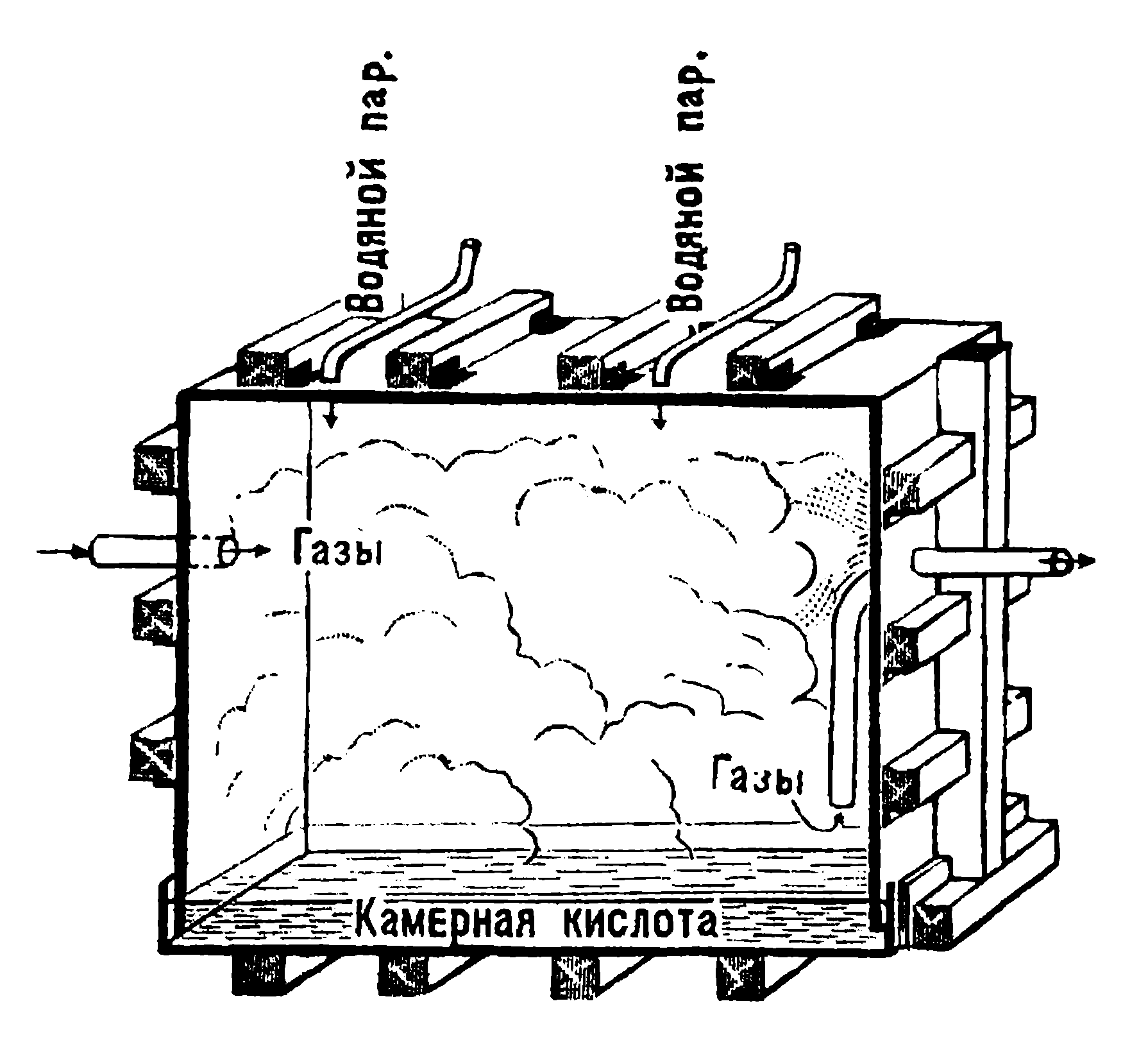
Рисунок 116. Свинцовая камера в разрезе.
Обычно сооружают заводы, состоящие из 3—4, реже 5 свинцовых камер, общей емкостью от 2 до 6 тысяч кубических метров (редко больше). Высота камер различна — от 8 до 16 метров — при ширине от 5 до 8 метров. Длина каждой отдельной камеры колеблется от 10 до 70 метров. Башни Гловера и Гей-Люссака делают высотою до 14 метров. В камерах общей емкостью в 3 000 м3 в течение суток можно получить около 27 тонн серной кислоты, содержащий около 35% воды. Кислоту крепче указанной концентрации, то есть содержащую меньше воды, непосредственно в камерах получить не удается. Крепость кислот вообще, в частности серной кислоты, измеряется с помощью ареометра (смотрите главу о питательных веществах). Камерная кислота имеет крепость 50—51° Боме.
За границей вместо камер строят особые башни или особые камеры, конической формы, в которых при одинаковом с прямоугольными камерами объёме получают в 5—10 раз больше кислоты. Из одной тонны серного колчедана обычно получают несколько более 2 тонн камерной серной кислоты.
Теряемые в процессе производства окислы азота (катализатор) пополняются в виде азотной кислоты (смотрите ниже), которая в небольших количествах постоянно вводится в верхнюю часть башни Гловера и превращается там в окислы азота.
Для сооружения камер, башен и так далее в камерном процессе применяется исключительно свинец, ибо камерная кислота на него не действует, в то время как железо, сталь, чугун и некоторые другие металлы при действии слабой серной кислоты разрушаются (то есть растворяются в ней). Крепкая серная кислота, наоборот, разрушает свинец, но не действует на железо, а поэтому с успехом может перевозиться в железных бочках и в железнодорожных цистернах. Камерная кислота транспортируется в стеклянных бутылях большой емкости, вставленных в плетеные корзины с прокладкой из соломы или древесной стружки.
Как было указано выше, в камерах получается серная кислота, содержащая около 35% воды. Остальное, если не считать незначительного количества примесей, целиком приходится собственно на серную кислоту. Камерная (слабая) серная кислота применяется лишь в некоторых областях промышленности (например, при производстве искусственных удобрений, некоторых минеральных солей и прочие), в то время как другие области промышленности требуют применения крепкой серной кислоты, содержащей лишь незначительный процент воды. Такая крепкая кислота, называемая в торговле „купоросным маслом“ изготовляется из камерной серной кислоты выпариванием из последней воды. Для этого камерную серную кислоту в прошлом столетии нагревали в стеклянных колбах или сосудах, сделанных из платины, на которую серная кислота не действует. Колбы иногда лопались, а платина хотя медленно, но изнашивалась, что создавало невыгодные условия работы на этих аппаратах вследствие весьма высокой стоимости платины. В настоящее время для упаривания серной кислоты, то есть для увеличения ее крепости, применяют сосуды из особого чугуна, фарфора или кварца, а иногда кислоту упаривают в аппаратах, сделанных из камней. В таких аппаратах, представляющих собою колонны или башни, навстречу движущейся сверху вниз камерной кислоте, проходят горячие дымовые газы, которые и выделяют из кислоты воду, образуя „купоросное масло“, содержащее от 4 до 7% воды. Купоросное масло с успехом можно перевозить в железных бочках.
Контактный способ
Проще всего крепкую серную кислоту можно получить так называемым „контактным способом“, который возник значительно позднее камерного, а именно, в 80-х годах прошлого столетия 1).
Сущность контактного способа состоит в следующем. Если тщательно очищенные газы из колчеданных печей нагреть до температуры около 450° Ц и пропустить через камеру, в которой находится „катализатор“ — платина, то сернистый газ присоединит к себе еще одну частицу кислорода (из воздуха, находящегося в газах колчеданных печей): при этом образуется другое соединение серы с кислородом, так называемый „серный ангидрид“. После охлаждения серный ангидрид поглощают водой или, лучше, купоросным маслом. При этом получается крепкая дымящая серная кислота, или так называемый „олеум“; он представляет собою серную кислоту (не содержащую воды), в которой растворен серный ангидрид.
1) Серная кислота по камерному способу стала изготовляться в заводском масштабе в середине XVIII столетия. Первый камерный завод в России был выстроен в 1 805 г.
На воздухе этот серный ангидрид выделяется из олеума в виде белого дыма, почему такая кислота и носит название „дымящей“. Прибавив к дымящей кислоте воду, мы получим сперва купоросное масло, а при дальнейшем прибавлении воды — слабую кислоту такой крепости, как камерная.
Катализатор, в качестве которого применяют платину, наносится в мелко раздробленном состоянии на какое-либо огнеупорное вещество, например на волокнистый асбест или на какую-либо минеральную соль; благодаря этому платина представляет большую поверхность, что имеет важное значение при соприкосновении ее с реагирующими газами. В этом процессе катализатор, являясь твердым веществом, не расходуется, но при плохой очистке газа от примесей, в числе которых содержится мышьяк и другие вещества, катализатор постепенно понижает производительность своей работы или, как говорят, „отравляется“ контактными „ядами“, к которым относятся мышьяк, ртуть, фосфор и некоторые другие вещества, являющиеся также ядами и для нашего организма. Отравленный катализатор „оживляют“, применяя особые методы.
Необходимое для поглощения серного ангидрида купоросное масло получают разбавлением части полученного олеума водой. При желании получить только купоросное масло весь олеум разбавляют водой до купоросного масла и часть его применяют для поглощения серного ангидрида, а оставшаяся (большая часть) является готовым продуктом.
Дымящая серная кислота (олеум) находит широкое применение в производстве разнообразных взрывчатых веществ, в производстве красок для тканей и пряжи, при обработке нефти и прочие.
Вместо платины в качестве катализатора можно применять колчеданные „огарки“, которые получаются при обжоге серного колчедана и являются отбросом производства.
Однако в этом случае не весь сернистый газ превращается в серный ангидрид. Поэтому оставшийся после поглощения серного ангидрида газ пропускают через камеру с платиновым катализатором, в которой оставшийся сернистый газ превращается в серный ангидрид.
Серная кислота вырабатывается в громадных количествах, что видно из следующих данных о мировой добыче ее за 1910 г. (в тоннах).
| Соединенные Штаты | 1 600 000 |
| Германия | 1 380 000 |
| Англия | 1 000 000 |
| Франция | 900 000 |
| Италия | 400 000 |
| Австрия | 300 000 |
| Бельгия | 250 000 |
| Россия | 150 000 |
| Япония | 80 000 |
| Швеция | 13 000 |
Из этого количества около 35% вырабатывалось контактным способом, а остальные 65%—камерным.
В России серная кислота в 1917 году вырабатывалась на 51 заводе, из которых— 33 камерных, 13—контактных и 5 заводов работали одновременно и камерным и контактным способами. Рост производства серной кислоты в России показан в следующей таблице:
| 1910 год | 175 000 тонн |
| 1912 год | 199 000 тонн |
| 1916 год | 348 000 тонн |
| 1917 год | 372 000 тонн |
В связи с послевоенной разрухой народного хозяйства выработка серной кислоты у нас сильно упала. В последние годы, однако, она снова стала земетно расти. Так в 1922—23 производственном году у нас было приготовлено 36 314 тонн, а в следующем (1923—24 г.)—уже 66 784 тонн
Азотная кислота
По степени важности для промышленности азотная кислота занимает второе место (после серной). В прошлом столетии азотная кислота изготовлялась исключительно из селитры—минерала, добываемого в Южной Америке. В настоящее время азотная кислота добывается главным образом из азота воздуха и из газа аммиака 1), который получается как побочный продукт при коксовании каменного угля.
Азотная кислота представляет собою прозрачную, бесцветную или окрашенную в желтый цвет жидкость. Азотная кислота так же, как и серная, производит сильные, трудно заживающие ожоги. Будучи вылита на солому, бумагу, стружки и подобный материал, крепкая азотная кислота воспламеняет их, будучи сама не горючей.
Соли азотной кислоты (например селитра, которая представляет собою натровую соль азотной кислоты) представляют собою прекрасные удобрительные вещества и в громадных количествах применяется для удобрения полей (смотрите ниже «Искусственные удобрения» ). Селитра применяется для получения из нее азотной кислоты лишь в небольшом количестве; значительное количество селитры расходуется как удобрительное вещество. Залежи селитры, находящиеся только в Америке, постепенно истощаются, и лет через 50 человечество останется без селитры — этого весьма ценного удобрения. Истощение залежей селитры сулило для человечества ужасные последствия, так как во многих странах повышение урожаев достигалось не только рациональной обработкой почвы, но и применением искусственных удобрений, из которых крупное значение имеет и селитра. Но человеческий гений нашел средства предупредить эту катастрофу: в начале текущего столетия были открыты новые способы получения азотной кислоты из азота воздуха. Из полученной таким способом азотной кислоты теперь получают и селитру (натровую или кальциевую; последняя носит название „норвежской“ селитры, так как она главным образом добывается в Норвегии).
1) Раствор аммиаха в воде носит название нашатырного спирта.
Как известно, воздух представляет собою смесь азота (79,2% по объёму) и кислорода (20,8 %). Азот — газ недеятельный; он вообще с громадным трудом дает химические соединения с другими веществами и в частности с кислородом. Но, если смесь азота с кислородом (то есть воздух) нагреть до температуры в 3 000°, то азот соединится с кислородом, образуя газ, так называемую „окись азота“. В дальнейшем этот газ после охлаждения при пропускании через башни окисляется, то есть присоединяет еще кислород и образует газ — двуокись азота. При прохождении этого газа через особые башни, орошаемые водой, получается азотная кислота. Эту кислоту можно превратить в искусственное удобрение —натровую или кальциевую селитру. С этой целью применяют в первом случае поваренную соль, во втором — известняк и получают искусственное удобрение в твердом виде.
Для получения упомянутой окиси азота из воздуха применяют электрические печи, которые дают необходимую для осуществления указанной реакции высокую температуру. Применяемые электрические печи имеют различную конструкцию. Электрическое пламя (вольтова дуга)1), применяемое в печах, бывает различной формы: в форме диска, длинного факела и прочие.
С целью получения электрической энергии пользуются так называемым „белым углем“ (смотрите выше, главу I), ибо применение топлива, даже малоценного, здесь невыгодно. При эксплуатации указанного способа, который носит название „дугового“ 2), утилизируется всего лишь 3% электрической энергии, а остальное количество идет на нагревание воздуха, азот и кислород которого лишь частично вступают во взаимодействие, образуя всего-на-всего лишь 3—4 объёмных процента окиси азота.
1) Смотрите главу IV. „Металлургия — получение металлов“, стр. 91.
2) От „вольтовой дуги“, которая применяется для получения высокой температуры.
Эта причина — не полное использование электрической энергии — не позволяет применять для получения электрической энергии топливо, ибо последнее дорого, и полученная с помощью топлива азотная кислота не могла бы конкурировать с кислотой, полученной из селитры.
Азотную кислоту дуговым способом получают главным образом в Норвегии и перерабатывают ее в натровую или кальциевую селитру, которой снабжают все страны для целей удобрения.
Масштаб производства веществ из азотной кислоты, полученной дуговым способом, дан в следующей таблице (в тоннах).
| 1915 год | 1916 год | 1917 год | 1918 год |
| 36 000 | 137 000 | 141 000 | 238 000 |
Мощность установок для получения электрической энергии на заводах азотной кислоты в Норвегии превышает 300 000 лошадиных сил, а в прочих странах (Германия, Франция и Австия)эта мощность составляет около 250 000 лошадиных сил.
Во время последней империалистической войны, когда для целей военной промышленности в колоссальных количествах требовалась азотная кислота, ее стали изготовлять из аммиака, который получали из его составных частей — азота (из воздуха) и водорода—или же из особого, азотсодержащего вещества—кальций-цианамида, применяемого для удобрения (смотрите ниже). Аммиак получают также в качестве побочного продукта при коксовании каменных углей, но количества аммиака, получаемые таким способом, сравнительно невелики, почему на практике применяют также и выше упомянутые способы, получая десятки тысяч тонн аммиака, необходимого не только для приготовления азотной кислоты и ее солей, но и других веществ 1).
1) Для получения удобрительного вещества— сульфата аммония и прочие.
С целью получения азотной кислоты из аммиака последний в сантиметрахеси с воздухом пропускают через камеру, в которой находится катализатор - платина, при посредстве которого аммиак превращается в окись азота. В дальнейшем окись азота перерабатывается на азотную кислоту теми же методами, которые были описаны нами выше.
Таким способом азотную кислоту изготовляют во многих странах, не исключая и СССР, где такой завод был выстроен в 1917 году Мощность этого завода, выстроенного на юге, достигает 8 000 тонн азотной кислоты в год.
Необходимый для фабрикации азотной кислоты аммиак у нас получали как побочный продукт при коксовании каменных углей, а в Германии его готовили главным образом из его составных частей — азота и водорода (по способу, разработанному Габером), или же из кальций-цианамида. В первом случае смесь азота и водорода при давлении в 200 атмосфер и при температуре в 1 000°, пропускали через камеру, в которой был помещен катализатор. Указанная смесь газов при такой температуре и давлении в присутствии некоторых веществ (катализаторов) сразу давала аммиак, который в дальнейшим расходовался для получения азотной кислоты. Во втором случае при получении аммиака из кальций-цианамида на последний действовали паром; при этом выделялся аммиак, а в остатке получалось вещество такого же состава, как и известняк. В Германии из азота и водорода было получено следующее количество аммиака: в 1915 г.— 40 000 тонн, в 1916 г.— 80 000 тонн, и в 1917 г.— 120 000 тонн
Для получения азотной кислоты из селитры последнюю в сантиметрахеси с серной кислотой нагревают в чугунных котлах и образующиеся пары азотной кислоты направляют в ряд гончарных баллонов, где они сгущаются (конденсируются) в жидкую азотную кислоту. С целью увеличения скорости реакции и получения кислоты хорошего качества, нагревание смеси селитры с серной кислотой совершают под уменьшенным давлением, для чего в конце установки помещают так называемым вакуум-насос, с помощью которого из всех баллонов и котла, в котором разлагают селитру, выкачивают воздух, получая необходимое разряжение. Баллоны, применяемые для сгущения азотной кислоты, изображены на рисунке 117.

Рисунок 117. Баллоны для сгущения азотной кислоты.
В котле после разложения селитры остается так называется „кислотный огарок“ (бисульфат), который является „побочным“ продуктом и находит ограниченное применение в технике. Этот бисульфат по окончании разложения селитры выпускается из котла в виде жидкой массы и по охлаждении застывает в твердую белую массу.
В России до империалистической войны ежегодно вырабатывалось около 9 000 тонн азотной кислоты на 34 заводах. Во время войны, в связи с колоссальной потребностью в азотной кислоте для производства взрывчатых веществ, производство азотной кислоты достигло 80 000 тонн в год. Все заводы СССР азотную кислоту вырабатывают из селитры, которую получают из Америки, и лишь один завод вырабатывает ее из аммиака.
Соляная кислота
Соляная кислота — по масштабу потребления ее в промышленности и значению—занимает третье место. В прошлом столетии соляная кислота имела крупное промышленное значение и служила главным образом для получения газа хлора, при посредстве которого изготовляли белильную (или хлорную) известь, применяемую в больших количествах для целей отбеливания тканей и бумаги и дезинфекции. В настоящее время соляная кислота утратила свое значение, ибо хлор получают непосредственно из поваренной соли, разлагая ее растворы электрическим током.
Для получения соляной кислоты применяется всем известная „поваренная солъ“, которая в колоссальных количествах применяется не только для многих целей промышленности, но и для пищевых целей 1).
В странах с сильно развитой промышленностью главное количество поваренной соли применяется для промышленных целей, и лишь небольшая часть — как вкусовое вещество. Так, например, в Соединенных Штатах для промышленных целей расходуется соли в 5 раз больше, чем для пищевых; у нас в СССР для пищевых целей расходуется соли в два раза больше, чем для целей промышленности. Потребление соли на душу населения может характеризовать развитие химической промышленности в стране. Годовое потребление поваренной соли на душу населения в различных странах дано в следующей таблице (за 1913 г. в килограммах):
| Соединенные Штаты | Англия | Франция | Германия |
| 44,6 | 37,1 | 32,0 | 23,4 |
| Италия | Австралия | Россия | Турция |
| 17,8 | 15,3 | 12,1 | 9,1 |
На пищевые цели в течение года один человек расходует в среднем около 8 килограмм. Остальное количество идет на технические цели.
1) Поваренная соль состоит из элементов натрия и хлора.
В СССР поваренная соль добывается в виде самосадочной (из соляных озер), каменной, выварочной и морской. Громадное количество поваренной соли в СССР добывается в виде „самосадочной“ из озер, которые находятся во многих местах СССР. Наиболее мощные соляные озера — Баскунчакское и Эльтонское—находятся в Астраханской губернии, вблизи Волги. В Баскунчакском озере, на дне его, находится громадный слой поваренной соли, которая в период летних месяцев, когда вода, находящаяся над поверхностью соли, испарится, выламывается кирками. Запасы соли в Баскунчакском озере исчисляются в 740 миллионов тонн, и при настоящем потреблении соли в СССР этих запасов хватит по крайней мере на 300 лет.
Добыча соли со дна Эльтонского озера более затруднительна, ибо даже в жаркое лето в озере остается вода 1), которая затрудняет выборку соли со дна озера. В Баскунчакском озере в год добывается около 23% соли от всей добычи ее в СССР. На долю самосадочной соли приходится 50 % от всей добычи ее в нашей стране.
Мощные месторождения каменной соли находятся в Екатеринославской губернии, на Урале (в Оренбургском уезде) и в некоторых других местностях СССР. В Оренбургском уезде месторождения каменной соли находятся в Илецкой защите. Разработка каменной соли ведется шахтами и штольнями на глубине, достигающей 50 метров. Илецкая каменная соль по чистоте не имеет себе равной. Однако отдаленность Илецкой защиты от потребляющих центров не позволяет илецкой соли конкурировать с баскунчакской, которая доставляется по Волге.
В Екатеринославской губернии известна брянцевская каменная соль, пласты которой достигают толщины 100 метров. Добыча ведется шахтами на глубине до 210 метров.
1) Эта вода естественно насыщена поваренной солью и носит название „рапы“.
Брянцевской соли добывается около 25% от всей добычи соли в СССР.
В недрах земли каменная соль под влиянием грунтовых вод иногда растворяется, образуя на большой глубине соляные рассолы. При прокладке на большие глубины буровых скважин эти рассолы выходят на поверхность земли, и после выпаривания из них воды получается чистая поваренная соль.

Рисунок 118. Завод соляной кислоты.
Такие рассолы находятся в Днепропетровской, Пермской и других губерниях СССР. Соль, полученная упариванием этих соляных растворов, носит название „выварочной“ соли. Для упарки рассолов применяют большие железные коробки с невысокими боковыми стенками. Дно коробки нагревают с помощью какого-либо топлива и по упарке воды соль вычерпывают лопатами и сушат.
Морская соль получается упариванием морской воды, которая содержит минеральные соли (по преимуществу поваренную соль). Содержание поваренной соли в морской воде сравнительно невелико (1 литр морской воды содержит от 15 до 35 % поваренной соли). Содержание поваренной соли в воде различных морей далеко не одинаково. Наиболее богата поваренной солью вода Средиземного моря и Атлантического океана. Наиболее бедна — вода Черного и некоторых других морей.
Добыча соли из воды морей производится испарением из последней воды с помощью естественного солнечного тепла. С этой целью морскую воду напускают в особые громадные бассейны, находящиеся на берегу моря, в которых, по мере испарения воды, соль выделяется и извлекается.
В СССР соль из морской воды добывают только в Крыму, и сравнительно в незначительном количестве.
Добыча поваренной соли в СССР достигает 1 500 000 тонн в год. Около 400 000 тонн расходовалось на цели промышленности, а остальные 1 100 000 тонн на пищевые цели.
На производство соляной кислоты расходуется около 3% всей добычи соли в СССР. Соляная кислота — жидкость и представляет собою раствор газа— хлористого водорода — в воде. Получают ее, нагревая поваренную соль с серной кислотой. При этом выделяется газ — хлористый водород, который в далынейшем пропускают через баллоны (подобные применяемым в производстве азотной кислоты из селитры), наполненные водой, в которой этот газ растворяется, образуя соляную кислоту.
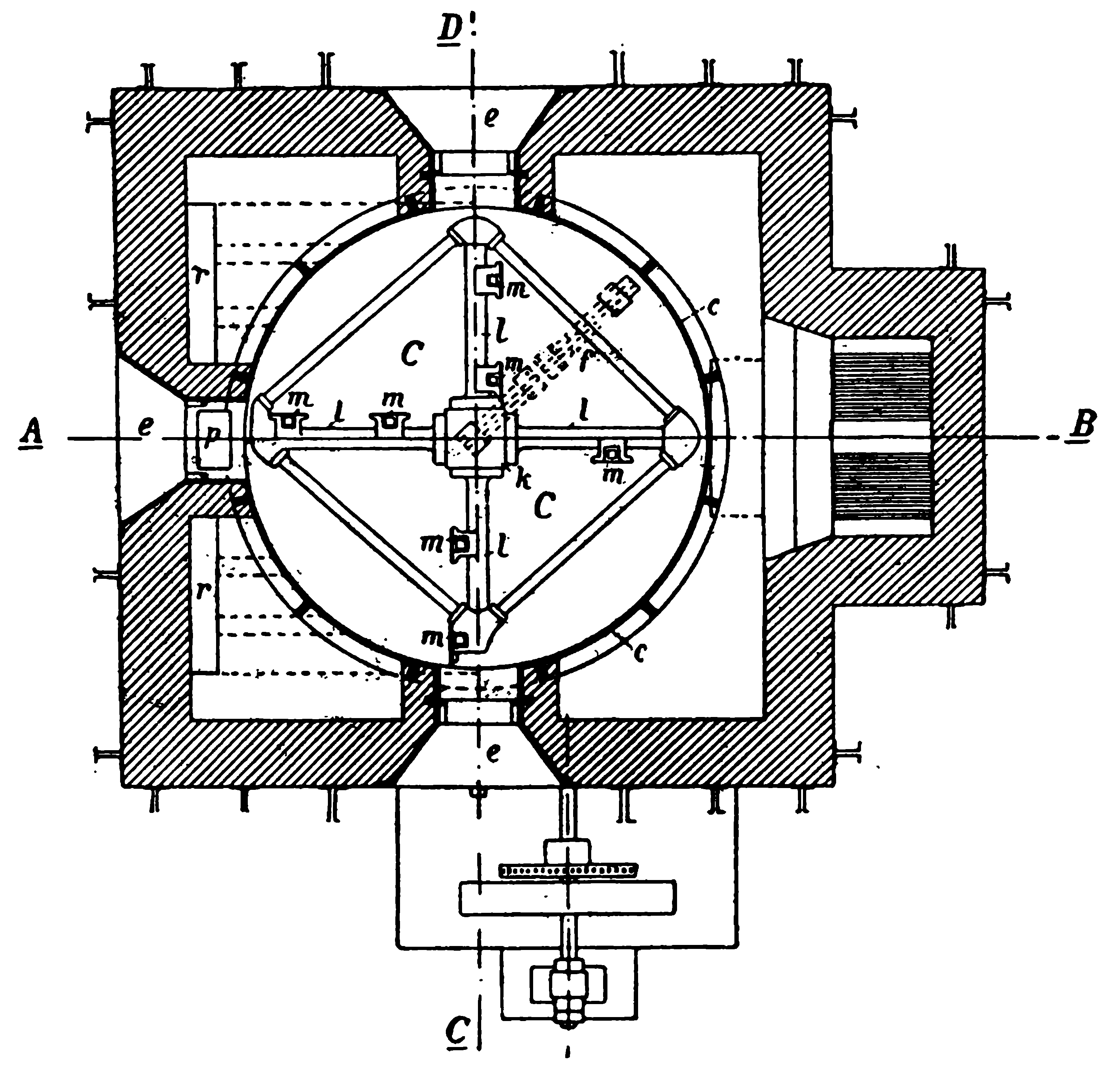
Рисунок 119. Механическая печь для получения соляной кислоты и сульфата.
Такая группа баллонов, поставленных под открытым небом (что возможно только в странах с умеренным климатом) и обслуживающая несколько печей для разложения поваренной соли, показана на рисунке 118.
После разложения поваренной соли серной кислотой в печах остается твердый остаток—сульфат (натровая соль серной кислоты), который в прошлом столетии применялся главным образом для производства из него соды (способ Леблана). В настоящее время он применяется в производстве стекла, глауберовой соли и некоторых других химических веществ.
Для разложения поваренной соли серной кислотой применяют печи особой конструкции, в которых размешивание смеси соли с кислотой и образовавшегося сульфата совершают вручную, или же этот процесс осуществляется при посредстве механических приспособлений. В первом случае применяемые ручные печи требуют затраты мускульной энергии, и работа на этих печах, в большинстве случаев, антигигиенична. Механические печи не требуют ручной работы, дают хорошего качества продукт и поэтому постепенно вытесняют ручные сульфатные печи. Механическая печь для получения соляной кислоты (вернее, хлористого водорода) и сульфата изображена на рисунке 119 и 120. Печь состоит из чугунной реторты А, внутри которой вращается вал i, снабженный гребками l—l с зубьями m—m. Реторта подогревается, для чего служит топка, изображенная с правой стороны рисунка. Поваренная соль в сантиметрахеси с серной кислотой загружается через коническую трубу g, попадает в реторту, из которой образующийся хлористый водород выходит через цилиндрическую трубу g1 и направляется в баллоны с водой — для получения соляной кислоты.
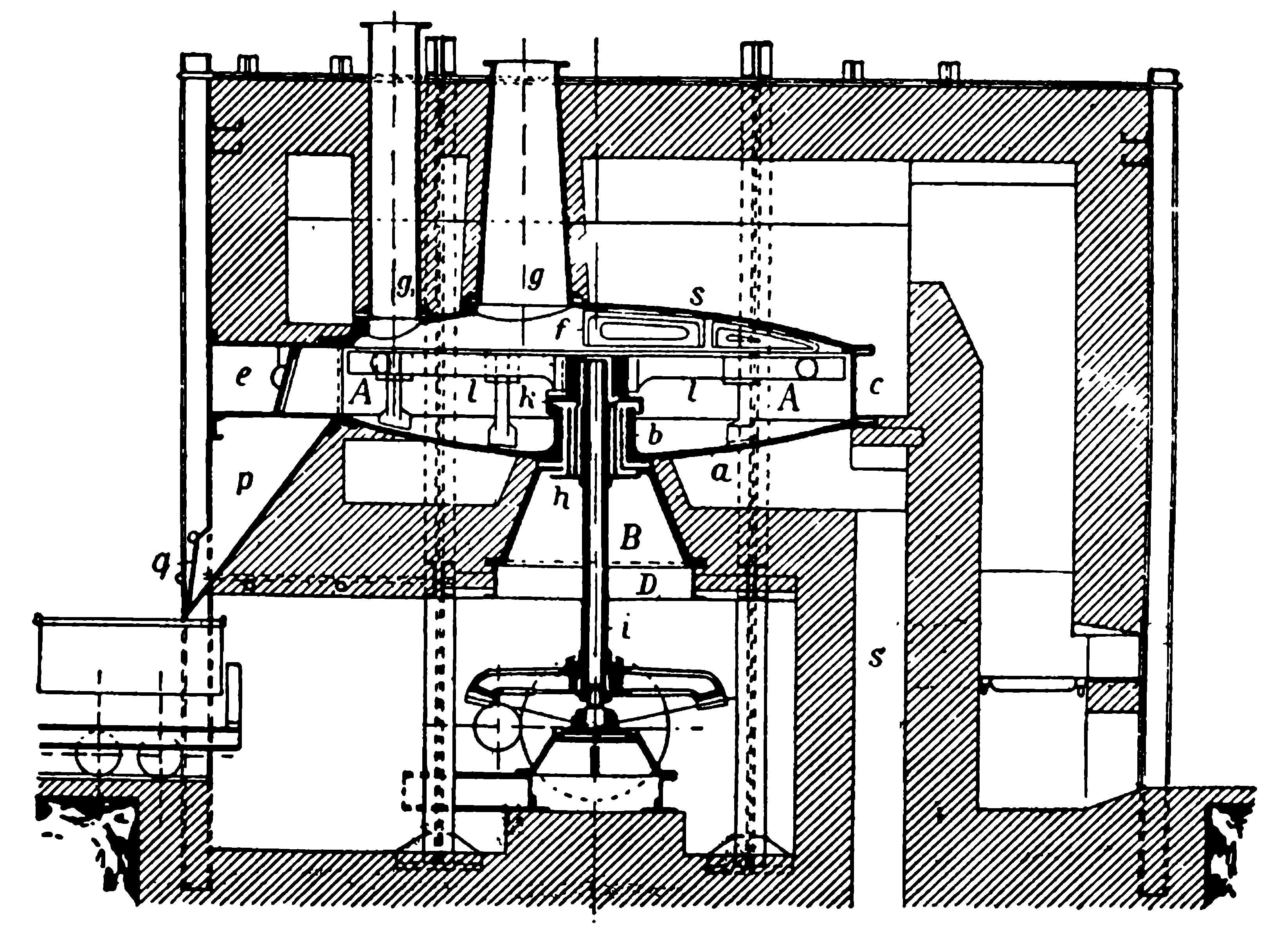
Рисунок 120. Механическая печь дли получения соляной кислоты и сульфата.
Полученный в реторте сульфат постоянно сваливается в карман p, откуда вываливается в вагонетку. Такая печь в течение суток может дать около 7 тонн сульфата и около 10 тонн соляной кислоты.
Полученная соляная кислота имеет обычно крепость в 18° Боме и содержит в растворимом виде всего лишь около 28% весовых газа — хлористого водорода. Самое большее в воде можно растворить около 32% хлористого водорода. Такая крепкая соляная кислота на воздухе „дымит“, частично выделяя растворенный хлористый водород.
Выработкой соляной кислоты и сульфата в РСФСР были заняты 21 завод (1917 год), теперь (1926 год) 12 заводов. В течение года на этих заводах вырабатывается теперь около 46 000 тонн соляной кислоты. Соляная кислота, полученная на этих заводах, применяется главным образом для получения хлористого цинка, который служит для пропитывания железнодорожных шпал с целью предохранения их от гниения, для получения хлора, который в свою очередь расходуется для фабрикации белильной извести, и наконец для получения уксусной кислоты.
Охрана труда в производствах минеральных кислот
Производства минеральных кислот — серной, азотной и соляной — относятся к производствам вредным. Как мы видели выше, все эти кислоты изготовляются из газов, которые легко загрязняют атмосферу рабочих помещений и создают неблагоприятные условия работы. Эта причина побуждает обращать особое внимание на непроницаемость всех аппаратов, на вентиляцию помещений и прочие. Сернистый ангидрид, окислы азота и хлористый водород являются сильными ядами для человеческого организма; при постоянном действии даже в небольших дозах они постепенно разрушают организм, вызывая болезни легких, действуют на слизистые оболочки глаз, носа и прочие. Вот почему к этим производствам, с точки зрения охраны труда, предъявляют особые требования. Рабочие помещения хорошо вентилируются, работу аппаратов стремятся сделать автоматической; в качестве противоядия рабочим выдают молоко и прочие. Все эти меры создают гигиенические условия работы.
Сода
Рассмотренная нами выше группа химических веществ — серная, азотная и соляная кислоты, как показывает их название, принадлежит к группе „минеральных кислот“ 1). Эта группа веществ обладает „кислым“ вкусом и имеет свойства, прямо противоположные свойствам веществ другой группы, называется „щелочами“. К группе щелочей относится всем известная сода, сода-бикарбонат (в общежитии называется „питьевой“ содой), каустик, поташ, аммиак и прочие. При действии щелочей на кислоты образуются минеральные соли. Впрочем последние в громадном большинстве случаев готовятся иными методами — непосредственно из минерального сырья.
Из всех щелочей наиболее крупное значение в промышленности имеет сода 2), которая в настоящее время готовится главным образом непосредственно из поваренной соли. В прошлом столетии, примерно до 1 875 года, соду изготовляли исключительно из сульфата, который, как мы видели выше, изготовляется из поваренной соли и серной кислоты. Этот последний способ был предложен в конце XVIII века Лебланом и в свое время имел крупное промышленное значение.
1) Существуют „минеральные“ и „органические“ кислоты. Первые добываются из минерального сырья (поваренной соли, серного колчедана и так далее), вторые—из „органического“ сырья (из жира животных, из растений, дерева, и прочие; сантиметров жиры, уксусная кислота и прочие)
2) Сода представляет собою натровую соль угольной кислоты и состоит из натрия, кислорода и углерода.
Способ этот имел то неудобство, что осуществление его без применения серной кислоты, которая требовалась для получения сульфата, не представлялось возможным. Соду по способу Леблана в настоящее время вырабатывают лишь в Англии на немногих заводах. В других же странах, в том числе и в СССР, эксплуатируется другой способ (Сольве), дающий возможность получить соду непосредственно из поваренной соли без применения серной кислоты.
Прежде чем перейти к описанию этого способа, мы скажем несколько слов о том, в каких областях промышленности сода находит применение. Во-первых, она в громадных количествах применяется для изготовления „каустической соды“, или, что одно и то же, известного всем „каустика“, который находит широкое применение не только для целей мыловарения, но и для некоторых других целей промышленности. Затем сода применяется как, сырье для изготовления стекла, применяется в текстильной промышленности, для изготовления краски — ультрамарина, „питьевой“ соды и прочие.
При получении соды по старому способу Леблана из сульфата последний, в сантиметрахеси с известняком и углем, нагревали в печах и полученную из печи массу обрабатывали водой. Полученный после такой обработки раствор, в котором заключалась сода, упаривали и получали готовый продукт — соду. На первый взгляд этот процесс кажется необычайно простым, но если мы примем во внимание необходимость изготовления сперва серной кислоты, а потом с помощью последней сульфата, то увидим, что способ Леблана, требуя в качестве сырья сульфат, является сложным и дорогим процессом.
При изготовлении соды непосредственно из поваренной соли последнюю в виде рассола насыщают газом аммиаком, затем рассолы очищают особым способом от примесей и после такой очистки насыщают их углекислым газом. При этом выпадает двууглекислая сода (бикарбонат), которая отделяется от раствора, заключающего нашатырь, фильтрованием.
Бикарбонат лри нагревании во вращающихся печах образует соду. Необходимый для осуществления этого процесса углекислый газ получают обжиганием известняка в известково-обжигательных печах 1). При таком обжиге из известняка выделяется углекислый газ, который применяется для насыщения рассолов, а твердый продукт обжига—
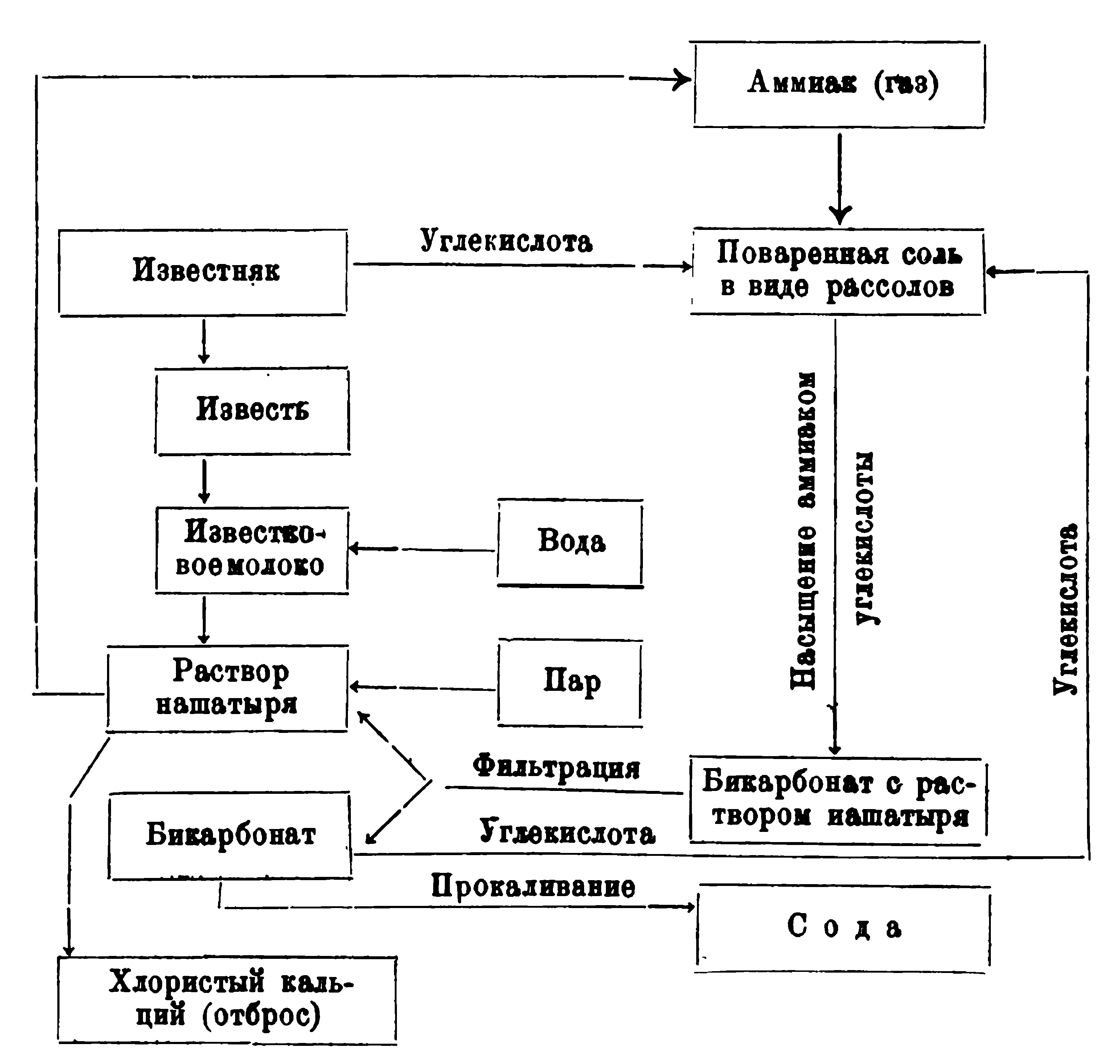
Рисунок 121. Схема получения соды.
известь — применяется для обратного получения аммиака из раствора нашатыря, который остается после отфильтровывания бикарбоната. Теоретически, для процесса получения соды по этому способу, аммиак не должен расходоваться, но расход этот практически имеет место.
Схема получения соды непосредственно из поваренной соли представлена на рисунке 121.
1) Об обжиге известняка смотрите ниже главу „О вяжущих строительных материалах“.
Для насыщения соляных растворов аммиаком, а затем (после очищения их) углекислым газом применяют высокие колонны. Такая колонна для насыщения углекислым газом соляного раствора, уже насыщенного аммиаком, представлена на рисунке 122. Колонна представляет собою цилиндрическую башню, высотою в 18 метров. Внутри колонна имеет горизонтальные перегородки с отверстиями, покрытыми колпаками. Вся колонна заполнена соляным раствором; снизу по трубе b нагнетается углекислый газ, который проходит соляной раствор снизу вверх. Образующийся бикарбонат в сантиметрахеси с раствором нашатыря1) выводится через трубу е, поступает на фильтры, где отфильтровывается, и затем поступает во вращающиеся печи (наподобие цементных, только меньшего диаметра), где прокаливается. При этом образуется сода и выделяется углекислый
1) Бикарбонат в воде, а также в растворе нашатыря растворяется трудно, а поэтому и выпадает из раствора.
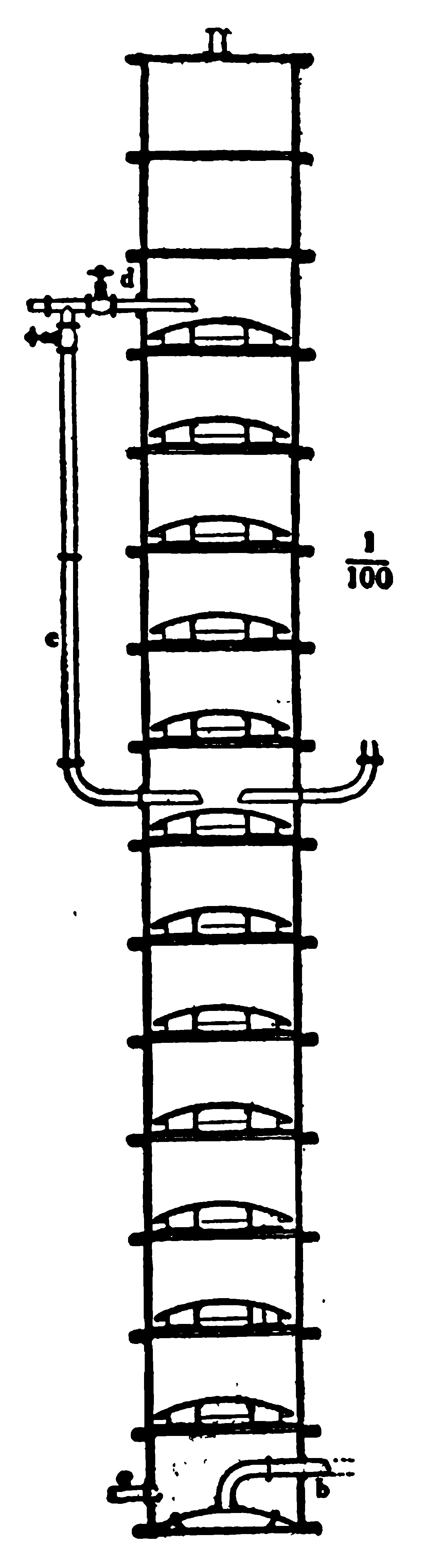
Рисунок 122. Колонна для насыщения соляного раствора углекислым газом.
газ, который применяется так же, как и углекислота известняка, для процесса образования бикарбоната.
С целью обратного получения аммиака из растворов нашатыря на последний в колоннах (подобных описанным) действуют паром и известковым молоком, полученным при обработке обожженной извести водою (смотрите схему). При этом выделяется газообразный аммиак, который поступает для насыщения рассолов, а оставшийся раствор хлористого кальция является, отбросом производства и выпускается в сточные канавы или реки.
Заводы для получения соды по способу Сольве отличаются большими размерами как вследствие их большой мощности, так и вследствие громоздкости применяемых в этом процессе аппаратов. Фотография части такого завода в СССР (в Пермской губернии) дана на рисунке 123.
на котором впереди видны три печи для обжига известняка.
В настоящее время около 96—97% всего производства соды приходится на соду, приготовленную по способу Сольве, и лишь 3— 4% — на соду по способу Леблана.
Производство соды на заводах Сольве за ряд лет дано в следующей таблице (в тоннах):
| 1908 год | 1910 год | 1912 год | 1913 год |
| 1 348 000 | 1 551 000 | 1 812 500 | 1 873 000 |
Самое большое количество соды вырабатывается в Соединенных Штатах, где производство только на одном заводе в Сиракузах достигает 250 000 тонн в год. В России было выработано следующее количество соды (в тоннах):
| 1900 год | 1908 год | 1910 год | 1913 г. 1914 г | |
| 76 000 | 110 600 | 123 300 | 159 300 | 145 400 |
| 1921/22 г | 1922/23 г | 1923/24 г |
| 31 578 | 54 676 | 79 905 |
Каустическая сода
„Каустик“, или „каустическая сода“, вырабатывается из обыкновенной соды или же непосредственно из соляных растворов при разложении их электрическом током, причем одновременно получается газообразный хлор, применяемый для фабрикации хлорной (или белильной) извести. Главное количество каустика изготовляется из соды. В этом последнем случае применяются два способа, из которых крупное промышленное значение имеет старый так называется „известковый способ“. Второй способ (Лёвига) более новый, применяется главным образом там, где имеется дешевая нефть.
Каустик в громадных количествах применяется в мыловарении, в текстильной промышленности, на нефтяных заводах (при очистке смазочных масел и керосина) и прочие.

Рисунок 123. Общий вид содового завода.
При эксплуатации „известкового способа“ на раствор соды при подогревании действуют обожженной известью, причем в растворе образуется каустик; раствор каустика, освобожденный фильтрованием от твердого осадка 1), упаривают в особых аппаратах при уменьшенном давлении (вакуум-аппараты), после чего окончательную упарку совершают в открытых чугунных котлах. Полученный в виде жидкости каустик разливают в железные барабаны, в которых он застывает и после укупорки барабанов поступает в продажу.
1) Этот осадок по составу представляет собою известняк.
При эксплуатации второго способа (Лёвига) смесь твердой соды с окисью железа 1) нагревают с помощью нефти во вращающихся печах. Образующийся плав, так называемое феррит-натрия, обрабатывают водой; при такой обработке в растворе получается каустик, который упаривается так же, как было описано выше, а в осадок выделяется окись железа, которая снова применяется для смешения с нею соды для последующей прокалки смеси во вращающихся печах.
При эксплуатации третьего способа, состоящего в разложении электрическим током растворов поваренной соли (смотрите получение белильной извести), получается раствор каустика, который подвергается упарке с целью получения готового продукта.
1) Окись железа берется в виде железной руды.
Каустическая сода изготовляется в размере примерно несколько более от производства соды. В России каустик вырабатывался на 5 заводах в следующих количествах (в тоннах):
| 1908 год | 1911 год | 1912 год | 1913 год | 1914 год | 1915 год |
| 41 300 | 49 709 | 47 800 | 52 600 | 53 309 | 59 295 |
В настоящее время (1927 год) работают пока три завода с годовой производительностью около 42 000 тонн.
Поташ
После сжигания дерева и трав остается зола, которая содержит так называемым „поташ“, являющийся ценным веществом, необходимым для осуществления многих химических производств и представляющим прекрасное удобрительное вещество 1).
После сжигания дерева и трав получается различное количество золы с различным содержанием поташа, что зависит от пород сжигаемых растений. Содержание золы в растениях варьирует от 0,2 до 4%. Самое большое количество золы получается от сжигания стеблей подсолнечника, который в громадных количествах культивируется в южных губерниях СССР, по преимуществу на Кубани.
Зола подсолнечника, содержащая до 50% поташа, у нас в СССР является сырьем для его получения. Процесс получения поташа из золы растений не сложен и состоит в обработке золы водою, отделении от полученного раствора поташа твердого нерастворившегося остатка и упаривании полученного раствора до твердого продукта.
За границей применяют и другие способы, а именно — поташ добывают из минерального ископаемого сырья (Стассфуртских солей), из овечьего жиро-пота и из паточного угля. Овечий жиро-пот получается при мойке шерсти овец, а паточный уголь — при прокаливании остатка, полученного после извлечения сахара на свеклосахарных заводах из черной патоки. Эти последние два способа имеют сравнительно ограниченное применение.
Поташ представляет собою калиевую соль угольной кислоты, в то время как сода является натровой солью.
Масштаб производства поташа в довоенной России (из золы растений) дан в следующей таблице (в тоннах):
| 1903 год | 1911 год | 1913 год | 1914 год |
| 4 000 | 6 400 | 6 550 | 3 350 |
В настоящее время (1927 год) производство составляет около 1 400 тонн в год.
Хлорная (белильная) известь
Хлорная, или белильная, известь в громадных количествах расходуется для целей беления тканей и бумаги. Она является также хорошим средством против иприта. Хлорная известь изготовляется из газа хлора, которым насыщается обожженная и слегка увлажненная известь.
Необходимый для приготовления хлорной извести хлор получается из соляной кислоты или же чаще — разложением растворов поваренной соли с помощью электрического тока. Газообразный хлор впускают в большие, сделанные из свинца или из бетона комнаты (камеры), на пол которых кладется небольшой высоты слой слегка увлажненной обожженной извести. Через несколько суток камеры открывают, выдувают с помощью вентилятора остатки хлора и полученную хлорную известь нагружают в деревянные бочки. Атмосфера в камерах все же содержит еще хлор, почему работающие в ней рабочие надевают на голову шлемы, под которые с помощью резиновых трубок постоянно вдувают свежий воздух. На рисунке 124 изображена группа рабочих, снабженных такими шлемами.
В последние годы вместо камер применяют особые аппараты, состоящие из нескольких рядов горизонтально расположенных цилиндров с мешалками, передвигающими известь с одного конца к другому. Навстречу извести проходит газообразный хлор, который поглощается известью с образованием хлорной извести.
Применение таких механически действующих аппаратов делает процесс получения хлорной извести вполне гигиеничным, почему такие аппараты как в СССР, так и за границей постепенно вытесняют камеры.
Хлорная известь содержит около 1/3 хлора (по весу) и применяется также для целей дезинфекции и прочие.
Производство хлорной извести в довоенной России достигало 20 000— 25 000 тонн в год. В 1923—1924 г. произведено около 7 000 тонн
Медный и железный купоросы
Медный купорос, представляющий собою красивые яркосиние кристаллы, в больших количествах применяется в гальванопластике1), для борьбы с вредителями виноградных лоз (для чего последние опрыскиваются раствором медного купороса), применяется в медицине, в производстве разнообразных медных красок и прочие.
Изготовляется медный купорос растворением обожженной меди в слабой серной кислоте при нагревании. Из полученного таким образом раствора, после его охлаждения и долгого стояния, выделются кристаллы медного купороса.
1) Гальванопластикой называется покрытие предметов слоем металла, в нашем случае слоем меди. Гальванопластика осуществляется с помощью электрического тока.
Железный купорос, представляющий собою красивые зеленые кристаллы, применяется в производстве чернил, для целей окрашивания тканей, в качестве дезинфекционного средства и прочие. Готовится он аналогично медному купоросу — растворением железа в слабой серной кислоте при нагревании и выкристаллизовании из раствора кристаллов купороса. В довоенной России изготовлялось ежегодно около 3 500 тонн железного и медного купоросов.
Аммиачная селитра
Аммиачная селитра находит широкое применение в технике взрывчатых веществ и изготовляется действием азотной кислоты на аммиачную воду (нашатырный спирт). Из полученного таким образом раствора выкристаллизовывается аммиачная селитра.
Производство аммиачной селитры в России во время войны достигало 10 000 тонн в год.
Калийная селитра
Калийная селитра применяется главным образом для изготовления черного пороха и изготовляется из известной уже нам натровой (чилийской) селитры и хлористого калия. Последний получается из Германии с Стассфуртских месторождений (смотрите калийные удобрения) или же получается в качестве побочного продукта в производстве поташа.
Для получения калийной селитры раствор хлористого калия кипятят с чилийской селитрой. При этом выпадает хлористый нагрий (поваренная соль), который отделяют от раствора. Из последнего выкристаллизовывается калийная селитра, которую отжимают от воды и осторожно сушаг.
Производство калийной селитры до войны у нас достигало 6 000 тонн. Почти все это количество шло на изготовление черного пороха, для изготовления которого неудобно применять чилийскую селитру вследствие ее гигроскопичности.
Сернокислый глинозем
Сернокислый глинозем находит широкое применение для очистки питьевых вод (смотрите очистку воды), в текстильной промышленности— в качестве протравы (смотрите крашение тканей) и в производстве бумаги.
Сернокислый глинозем изготовляется из бокситов (минералы, залежи которого находятся во Франции и у нас, в Новгородской губернии) или же из белой глины.
Существуют несколько способов получения сернокислого глинозема. Для получения чистого глинозема из бокситов особыми способами получают чистую окись алюминия, которую растворяют затем в серной кислоте и раствор упаривают. При получении нечистого глинозема прокаленную белую глину кипятят в серной кислоте, от полученного раствора отфильтровывают нерастворившийся осадок и раствор упаривают. По охлаждении получается белая твердая масса глинозема, которая разбивается на куски и укупоривается в бочки.
Производство сернокислого глинозема в довоенной России достигало 16 000 тонн. В 1923/24 годах произведено 5 500 тонн
Небольшое количество глинозема перерабатывалось в алюминиевые квасцы.
Серпистый натр
Сернистый натр находит широкое применение в текстильной промышленности для приготовления так называемое с/рнистых красителей и для крашения хлопчатобумажных тканей при помощи этих красителей. Кроме того сернистый натр применяется в кожевенном производстве для сгона волос с кож животных.
Сернистый натр изготовляется нагреванием смеси сульфата с углем в печах. Кислород, который входит в сульфат, отнимается углем, сгорающим за счет этого кислорода до углекислого газа. Полученный в печи плав растворяют в воде и раствор после отделения от осадка упаривают. Полученная густая жидкость разливается в железные барабаны, в которых застывает в твердую массу мясо-красного цвета.
В настоящее время сернистый натр изготовляется на многих заводах СССР. Масштаб производства достигает 6 500— 7 000 тонн в год.
Хлористый цинк
Хлористый цинк изготовляется в виде жидкости или твердого вещества растворением цинка или цинковых отбросов (золы) в соляной кислоте и в больших количествах применяется для пропитывания (консервирования) железнодорожных шпал, которые, будучи пропитаны хлористым цинком, предохраняются от гниения. Вместо хлористого цинка для той же цели применяют креозот, получаемый при сухой перегонке дерева или каменного угля.
В довоенной России ежегодно для целей консервирования шпал изготовляли до 10 000 тонн хлористого цинка.
Хромпики
Хромпики изготовляются из минерала — хромистого железняка, мощные месторождения которого находятся на Урале.
Хромпики и другие хромовые соли находят широкое применение в кожевенной промышленности для целей дубления кож, в текстильной промышленности (в крашении и ситцепечатании), в производстве минеральных красок и прочие.
Различают калиевый и натровый хромник. Первый изготовляется сплавлением измельченного хромистого железняка с поташем и известью, обработкой полученного плава водой и подкислением раствора серной кислотой; из полученного таким способом раствора выкристаллизовываются красивые яркокрасные кристаллы калиевого хромпика.
При изготовлении натрового хромпика вместо поташа берут соду, проделывают те же операции и полученный раствор упаривают до твердого продукта — натрового хромпика, который представляет собою желтые ноздреватые куски.
Фосфор
Фосфор до 30-х годов прошлого столетия в больших количествах применялся для фабрикации спичек; фосфор входил в состав зажигательной массы спичечных головок.
После 30-х годов прошлого столетия перешли к изготовлению так называемым „безопасных спичек“, и фосфор стал применяться для изготовления терочной массы спичечных коробок. В настоящее время для этой цели в СССР применяется около 80 тонн красного фосфора ежегодно.
Желтый фосфор добывается из костяной золы, которая получается обжиганием костей. Костяную золу обрабатывают серной кислотой и полученный после отделения нерастворимых веществ раствор упаривают до тестообразной массы. Эту массу смешивают с порошком древесного угля и прокаливают в особых печах. При прокаливании выделяется фосфор в виде пара, который улавливается в особых холодильниках водою, вторично перегоняется с целью его очистки и формируется в палочки.
В последние годы фосфор стали получать из более дешевого материала, фосфорита, который добывается из недр земли и служит исходным веществом для получения искусственного удобрения — суперфосфата (смотрите ниже). С этой целью измельченный фосфорит в сантиметрахеси с углем и песком нагревается в электрической печи; при нагревании этой смеси в парообразном состоянии выделяется фосфор, который улавливается водою и затем очищается вторичной перегонкой.
Красный фосфор, который входит в состав терочной массы спичечных коробок, изготовляется из желтого нагреванием его в железных эмалированных котлах без доступа воздуха. Производство спичек. Зажигательные спички появились в начале прошлого столетия во Франции. Для их изготовления применяли сперва сернистую сурьму в сантиметрахеси с серой, а позднее—желтый фосфор. При фабрикации так называемым „фосфорных спичек“, которые в настоящее время совершенно вышли из употребления, концы стержней спичек погружают в так назыв „зажигательную“ массу, которая приготовлялась из желтого фосфора, клея, серы и некоторых других веществ
Приготовленные таким образом спички могли зажигаться трением головки их о любую шероховатую поверхность.
На спичечных фабриках, изготовлявших таким способом спички, стали появляться ужасные заболевания рабочих — главным образом болезни десен и челюстей, — повысилась смертность рабочих, что объяснялось разрушающим действием фосфора на организм человека. Немецкий химик Беттгер в 50-х годах прошлого столетия изобрел так называемое безопасные шведские спички 1), зажигательная масса которых совершенно не содержала фосфора.
Зажигательная масса в спичках, применяемых в настоящее время, состоит из бертолетовой соли, парафина и сернистой сурьмы. Существует довольно много рецептов зажигательной массы; однако, в массу обязательно входит бертолетова соль в сантиметрахеси с вяжущими, (камедью и прочие) и другими веществами.
Спички делаются из обыкновенной ели, реже из сосны, липы и другие пород дерева. В большинстве случаев их делают четырехгранными, для чего применяют особые машины. Концы спичек погружают в зажигательную массу, сушат и укупоривают по 75 шт. в деревянные коробки, сделанные из тонких фанерных дощечек, оклеенных бумагой.
Боковые поверхности коробки покрываются смесью красного фосфора
1) Шведскими они называются потому, что были впервые введены в употребление в Швеции. с веществами, придающими шероховатость.
В настоящее время изготовляются только безопасные шведские спички. Изготовление фосфорных спичек, то есть спичек, в зажигательную массу которых входит желтый фосфор, теперь запрещено во всех государствах.
В СССР выработка безопасных спичек производится на заводах, число которых достигает 60. В нижеприведенной таблице показана выработка спичек за ряд лет в довоенной России в миллионах штук:
| Годы | Количество спичек в миллионах штук | ||
| Фосфорных | Бесфосфорных | Всего | |
| 1 893 | 62 576 | 74 366 | 136 942 |
| 1900 | 18 686 | 190 156 | 208 842 |
| 1911 | 498 | 305 495 | 305 993 |
| 1914 | — | 337 830 | 337 830 |
Из этой таблицы мы видим, что производство фосфорных спичек постепенно падало и наконец совершенно прекратилось (1914 год), в то время как производство безопасных шведских спичек постепенно возрастало. В настоящее время и в особенности в довоенное— большое количество спичек вывозилось за границу. Так, например, в 1913 году было вывезено около 5 000 тонн спичек, из которых половина вывозилась в Персию.
Иод
Иод представляет собою твердое вещество с металлическим блеском. Хорошо растворяясь в спирте, иод Образует так называемым „иодную тинктуру“, которая применяется в медицине. Иод находит широкое применение в производстве фармацевтических иодных препаратов, например йодистого калия, йодоформа и другие солей, которые применяются в медицине.
Иод добывается главным образом из растворов, полученных при очистке природной селитры. Залежи селитры находятся только в Южной Америке (Чили). Добытую там селитру с целью отделения ее от примесей растворяют в воде, из раствора которой выкристаллизовывается чистая селитра. Оставшийся так называется „маточный раствор“ содержит иод, который с помощью особых методов извлекается из раствора.
Некоторое количество иода получают из золы морских водорослей, произрастающих на берегах Нормандии, Бретани и Шотландии, на южном побережья Японских островов и на Мурманском берегу Ледовитого океана.
Зола этих водорослей содержит до 2% иода.
Главное количество иода добывается в Чили, где добыча достигает 450—550 тонн ежегодно. Добыча иода из золы водорослей сравнительно незначительна и не превышает 26 тонн иода ежегодно.
Мышьяк
Мышьяк в виде мышьяковистой кислоты, или „белого мышьяка“, находит применение в стекольном производстве для обесцвечивания стекла, для приготовления медных красок, для истребления крыс, как консервирующее средство в медицине (сальварсан и другие), в сельском хозяйстве и прочие. Мышьяк является сильным ядом: 0,2 грамм белого мышьяка действуют на человека смертельно. Сернистый мышьяк применяетсй в кожевенном деле для удаления волос с выделываемых кож.
Добывается мышьяк из руд— мышьякового колчедана, реальгара, аурипигмента и прочие. Методы получения белого мышьяка состоят в накаливании руды и улавливании выделяющегося мышьяка в холодильниках.
Соединения мышьяка, помимо вышеуказанных применений, имеют серьезное значение как средство для борьбы с вредителями в сельском хозяйстве. В России в 1914 году на эти цели было израсходовано около 5 000 тонн соединений мышьяка.