 > Техника, страница 70 > Периодический закон
> Техника, страница 70 > Периодический закон
Периодический закон
Периодический закон, закон периодичности химических и физич. свойств элементов. Краткая формулировка П. з. состоит в следующем: все химические и подавляющее большинство физич. свойств элементов представляют собой периодич. ф-ию (прерывную) от величины заряда атомного ядра. Закон этот был открыт Д. И. Менделеевым в 1869 г. и опубликован в том же году в первом томе Журнала русского физико-химич. общества, а также и за границей. В то время не существовало никаких представлений об атомном ядре, и Менделеев формулировал свой П. з. несколько иначе, а именно за аргумент взял вместо заряда ядра ат. вес и на основе своего постулата развил идей о естественной периодической системе элементов, разместив в ней отдельно элементы вполне правильно—в порядке возрастания ядер-ного заряда (смотрите табл.). При этом Менделееву, как известно, пришлось поступиться в трех случаях правилом постепенного нарастания ат. веса и поместить элемент с меньшим ат. весом после элемента с весом бблыним. Список элементов, известных в настоящее время, обнаруживает четыре случая подобной аномалии атомных весов. В 1913 году Мозли заменил в формулировке Менделеевского закона ат. вес зарядом ядра, находящим непосредственное выражение в так называемым порядковом числе, или атомном номере, элемента. Своеобразный смысл понятия об ат. в был раскрыт позднее работами Астона и Гаркин-са. Первые проблески понимания причин периодичности свойств элементов мы находим в работах Дж. Дж. Томсона, но только Н. Бор (1913) дал ясное толкование как строения электронных оболочек атомов, так и периодической системы элементов. Свое завершение идеи Бора получили в 1925 году в принципе, высказанном Паули: «в атоме не может существовать двух электронов,
| 1 Порядк. 1 номер | Название элемента | Символ элемента | Средний ат. в. | Ат. в изотопов | Порядк. номер | Название элемента | Символ элемента | Средний ат. в. | Ат. В.
ИЗОТОПОВ |
| 1 | Водород. | н | 1,0078 | 1,0078 | 49 | Индий. | In | 114,8 | 115 |
| 2 | Гелий. | Не | 4,0020 | 4 | 50 | Олово. | Sn | 118,70 | 112i, 114к, 1161, |
| 3 | Литий. | Li | 6,94 | 6Ь, 7а | 116С, 1171, 118Ь, | ||||
| 4 | Бериллий. | Be | 9,02 | 9 | 119е, 120а, 121b, | ||||
| б | Бор. | В | 10,82 | юЬ, 11а | 122g, 124d | ||||
| 6 | Углерод. | С | 12,000 | 12 | 51 | Сурьма. | Sb | 121,76 | 12la, 123b |
| 7 | Азот. | N | 14,008 | 14 | 52 | Теллур. | Те | 127,5 | Г26Ь, 128a, 130C, |
| 8 | Кислород. | О | 16,0000 | 16,17,18 | 53 | Иод. | 3(1) | 126,932 | 127 |
| 9 | Фтор. | F | 19,00 | 19 | 54 | Ксенон. | X | 130,2 | 124i, 126h, 128f, |
| 10 | Неон. | Ne | 20,183 | 20а, (21), 22Ь | 129a,130g,131C, | ||||
| 11 | Натрий. | Na | 22,997 | 23 | 132b, 134d, 136e | ||||
| 12 | Магний. | Mg | 24,32 | 24а, 25b, 26с | 55 | Цезий. | Cs | 132,81 | 133 |
| 13 | Алюминий. | AI | 26,97 | 27 | 56 | Барий. | Ва | 137,36 | (136b), 138a |
| 14 | Кремний. | Si | 28,06 | 28а, 29b, ЗОС | 57 | Лантан. | La | 138,90 | 139 |
| 15 | Фосфор. | P | 31,02 | 31 | 58 | Церий. | Се | 140,13 | 140a, 142b |
| 16 | Сера. | S | 32,06 | 32а, 33b, 34С | 59 | Празеодим. | Рг | 140,92 | 141 |
| 17 | Хлор. | Cl | 35,457 | 35а, 37Ь | 60 | Неодим. | Nd | 144,27 | 142, 144, (145), |
| 18 | Аргон. | Ar | 39,944 | ЗбЬ, 40а | 146 | ||||
| 19 | Калий. | к | 39,104 | 39а,4lb | 61 | Иллиний. | 11 | — | |
| 20 | Кальций. | Ca | 40,07 | 40а,44b | 62 | Самарий. | Sm | 150,43 | |
| 21 | Скандий. | Sc | 45,10 | 45 | 63 | Евр. | Eu | 152,0 | |
| 22 | Тита а. | Ti | 47,90 | 48, (50) | 64 | Гадолиний. | Gd | 157,3 | |
| 28 | Ванадий. | Y | 60,95 | 51 | 65 | Тербий. | Tb | 159,2 | |
| 24 | Хром. | Cr | 52,01 | 52 | 66 | Диспрозий. | Dy | 162,46 | |
| 25 | Марганец. | Mn | 54,93 | 55 | 67 | Гольмий. | Но | 163,5 | |
| 26 | Железо. | Fe | 55,84 | 54b, 56а | 68 | Эрбий. | Er | 167,64 | |
| 27 | Кобальт. | Со | 58,94 | 59 | 69 | Туллий. | Tu | 169,4 | |
| 28 | Никель. | Ni | 58,69 | 58а, 60Ь | 70 | Иттербий. | Yb | 173,5 | |
| 29 | М едь. | Cu | 63,57 | 64а, 65Ь | 71 | Лютецип(Кае-. | |||
| 30 | Цинк. | Zn | 65,38 | 63а, (65), 66b. | сиопеий). | Lu (Cp) | 175,0 | ||
| (67),68e,(69),70d | 72 | Гафний. | HI | 178,6 | |||||
| 31 | Галлии. | Ga | 69,72 | 69а, 71Ь | 73 | Тантал. | Та | 181,36 | |
| 32 | Германий. | Ge | 72,60 | 74а, 72Ь, 70с,73, | 74 | Вольфрам. | W | 184,0 | 182, 183, 184, |
| 75, 76, 71, 77 | 186 | ||||||||
| 33 | As | 74,93 | 75 | 75 | Рений. | Re | 186,31 | 185b, 187a | |
| 34 | Селен. | Se | 79,2 | 74f, 76С, 77е, | 76 | Осмий. | Os | 190,9 | 186e, 1871, 188 d, |
| 78Ь, 80а, 82d | 189C, 190b, 192a | ||||||||
| зь | Бром. | Br | 79,916 | 79а, 81Ь | 77 | Иридий. | Ir | 193,1 | |
| зб | Криптон. | Kr | 82,9 | 78f, 80е, 82С, | 78 | Платина. | Pt | 195,23 | |
| 83d, 84а, 86Ь | 79 | Золото. | Au | 197,2 | |||||
| 37 | Рубидий. | Rb | 85,45 | 85а, 87Ь | 80 | Ртуть. | Hg | 200,61 | 198d,199C,200b. |
| 38 | Стронций. | Sr | 87,63 | 86Ь, 88а | 201e, 202a, 204f | ||||
| 39 | Иттрий. | Y | 88,92 | 89 | 81 | Таллий. | Tl | 204,39 | |
| 40 | Цирконий. | Zr | 91,22 | 90а, 92с, 94Ь, | 82 | Свинец. | Pb | 207,21 | 206b, 207C, 208a, |
| 41 | Ниобий (Ко-. | 83 | Висмут. | Bi | 209,00 | 209 | |||
| лумбий). | Nb (Cb) | 93,5 | 84 | Полоний. | Po | 210,0 | |||
| 42 | Молибден. | Mo | 96,0 | 85 | Экаиод. | EkJ | — | ||
| 43 | Мазурий. | Ma | — | 86 | Радон (Эмана- | Rn (Em, | |||
| 44 | Рутений. | Ru | 101,7 | ций, Нитон). | Nt) | 222 | |||
| 45 | Родий. | Rh | 102,9 | 96p, 98g, 99е, | 87 | Экацеэий. | EkCs | — | |
| 100d,101b,102а, | 88 | Радий. | Ra | 225,97 | |||||
| 104с | 89 | Актиний. | Ac | (227) | |||||
| 46 | Палладий. | Pd | 106,7 | 90 | Торий. | Th | 232,12 | ||
| 47 | Серебро. | Ag | 107,880 | 107а, 109Ь | 91 | Протактиний. | Pa | (231) | |
| 48 | Кадмий. | Cd | 112,41 | 110с, Ше,112Ь, | 92 | Уран. | U | 238,14 | |
| 113d, 114а, 1161 |
Изотопы радиоактивных элементов—см. Спр. ТЭ, т. I. Буквы при ат. в изотопов указывают содержание того или иного изотопа в составе элемента (а—наибольшее, Ь—меньше и т. д.).
имеющих совершенно идентичные квантовые числа». Этот принцип позволил теоретически объяснить структуру периодической системы. В настоящее время в связи с дальнейшими успехами науки (волновая механика, новое учение Лондона о валентности, новые экспериментальные данные) П. з. может быть истолкован еще глубже и продолжает служить путеводной нитью для исследователей свойств вещества.
Попытки классификации элементов делались и до Менделеева: Доберейнер (1829 г.) установил закон триад, по которому аналогичные (по свойствам) элементы м. б. сгруппированы по три в «триады», причем ат. в среднего члена такой группы близок к полусумме ат. в крайних элементов; эту идей далее развивали Петтенкофер, Дюма. Значительно ближе к П. з. подошел
Шанкуртуа (1826 г.), еще ближе Ньюландс (1865 г.) в своем законе октав. Менделеев расположил все известные ему химич. элементы в порядке возрастания ат. в и отметил, что в таком ряду периодически повторяются аналогичные серии элементов, т. н. периоды. Если написать один период под другим, то в отдельные вертикальные столбцы, названные Менделеевым группами, попадают элементы, аналогичные по своим физич. и химич. свойствам. Заметив, что целый ряд элементов не укладывается в систему, если им приписать ат. в., общепринятые в то время, Менделеев признал необходимым исправить эти веса. Так, для элемента индия принимался в то время ат. в 75,4 (37,7 х 2, т. к. индий считали двухвалентным элементом по нек-рому сходству с цинком); однако в ряду Менделеева место для элемента с ат. в 75 занято ом:
IV гр. V гр. VI гр.
Ge As Se
72,5 74,96 79,2
Ясно, что ат. в индия не м. б. равен 75,4; остается предположить, что валентность индия равна не двум, но трем или четырем, и ат. в его тогда будет соответственно 37,7 х хЗ=113 или 37,7x4=151. Предположив, что индий трехвалентен, Менделеев нашел для него место в системе между кадмием (ат. в 112) и оловом (ат. в 119) и т. о. указывал на необходимость искать аналогии индия не с цинком (II группа), но с алюминием (III группа),что при дальнейшем исследовании вопроса оправдывается. Подобным путем были исправлены или установлены Менделеевым ат. в индия, урана, платины, осмия, иридия, золота, титана, бериллия, церия, иттрия. Д. И. Менделеев не остановился на исправлении ат. в элементов известных. Ему принадлежит также предсказание новых, тогда еще неизвестных, элементов со всеми их важнейшими физич. и химич. свойствами. Предсказаны были аналог бора— экабор, аналог алюминия — экаалюминий, затем экасилиций, экатантал, экамарганец и двимарганец, экацезий и экаиод. Из этих 8 элементов первые шесть теперь уже открыты и названы: скандий, галлий,германий, протактиний, мазурий и рений. Как близко совпадение между свойствами элементов, предсказанных Менделеевым и фактически открытых, видно из следующего сопоставления:
Предсказано Д. И. Мен- Найдено Кл. Винклером делеевым в 1871 г. в 1886 г.
| Экасилиций. | Es | Германий. | Ge |
| Ат. в. | 72 | Ат. в. | 72,5 |
| Уд. в. | 5,5 | Уд. в. | 5,469
GeC>2 |
| Ф-ла окисла | EsOa | Ф-ла окисла | |
| Уд. в окисла | 4,7 | Уд. в.окисла | 4,703 |
| Хлористое | EsCIa
100* |
Хлористое | GeCl4 |
| соединение | соединение | ||
| i "кип. ·. ·. | 86° | ||
| Уд. в. | 1,9 | Уд. в. | 1,887 |
| Металлоор- | Металлоор- | ||
| ганич. соеди- | ганич. соеди- | ||
| нение. | Es(C2H5)i | нение. | Ge(C2H5)4 |
| 160° | i °κνη. | 160° | |
| Уд. в. | 0,96 | Немного легче воды | |
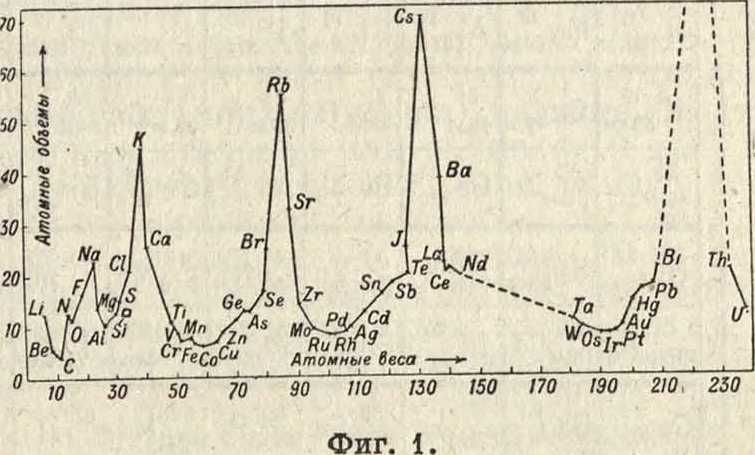
Весь фактич. материал химии, представлявший ранее бессистемное скопление разрозненных данных, получил на основе П. з. новое освещение и был систематизирован; блестящие обобщения, предсказания, новые пути исследования и выше всего сама философская идея о существовании естественной системы элементов, о существовании закона, подчиняющего себе многообразие элементов,— вот вклад в науку, обессмертивший имя Д. И. Менделеева. В 1870 г. германский химик Лотар Мейер, уже знакомый с открытием Менделеева, опубликовал статью, в которой дал кривую атомных объёмов, особенно ярко подчеркнув этим с количественной стороны идей периодичности физич. свойств химич. элементов (фигура 1).
Открытие периодической системы элементов дало химии мощный толчок вперед, но самый принцип построения системы, причина периодичности химических и физических свойств оставались тайной до недавнего времени. Только успехи физики, разгадав
шей природу рентгеновых лучей и линейчатых оптических спектров, позволили в настоящее время дать истолкование этой системе. С современной точки зрения каждый нейтральный материальный атом состоит из равного количества частиц положительного электричества (протоны) и отрицательного электричества (электроны). Все протоны данного атома и некоторая часть его электронов (цементирующие электроны) составляют ядро атома; вокруг ядра, лежащего в центре атома, расположена электронная с ф е р а, то есть пространство, заключающее в себе все остальные (иногда называемые планетарными) электроны. Т. к. заряды протонов и электронов равны друг другу по величине и только противоположны по знаку, заряд ядра равен всегда разности между числом его протонов и цементирующих электронов, умноженной на элементарный заряд (4,77 10-10 абс. эл.-ст. ед.);
число планетарных электронов конечно также равно этой разности, то есть равно числу свободных положительных зарядов ядра. Масса ядра приблизительно равна сумме масс его протонов, а т. к. масса ядерного протона, выраженная в шкале ат. в., близка к единице, следовательно и вес ядра в той же шкале равен числу входящих в него протонов; электроны имеют малую массу, приблизительно в 1 842 раза меньшую, чем масса одного протона, а потому массу цементирующих электронов можно в первом приближении не принимать во внимание; то же можно сказать и про планетарные электроны. Таким образом ат. в первом приближении должен быть равен числу протонов, входящих в ядро атома.
В 1913 году Мозли, изучая рентгеновы спектры элементов, нашел основной закон, согласно к-рому положительный заряд ядра (а следовательно и число планетарных элекФронов) атомов данного элемента есть величина вполне определенная и равная порядковому номеру элемента в таблице Менделеева. Т. о. положительный заряд ядра первого по порядку элемента—водорода—равен заряду одного протона, а так как ат. в водорода равен 1, то в водородном ядре очевидно присутствует только один протон и нет совсем цементирующих электронов; формула водородного атома будет [р]е, где р, стоящее в квадратных скобках, обозначает ядро, состоящее из одного протона, а е есть единственный планетарный электрон. Формула кальциевого атома будет [р40ег0]е20, так как атомный вес кальция равен 40, а порядковый номер—20. Заряд ядра последнего элемента таблицы урана оказался равным 92; на этом основании можно утверждать, что согласно закону Мозли и порядковый номер урана тоже равен 92, то есть между водородом и ураном в системе должно стоять ровно 90 элементов. Мы не знаем до сих пор, продолжается ли система дальше урана, то есть существуют ли в природе атомы тяжелее и сложнее урана, имеющие заряд ядра в 93, 94 и т. д. единиц, но если принять уран за последний элемент, общее число их будет равно 92. Из этих 92 элементов в настоящее время только два остаются еще неоткрыты ми, а именно экацезий и экаиод, предсказанные еще Менделеевым. Выше приводится таблица элементов с сохранением способа написания ее, предложенного Менделеевым; наиболее существенным дополнением к форме таблицы является включение в клетку каждого элемента наряду с ат. весом порядкового числа, равного заряду ядра.
Как видно из вышеприведенной таблицы (фигура 2), вся периодическая система элементов состоит из семи периодов. Шесть первых периодов кончаются инертными газами: Не, Ne, Аг, Кг, X, Rn; седьмой период, не законченный, имеет последним элементом уран. Первый период — гелиевый — состоит из двух элементов: водорода и гелия; второй и третий периоды (неоновый и аргоновый), или т. н. малые периоды, состоят каждый из 8 элементов; четвертый и пятый (криптоновый и ксеноновый), т. н. большие периоды, содержат по 18 элементов; шестой пе риод—самый большой (радоновый)—содержит 32 элемента; от седьмого периода мы знаем лишь обрывок из шести элементов. Вышеупомянутые числа 2, 8, 18 и 32, характеризующие длины периодов, укладываются в простые ф-лы вида: 2 · I2=2; 2 · 2!=8;. 2 · 32= 18 и 2 · 42=32, на что указал еще Ридберг. Т. о. мы видим, что химич. характеристика элементов меняется в ряду элементов, расположенных в порядке возрастания ядерного заряда, действительно периодически: после некоторой серии химически активных элементов в системе периодически появляются инертные элементы, причем порядковые номера этих последних подчинены строюму математическому правилу. В первом периоде мы имеем один активный элемент-водород и один инертный— гелий; в последующих периодах мы имеем опять по одному инертному элементу (в-совокупности они дают семейство инертных газов), но число активных возрастает: во втором и третьем периоде их по семи, в четвертом и пятом по 17, в шестом 31. При этом 7 активных элементов второго (неонового) периода резко отличаются друг от друга и являются первыми и наиболее типичными представителями семи семейств, составленных аналогичными по своим-свойствам элементами; эти семейства следующие: I семейство одновалентных щелочных металлов (Li, Na, К, Rb, Cs, F.kCs), II семейство двухвалентных щелочноземельных металлов (Be, Mg. Са, Sr, Ва, Ra), III семейство трехвалентных бора иземельных металлов (В, А1, Ga, In, ΤΙ), IV семейство четырехвалентно го“ углерода (С, Si, Ge, Sn, Pb), V семейство пятивалентного азота (N, Р, As, Sb, Bi), VI семейство кислорода (О, S, Se, Те, Ро), VII семейство галогенов (F, Cl, Br, J, EkJ). Т. о. к. 7 активным элементам 2-го периода примыкают в и&честве химич. аналогов все 7 активных элементов третьего периода, а из последующих 4-го, 5-го и 6-го периодов тоже? только по семи элементов; этот факт подчеркнут нами в таблице тем, что символы аналогичных элементов поставлены точно-один под другим в вертикальный столбец. Одна из главных аналогий между членами каждого отдельного семейства — одинаковая высшая валентность по кислороду; высшая валентность всех аналогов углерода равна четырем и по отношению к кислороду и по отношению к водороду; высшая валентность аналогов азота по кислороду равна Ьу
| 1 | II | ni | IV | V | VI | VII | VIII | 0 | ||
|
и 1 П 1.0078 |
2 Не
4.002 Π“ | |||||||||
| 1 · 3 LI 6.940 | Ве91 | R 5
D 10.82 |
r 6
° 12.00 |
^’14.00 | 0 8
U 16.000 |
F 9
r 19.00 | 10 Np
20.18 Me | |||
| ^322Я7 | AI 13
Ml 26.97 |
ς. 14
ύΙ 28.06 |
P 15
r 31.02 |
ς 16
^ 32.06 |
CI3L | 18 Ar
39.94 | ||||
| и 19
39.104 |
Са20
40.07 |
21 ς
45.10 |
22 τ. 47.90 1 1 | 23 у 50.95 W | 24 Cr
52.01 υΓ |
26 Pe
55.84 r e |
27 pn58.94^° | 28
58.69 N |
||
| 29 г63.57 | 30 v65.38“ П | r 31
69.72 |
r 32 ^ 6 72.60 | As& | c 34
79.2 |
n 35 0Γ79.916 | 36 Kt*
82.9 | |||
| Rb& | Sr38
ОГ87.63 |
39 y.
88.93 Y |
40 Zr
91.22 |
95.8 Nb | /62оМ° | 45 u Ma | “ D
101.7 °U |
102.9^ | 46 Pd
106.7 rc* |
|
| 107.880^6 | nSt^d | 49
I*1 114.8 |
ς 50 ύΠ118.70 | Cl· 51 00121.76 | T 52 * e 127.5 | T 53 J 126.93 | 54 у
130.02 Λ | |||
| fV 55 132.81 | г? 56
Ba!37j6 |
57 1 138.90 La | 58 p 59 p 60 », j 61 τ, 140.13 140.92 ГГ 144.27 |
- | ||||||
| 62 p 63 r- 64 p j 150.433 01752.0 U 157.3"“ | 65 Tl· 66 n 67 i· 68 r· 159.2 ° 162.46 163.5 **° 167.64 е-* | |||||||||
| 69 T 70 wt 71 i 169.4 *U 173.5175.ol-U | ,78ZSHf | 73 x181.4* 3 | 74 W
184.0 vv |
75 D
188.3iKe |
76 П
190.9US |
77 Ir
193.1 11 |
78 Pt
195.23 Г 1 | |||
| тг^ч | 80 Ησ 200.61 пь | Tl 81
1 204.39 |
РСг, | Ri 83
D 209.00 |
n 84 P° 210 | EU85 | 86 D222 ^ ΓΙ | |||
| EkCs87 | Ra 88
^ “225.37 |
89.
(22?) |
90 ji
232.12 П |
91 n
(231) °a |
92 и238.14 u | |||||
|
Типичные R20 RO R203 ROo R205 R0j R2O7 формулы окислов RH4 RH3 RHZ RH Летучие вобороЭные соеЗинения | ||||||||||
Фигура 2.
по водороду 3, в семействе кислорода соответственно 6 и 2, для галогенов 7 и 1 и т. д. Эти аналогии находят свое символическое изображение в таблице в виде ф-лы высших окислов и водородных соединений, приписанных к каждому вертикальному столбцу. Каждая горизонтальная серия из семи активных элементов начинается электроположительным щелочным металлом, кончается электроотрицательным галогеном. В больших периодах (4-м и 5-м) между щелочноземельным металлом и земельным помещается декада металлич. элементов нового типа:
4- и период:
К Са [Sc Ti V Cr Μη Fe Co Ni Си Zn] Ga Ge As SeBrKr;
5- и период:
RbSr[Y Zr Nb Mo MaRuRh Pd AgCd] In Sn SbTe .1X.
Если элементы, стоящие до и после скобки, являются аналогами элементов 2-го и 3-го периодов, то декады, заключенные в скобки, представляют собой серии нового типа, причем вставная декада 5-го периода аналогична декаде периода 4-го, то есть элементам ряда Sc—Zn. Точно такую же вставную декаду мы находим и в 6-м периоде, но там она осложнена тем, что между первым и вторым членом декады в свою очередь вставлена еще новая серия т. н. редкоземельных элементов, состоящая из 14 членов. Т. о. строение 6-го периода можно представить так: Cs Ва (La [Се Рг Nd II Sm Eu Gd Tb Dy Но Er Tu Yb Lui Hf Та W Re Os Ir Pt Au Hg) Tl Pb Bi Po EkJ Rn. 8 элементов 6-го периода являются аналогами 8 представителей 2-го и 3-го периодов, 10—аналогами элементов соответственных вставных декад 4-го и 5-го периодов, а остальные 14 представляют собой новую своеобразную серию металлов, не имеющую аналогов в вышележащих периодах системы. 7-й период м. б. представлен так: EkCs Ra (Ac Th Pa U.), т. e. кроме двух типичных щелочного и щелочноземельного металлов мы имеем еще 4 члена, представляющих как бы начало вставной декады, т. к. действительно элементы Ас—U сходны с элементами La—W, Y—Mo, Sc— Cr. По аналогии с 6-м периодом можно было бы ожидать между Ас и Th вставку из 14 аналогов ряда Се—Lu, но на самом деле это не имеет места.
Хотя появление металлов вставных декад представляет собою новое развитие идеи химич. активпости, а не простую вариацию типичных элементов малых периодов, тем не менее большая часть из них м. б. размещена в те же 7 групп, которые были нами указаны. Мы могли бы ожидать, что вставленная между двухвалентным кальцием и трехвалентным галлием декада металлов будет состоять из металлов двух- или трехвалентных со свойствами, промежуточными между кальцием и галлием. На самом же деле мы имеем вслед за двухвалентным кальцием сразу трехвалентный скандий, затем четырехвалентный титан, пятивалентный ванадий, шестивалентный хром и семивалентный марганец; то есть природа здесь, хотя и в иной форме, но имитирует до известной степени ход валентности в малых периодах. Элементы конца вставной декады Си и Zn также примыкают по некоторым своим свойствам к типичным элементам I и II групп системы, но железо, кобальт и никель не имеют даже отдаленных аналогов в малых периодах, и Менделееву пришлось их поместить в особую, VIII группу; этот факт подтверждает мысль об исключительном положении всех элементов вставной декады и о> нек-ром сомнении в правильности помещения нек-рых ее членов в один столбец с элементами малых периодов. О том же говорит особенное, свойственное элементам вставных декад, свойство—давать комплексные соединения, яркая окраска ионов, образуемых этими элементами, магнитные их свойства и многие другие своеобразные проявления их природы, отличающие вставные декады от типичных элементов. Еще более своеобразна и исключительна но своим особенностям группа 14 элементов редких земель; свойства этих элементов близки друг к другу, и вследствие этого их разделение и очистка весьма затруднительны.
Т. о. в системе элементов мы можем отличать следующие составные части: 1) два простейших элемента—водород и гелий, составляющие первый период; 2) 42 типичных элемента (2-й и 3-й периоды и их аналоги из последующих периодов), дающие 8 вертикальных столбцов или групп от 0 до VII;
3) 34 элемента вставных декад, помещенных в те же вертикальные столбцы от I до VII, а также в особую VIII группу. 25 из них, попадая в вертикальные группы, образованные типичными элементами, составляют т. н. побочные подгруппы: 1а—благородные металлы Си, Ag, Аи; На—подгруппа цинка Zn, Cd, Hg; Ilia—подгруппа скандия Sc, Y, La, Ac; IVa—подгруппа титана Ti, Zr, Hf, Th; Va — подгруппа ванадия V, Nb, Та, Pa; Via—подгруппа хрома Cr, Mo, W; Vila— подгруппа марганца Μη, Ma, Re. VIII группа составлена тремя триадами: Ре, Со, Ni; Ru, Rh, Pd и Os, Ir, Pt; 4) наконец в системе имеем еще 14 металлов редких земель.
Сложное строение системы долгое время было загадкой и только после успехов физики, выяснившей на основе изучения спектров структуру электронных оболочек атомов, установлены были принципы, лежащие в оспове явления периодичности. Прежде всего было выяснено, что состояние каждого планетарного электрона, рассматриваемого отдельно от остальных электронов атома, м. б. охарактеризовано четырьмя символами—т. н. квантовыми чи — соответственно числу независимых периодич. движений или числу степеней свободы данного электрона; три из них отвечают трем пространственным"координатам (в первоначальной теории Бора этому отвечали три одновременных движения: вращение электрона по орбите, вращение самой орбиты в известной плоскости вокруг ядра атома и наконец прецессионное вращение этой плоскости), четвертое связано с вращением электрона вокруг его собственной оси. Эти четыре числа мг·, 1г·, limas{ связаны между собою следующими законами: О < 1г- < щ — 1,
hm- + h> + (If — 1) + ··· — ht,
S{ =’± 1 · гт 2
Принимая во внимание эти математич. ограничения^ также высказанный в 1925 году Паули принцип, согласно к-рому в атоме не может существовать двух электронов, для которых все 4 квантовые числа совпадали бы, мы можем вычислить,
•сколько электронов, отвечающих главным квантовым ч и<= 1, 2, 3, ., может поместиться в 1-й, 2-й, 3-й,. электронной оболочке, или сфере, окружающей ядро атома.
По вычислению оказывается, что в первой сфере м.б. максимум 2 электрона, во второй 8,
® третьей 18, в четвертой 32, и получаем ряд чисел, характеризующий длину периодов системы элементов, причем 8 электронов, имеющих пг-= 2, разбиваются на 2 подгруппы: для .ϊ,·=0 мы имеем два электрона
41т= 0, Sjm — + 2), для ί,·= 1 имеет уже шесть электронов ((„= + 1,0 и -1 и в каждом случае sim=±|). Далее 18 электронов третьей сферы разбиваются на три подгруппы, •имеющие различное второе квантовое число If в одной из них 2 электрона, в другой 6, в третьей 10; 32 электрона 4-й сферы делятся соответственно на подгруппы в 2, 6, 10 и 14 электронов. Эти числа играют, как оказывается, решающую роль в построении периодической системы. Проходя в системе •от первого элемента по порядку до последнего, мы все время имеем возрастание заряда ядра, а следовательно и числа планетарных электронов, которые и будут размещаться вокруг ядра, согласно принципу Паули; при этом, как можно показать теоретически, законченному постройкой слою из 8 электронов (2+6), а в случае гелия слою из двух электронов (%= 1) отвечает атом со свойствами инертного газа. Строя электронные оболочки вокруг ядра, мы должны периодически заканчивать одну и приниматься за постройку следующей, более внешней (увеличение п{ на 1); в этот момент мы и будем иметь конец периода, характеризуемый появлением инертного газа. Водород и гелий отвечают постепенному заполнению 1-й электронной сферы на протяжении периода Li—Ne, заполняется 8 электронами 2-я сфера, период Na—Аг отвечает постепенному заполнению 8 электронами 3-й сферы, которая согласно сказанному может содержать в себе не 8, а 18 электронов. Дальнейший ход заполнения электронами пространства вокруг ядра ясен из следующей схемы (смотрите схему строения электронных оболочек), в которой римскими цифрами изображены последовательно заполняемые электронные • сферы; арабские цифры представляют собою число новых электронов, попадающих в атом и размещающихся в том или ином •слое; (смотрите Строение атома).
Из этой схемы ясно, что типичные элементы сходны между собой вследствие одинако-.вой структуры самого внешнего электрон-
Схема строения электронных оболочек.
| Периоды | I | II | III | IV | V. | VI | VII | |||||||||
| 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 14 | 2 | 6 | 10 | 2 | 6 | 10 | 2 | |
| Н-Не | 2 | |||||||||||||||
| Li—Ne | 2 | 2 | 6 | |||||||||||||
| Na—Ar | 2 | 2 | 6 | 2 | 6 | |||||||||||
| К—С a | 2 | 2 | 6 | 2 | 6 | 2 | ||||||||||
| Sc-Zn | 2 | 2 | 6 | 2 | 6 | 10 | 2 | |||||||||
| Ga—Кг | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | ||||||||
| Rb—Sr | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 2 | |||||||
| Y—Cd | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 | 2 | ||||||
| Ια—X | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 | 2 | 6 | |||||
| Cs—В a | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 | 2 | 6 | 2 | ||||
| La | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 | 2 | 6 | 1 | 2 | |||
| Ce—Lu | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 14 | 2 | 6 | 1 | 2 | |||
| Hf-Hg | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 14 | 2 | 6 | 10 | 2 | |||
| Tl—Bn | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 14 | 2 | 6 | 10 | 2 | 6 | ||
| EkCs—Ra | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 14 | 2 | 6 | 10 | 2 | 6 | 2 | |
| Ac—U | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 14 | 2 | 6 | 10 | 2 | 6 | 4 | 2 |
ного слоя (последовательное заполнение его 8 электронами); металлы вставных декад отвечают вхождению 10 электронов во II слой снаружи; металлы редких земель соответствуют накоплению 14 электронов в III снаружи слое (IV слой при наличии более внешних V и VI). Современная теория валентности (Лондон) основана на представлении о непарных эле к,т р о н а х, не имеющих внутри атома партнера, обладающего теми же самыми первыми тремя квантовыми чи и отличающегося только знаком четвертого квантового числа (вращение электрона вправо или влево обозначается символами ± 2) Приложение этой теории к системе элементов объясняет как периодичность валентности, так и многие другие ее особенности, например низкую валентность кислорода и фтора.
Во всех случаях периодичности физич. и химич. свойств элементов в основе лежит факт периодичных изменений внешней электронной оболочки, имеющих место при рассмотрении элементов, расположенных в ряд Менделеева. От структуры внешней электронной сферы зависит, каким образом атом реагирует на воздействия внешней среды. Свойства центральной части атома не отражаются непосредственно на явлениях, происходящих на его поверхности. Существуют однако явления, зависящие как-раз от ядра атома и не связанные тесно с его периферией ;сюда относятся явления радиоактивности и вообще весь комплекс проблем, касающихся прочности ядер, их синтеза и дезинтеграции. Рассматривая эти явления, мы уже не можем ждать периодичности или во всяком случае закон периодичности будет иной, никак не связанный со структурой электронных оболочек, но зависящий от строения ядер. Гаркинс первый указал на то, что повидимому существует особая периодичность и для ядерных свойств, но период, открытый им, оказался равным не 8 и не 18, а всего только 2; на протяжении всей системы четные по порядку элементы оказались более распространенными в при-
роде, чем нечетные; число изотопов (йм.) у четных элементов значительно и веса их большей частью четны. Нечетные элементы мало распространены в природе, число изотопов у них не превышает двух и за редкими исключениями веса их нечетны. Таким образом, проходя через систему, мы попеременно будем встречать элементы с более прочными и менее прочными ядрами. Тем же Гаркинсом была высказана идея о потере массы, происходящей при образовании тяжелых атомов из водорода благодаря громадному экзотермическому эффекту. Астон, изучавший отклонения масс отдельных атомов от целых чисел, составил в 1930 году таблицу этих отклонений и на основании ее пришел к заключению, что наибольшая потеря массы, а следовательно и наибольший экзотермич. эффект образования, отвечает элементам, лежащим в системе около железа. Этот факт, возможно, и объясняет большое распространение в природе железа. Т. о. периодическая система, построенная на основании данных о периферических свойствах атомов, в настоящее время начинает служить и выяснению проблемы эволюции материи. Система Менделеева оказалась не искусственной классификацией элементов, а естественной системой их; она послужила и долго будет служить источником рабочих гипотез, путеводной нитью исследователя.
Лат.: Менделеев Д., Основы химии, 9 над., т. 2, М.—Л., 1928; Хвольсон О. Д., Финика наших дней, 2 издание, М,—Л., 1929; Бор Н., Три статьи о спектрах и строении атомов, пер. с нем., М.—Д., 1923; Крамере Г. А. и Го льет X., Строение атома и теория Бора, пер. с англ., М.—Л., 1926; Чугаев Л., Дериодич. система химических элементов, Москва, 1913; Спр. ТЭ, т. I, стр. 45—55; Meyer L. и. Mendeiejeff D., Abhandiun-gen ilber d. natiirliche System d. cbemischen JElemente, Ostwalds Klassiker d. exakten Wissenscbaften, 68, Leipzig, 1895; E u c k e n A., Lebrbucb d. cbemischen Physik, Leipzig, 1930; S c b m i d t K., Das perio-Uiscbe System d. cbemischen Eleinente, Lpz., 1917; Kabinowitz E. u. Thiel o, Das periodisebe System d. Eiemente, Stg., 1930. С. Щунарав.