 > Техника, страница 71 > Плавиковая кислота
> Техника, страница 71 > Плавиковая кислота
Плавиковая кислота
Плавиковая кислота, водный раствор фтористого водорода, HF, молекулы которого в водном растворе ассоциированы и имеют состав H2F2. Фтористый водород встречается в природе в свободном состоянии (как таковой или в виде П. к.) крайне редко. Однако поданным нек-рых авторов, например Мат-теучи [х] HF удалось обнаружить в газообразных продуктах у вершины Везувия.
Значительно более распространены в природе соли П. к. в виде минералов, например криолит (смотрите), плавиковый шпат (смотрите), вильомит NaF (уд. в. 2,79, тв. 2—2,5) и др. Плавиковый шпат обычно и является сырьем для производства фтористого водорода и П. к.
Получение фтористого водорода. 1) HF образуется при непосредственном соединении фтора и водорода; эта реакция протекает и в отсутствии света и даже при охлаждении до ί°—252,1°. 2) При действии фтора на Н20, NH3, H2S и углеводороды фтор отнимает водород и дает HF, причем в нек-рых случаях протекание реакции облегчается одновременным образованием флюоридов металлоида,связанного с водородом. 3) Флюориды (фториды) металлоидов легко гидролизуются, давая с водой HF, то есть образуя П. к. Так, JF5 или PFa дают с водой раствор П. к. 4) Некоторые фториды металлов, например фтористый свинец, фтористое серебро, при действии на них перегретого водяного пара выделяют HF, конденсирующегося с водой в виде П. к. 5) При действии конц. серной кислоты на фториды и соли кремнефтористоводородной кислоты (H2SiFe) образуется HF. Этим путем чаще всего получают HF в лабораториях. Эта же реакция лежит в основе производства П. к. Заводской метод получения HF и П. к. состоит в подогревании лучших сортов плавикового шпата (не содержащих Si02) до 130° с серной к-той, содержащей 10% воды, в реторте—котле из чугуна с чугунной же освинцованной крышкой. По Р. Baud [2] загрузка состоит из 100 в ч. CaF2 (с примесью Si02 не более 2—3%), 180 в ч. 90%-ной серной кислоты и 150 в ч. гипса, к-рый понижает разъедание аппаратуры. Реторта соединяется с серией свинцовых конденсаторов, содержащих воду или разбавленную П. к. Полученная к-та собирается в свинцовые бутыли. Реакция протекает по ур-ию: CaF2+H2S04=CaS0«+2HF.
В присутствии Si02 выход HF резко уменьшается вследствие побочной реакции: Si02+6HF=2H20+H2SiFe.
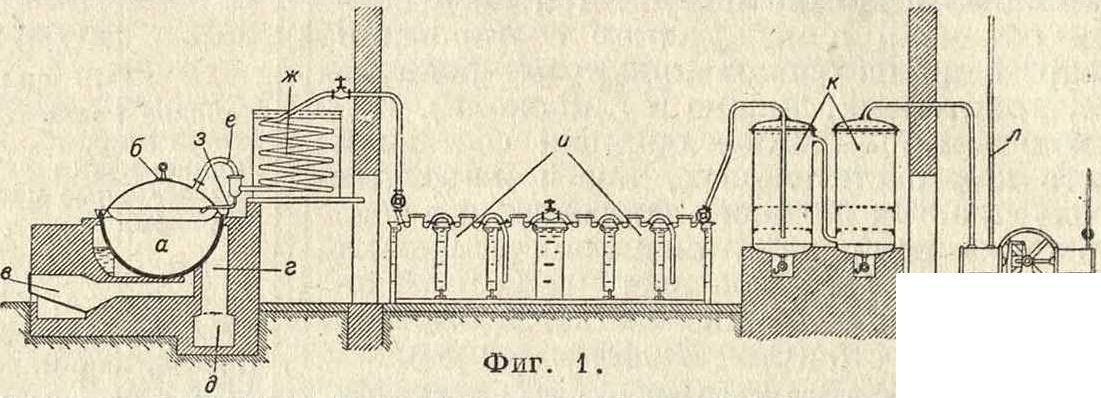
Современная аппаратура для получения П. к. состоит в следующем (вакуум-метод Эккельта [®], фигура 1). Разложение CaF2 серной к-той производится в чугунном котле а, с толщиной дна 4,5 см. Котел закрывается тяжелой свинцовой выпуклой крышкой б (толщина 10 миллиметров), борта которой образуют фланцы, стягиваемые с бортами котла; при этом борта крышек загибаются вверх, образуя вокруг крышки жолоб, в к-рый наливают воду для охлаждения. В свинцовую крышку впаяны защитные лотки для того, чтобы конденсирующаяся серная к-та не стекала по стенкам котла. Для большей не проницаемости между котлом и насадкой применяют каолиновую замазку. Котел снабжен топкой в; топочные газы, обогнув котел, проходят через г в канал д. Загрузка состоит из 800—900 килограмм CaF2 и 1 200—1 400 килограмм 60%-ной серной к-ты. Переработка этой загрузки требует двух дней; получаемый газообразный HF проходит через трубу с в змеевик ж механически унесенная H2S04конденсируется и стекает через трубу з обратно в котел а. Газ из змеевика поступает в свинцовые конденсаторы и, содержащие по 250 л Н20 или разбавленной к-ты. В систему включают 2 батареи по 3 конденсатора в каждой. Конденсаторы стоят в охлаждающей ванне, с циркулирующей водой. По выходе из конденсаторов газ попадает в поглотители к—два чугунных котла высотой 2 м, асфальтированных изнутри; для этого газ просасывается в первом котле сквозь известковое молоко и во втором котле сквозь известь. Вышедшие из поглотителя газы откачиваются с помощью насоса и удаляются наружу через трубку л. Этим путем получают обычно 25%-ную кислоту. При правильной работе 2 котла работают вместе. Продажная П. к., получаемая дистилляцией, содержит 40—52% HF, maximum 55%.
Техническая II. к. всегда содержит серную и кремнефтористоводородную к-ты, равно как Fe, As, Pb, S02, иногда H2S (если исходный CaF2 содержал сернистое железо). Для удаления кремнефтористоводородной кислоты добавляют немного поташа (причем выпадает K3SiF6) и дистиллируют. Тяжелые металлы удаляют сероводородом, предварительно разбавив П. к. до 40%-ной концентрации. Для удаления H2S добавляется Ag2C03 или Ag.20. От S02 П. к. освобождают добавлением КМпО„, после чего раствор подвергают перегонке. Иногда для очистки П. к. к половине ее количества добавляют К2С03 для образования KF, и к декантированному раствору добавляют вторую половину к-ты. Из раствора выкристаллизовывают KHF2, из которого регенерируют HF нагреванием: KHF2= HF + KF. Для перевозки и хранения П. к. применяют свинцовые сосуды либо сосуды из парафина или воска. Вулканизованный каучук для этой
цели не годится [4], хотя и до настоящего времени резиновые бутылки употребляются.
Свойства фтористого водорода. HF бесцветный газ, конденсирующийся в виде бесцветной, прозрачной, на воздухе дымящей жидкости; ΐ„η. +19,5° Г5], Гпл, -92,3°; i?™™.-102,5°. Уд. в жидкого HFnpn 13,6°— 0,9885,при 11,1°—0,9922; теплота образования HF по Вартенбергу:
Таблица 1,-
-У дельные веса растворов ГГ. к. при 20° [12] д 050% содержания HF.
ТТ
2 хх2 ШЗ
= HFM3 + 64 Cal. П
| ^^Единицы, % Десятки, % | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | |
| 0 | 1,003 | 1,007 | 1,011 | 1,014 | 1,018 | 1,023 | 1,027 | 1,030 | 1,035 | ||
| 1 | 1,038 | 1,041 | 1,045 | 1,049 | 1,052 | 1,055 | 1,059 | 1,062 | 1,066 | 1,069 | |
| 2 | 1,072 | 1,076 | 1,049 | 1,052 | 1,086 | 1,089 | 1,092 | 1,095 | 1,098 | 1,101 | |
| 3 | 1,104 | 1,106 | 1,119 | 1,112
1,138 | 1,114
1,141 |
1,117 | 1,120 | 1,122 | 1,125 | 1,127 | |
| 4 | 1,130 | 1,133 | 1,136 | 1,143 | 1,146 | 1,149 | 1,152 | 1,154 | |||
| 5 | 1,157 | ||||||||||
| Таблица 2.- | -Молекулярная и | электропро 25° [13]. | водность при 0° | ||||||||
| V | 1 | 2 | 4 | 8 | 16 | 32 | 64 | 128 | 256 | 512 | 1 024 |
| 18,94 | 20,42 | 23,57 | 28,30 | 36,60 | 47,39 | 61,55 | 81,2 | 105,8 | 135,8 | 173 | |
| я25. | 24,46 | 26,17 | 29,88 | 36,21 | 46,37 | 60,8 | 80,7 | 106,7 | 140,8 | 181,5 | 230 |
О. Руф и Ф. Лаас дают для этой же реакции 62,3 Cal [7]. Теплота конденсации:
HFM3=HF^a“. + 7,2 Cal. [8]
Теплота растворения:
HFra3 + 400 Н20=HFe? + 11,56 Cal. [·]
Жидкий безводный HF не проводит электрического тока L9J: электропроводность его <14- 10-6. Диэлектрич. постоянная ®=83,6 при 0° и 110,6 при —27° [l0J; t°mn. галоидо-водородов таковы: HJ —35,7°; НВг —68,7°; ЫС1—83°.Ненормально высокая HF ука зывает на склонность его молекул к ассо-
циации.Тоже следу
1==*
60° 80° 100°С
Фигура 2.
ет из рассмотрения кривой плотности пара HF (фигура 2). Молекулярный вес HF, определенный из плотности пара, при 21,4° равен 51,8 и лишь при 90° он падает до 20,58. В жидком состоянии HF не действует на металлоиды, а также и на металлы (за исключением щелочных). В газообразном состоянии HF действует при нагревании на Li и В; при красном калении—· на Zn и Cd. HF легко реагирует с S02, Sa05, As203, В203, труднее с мелкодисперсным Si02; с СиО—при 400°, с ZnO, CdO, CoO,NiO при ярко красном калении, с Сг203при 1 000° [“]. Разрушает бумагу, каучук, гуттаперчу. Не действует на серу, которая применяется в качестве замазки при производстве П. к.
Свойства П. к. При растворении HF в Н20 образуется П. к. Жидкий HF смешивается с водой во всех отношениях (до 19,4°). При более высокой <° растворимость HF в воде падает. 70%-ная П. к. не замерзает и при —70°; при нагревании она выделяет после определенной t° HF и по мере приближения t° раствора к 120° состав кислоты приближается к 36%; при ί° 120° перегоняется к-та указанного состава. С водой HF дает кристаллогидраты. Уд. веса растворов П. к. приведены в таблице 1.
Уд. теплоемкость 5%-ного раствора П. к. ра^на 0,947, 25,92%-ного=0,798. Теплота нейтрализаций NaOH равна 16,272 cal [*], LiOH—16,4; КОН =16,1.
Молекулярные электропроводности П. к. (вмо)приведены выше в таблице 2, где v—число л, в которых разбавлен 1 г-моль П. к. Zn и Fe растворяются в П. к. легко; В и Si понемногу, Си и Ag разъедаются очень медленно; Аи и Pt совершенно не разъедаются. Окислы в большинстве случаев реагируют с П. к.; в частности легко реагирует аморфный и мелкодисперсный Si02. П. к. дает соли не только средние, например K2F2, но и кислые, например KHF2, то есть ведет себя как двуосновная к-та H2F2; с фторидами П. к. легко дает комплексные соли, которые известны в большом числе. Общая формула этих комплексов Hn[MeFm] или Men"[MeFm], например: H2SiFe; K2SiF„; Na3AlF„ и др. П. к. входит также в комплексные соединения других типов. Отметим, что KF плохо растворяется в воде, a AgF хорошо, что не совпадает со свойствами других галоидных солей этих металлов в водных растворах.
HF и пары П. к. требуют большой осторожности при производстве, так как они пора кают органы дыхания. Жидкая П. к. производит на коже болезненные ожоги; для уменьшения боли Фреденгаген [®| рекомендует применять суспензию гидрата окиси магния в воде. Слабые растворы П. к. уничтожают деятельность многих микроорганизмов и применяются потому в технике как дезинфекционное средство.
Применение]!, к. чрезвычайно разнообразно. 1) Для травления стекла—применяют либо пары П. к. либо различные растворы, например раствор 32% (NH4)2F2 в 20%-ной П. к. 2) Для удаления песка с поверхности чугунных отливок. 3) При элек-тролитич. процессах, например при получении хлоратов и персульфатов, при катодном осаждении железа и т. д. 4) Для очистки графита. 5) Для пропитки шпал, и вообще как консервирующее средство в разных производствах, например в варении. О применении солей П. к. см. Фтора соединения.
Лит.: i) М e 1 1 or J., A Comprehensive Treatise on Inorganic a. Theoretical Chemistry, v. 2, p. 129, 1927;
2) B a u d P., Chimie industrielie, p. 232, P., 1927;
3) Neumann B., Lehrb. d. chemisehen Technologic u. Metallurgie, p. 266, Lpz., 1923; 4) Hfraens W.C., «Ζ. ang. Ch.», Lpz., 1895, Jg. 8, p. 434; δ) Μ о i s s a η H„ «CR», 1900,1.129, p.799; β) War tenberg H.u.Fltj· n er Ο., «Ζ. anorg. u. allg. Ch.», Lpz., 1926, B. 151, p. 313; В Ruff O. u. L a a s F„ ibid., 1929, B. 183, p. 214; 8) G u n t z A., «CR», 1883, t. 96, p. 1689; 9) FredenhagenK. u. Cadenbach G-., «Ζ.
anorg. u. allg. Ch.», Lpz., 1929, B. 178, p. 289; i«) Fre-denhagenK.u. DahmlosJ., ibid.,B.178, p.272, 1929; 4)Handbucb der anorg. Chemie, hrsg. v. R. Abegg u. F. Auerbach, B. 4, Abt. 2, p. 45—46, Lpz., 1913;
4) ff i n t e I e r, «Ζ. ang. Ch.», Lpz., 1902, Jg. 15, p. 33; i3) D e u s s e n, «Zeitschrift fiir anorganische und allgemeine Chemie», 1905, B. 44, p. 300, 408; Ullm. Enz., 2 Aufl., B. 5, p. 570; Hackspill L. et R e m y-G eaueti P., Petite industrie chimique, p. 257 et suiv., Paris, 1927. Б. Ормонт.