 > Техника, страница 72 > Подвижность ионов
> Техника, страница 72 > Подвижность ионов
Подвижность ионов
Подвижность ионов. Под этим термином понимают величину I (или 1а для аниона, 1к—для катиона), пропорциональную абсолютной скорости движения иона: l=F и, (1)
где F—фактор пропорциональности, и—абсолютная скорость иона, то есть путь (в см), проходимый ионом за 1 ск. в водном растворе при падении потенциала в 1 V на 1 см. Фактором пропорциональности в ур-ии (1) является т. н. число Фарадея (заряд 1 г-эквивалента любого иона); F=96 494 С. Такой выбор фактора пропорциональности вызван тем, что согласно закону Кольрауша (смотрите Электропроводность электролитов) значение эквивалентной электропроводности ца при бесконечном разведении для электролита равно сумме подвижностей его ионов: /г», — Ia -Ь ϊ/Γ · (2)
Следовательно П. и. должна иметь ту же размерность, что и эквивалентная электро-a-i см2
проводность, то есть —-. Умножая раз-
эквив. см мерность скорости иона ск на размерность числа Фарадея а---, имеем для I раз-
мерность эквивалентной электропроводности. Величина П. и. зависит от природы иона, £° и среды (растворителя). Значения подвижности нек-рых ионов при 18° и их £°-ные коэф-ты даны в следующей таблице. Подвижность ионов в бесконечно разбавленных растворах, при £°=18°.
| Ион | Подвижность ίχ | 1°-ный коэф. в % на 1° | Ион | Подвижность 1а | (“-ный коэф. в % на 1” |
| н·. | 315 | 1,54 | ОН. | 174 | 1,8 |
| bГ. | 33,4 | 2,65 | F.. | 46,6 | 2,38 |
| Na’. | 43,5 | 2,44 | C1. | 65,5 | 2,16 |
| κ·.. | 61,6 | 2,17 | Вг. | 67 | 2,15 |
| Ag’. | 54,3 | 2,29 | У. | 66,5 | 2,13 |
| NH,·. | 64 | 2,22 | Ν03. ·. | 61,7 | 2,05 |
| ViCa”. | 51 | 2,47 | СЫзСОО | 35 | 2,38 |
| paBa". | 55 | 2,39 | VaSO,". | 68 | 2,27 |
| >/iCu“. | 46 | — |
Подробную таблицу см. Спр. ТЭ, т. IV, стр. 306 или же Landolt-Bornstein, Physikaklisch-chemische Tabellen, II B., p. ί 101—1105.
Как видно из таблицы, ионы водорода и гидроксила обладают наибольшей подвижностью по сравнению с другими ионами; этим объясняется значительно бблыная электропроводность растворов к-т и оснований по сравнению с таковой для эквивалентных растворов солей. Никакой простой зависимости между П. и. и химич. и физич. свойствами тех же ионов нельзя указать. Это объясняется тем, что ионы в растворе гидратированы и степень гидратации (смотрите) для различных ионов различна. Чем сильнее гидратирован ион, тем больше его объём и тем меньше его подвижность (например ион Li). Ионы водорода и гидроксила гидротирова-ны слабее всего. Температурный коэф.подвижности для большинства ионов равен £°-ному коэф-ту внутреннего трения воды, взятому с обратным знаком. Это показывает, что при передвижении ионов имеет место трение воды о воду (гидратной воды о воду раствора). Исключением являются ионы водорода и гидроксила, у которых гидратация или совсем отсутствует или имеет место в очень незначительной степени. Влияние растворителя на П. и. определяется правилом Вальдена: при постоянной £° подвижность одного и того же иона в различных растворителях обратно пропорциональна коэфициентам внутреннего трения последних. П. и. находят из значения эквивалентной электропроводности раствора электролита при бесконечном разведении (ф-ла 2), пользуясь значением т. н. числа переноса данного иона (п или 1-и).
Числом переноса иона называется отношение скорости движения данного иона к сумме скоростей движения обоих ионов данного электролита;
1а
’U + ΐκ
или 1 — п =,
1К
1 + 1к’
(3)
причем число переноса аниона обозначается обычно через п, а число переноса катиона через 1-и. Число переноса, являясь мерой относительной скорости движения иона, входящего в состав данного электролита, показывает вместе с тем, какая часть электричества переносится при прохождении тока через раствор данного электролита этим ионом. Числа переноса м. б. экспериментально найдены при помощи специальных приборов. В этих приборах величину чисел переноса получают на основании определения изменения концентрации электролита в анодном и катодном слое при электролизе. Можно показать, что в том случае, если скорости движения ионов, входящих в данный электролит, одинаковы, то убыль вещества в анодном и катодном слое будет одинакова; если же равенства скоростей нет, то и убыль вещества у электродов будет различна. Последнее можно себе наглядно представить на следующих схемах. Представим себе раствор между электродами, мысленно разделенным на 3 слоя; анодный, средний и катодный; пусть в каждом слое находится нек-рое количество г-эквивалентов ионов (например по 5). Обозначим положительные ионы знаком -f, отрицательные знаком -. тогда состояние раствора до электролиза представится схемой фигура 1. Пропустим через раствор такое количество электричества,
к-рое необходимо для осаждения 5 г-экви-валентов. При этом допустим, что скорость движения катиона относится к скорости
Катод
%+++++
+ + + + +;+ + + + +
Катодн. простр.
Среднее простр. Лнодн простр.
Фигура 1.
движения аниона как 2:3. В этом случае при прохождении указанного количества электричества через раствор, через любое его поперечное сечение должны пройти три г-эквивалента анионов по направлению к аноду и два г-эквивалента катионов по направлению к катоду. Тогда., если бы не было разрядки ионов у электродов, мы получили бы распределение ионов в растворе, приведенное в схеме фигура 2. Ионы, не имеющие
| + 4- + + 4- + + | + 4+4-4- | + + + | |
| Катодн простр | Среднее простр. | Анодн простр. |
Фигура ‘2.
партнеров, разрядятся у электродов и после этого мы получим следующую картину распределения вещества в нашем электролите (фигура 3), где кружками обозначены разрядившиеся ионы. Резюмируя данные всех 3 схем, можно сказать, что между скоростью движения ионов и изменением концентрации ве-
• Катод
•о! о I 81
Катодн простр.
Среднее простр. Фигура 3.
+ +
Лнодн. простр. щества у электродов существует следующая зависимость:
скорость аниона убыль вещества у катода скорость катиона убыль у анода откуда число переноса аниона
χ убыль вещества у катода п =
Ικ+Ια сумма убыли у катода и анода
Практически убыль вещества у электродов для нахождения чисел переноса можно определить в приборе, изображенном на фигуре 4, где А—катод, В—защитный тигель, препятствующий осадку металла, получающемуся на катоде и обычно плохо на нем держащемуся, попадать в остальные части прибора, С— анод, D — катодное пространство, Е—кран для сливания катодного слоя раствора для анализа,
F—среди, часть, концентрация в которой не должна меняться, G—подвижный запор для отделения среднего пространства F от анодного слоя Н. Из ф-л (2) и (3) получаем значения 1Л и 1К:
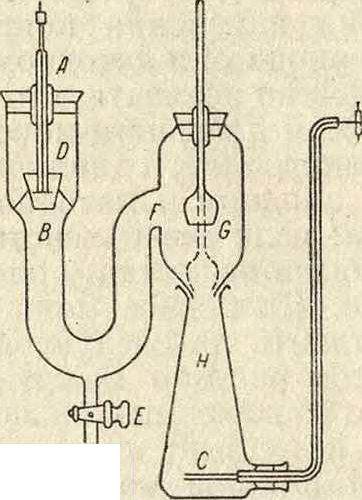
Фигура 4.
ΐΑ=ημ«, и (l — ri) μ“,
откуда, зная величину μ» и найдя экспериментально числа переноса, можно вычислить значение подвижности входящих в данный электролит ионов. Достаточно знать подвижность одного иона, чтобы определить из значений эквивалентных электропроводностей при бесконечном разведении по формуле Кольрауша подвижности всех остальных ионов. Из значений П. и. - могут быть по формуле (1) вычислены и их абсолютные скорости. Для окрашенных ионов значение абсолютной скорости м. б. найдено и экспериментально—путем наблюдения за временем перемещения окрашенного слоя жидкости при электролизе раствора.
Лит.: Э г г е р т Дж., Учебник физич. химии, нер. с нем., 2 изд., стр. 368—384, М.—Л., 1931; Оги-b e G., Grundziige der theoretischen und angewandten Elektrochemie, 2 Aullage, p. 20—64, Dresden—1 eipzig, 1930, p. 20—64; Foerster F., Elektrocliemie vas-seriger Losungen, Handbucb der angewandten pbysika-lischen Chemje, hrsg. v. G. Bredig, В. 1, p. 80 — 120. Leipzig, 1923. с. Плетенев.