 > Техника, страница 73 > Поляризация гальваническая
> Техника, страница 73 > Поляризация гальваническая
Поляризация гальваническая
Поляризация гальваническая, изменение в характере поверхности электродов или в прилегающих к электродам слоях электролита, происходящее вследствие прохождения через него электрич. тока и обусловливающее необходимость приложения нек-рого добавочного (кроме напряжения, равного произведению силы тока на сопротивление проводника) напряжения для того, чтобы осуществить прохождение тока через данный электролит. Это добавочное напряжение необходимо для преодоления т. н. встречной эдс (эдс П. г.), которая возникает вследствие упомянутых изменений, вызываемых проходящим током. Так наир., если опустить в раствор медного купороса два платиновых электрода, то для осуществления электролиза данного раствора необходимо приложить к электродам совершенно определенное (в смысле нижнего предела) напряжение. Если затем разомкнуть ток и соединить электроды с вольтметром, то последний обнаружит наличие в данной системе эдс, направление которой противоположно направлению выключенного первичного тока. Возникшая при этом эдс обусловлена тем, что при прохождении через данный раствор тока на одном полюсе отложилась медь, а на другом выделился кислород, отчасти затем удержавшийся на платине. Поверхность платиновых электродов вследствие этого изменилась, один из них получил свойство медного, а другой кислородного электрода и они, находясь в растворе, образовали гальваническую цепь
О a I CuSOi I Си,
эдс которой направлена против первоначально приложенного к электродам внешнего напряжения; эта эдс и должен быть компенсирована внешним напряжением для того, чтобы ток смог проходить через электролит. Такого рода эдс П. г., обусловленная изменением характера поверхности электродов, будет иметь место всегда, когда раствор электролита подвергается электролизу между химически неизменяющимися электродами. Величина ее зависит от того, какие процессы имеют место у катода и анода. Установлено,
что величина ее получается как сумма поляризационных потенциалов анода и катода Р=Еа + Ек.
Поляризационные потенциалы анода и катода (Еа и Ек) представляют собою разность потенциалов между соответствующими электродами и раствором. Они м. б. рассчитаны по формуле Нёрнста (смотрите Потенциал электродный) только в том случае, если электролиз не сопровождается иными видами поляризации (концентрационной, химической, перенапряжением). Непосредственное измерение электродвижущей силы П. г. при помощи вольтметра даже с очень большим сопротивлением произвести нельзя, так как при замыкании тока через вольтметр эдс быстро падает вследствие того, что вещества, обусловливающие П. г., снова переходят в раствор, так что для измерения П. г. пользуются, как и всегда при измерении эдс, компенсационным методом. Наименьшее значение напряжения, необходимого для начала электролиза раствора данного электролита между платиновыми или другими химически не изменяющимися электродами, называется его упругостью разложения. Но на основании изложенного выше для начала электролиза следует приложить к опущенным в электролит электродам напряжение, равное эдс П.г. .величина которой зависит от свойств отлагающихся на электродах веществ, следовательно упругость разложения будет зависеть от характера электролита, что и видно из табл. 1.
То, что кислородсодержащие кислоты и щелочи обладают приблизительно одинаковыми упругостями разложения, объясняется тем, что продуктами их электролиза являются одинаковые вещества (водород и кислород). Несоответствие величины упругости разложения к-т и щелочей с эдс цепи EyVi-N раствор кислоты О2, подсчитанной по формуле Нёрнста и имеющей величину 1,237 V, объясняется явлением т. н. перенапряжения (смотрите ниже). Аналогичное же несоответствие с теоретич. значением и по тем же причинам имеет место и для остальных веществ.
Если подвергнуть электролизу раствор медного купороса, имея в качестве электродов медные пластинки, то несмотря на то, что характер поверхности электродов по мере течения электролиза меняться не будет, явление П. г. здесь может иметь место вследствие изменения концентрации раствора у электродов; действительно по мере хода электролиза ионы меди будут разряжаться у катода и образовываться у анода; концентрация ионов у катода будет возрастать, у анода уменьшаться; если при начале электролиза концентрация в любых местах электролита была одинакова, то во время электролиза вследствие названных выше процессов, которые не м. б. компенсированы полностью ни диффузией ни переносом ионов током, т. к. эти процессы идут слишком медленно, между солями раствора, прилегающими к электродам, создается разность концентраций. Эта разность концентраций обусловит возникновение некоторой эдс (смотрите Элемент концентрационный), направление которой будет опять противоположно направлению тока в цепи. Этот вид П. г. носит название концентрационной, обычно его определяют как разницу в значении потенциала электрода, рассчитанного для существующей в растворе суммарной концентрации ионов и наблюденным его значением при электролизе, обусловленную изменениями концентрации ионов в слоях раствора, прилегающих к электродам.
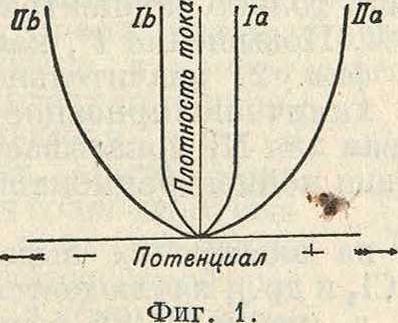
Если подвергнуть раствор, через к-рый идет ток, интенсивному перемешиванию с целью устранения разности концентраций, то величина П. г. уменьшится; устранить же ее совершенно все же не представляется возможным, т. к. даже при самом сильном перемешивании в непосредственной близости от электродов будет находиться покою-щийся тонкий слой, концентрация ионов в к-ром будет отличаться от общей концентрации ионов в растворе. Повышение ί°, вызывающее повышение скорости диффузии и скорости переноса ионов током, также способствует уменьшению концентрационной П. г. Величина последней очевидно будет тем больше, чем больше плотность тока, ниже ί°; меньше концентрация ионов в растворе и слабее перемешивание. Т. к. изменение концентрации сказывается лишь сравнительно незначительно на величине электродного потенциала (изменение концентрации в 10 раз вызывает изменение потенциала всего лишь на 0,058 V в случае одновалентного металла и на 0,029 V в случае двухвалентного при 18°), то величина эдс П. г. в этом случае обычно не велика. Графически явление П. г. представляют кривой зависимости электродного потенциала от плотности тока. На фигуре 1 кривые 1а и 1Ь показывают соответственно изменение потенциала анода и катода при электролизе с различной плотностью тока. Начало координат соответствует значению электродного потенциала, рассчитанного по формуле Нёрнста равновесия). Фигура 1 показывает, что значительное изменение плотности тока вызывает в этом случае только незначительное изменение потенциала электрода (кривая идет резко вверх). В нек-рых случаях, особенно при электролизе комплексных солей, наблюдаются ненормально отлогие кривые, выражающие зависимость электродного потенциала от плотности тока (кривые На и НЬ на фигуре 1). Такой ход кривой не м. б.- объяснен только простым изменением концентрации ионов у электродов; для его объяснения допускают, что течение нек-рых процессов у электрода происходит не с бесконечно большой, а с конечной скоростью; например если имеет место процесс разрежения ионов ме-
Таблица 1, — Значение упругости разложения нормальных растворов в V.
| ZnSOi | 2,35 | Pb(N03)2 | 1,52 | COSO4 | 1,92 | u2so4 | 1,67 |
| ZnBr2 | 1,8 | AgN03 | 0,7 | CoC 12 | 1,78 | HN03 | 1,69 |
| NiSOj | 2,04 | Cd(N03)2 | 1,98 | NaOH | 1,69 | H3P04 | 1,7 |
| NiCl2 | 1,85 | CdS04 | 2,03 | KOH | 1,67 | HC1 | 1,31 |
| CdCl2 | 1,88 | NH4OH | 1,74 | HBr | 0,94 |
(т. н. потенциал
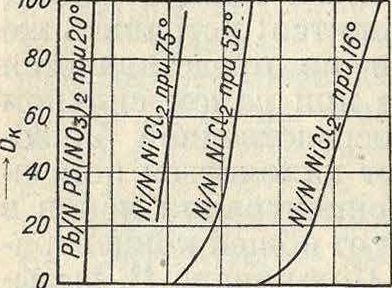
талла с выделением его в свободном виде на катоде, то этот процесс можно разбить на две стадии: сначала ионы отдают свой заряд с выделением металла, затем равновесие в электролите, нарушенное разрежением ионов, снова восстанавливается благодаря диссоциации комплексных ионов или иногда просто нейтральных молекул (например ШС12> Ni“ + 2C1); если скорость диссоциации гораздо меньше, чем скорость разрежения ионов, то это ведет к понижению концентрации ионов у электрода и имеет своим следствием явление П. г. Этот вид П. г., обусловленный медленным течением электродных процессов, носит название химической поляризации; она отличается от концентрационной тем, что ее величина не зависит от скорости перемешивания раствора. На фигуре 2 представлены кривые «плотность тока—потенциал» для осаждения свинца из слабо подкисленного -oj 02 0.3 ОА 0.5 as -ojv азотной к-той нор-£h мального раствора
фиг 2. Pb(N03)2 и никеля из нормального ра-створаШС12, подкисленного полупроцентной борной к-той. Кривая для свинца круто идет вверх, очень мало отклоняясь при повышении плотности тока от потенциала равновесия свинца, представляя собою типичную кривую концентрационной поляризации (на фигура 2: абсцисса sh—потенциал осаждения в У, отсчитанный относительно нормального водородного электрода; ордината Dk—плотность тока в А-10_10/сл»2).
Совершенно иную картину дает ход той же кривой для никеля. Здесь имеет место сильно растущая с плотностью тока П. г., которая тем больше,чем ниже F. Никель представляет собою типичный металл, осаждение которого даже из раствора простых солей (хлорид, сульфат) сопровождается сильной химич. поляризацией; то же наблюдается у Fe и Со; другие металлы, как Си, Ag, Zn, Cd, обнаруживают значительную химич. поляризацию только при электролизе их комплексных (например цианистых) соединений. Осаждение нек-рых металлов, как например РЬ, сопровождается обычно только концентрационной поляризацией. Повышение t°, как было уже видно из фигура 2, значительно уменьшает величину химич. поляризации. Напр. при Р 75° кривая для Ni показывает почти полное отсутствие концентрационной поляризации.
В случаях, когда на электродах выделяются газы (Н2, 02, С12 и др.), наблюдается своеобразный вид П. г., не могущий быть объясненным описанными видами ее, так как величина возникающей в этом случае электродвижущей силы П. г. зависит от материала электрода, на к-ром выделяется газ. Это явление носит название перенапряжения, под величиной которого обычно понимают разницу между потенциалом равновесия данного газового электрода и тем потенциалом, к-рый необходим для выделения этого газа на электроде из данного металла. Наибольшее практич. значение имеют величины перенапряжения для кислорода и. водорода, значение которых (в V) приведено в таблице 2.
Таблица 2.—В еличины перенапряжения для кислорода и водорода.
| Материал электрода | Перенапряжение | ||
| водород в 2 N
H2S04 *ι |
кислород Bi/jJV КОН *ι | *2 | |
| Платинированная | |||
| платина. | 0,00 | 0,23 | 0,005 |
| Pci.. | -0,26 | 0,42 | 0,46 |
| Au.. | 0,05 | 0,52 | 0,02 |
| Ag.. | 0,07 | 0,40 | 0,15 |
| Си.. | 0,19 | 0,25 | 0,23 |
| Ni.. | 0,14 | 0,12 | 0,21 |
| Pb .. | 0,36 | 0,30 | 0,64 |
| Hg.. | 0,44 | 0,78 | |
*ι Величина перенапряжения, определенная из упругости разложения. *2 Величина перенапряжения водорода, определенная по началу выделения пузырьков.
Для определения величины перенапряжения предложено несколько методов (начало-выделения пузырьков газа, конец выделения пузырьков, определение упругости разложения). Данные, даваемые различными методами, могут довольно сильно друг от друга отличаться. Перенапряжение быстро возрастает с повышением плотности тока, величина его достигает максимума обычно не сразу после включения тока, иногда с начала электролиза проходит несколько часов, в течение которых перенапряжение все увеличивается. Для данного металла перенапряжение зависит от характера его поверхности, чем более она шероховата, тем перенапряжение меньше. Повышение Г уменьшает перенапряжение.
Для объяснения явления перенапряжения предложено много теорий. Наиболее просто это явление м. б. объяснено тем, что полученные в результате электролиза газы в атомарном состоянии переходят в молекулярные не моментально, а с известной конечной скоростью; это имеет своим следствием нек-рое накопление у анода атомарного кислорода, а у катода—атомарного водорода; атомы газа, обладающие высокой реакционной способностью, могут реагировать с веществом электрода, образуя с ним соединения (гидриды на катоде и высшие окислы на аноде). Такого рода соединения, часто весьма не стойкие и не могущие быть изолированными, присутствуя на электродах, дают начало встречной эдс, обусловливая тем самым явление перенапряжения. Такой взгляд подтверждается тем, что в: нек-рых случаях, когда этого рода соединения являются стойкими, они м. б. непосредственно обнаружены, например перекись свинца на свинцовом аноде, сурьмянистый водород, содержащийся в заметных количествах в водороде, выделяющемся на сурьмяном катоде, и т. д. Если металл обладает способностью поглощать большие количества освобождающихся при электролизе атомов газа (например палладий водорода), то в этом случае при начале электролиза перенапряжение может иметь, как это видно из табл. 2, отрицательный знак, то есть прохождение тока начинается при более низком значении потенциала электрода, чем это соответствует по-
тенциалу равновесия, причем оно в начале не сопровождается выделением водорода. Последнее наступит только тогда, когда вследствие насыщения металла газом потенциал электрода достигнет по крайней мере своего равновесного значения.
П. г. наблюдается и в гальванических элементах (смотрите), в которых действием тока вызывается отложение газов на поверхности электродов. Благодаря такого рода П. г. эдс элементов непостоянна, то есть изменяется в зависимости от продолжительности непрерывного действия элемента; в силу этого постоянные элементы составляются обычно из двух жидкостей, чем достигается уничтожение выделения газов на электродах при прохождении тока. Явление П. г. имеет большое значение при технич. использовании электролиза. Т. к. наличие П. г. требует повышенного напряжения для осуществления электролиза, то в технике обычно стремятся ее уменьшить введением перемешивания или циркуляции электролита и в нек-рых случаях повышением ί° или введением т. н. деполяризаторов. НоП. г. в технике не есть только отрицательное явление, нек-рые технически важные процессы были бы немыслимы без П. г.; например с точки зрения теории эдс нельзя себе представить возможности выделения нек-рых металлов, стоящих выше водорода в ряду напряжений (смотрите Потенциал электродный) из водных растворов, т. к. при электролизе должен был бы выделяться сперва водород. Так например, потенциал цинка в нормальном растворе равен 0,76 V, а потенциал водорода даже в нейтральном растворе—0,405 V, следовательно при электролизе должен сперва разряжаться водород, но т. к. перенапряжение водорода на цинке велико, то цинк легко выделяется на растворе даже из кислых растворов, чем широко пользуются как при получении цинка и нек-рых других металлов из руд, так и при процессе электролитич. покрытия металлами (электролитич. цинкование, кадмирование, никелирование и т. д.) и при количественном определении металлов методом электролиза (электроанализ). П. г. лежит также в основе работы аккумуляторов (смотрите Аккумуляторы электрические). УстранениеП. г., или т. н. деполяризация, может производиться различными путями, например в элементах, где П. г. обусловлена обычно выделением водорода, вводят с этой целью окислители (перекись марганца в элементах Лекланше, двухромовокислый калий в элементах Грене и т. д.). Наоборот, анодную П. г., связанную с выделением кислорода, можно устранить добавлением восстановителей. Технически важное значение имеет деполяризация при катодном осаждении металлов, каковую можно представить себе след, обр.: как было уже установлено, П. г. при осаждении металлов сказывается в том, что потенциал осаждения металла является более отрицательным, чем его равновесный потенциал. С точки зрения ф-лы Нёрнста (смотрите Потенциал электродный) это можно представить себе, приписав электролитической упругости растворения све-жеосажденного металла бблыную величину, чем та, к-рую имеет металл при равновесии. Следовательно если понизить электролитич. упругость растворения металла, то осажде ния его можно достигнуть при более низком потенциале, чем это соответствует равновесию. Такого рода понижение упругости растворения имеет место тогда, когда металл, образует на катоде сплав. Электролитич. упругость растворения металла в сплаве тем меньше, чем ниже его концентрация в сплаве. Особенно сильное понижение электролитич. упругости растворения будет иметь, место тогда, когда металл катода вступает с осаждаемым металлом в химич. соединение. Классич. пример этого рода деполяризации имеет место при электролитич. получении щелочных металлов на ртутном катоде; хотя щелочные металлы обладают наивысшей из всех металлов электролитической упругостью растворения, их все же можно получить на ртутном катоде, подвергая электролизу водный раствор соли (например NaCl). Это объясняется следующими причинами: во-первых, в случае натрия металл дает со ртутью соединение NaHg6, в к-ром электролитич. упругость растворения натрия очень сильно понижена, во-вторых, водород имеет на ртутном катоде особо большую величину перенапряжения, что и облегчает выделение натрия. Этот процесс находит себе применение в технике при электролитич. получении щелочей. Деполяризация может иметь место и при электролизе раствора, содержащего соли нескольких металлов, например из растворов, содержащих наряду с железом или никелем цинк, можно· при осаждении железа или никеля получить сплав Fe-Zn или Ni-Zn, так как осаждение неблагородного цинка делается возможным благодаря образованию сплава при тех значениях потенциала, которые свойственны более благородным Fe и Ni. Аналогично объясняется технически важное осаждение цинка вместе с медью при электролизе, их комплексных (цианистых) солей, дающее возможность покрывать металлы электролитически латунью.
Лит.: Изгары шевН. А., Электрохимия и ее технич. применение, стр. 114—146, Л., 1929; Леблан М., Руководство по электрохимии, пер. с нем., стр. 342—396, М.—Л., 1930; Grub е GrundzUge der theoretischen und angewandten Elektrochemie,
2 Aufl., p. 102—207, Lpz., 1930; Eoerster F., Elektrochemie wasseriger Losungen, Handbuch d. angewandten physikaliscben Chemie, hrsg. v. G. Bredig, p. 275—482, Lpz., 1923. С. Плетенев.