 > Техника, страница 75 > Радикалы
> Техника, страница 75 > Радикалы
Радикалы
Радикалы, части молекул, переходящие при различных химич. реакциях как целое из одного соединения в другое. Простейшими Р. например являются одновалентные углеводородные остатки/метил СН3,этилС2Н5, фенил СеН5,нафтил С10Н7 ит.п. Понятие о Р., как о неизменяемой части молекулы, в свое время послужило основанием для создания теории строения органич. веществ—теории Р., — разделявшейся виднейшими учеными первой половины 19 века. По этой теории радикалам в строении органич. веществ отводилась роль, аналогичная роли элементов в построении минеральныхвеществ. Кажущаяся неизменяемость Р. вызвала многочисленные попытки получения свободных Р., то есть молекулярных остатков, могущих существовать не только в соединениях, но и самостоятельно. Такими свободными Р. одно время считали циан (Гей-Люссак), какодил (Бунзен), метил, этил, амил (валил) (Франк-ланд, Кольбе). В дальнейшем, главным образом после того как было доказано, что при реакциях, которыми пользовались исследователи, получались не Р., а их димеры [так, вместо CN и СН3 подучались (CN)2 и СН3 ·
• СН3], теория радикалов была отброшена. Явившаяся ей на смену теория строения (Гергардт, Кекуле, Бутлеров) стала рассматривать Р. лишь как символы, облегчающие понимание реакций между органич. веществами, но лишенные самостоятельного значения. Впоследствии однако оказалось, что постоянная четырехвалентность углерода—одно из основных требований класснч. теории строения—иногда не сохраняется и что при наличии известных структурных и других условий м. б. получены и выделены соединения типа т. н. свободных Р.
Свободные Р. Под свободными Р. обычно понимают соединения, в состав которых входят элементы, обладающие валентностью на единицу меньшей, чем это следует из их положения в периодич. системе. Все свободные Р. окрашены, обладают резко выраженной тенденцией к присоединению различных атомов или атомных групп и в конц. растворах или в чистом состоянии б. или м. полно (в зависимости от особенности строения) рекомбинируются в димерные формы.
Р.с трехвалентным углеродом. Триарил метил ы—соединения, отвечающие формуле R3C (R—арильные остатки), получающиеся действием раздробленных металлов (Ag, Си, Zn, Hg) на растворы триарил-хлорметанов в эфире или бензоле. Первый Р. с трехвалентным углеродом—трифенил-метил («тритил»)—получен в 1900 г. Ромбергом при помощи реакции:
(CeH6)3CCl+Ag=(CeH5)3C + AgCl.
В растворах трифенилметил существует наряду со своим димером—гексафенилэтаном: (СвН5)3С С(С6Н5)3 ΪΪ 2(СеН5)3С.
Нек-рые гексаарилметаны диссоциированы на Р. относительно слабо (например гексафе-нилэтан), у других степень диссоциации настолько велика, что даже в конц. растворах ее можно считать полной. Введение С6Н5- и N02-rpynnbi в арильные остатки обычно способствует увеличению степени диссоциации: например гексафенилэтан диссоциирован в бензоле лишь на 2%, дифенил-тетрафенилэтан (С6Н5)2 (С6Н4-С6Н5) C-C(CeH4-C6H5)(CeH5)2— уже на 15%; тетрабифенил -дифенилэтан (С6Н5) (C6H4-CeH5)2С-С (С6Н4.СсН5)2 (С6Н5)— на 80% и гексабифенилэтан (С6Н5-С6Н4)3С·
• С(С6Н4-С6Н6)3—на 100%.
Три(и-нитрофенил)метил, так же как и гексабифенилэтан, известен только в виде Р. Многократно фенилированные пропаны и бутаны при их получении распадаются на Р. с трехвалентным углеродом: октофенил-пропан и декафенилбутан полностью диссоциированы, первый—гна трифенилметил и пентафенилэтил, а второй—на пентафенил-этилы. Известны также соединения с трехвалентным углеродом, содержащие кратные связи; например Циглером были получены следующие Р.:
евн3с-с-с.н5
сн3ос6н4
СН30СсН4-С
(С0Н5)2С:СН
НС сн
С6НаС
CR3 ί: 2 R3C помимо природы радикалов R, связанных с эуа-новыми атомами углерода, зависит от природы растворителя, степени разбавления и t°. Наиболее характерные свойства соединений с трехвалентным углеродом—окрашенность и способность к присоединению кислорода, галоидов и щелочных металлов. При действии молекулярного кислорода на три-фенилметилы, последние превращаются в перекиси:
2(С6Н5)3С + 02=(С6Н5)3С-0-0-С(С6Н5)3. Продукт присоединения натрия к трифенил-метилу в пиридиновом растворе диссоциирован на ионы:
(C6H5)3CNa Ц (C6H5)3C+Na
К относительно устойчивым соединениям с трехвалентным углеродом относятся также металлокетилы, получающиеся при растворении одного эквивалента щелочного металла в эфирном растворе диарилкетона: (CeH5)2CO+Na=(C6H5)2CONa.
Металлокетилы — интенсивно окрашенные вещества, бурно реагирующие с кислородом. В отличие от этих относительно устойчивых Р. известны соединения с трехвалентным (а также меньшей валентности) углеродом, образующиеся при различных (га. обр. термического характера) реакциях, но существующие весьма ограниченное время. Недавно Панет (Paneth) показал, что тетраметил- и тетраэтилсвинец при нагревании до ί° красного каления распадаются на свободные Р.—метил или этил:
(СН3)4Рb=4СН3+РЬ.
Средняя продолжительность жизни (где г—время половинного распада) для метила равна 1,44-10~3 ск. Весьма вероятно также, что наряду со свободным гидроксилом ОН, как продуктом термического распада воды Н20 ίΉ+ΟΗ, при гор.ении углеводородов, например метана, образуются Р.:—СН3, =СН2, ξΟΗ,—СИС—.Изучение образования свободных Р. имеет весьма существенное значение для понимания механизма химич. реакций.
Р. с двухвалентным азотом были получены Виландом как продукты диссоциации тетраарилгидразинов. Так например, тетрафенилгидразин в органич. растворителях распадается следующим образом:
(ΟβΗ5)2Ν·Ν(ΟβΗ6)2 Ц 2(C6H5)2N.
Тетрафенилгидразин диссоциирован только частично. В отличие от гексаарилэтанов замена фенильных групп бифенильными не увеличивает диссоциации. Введение нитрогрупп полностью подавляет диссоциацию. Вместе с тем введение СН3 в о-положение, или лучше—метоксила СН30 или диметил-аминогруппы (CH3)2N в η-положение, вызывает почти полную диссоциацию.Гольдшмидтом было также показано, что фенилированные тетразоны распадаются на соединения с двухвалентным азотом—гид раз илы,
например
<CeH5)2N-N-C6Hs
(0,η5)2ν-ν·-ο6η5 *"
гексафенилтетразон
2(C6Hs)2N-N-C6Hs.
трифенилгицразил
В отличие от трифенилметилов или аналогичных им веществ соединения с двухвалентным азотом весьма устойчивы относительно кислорода; окись же азота они присоединяют, превращаясь при этом в бесцветные продукты R2N-NO.
Органич. соединения с четы-рехвалентным азотом (аналогично N02) были получены в виде соединения типа R2NO (R—арил).Их природа,как свободных Р., появляется в окраске и способности к присоединению других свободных Р., например о
(C6H5)2XO + C(C6H5)3=(C6H5)2NC(C,:H5)3. Устойчивость их весьма различна: в то время как дианизилазотокись (СН30-С6Н4)2 N0 устойчива в течение года, ди-и-толилазот-окись (CH3-C6H4)2NO может сохраняться без изменения только не более 3 час. К соединениям с четырехвалентным азотом относится также тетраэтиламмоний (C2H5)4N, об-
разевание которого при электролизе йодистого тетраэтиламмония весьма вероятно.
Р. с одновалентным кислородом в чистом состоянии выделены не были. По Гольдшмидту они образуются в результате диссоциации Перекисей типа:
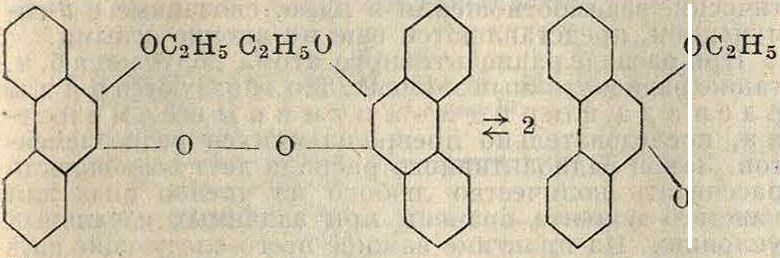
Растворы их интенсивно окрашены, присоединяют калий и трифенилметил.
Органич. производные других четырехвалентных элементов также обнаруживают способность к образованию свободных Р. Исключение составляют гексаарилдисила-ны R3Si—SiR3, не распадающиеся на свободные Р. Из гексаарилстананов фениль-ные производные не диссоциируют, тогда как гексатолилстанан (CH3-C6H4)3Sn · Sn-(СН3-С6Н4)3 обнаруживает частичную диссоциацию. В отличие от замещенных этапов гексациклогексилстаяан в разбавленных растворах полностью диссоциирован. Замещенные плумбаны RsPb · PbR3 также полностью диссоциированы на R3Pb, если R= =C6HU (циклогексил) или этил СаН5.
Лит.: Ш о р ы г и н Π. П., Успехи органич. химии, М.—Л., 1928, стр. 58: S m i d 1 i n J., Das Tri-phenylmethyl, Stg., 1914; Walden P., Chemie der freien K,aditale, Lpz., 1924; Ziegler, «Ztschr. i. angew. Chemie», Lpz., 1927, Jg. 43, p. 915; P a n e t h F. u. Hofeditz W., Ober die Darstellung von freien Methyl, «В», 1921, В. 62, p. 1335; P a n e t h F. u. L a u t s c h W., Ober die Darstellung d. freien Aethyls, «Naturwissenschaften», B., 1930, Jg. 18, p. 307; «B», 1931, B. 64, p. 2702, 2708. С. Медведга.