 > Техника, страница 79 > Свободная энергия
> Техника, страница 79 > Свободная энергия
Свободная энергия
Свободная энергия, часть внутренней энергии тела или системы тел, целиком превращающаяся в работу при изотермических обратимых процессах. С. э. является термодинамич. ф-ией F состояния системы, вид которой легко определяется из общего выражения 1-го и 2-го начал термодинамики (смотрите):
TdS^dU + dA (dA=p dv).
Для изотермич. процессов: Т — Const и
dA — pdv^ — dFT, F — U — TS=(v, T),
e.
dF
dv P’
fT =S и U=F-Tf?, U=F+TS
(ур-ие Гиббса-Гельмгольца). Физич. смысл понятий С. э. и связанная энергия G=TS был дан Гельмгольцем (1881 г.). С. э. как наиболее простой вид термодинамич. потенциала, определяющего равновесие и условия возможности (необратимости) процессов при Т—=Const, V=Const, dFT=0, dFT < 0, была введена Массье (1869 г.) и затем подробно рассмотрена Дж. В. Гиббсом (1873—76 гг.) (смотрите Потенциал термодинамический). С. э. является внутренним изотермич. потенциалом и определяет условия равновесия любой сложной системы при Т=Const ур-ием dF=0. Из условия возможности процессов в такой системе dF < 0 следует, что устойчивому равновесию отвечает минимум С. э.:
->о.
^=т1п- 1г = 0<
дх2
В обратимых изотермических процессах внешняя работа, совершаемая системой, в точности равна убыли С. э.:
dAm — — dFT.
Эта работа—наибольшая и называется максимальной работой dAm. При любом другом процессе перехода системы между двумя данными состояниями—начальным 1 и конечным 2, то есть при любом неизотермическом или необратимом процессе, работа Ап всегда меньше А,п.
Аи < Am=— (F„ — Ft)T.
С. э. любого тела м. б. представлена в виде
F(T, v)=F0 + y>(T)—$p dv.
τ
Зная вид этой ф-ии, можно найти уравнение состояния, т. к.
, т 9F
• Ρ=ψ{ν, Г)=— g^-.
Для идеального газа находим:
F (Т, V)=F0 + с,Т (1 - In Т) — RT In v.
По 3-му началу термодинамики — тепловому принципу Нернета—для конденсированных систем, то есть систем, состояние которых практически определяется одной лишь Т, постоянная интегрирования F0—начальное значение F при абсолютном нуле—равна U„ и
(°-*)=(™).= 0 дт>« Var/o
С. э. или максимальной работой обратимой химической реакции
паа 4- пф +. + пА А + пвВ.
называется изменение С. э. (или вообще термодинамич. потенциала) при этой реакции:
Ап=—&F=1ηαμα — ^ηΑμΑ.
Здесь μ — химич. потенциал данного реагента (i“a=т· е- прирост С. э. системы при увеличении числа молей данного реагента m на 1 без изменения концентрации. При вычислении Ат условно полагают концентрации всех реагентов равными единице. Если при этом Ат > 0, реакция пойдет при Т=Const и»=Const слева направо; при Ат < 0 произойдет обратное. Когда при этом все концентрации, изменившись, достигнут равновесных значений, то удовлетворится условие динамич. равновесия при химич. реакциях Ат=0 (смотрите Равновесие химическое).
Строго говоря, поверхностный слой каждого тела обладает иным запасом С. э., нежели соответствующая часть того же тела, взятая внутри его объёма, что обусловлено особым состоянием молекул у поверхности раздела, вследствие различия в интенсивности молекулярных сил в обеих граничащих фазах (смотрите Поверхностное натяжение, Полярность). Избыток С. э., приходящийся на 1 см2 поверхности раздела двух фаз, называется удельной свободной поверхностной энергией σ12, или поверхностным натяжением данного пограничного слоя. Поэтому вообще для всякой двухфазной системы имеем не F=F-l+F^, a F=F^Fa+Fla, где Flz== а 12 · S (Дюгем, Гиббс). Для двухфазных систем с сильно развитой поверхностью раздела (дисперсных систем, например эмульсий, туманов и др.) дополнительный член σ12 · S м. б. весьма велик, чем и определяются их особые свойства (смотрите Эмульсии, Капиллярные явления). Если, в случае многокомпонентной системы, состав пограничного слоя отличается от состава прилегающих объёмных частей фаз, то
F12=σ12 · S + prS
при этом сгущение или адсорбция (смотрите) Г=ms —m.v мол/с.м2 будет иметь место для тех компонентов, которые своим нахождением в пограничном слое понижают избыток С. э., то есть понижают пг2. Адсорбция Г связана с вызываемым ей понижением поверхностного натяжения ур-ием Гиб-
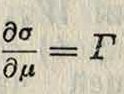
или для малых концентраций
μ=ΠΤ Ыс + р0, 1~Г(е,Т).
являющимся основным законом теории а д-сорбционных явлений. См. Свободная поверхностная энергия.
Лит.: Планк М., Термодинамика, Л.—М., 1925; Брандт А. А., Основания термодинамики, 4 изд., ч. 1—2, М.—11., 1923; Богуславский С. А., Основания молекулярной физики и применение статистики к вычислению термод. потенциалов, «Научные известия», Физика, сборн. 3, М., 1922, стр. 1—93; Вознесенский С. А. и Ребиндер П. А., Руководство к лабораторным работам по физич. химии, М.—Л., 1928; Lewis G. a. Randall М., Thermodynamics a. the Free Energy of Chemical Substances, N. Y., 1923; Gibbs J. W., «Scientific Papers», London, 1906; D u h e m P., Traite d’Energ№que ou de thermodynamique g6n6rale, t. 1—2, Paris, 1911; M a s s i e u, «CR», 1869, t. 69, p. 858, 1057; «Le journal de physique et de radium», Paris, 1877, t. 6, p. 216; Helmholtz H-, Abhandlungen zur Thermody-namik, Ostwalds Klassiker d. exakten Wissenschaft, 142, Lpz., 1921. П. Ребиндер.