 > Техника, страница 79 > Сера
> Техника, страница 79 > Сера
Сера
Сера, S, химич. элемент VI группы периодической системы, порядковый номер 16, ат. в.
32,06, ат. объём 15,5. С. — один из немногих элементов, известных еще в глубокой древности.
Физические свойства С. Самородная С.—характерного желтого цвета, приобретающего, в зависимости от примесей, оттенки красный, зеленый или коричневый. С. (как и селен) существует в виде ряда аллотропии, модификаций во всех физич. состояниях: в твердом (кристаллическом) виде, в расплавленном и в парообразном. В определенных условиях С. может быть получена в аморфных модификациях, а также легко образует коллоидно-дисперсные системы. Ромбическая модификация (октаэдрич. С., к которой относится почти вся С., встречающаяся в природе) образует кристаллы ромбич. системы, уд. в 2,0788 при 0°; тв. по Мосу 1—2. Средний коэфициент расширения 0,5995 · 10 4; уд. теплоемкость (0,95°) 0,1751 см/г атомная теплоемкость 5,95; 4°пл. 114,5°; теплота плавления (при 100°) 14,9 Cal; непроводник электричества; при трении электризуется отрицательно.
Моноклиничеекая модификация (приз-матич. С., S3) не стабильна при обычной (° и постепенно переходит в ромбическую (S „). Поэтому в природе моно-клинич. С. встречается редко. Мопоклинич. С. образуется при расплавлении С. и быстром ее охлаждении, при возгонке С. и при переходе аморфной С. в ромбическую (очевидно как промежуточная стуиенъ). Физич. константы этой нестойкой модификации определены менее точно, чем S„. Твердость ββ несколько больше, чем у S„; уд. в 1,95; уд. теплоемкость (2—43,4°) 0,1794; Г„л_ 119,2°;
скрытая теплота плавления 10,4 Cal. Обе модификации энангиотропны и переходят одна в другую (S„ S3). Су ществует при определенном давлении определенная 1°, выше которой существует ββ-φορΜα, а ниже—S „-форма, переход из первой формы во вторую и обратно постигается например простым изменением 1° при постоянном давлении. При быстром понижении Р мопоклинич. С. может быть сохранена п при низких Р в переохлажденном состоянии. Наблюдаются случаи и перегретого состояния. Теплота превращения S„^=2,4 cal (на 1 г С. при 0°). Известен также ряд других модификаций С., б. ч. нестойких, переходящих при низкой 1° в ромбическую, а при высокой Р в моноклинич. модификацию; так, известна вторая моно-клинич. модификация Sn, образующая бесцветные прозрачные листочки или пяти-шестисторонние таблички. Кристаллы обладают двойным лучепреломлением и сильно ирризируют. Уд. в меньше, чем у ромбич. модификации. Для получения этой модификации растворяют С. в насыщенном овом растворе сернистого аммония и оставляют на воздухе. Появление Зп-модификации легко и. 0. обнаружено по перламутровому блеску кристаллов, которые нестойки и легко переходят в S„. Имеются также указания на существование триклинич. и ромбоэдрич. модификаций С.; последняя получается в виде мелких прозрачных кристаллов при обработке тиосерной (серноватистой) кислоты хлороформом и испарении последнего; уд. в модификации равен 2,135.
При нагревании С. плавится, становится жидкой и светлой. Около 160—170° плав загустевает и темнеет. При более высокой Р плав становится темнокоричневым и до 200—250° густеет. При дальнейшем повышении 1° плав снова становится жидким. Если вылить в холодную воду
I расплавленную С. с Р 120—140°, она застывает в виде ломких кусков; вылитая же при 1° ок. 200° (и вообще вяз-I кая С.) в холодной воде образует пластичную массу, называемую пластичнойС. Этот вид С. содержит некоторое количество аморфной модификации, не растворимой в CSa и других растворителях. В зависимости от Р выливаемой С. и присутствия в пейпостороннпх веществ, особенно иода, количество аморфной С. сильно меняется. В настоящее время обычно принимают, что расплавленная С. содержит две модификации—кристаллическую Sx и аморфную, нерастворимую S^, причем S), ~ S^— равновесная реакция, для протекания которой слева направо благоприятно повышение р и действие химически активного света (дуговая лампа), что удается обнаружить по понижению Рзатв или по выделению аморфной С. из освещенных растворов. Уд. в расплавленной С. при 120°—1,81, при 133°—1,86, при 302°—1,70. Коэф. расширения при 115°—557-10-0, при 150°—380-10-6, при 170°—210-10~о, при 190°·—262-10—в, при 212°—320-10 — 6. Максимальная вязкость при 200°; уд. теплоемкость (119—146°) 0,2346; уд. электрич. сопротивление (при 130°) 2-10Ю. А м о р ф-н а я С. Sy, получается при обработке пластич. серы CS»; S х растворяется и в нерастворимом остатке остается гл-обр. S,j_. Возможно, что при всяком осаждении С. в водном растворе сначала образуется S^, которая постепенно переходит в S>. Обычно осаждению предшествует образование коллоидной С. Присутствие к-т и галоидов каталитически препятствует образованию S из S^,; аммиак и щелочи ускоряют этот переход. При освещении растворов ультрафиолетовым светом происходит образование аморфной формы (S? гг S^J; так, раствор С. в CS2 в этих условиях мутнеет с образованием S^. Твердую S^, в отсутствии Sx получить и сохранять крайне трудно, поэтому большинство констант относится собственно к смеси обеих модификаций, как и в случае пластич. С. Уд. в при комнатной Р 1,88. Коэф. расширения определен очень ненадежно вследствие перехода в SA или в Sa при более высокой Р. Парообразная С. Плотность паров С. при (°, близких к (°пл (144°), 6,5—6,6, то есть молекулярная формула С.—Se; при Р, близкой к 1 000°, существуют лишь молекулы S2; т. о. при нагревании паров С. происходит диссоциация ее молекул. Выше 1 000 молекулы состоят из двух атомов; так, при 1 500° D =2,17, при 1 719° D=2,19. В интервале 1 240—2 020“ мол. в С. соответствует формуле Si,7. Т. о. с повышением 1° молекулярный состав С. падает от Sx до Si 3, причем соответственно меняется цвет паров; светлые при Рущп. пары С. постепенно желтеют и ок. 500° становятся темнокрасными, затем ок. 650° светлеют вновь.
Теплопроводность ромбической серы при 0° 0,0007 cal/смск.; f пл. 112,8°; 4°кчп. 445,5°. Упругость паров (при 0°) 0,15 10"4. Теплота возгонки (при 150°) 18 500 са1/г-атом, при fram. 15150 са1/г-атом. Sa сильно преломляет свет. При20° Нα= 1,9579;=2,0377; пу=2,2452 (для линии D). Электропроводность С. ничтожна, порядка 10-1вмо, для расплавленной С. порядка 10*12мо при 115° и 10‘8мо при 430°, то есть растет с 4°. Диэлектрич. постоянная (для λ=оо) е<х=3,811,=3,97,εγ=4,773; т. о. соотноше ние Максвелла ε=п2 для Set справедливо. С. сильно диамагнитна. Магнитная проницаемость κ=0,8 · 10~6 (по сравнению с воздухом). Растворимость С. в воде незначительна (практически нерастворима). Из других растворителей .С. (ее ромбич. модификации) следует отметить CS2, бензол и ; СС14 и тетрахлорэтан при комнатной t° дают 1%-ные растворы С. Мол. в растворенной С. в различных растворителях по криоскопия, и эбулиоскопич. данным колеблется в пределах 240—292, что соответствует формуле S6—S9, чаще всего S8.
Химические свойства С. Известны три изотопа С. с ат. в 32, 33 и 34. Химич. свойства С. определяются ее атомным номером (16), то есть наличием шестивалентных электронов во внешней оболочке атома и в соответствии с этим положением С. в VI группе периодич. системы. Т. о. в соответствии с правилом Абегга и Кос· селя С. образует соединения с главным валентным числом 6 по кислороду и 2 по водороду.
Главное координационное число С. по Вернеру равно 6 (SF„). Для кислородных к-т С. и их солей главное координационное число равно четырем Н2[0° S0°], Благодаря заметно выраженным амфотерным свойствам С. она легко окисляется и довольно легко восстанавливается, давая устойчивые кислородные и сравнительно (но менее) устойчивые водородные соединения. С кислородом С. образует несколько соединений, с водородом за счет главной валентности только одно соединение — сероводород (смотрите); остальные обязаны своим образованием проявлению сил побочной валентности и все одного типа—полисульфиды. Темп-pa, при которой С. реагирует с молекулярным водородом, сравнительно высока (400—450°); с атомным водородом С. реагирует при комнатной t°. Координационное строение полисульфидных кислот Ha[SSn] и общая формула H2Sm, где ms3. В комплексах с ами по нек-рым данным m равно 6 и даже 8. С кислородом (за счет главной валентности) С. образует ряд соединений (S02, S03 и возможно S203), кроме того свыше десятка соединений более сложного химич. состава, разного строения и разных свойств. Сюда относятся, кроме сернистой и серной к-т, кислоты с ф-лами H2S02(?), H2SOs, H2S206, политионовые к-ты, тиосерная к-та и ряд других соединений (смотрите Серы соединения). Как и с водородом, с кислородом С. соединяется также лишь при нагревании, причем загорается и на воздухе. Темп-pa воспламенения С. на воздухе ок. 260°; пламя горящей С. имеет синеватый цвет. При горении в обычных условиях С. образует гл. обр. сернистый ангидрид S02. С галоидами С. соединяется при низких 1° (до 100°); исключение составляет иод, с которым С. повицимому не дает соединений. С углеродом С. соединяется при г° 900—950°, образуя CS2.C селеном и теллуром С. образует сплавы, с кремнием и фосфором — сульфиды. Бор, сурьма, висмут и почти все металлы дают сульфиды. Теплота образования металлич. сульфидов обычно довольно велика. Не получены непосредственным взаимодействием с С. лишь соединения с J, N, Au, Pt (?) (в нек-рых случаях косвенным путем такие соединения м. б. получены, например сернистый азот N4S4). С конц. серной к-той С. реагирует при t° ок. 300° с образованием S02:
2H2S04 + S=2H20 + 3S02.
Азотная к-та окисляет С. до S02:
2HN03 + S=H20 + N203 + S02.
Соляная к-та на С. не действует. Иодистоводо-родная к-та и газообразный HJ восстанавливают твердую С. при повышенной г°:
S(me.) + = H2S + 2J (me.)!
реакция эта обратима, причем при высоких t° (с газообразным HJ) и в сильно концентрированных растворах HJ реакция идет слева направо; при больших же разбавлениях равновесие смещается справа налево. С02 при г° ок. 400° и выше окисляет С., причем образуется ряд продуктов: COS, S02, СО, CS2 и др. Вода при высоких г° реагирует с С.:
3S+2H20=S02+2H2S.
При кипячении С. с водой, если и наблюдается химическое действие, то его следует приписать гл. обр. действию щелочей, экстрагируемых водой из стекла. Со щелочами С. реагирует с образованием гипосульфита и сульфгидрата: 4Ka0H+4S=Na2S203+2NaSH + H20.
С растворенным Na2S С. образует полисульфиды типа Na2[SSn ], где п=4 или 5; в смеси с бер толетовой солью С. ает от удара и трения; с углем и селитрой образует черный ; свойства иона С. см. Сероводород. в Ормонт.
Распространение С. в природе. С. в природе встречается в виде самородной и химически связанной С. в виде 1) сульфидных руд: а) железа FeS2 (колчедан); б) цветных металлов: Cu2S(медный блеск), ZnS (цинковая обманка), HgS (киноварь), Ag2S (серебряный блеск), As2S2 (реальгар), As2S3 (аурипигмент), CuFeS2 (халькопирит) и т. д. 2) В виде природных сульфатов металлов первых трех групп периодической системы: гипс CaS04 · 2Н20, ангидрит CaS04, глауберова соль (мирабилит) Na2S04 · 10Н2О, глауберит Na2S04 CaS04, англезит PbS04, тяжелый шпат BaS04, алунит K2A16(0H)12(S04)4 и др. 3) В виде С., входящей в состав каменного угля или сопутствующей ему в виде пирита. 4) С. битуминовых сланцев.
С., содержащаяся в нефтях в форме органич. соединении, в минеральных источниках, а также в растениях и в составе животных организмов (белок, волосы, ногти, кровь), промышленного значения пе имеет. Значение перечисленных основных групп серных ресурсов в составе доступной человеку зоны земной коры различно, что объясняется самой их генетикой. Поскольку в земной коре имеется зона сульфидов, залегающих непосредственно под зоной окисленных горных пород и минералов, за этой группой остается доминирующее значение; однако выходы сульфидов на земную поверхность ограничены. Наиболее распространены в поверхностных частях земной коры сульфаты.
Все месторождения самородной С. можно разбить на следующие группы: 1) месторождения, связанные с выпадением С. из минеральных источников (не имеющие промышленного значения); 2) месторождения, связанные с осадками той или иной системы, с изверженными породами или поствулканич. деятельностью; к этой группе относится главная масса месторождений, имеющих промышленное значение;
3) месторождения, связанные с распадом колчеданов. Самородная С. образуется б. ч. в результате восстановления сульфатов, причем для ее образования необходимо сочетание целого ряда специфических условий, как то: климат, наличие природных минеральных восстановителей или бактерий и т. д. Почти вся мировая серная промсть базируется на самородной С.
Самородная С. встречается в виде гнезд или в мелкодисперсном виде в мергелях, известняке, гипсе, глине и других породах. Главнейшие мировые месторождения самородной С. находятся в Луизиане и Тексасе (США), а также в Сицилии и на материке Италии. Запасы этих месторождений исчисляются десятками млн. т, при среднем содержании С. в руде 20—40%.
Небольшие залежи С. встречаются в Европе — Гредин, Польша (у Кракова), Испания, Германия (Шлпесен), Франция, Исландия; в Америке—Чили, Перу, Аргентина, Виргиния, Малые Антильские о-ва; в Азии—Япония (о-ва Хоккайде, Киушиу, Хонди), Ява, Турция, Месопотамия, Белуджистан; в Африке—Египет, Тунис, ю.-з. Африка, Австралия, Новая Зеландия, нек-рые острова Новой Каледонии. Из всех перечисленных месторождений С. международное значение имеют лишь залежи США и Италии. Месторождения С. в СССР до настоящего времени еще недостаточно разведаны. Наиболее разведанными являются нек-рые месторождения Ср. Азии. Наиболее богатые и мощные месторождения находятся на окраинах СССР. По последним геологоразведочным данным Представляет значительный интерес Алексеевское месторождение, расположенное в Самарско-Кинельском районе. Нек-рое значение для местной пром-сти могут иметь месторождения Южноуральской группы (например Васкунчак-ское). Из месторождений Крыма небольшое промышленное значение имеет Чекур-Кояшское месторогндение близ города Керчи. В с.-в. части Дагестана с начала 19 в известна Аварская группа, состоящая из шести месторождений, довольно близко расположенных друг к другу. Около г. Махач-Кала расположена Петровская группа месторождений. Серные месторождения Грузии промышленного интереса не представляют. Из месторождений Армении можно отметить Гемюрекое месторождение, расположенное близ города Нахичевани. С. залегает гнездами в мергелях; процентное содержание С. в руде доходит до 40. Неразведанные месторождения С. имеются в Забайкалья (Нерчин-екий округ), б. Иркутской губернии, Алтае, Кузбассе и на Камчатке. Весьма значительное количество серных месторождений (ок. 30) имеется в среднеазиатских республиках—на месторождениях Шор-су (Коканд), Кара-кум. С. встречается там гл. образом в мергелях, известняках и конгломератной руде (галька, сцементированная сера). Среднее содержание. С. в руде 20%. Запасы С. определяются в несколько сотен тысяч т. В настоящее время месторождение Шор-су промышленно эксплоатируется. Каракумское месторождение расположено в Каракумской пустыпе в 226 км от г. Ашхабада; С. находится в сцементированном ей песчанике и гипсе; содержание ее колеблется от 25 до 80%. Несмотря на большие трудности Каракумское месторождение промышленно эксплоатируется. Гаурдагское месторождение, открытое в 1926 г., находится у Афганской границы. Запасы С. повидимому исчисляются ылн. т. С. залегает в плотных гипсах и известняках. Питьевой воды вблизи месторождения нет, минерализованная имеется. Чангыр-Ташское месторождение расположено в 11 км от ж. д., в 18 км от г. Джалал-абада. С. заключается в гипсах. Содержание С. в руде доходит до 30%.
Добычаипереработкасамород-н ы х серных руд. Существующие способы получения С. из самородных серных руд разбиваются на следующие технология. процессы:
1) выплавка из руды за счет сжигания части С.;
2) выплавка паром или перегретой водой под давлением (надземная или подземная); 3) выплавка или дистилляция при сжигании углеродистого топлива; 4) выплавка при помощи подземных пожаров; 5) экстракция растворителями (сероуглерод, керосин); 6) экстракция вы-сококипящими жидкостями (растворы солей: СаС!2, MgCl2, NaCl и др.); 7) механич. и аэрационное обогащение серных руд; 8) флотационное обогащение серных руд; 9) электростатич. обогащение серных руд. Наибольшее промышленное значение получили методы (1) и (2). Переработка самородных серных руд начала развиваться с 60-х гг. прошлого столетия в Италии. До этого времени переработка серных руд производилась кустарно — местным населением. Руду складывали в кучи, калькареллы, имевшие высоту 4 метров при 2,5 метров в диам., или вырывали плоскую яму в 10—20 сантиметров глубины, причем ее под шел наклонно к одной стороне, для стока выплавляемой С. Метод основан на том, что часть С. поджигают и за счет теплоты ее сгорания выплавляют другую часть С. Получающийся при выплавке S02 выпускают в воздух. С. плавится и выгорает только во внутренней части калькареллы, а внешняя служит как бы крышкой. Калькареллы складывались из 5—6 тонн руды; выход С. в калькареллах 30—40% от первоначально содержащейся в руде. В 60-х гг. прошлого века калькареллы стали заменять калькаронами (фигура 1),
сличаются от каль-только значительно большими размерами. Калькароны складывают вместимостью от 200 до 2 000 м3 руды. Кроме того у калька-рон выкладывают специальные основания, а также делают более совершенную покрышку d из обожженной рудной мелочи. Производительность калькароны значительно выше, чем калькареллы. При хорошем ведении процесса в калькаронах отношение расплавленной С. к сгоревшей 2:1. Зажигают калькарону через воздушные каналы е,
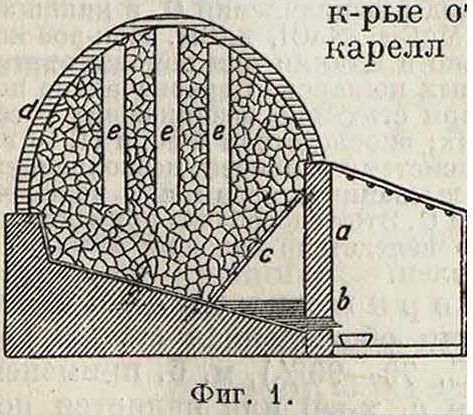
бросая горящие пучки соломы·, смоченные в С., в каналы; С. плавится, просачивается через колосник с через отверстие b в стенке а и выпускается в специальные формы емкостью 50— 60 килограмм. Выпуск С. начинается через месяц после розжига калькароны и производится 2—3 раза в сутки. Режим печи и нужную t° устанавливают посредством пробивания или замазывания отверстий в нижней части печи, а также утолщением или утоньшением покрышки. Т. к. горящая зона опускается сверху вниз, то С. плавится, не разогреваясь до слишком высокой ί° и сохраняя подвижность и светложелтый цвет; примеси в калькаронной сере остается 1—2%. Процесс идет очень медленно, от 11/2 до 3 мес., в зависимости от размера калькароны.
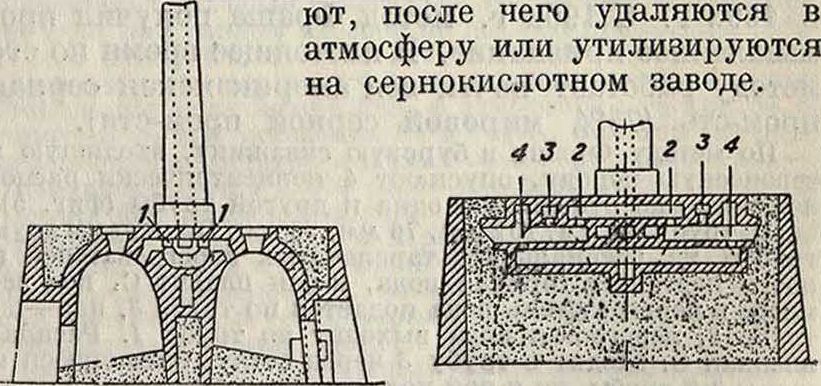
Более совершенным методом выплавки является применение многокамерных печей Жилля (современная 6-камерная печь: фигура 2 — план, фигура 3—разрез по камерам, фигура 4 — разрез по каналам).
Камеры складывают из кирпича и соединяют между собой системой специальных каналов 1, 2, 3, фигура 2.
4, по которым циркулирует воздух и горячие дымовые газы. Каждая камера вмещает 15—40 м3 руды. Разжигают печь забрасыванием пучков соломы в нагруженную до половины камеру или от отдельной топки, идущей на дровах или угле. Воздух входит в камеру, наполненную отработанной горячей пустой породой, и нагретым поступает в камеру плавления; горячие газы из камеры плавления проходят камеру, загруженную свежей рудой, к-рую подсушива-
Фигура 3. Фигура 4.
Одна из камер печи всегда находится под нагрузкой и выгрузкой. Пяти- и шестикамерные печи регулируют т. о., что плавление идет сразу в двух камерах. Расплавленная С. по наклонному полу камер стекает в специальные формы (как и из калькароны). Производительность 6-камерных печей исчисляется в 8 000— 9 000 тонн обработанной руды в год; количество примесей в С. не превышает 1 х/2—21/2%.
Выплавку С. из руды помощью пара предложил Жилль Джузеппе (1858). Его аппарат состоит из вертикального цилиндра из котельного железа с помещенной внутри аппарата сеткой, на которую загружается руда. В герметически закрытый аппарат под давлением 3—Зх/а atm (то есть при t° 125—140°) пускают пар. Разжижен-
.-TS.-.lsi.-jav.v· -
·β·. 4,.:.
: i: ·: г. _
ΤΓ ν · !
4 3
,
ная С. вместе с сконденсировавшейся водой собирается в нижней части цилиндра, откуда и выпускается. По выпуске С. выгружают отра-
N
1
N
ботанную породу. Опыты по выплавке” С. с помощью пара показали неблагоприятные результаты при значительном остатке С. в отработанной руде, доходившем до 10—12%. С. получалась нечистой, т. к. при выпуске смешивалась с пустой породой; наиболее благоприятные результаты получались при работе на гипсовых рудах. Несмотря на отрицательные результаты первых опытов по выплавке С. из руд паром было предложено громадное количество паровых аппара тов различных конструкций, которые можно классифицировать след, обр.: 1) вертикальные паровые аппараты, 2) горизонтальные паровые аппараты, 3) аппараты иного рода (вращающиеся и др.). Стоимость 1 тонна С., полученной паровым методом, определяется в 60—70 лир.
Громадный переворот в развитии серной промышленности произвел метод выплавки С. под давлением перегретой водой непосредственно под землей, предложенный америк. инж. Фрашем в 1892 г. С 1902 г. метод Фраша получил промышленное признание. В настоящее время по его методу работает почти вся американская серная промсть (75% мировой серной пром-сти).
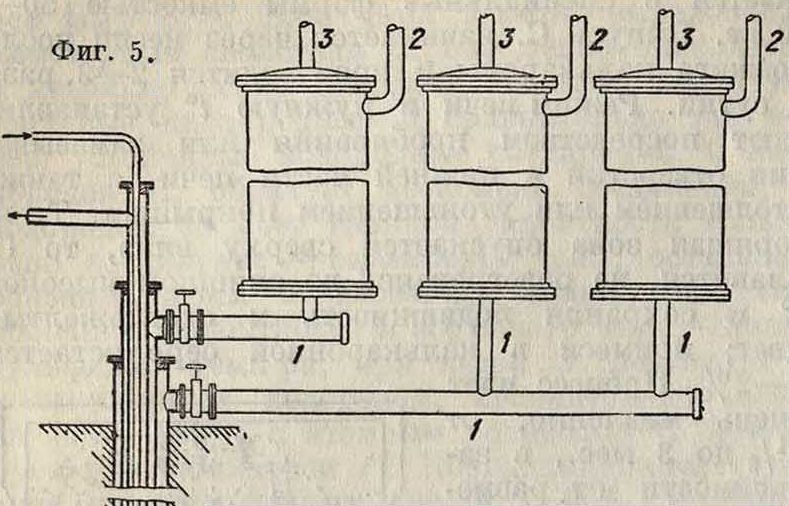
По методу Фраша в буровую скважину, входящую в серопосную породу, опускают 4 концентрически расположенные по отношению одна к другой трубы (фигура 5); диам. труб: 254 миллиметров, 152 миллиметров, 76 миллиметров, 25 миллиметров. По первым двум трубам из специальных тарельчатых перегревателей в почву поступает горячая вода, которая плавит С. под землей; в перегреватель вода подается по трубе з, пар—по трубе 2, перегретая вода выходит по трубе 1. Расплавленная С. входит в трубу 3 через сетку, имеющуюся в конце 3-й трубы, по которой под давлением воздуха, нагнетающегося через трубу 1, выбрасываете/ι на поверхность, где собирается в специальные большие дощатые разборные приемники, где и застывает огромными глыбами высотой в 18—20 метров и весом 80 000—120 000 тонн Такие глыбы разбиваются ом либо механически либо сжатым воздухом при помощи скважин, высверливаемых перфоратором. В последнее время выходящую из скважин С. пускают на стальные конвейерные леТиты, на которых происходит затвердевание С. Получаемая С. очень чиста (С. свыше 99,5 %). Метод Фраша требует большего количества воды и топлива (9 мл воды и 300—400 килограмм нефти на т С.). Несмотря на громадную производительность (в среднем каждая скважина выбрасывает 300 тонн С. в сутки) применение этого метода обусловливается наличием на серном месторождении достаточного количества воды и топлива. Кроме того само месторождение должно удовлетворять следующим требованиям: 1) достаточная глубина залегания серных пластов: 1504-300 м; 2) руда должен быть богатой— 504-70% S; 3) покрывающая порода должен быть достаточно устойчивой к подземному давлению, образуя купол, как бы естественную крышку громадного подземного автоклава. Скважины располагают на расстоянии 254-35 метров друг от друга; т. о. выработка месторождения достигает все-10 25%. Стоимость 1 тонна С. по методу Фраша 304-35 лир.
Применение перегретой воды для надземной переработки серных руд было начато в конце прошлого столетия инж. Паоло, Дечио и Патка-новым, которыми были сконструированы специальные автоклавы для переработки сыпучих руд. Видоизмененный инж. Волковым, этот метод применен на Каракумском месторождении и позднее на месторождении Шор-су. Т. о. в настоящее время месторождения СССР эксплоа-тируются только этим способом (Чекур-Кояш-ское месторождение эксплоатируется с помощью обогатительной фабрики, выпуская в качестве продукта не чистую С., а концентрат, содержащий 75% S). Аппарат инж. Волкова представляет собой вертикальный автоклав из котельного железа, выдерживающий давление до 6 atm. Через верхний люк автоклава загружаются руда и вода (в количестве 25% от веса руды), люк герметически закрывается, и в автоклав пускается острый пар, прогревающий всю массу до 150°. Выплавляющаяся С. собирается в нижней части автоклава, порода же в виде мелких частиц, смоченных водой, располагается в верхнем слое. Жидкая С. выпускается под давлением через патрубок, имеющийся в нижней части автоклава. После выпуска С. пар перепускается в следующий автоклав, давление снижается до атмосферного, а через люк внизу автоклава выбрасывается отработанная порода, смешанная с водой. Остаток С. в обработанной т. о. породе значителен (до 40—50% от первоначального содержания С. в руде).
Весьма интересным является момент полного использования С. в руде при замене С., сгорающей в печи Жил-ля, каким-либо иным топливом. Здесь можно отметит!, работы, идущие по трем направлениям: 1) перегонка С. в ретортах; 2) расплавление или дистилляция С. из руды в атмосфере горячих инертных газов, получаемых из генератора; 3) добавка к серной руде, поступающей в плавку, угля. Первый из указанных способов является наиболее старейшим, применявшимся в Италии в 60-х гг. прошлого столетия; реторты (доппионы) составляли батарею, обогреваемую одной печыо.
Ин-том прикладной минералогии (Москва) разработан процесс дистилляции С. из руды в шахтных или вращающихся печах горячим инертным газом, после чего охлажденная мелкодисперсная С. должна улавливаться в электрофильтре. Для месторождений, обладающих достаточными топливными ресурсами, применение данного метода может оказаться весьма рациональным. В Перу (IO. Америка) оказался пригодным метод ТЮо.ч’а. Руду, состоящую из смеси песка и С. (с содержанием С. до 48%), помещают в вагонетки и пропускают сквозь туннель, где циркулируют горячие газы. По превращении руды в кашеобразную массу ее центрифугируют (чугунная центрифуга); расплавленную С. собирают; остаток С. извлекают из руды обжигом в виде SO2. Применение искусственной шихты из серной руды и угля было сделано в специально сконструированных печах Руффо, Рибони Пьетро и др., но экономически ни один из предложенных способов себя не оправдал. Методы извлечения С. в экстракторах сероуглеродом не привились вследствие трудностей работы и имевших место несчастных случаев (пожары). Также не получают широкого распространения и экономически себя не оправдывают методы выплавления С. в кипящих растворах солей; СаС1г, MgCk, NaCl, ZnCh- Нек-рое количество С. было получено в Италии при помощи оригинального метода подземных пожаров. Первоначально получали С. в рудниках при стихийно возникавших в соседних рудниках пожарах; впоследствии Фиори (1910 год) предложил специальную систему галлерей, позволяющую управлять искусственно вызванным подземным пожаром в целях получения чистой С. Этот способ был применен на некоторых рудниках, но вследствие больших потерь С. в настоящее время оставлен.
Получение серных концентратов. Концентрат, или обогащенная серная руда (с содержанием С. 70—90%), м. б. применен как продукт (например в с. х-ве) или является полуфабрикатом для дальнейшего получения из него чистой С. по одному из вышеописанных методов. Концентраты получают механическим обогащением серных руд, флотационным и электростатическим методами. При механич. обогащении серных руд применяют грохоты раз-
личных систем, помол в шаровых мельницах с деревянными шарами (где сера истирается в порошок, а сопровождающаяся пустая порода остается в виде кусочков) и методы аэрационного отвеивания в специальных сортировочных трубах. Флотация (смотрите) серных руд производится в специальных ваннах в присутствии флотационных реагентов. Серная руда, подвергаемая процессу флотации, размалывается до 90—100 меш. В заграничной практике процесс флотации серных руд большого применения не имеет, в СССР имеются флотационные серные заводы (Чекур-Кояшский рудник — Крым и в Шор-су — Ср. Азия). Электростатический метод обогащения серных руд основан на различной электропроводности серы и других компонентов руды.
Получение С. из сульфидов. Для получения серы из сульфидов было предложено значительное количество различных способов, но промышленное осуществление получили только три: 1-й способ (Клаус-Ченса), выделение G. из сульфида кальция, впервые осуществлен в Англии; 2-й способ получения С., путем термин, выделения половины связанной С. из колчедана, осуществлен в Швеции; 3-й способ, разработанный в Ин-те прикладной минералогии проф. Юшкевичем, инж. Каржавиным и др., осуществлен на Урале. Этот способ основан на сжигании сульфида (применяется флотационный колчедан) в S02 в специальных печах, с последующим восстановлением S02 генераторным газом и углем до С. в присутствии катализатора (боксит):
I. S02+2C=2CO+S;
II. 2S02+3C=2S+2C0+C02;
III. S02-t-2C0=2C02-j-S.
Ин-том прикладной минералогии (проф. Юшкевичем) изучен состав обжиговых газов уральских медеплавильных з-дов с точки зрения извлечения из них С. и проработки методики регулирования состава газовой смеси в смысле предельного снижения CS2 и COS и обогащения смеси S02. В качестве катализатора при этих реакциях м. б. применены боксит (смесь Fe20, и A12Oj) и другие вещества, например FeS на пемзе и др. Вообще проблема получения С. из S02является для СССР одной из важнейших задач современной техники, особенно цветной металлургии; при неиспользовании отходящих металлургии. газов не только теряется огромное количество содержащейся в них С., но и отравляется местность вокруг заводов. Говард (W. Howard) запатентовал следующий метод: отходящие газы пропускаются через воду, в к-рую продувается воздух, а смесь S02 с воздухом восстанавливается раскаленным углем. Беннер и Томсон предложили метод получения С. из S02 восстановлением S02 генераторным газом, водородом и т. д. при ί° 300°; катализатором служит боксит. Интересно применение в качестве восстановителя водорода, метана, естественных газов и других восстановителей. Pensilvania manufakturia" ставила опыты по восстановлению S02 распыленным минеральным маслом в присутствии CaS по реакциям: 3S02+C2H4 3S + 2C02+2H20,
2CaS+3S02 -» 2CaS03+3S,
2CaS03+C2H4=2CaS+2C02+2H20.
Попытки получения G. из колчеданов путем их разложения оказались до сих пор экономически неудачными. Костеану предложил метод получения С. действием С03 на ZnS.
Метод Клаус-Ченса основан на обработке сульфида кальция CaS (к-рый получается как остаток в результате получения соды по Леблану) углекислотой и парами воды:
CaS-fC02+Н20=СаС0з+Н2§.
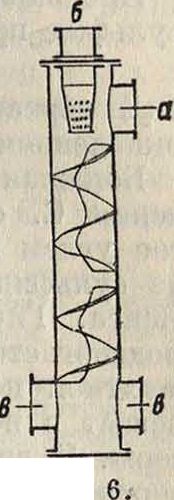
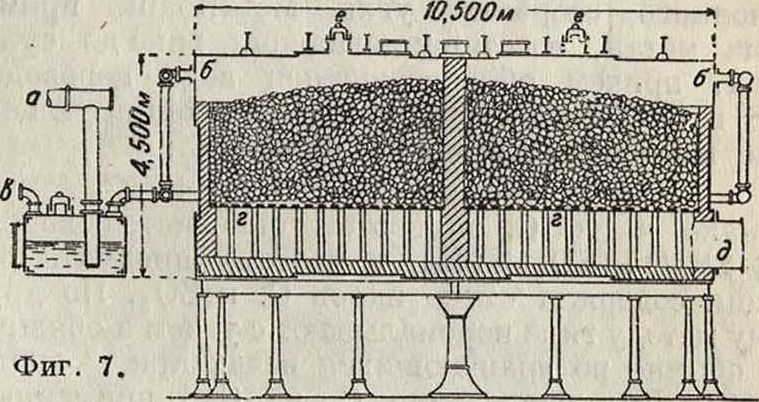
Газ, содержащий 35% H2S, смешивается с воздухом в специальных смесителях (фигура 6: H2S подают через трубу о, воздух вдувают через б, газы отводят через о) и сжигается на поверхности соответствующего катализатора в специальных печах [фигура 7: а — газопровод, б — впуск газов, в —· их выпуск, г — решетка для катализатора (боксит), д — отверстие для вывода газов, с — предохранительный клапан]; H2S окисляется до S:
2I-I2S+ 02=2H20 + 2S.
Катализатором служит окись железа, вельдоновский ил (смотрите Хлор) или, чаще всего, боксит. По этому способу получается весьма чистая фиг
С., но в отходящих газах вследствие реакции 3S+2H20=S02+2H2S теряется некоторое количество С. По другому способу H2S смешивают
с S02; в результате окислительно-восстановительной реакции сера выделяется в элементарном виде.
Действуя попеременно то водяным паром то восстановительным пламенем, Холл извлекал С. из пирита и других сульфидов. По другому способу Холл предварительно смешивал колчедан с известью. Но мнению автора расход угля при данном способе не должен превышать 10 % от веса руды. Разложение FeS2 на FeS и S производилось в муфелях в шахтных вращающихся печах. Фрелих (Frolich) вел разложение FeS2 в атмосфере С02 или N2 с примесью 02 для окисления Fe в Fe203. Вальтер вел разложение при недостатке воздуха в печи Герресгофа; Райт— в электропечи при (° 3 000°; Ныо Джерсей (New Jersey)—в муфелях без доступа воздуха; Урбаззн—в атмосфере генераторного газа; Хэниш и Шредер составляли шихту из колчедана и кокса и вели процесс в шахтных печах. Фирма «Agfa» для выделения С. из пирита применяет шахтные печи, прогреваемые генераторным газом. Уральский научно-исследовательский химии, институт для выделения С. из пирита (брикетированный флотанионпый колчедан) применяет шахтные печи; г. нижней части шахты происходит горение FeS, в верхней части идет отгонка первого атома S из загружаемого колчедана сернистым газом, к-рый используется на сернокислотном заводе или восстанавливается по описанным выше методам. Ин-том прикладной минералогии и Гос. ин-том проект, химич. аппаратуры (Москва) ведутся работы по выделению С. из флотационных колчеданов во вращающихся печах, причем отгонка первого атома производится за счет S02, выделяющегося при горении FeS и частично FeS2; S02 восстанавливается специально подводимым в печь генераторным газом. Ин-том прикладной минералогии ведутся также работы по выделению С. из углистого колчедана в шахтных и вращающихся печах, при ведении процесса аналогично генераторному (Креймер).
Получение G. из сульфатов. В наиболее распространенных сульфатах содержание серы определяется следующими цифрами: гипс 18 -г- 22%, ангидрит 22 -1- 25%, барит 11% и т. д. Для получения из сульфатов элементарной С. предложен ряд методов, которые по существу м. б. сведены к одной из основных двух схем.
Диссоциация сульфата идет при высокой f по реакциям:
R2SO4=R2O + SO3 (R—щелочный металл),
S03=S02 + 0.
Далее S02· восстанавливается углем, генера-торным газом и тому подобное. до С. (как описано выше при получении С. из сульфидов).
Предварительное восстановление сульфата в сульфид происходит по схеме:
R2S04-t-2C=R2S-f-2C02.
R2S переводится в сероводород с дальнейшим окислением в С.
Ббльшая часть предложенных методов получения С. основана на восстановлении сульфатов углем и другими восстановителями, причем из сульфидов С. выделяется по методу Клаус-Ченса. Гипс в смеси с горючим и воздухом подвергается восстановлению в нижней части шахтной печи, причем образовавшийся В02 успевает в верхней части печи восстановиться до серы. К гипсу задают добавки, способствующие переводу образующейся СаО в легкоплавкий шлак. Результаты работы по этому методу неудовлетворительны; причины кроются очевидно в малой скорости взаимодействия между S02и СО. Вместо генераторного газа и продуктов неполного сгорания угля Metal lbank применяла метан, восстанавливающий гипс до сульфида, причем образовавшаяся вода переводит CaS в СаО с выделением H2S, диссоциирующего при высокой f с образованием С.:
CaS04+CH4=Ca0 + C02+H2 + S+H20.
Однако часть С. при этом окисляется водой: S + 2H20=S02 + 2H2, и поэтому продукты реакции содержат смесь паров С. и S02. По другому методу гипс перемалывают с углем и обжигают обычно во вращающихся печах при. t° около 1 000°. Для извлечения С. из CaS применяют либо метод Клаус-Ченса либо метод Гельвига я Шаффнера (нагревание с М<гС12 в присутствии паров воды при 1° около 100°). Промышленное применение имел также способ Прехта; по этому способу гипс прокаливается с углем и веществами, содержащими Si02:
2CaS04+C + Si02=Ca2Si04+2S02-bC02.
S02 перерабатывается на серную к-ту или на С. В СССР, богатом залежами гипса в центральных районах, проблема использования С. гипса представляет промышленный интерес. Способ получения С. из глауберовой соли получает для СССР большое значение в связи с имеющимися большими естественными залежами этого сырья (Карабугаз). Имеет также интерес получение С. как побочного продукта из алунитов при производстве алюминия по методу Камец-кого (Ин-т прикладной минералогии). Размолотая алунитовая порода обрабатывается смесью раствора соды и известкового молока. Образующийся едкий натр разлагает алунит и дает с глиноземом алюминат натрия, с серной к-той алунита — сульфат натрия, который регенерируется по Леблану; отвалы последнего процесса в виде сульфида используются для получения С. по Клаус-Ченсу. Из тяжелого шпата сера может быть получена при восстановлении барита во вращающихся печах с последующим выделением серы из сернистого бария по Клаус-Ченсу.
С.из угля и сланцев. Содержание С. в каменных углях обычно колеблется от 0,5 до 3%, в буром угле до 6%. Общее количество С., содержащейся в добываемых ежегодно в мире 1г/2 млрд, т угля (каменного и бу рого), достигает 18 млн. т, что превышает мировую добычу самородной С. в 6 раз. Утилизируются в настоящее время лишь ничтожные количества С. угля — при очистке светильного газа нек-рых коммунальных заводов. Широкое же использование С. коксовых газов в мировой практике еще не осуществлено. Для выделения С. из газов коксовых печей предложено много различных методов, в основном разбивающихся на: 1) сухие (с помощью абсорбентов) и 2) мокрые. При получении светильного газа сухой перегонкой угля С., превращаясь в H2S, CS2, тиофен и другие соединения, входит в состав образовавшегося светильного газа, при очистках которого С. частично переходит в FeS, частично же осаждается в виде элементарной С. (При вылеживании на воздухе FeS выделяет серу.) При повторном использовании и регенерации путем окислительной аэрация этой (л я-м и н г о в о й) массы содержание С. в ней доводят до 50—60%. Образующиеся при этом процессе цианиды железа экстрагируются, после чего свободная С. извлекается дистилляцией, экстрагированием сероуглеродом или каким-либо другим способом. Значительная часть С. при обработке массы упомянутыми способами остается связанной и м. б. выделена только при сжигании в S02. На герм, заводах был применен ряд абсорбентов С. из газа, например активированный уголь (J. G., Леверкузен), силикагель и др. Дальше С. выделяется или экстракцией растворителями или другим способом в элементарном виде. Рашиг предложил воспользоваться реакцией 2H2S -f S02 2Н20 +
+ 3S, но успеха в этом направлении достигнуть не удалось. В последнее время отдают предпочтение мокрым методам получения С., куща относятся: 1) железо-аммиачный, 2) железо-содовый, !1) метод Тейлокс, в к-ром участвуют овистые соли, дающие с С. растворимые в щелочах сульфоовистые соли, а последние при окислении воздухом выделяют элементарную С. Сущность первых двух методов сводится к промывке газа в скрубберах поглотительной жидкостью: слабым (0,5%) раствором соды или аммиака с участием в обоих случаях небольших количеств суспендированной водной окиси железа или никеля. Из образовавшегося ила элементарная С. получается окислением или продуванием воздуха, а железо регенерируется в водную окись. С., получаемая по данным методам, содержит 40—45%. влаги и 20—25% золы, представленной в подавляющей части окисью железа. По размерам частиц коксовая С. приближается к коллоидной (5 μ). Значительные количества С. содержатся и м. б. выделены из горючих сланцев; G. может быть выделена при переработке сланцев на смолу и газ одним из следующих методов: 1) железо-содовым (аналогично очистке коксовых газов); 2) хлорным, причем получается чистый газ С. и соляная к-та; 3) активированным сланцевым полукоксом: швель-газ пропускается через сланцевый полукокс, активированный перегретым паром. Сероводород газа окисляется в С., которая поглощается полукоксом в количестве 75% от собственного веса и затем экстрагируется из него бензином или выплавляется перегретым паром; 4) тионатным способом с получением сульфата аммония и С. (Е. Ваковский). Выход С. ок. 1,5% от взятого в переработку сланца.
Переработка и о ч и с т к а С. Добываемая в Америке по методу Фраша С. обычно настолько чиста, что дальнейшей переработки не требует (99,8—99,9% S). Для применения в с. χ-ne и нек-рых других отраслях пром-сти и весьма чистая С. в определенных случаях требует дальнейших операций обработки (например размола). С., полученная в результате выплавки в печах или других аппаратах, называется сырой или комовой С. Обычно комовая С. получается достаточно чистой, содержа 98—99% С.” но в связи с повышенными требованиями рынка часть комовой С. поступает в переработку на рафинировочные з-ды. В настоящее время значительное количество рафинировочных заводов работает в Марселе (Франция) и в нек-рых городах Сицилии; несколько рафинировочных заводов есть и в СССР.
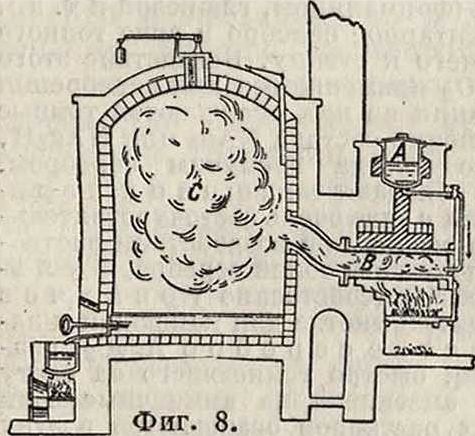
Рафинированная С. выпускается в виде т. н. серного цвета, то есть возогнанного или сублимированного серного порошка, а также в виде черенковой (палочной) С. Небольшие количества С. очищают расплавлением и отстаиванием в котлах (есть предложения по очищению С. фильтрацией); главная масса С. очищается в специальных печах (Мишель, Лами и др.). Рафинировочный аппарат (фигура 8) состоит из чугунного котла А для плавления серы, перегонной реторты В и конденсационной камеры С. Котел для плавления вмещает около G00 килограмм С.; у одной камеры конденсации устанавливается несколько (2—4) таких котлов и реторт. Реторта В обогревается топкой и окружена каналами, в которых циркулируют горячие дымовые газы. С., загружаемая в котел А (ί° 125—150°), плавится в нем и понемногу стекает в реторту, в которой возгоняется. Пары С. осаждаются в камере конденсации; под ее имеет наклон к выпускному отверстью для жидкой С. Часть возогнанной С. осаждается в виде серного цвета на стенах камеры. Средняя производительность двухретортной печи, при попеременной нагрузке каждой из реторт 4 ч.,— 1 800 килограмм дистиллированной С. в сутки. При увеличении 1° производительность печи увеличивается, причем получается гл. обр. черенковая С. Вели хотят иметь только серный цвет, то выход продукта едва достигает трети от производительности печи на черенковую С., поэтому серный цвет значительно дороже. Черенковая С. собирается непрерывно во время работы печи в специальные формы. Очистка камер от серного цвета производится через каждые
5—б дней. Потеря С. при рафинации определяется в 2—2,5%. Расход каменного угля 200— 250 килограмм/т полученной серы.
Серный цвет адсорбирует серную кислоту и S02, которые всегда образуются в дистилля-ционных камерах, и поэтому требует перед выпуском на рынок промывки водой (черенковая С. этих примесей не содержит). В последнее время сублимированная С. заменяется молотой С., получающейся путем размола комовой или рафинированной С. на специальных мельницах. Во избежание возможных ов серной пыли размол производится в атмосфере инертного газа (азот, углекислота). В СССР предложен аппарат типа центрифуги для по лучения мелкой дисперсной С. из расплавленной. Во Франции каменные камеры конденсации заменяют свинцовыми, причем процесс, дистилляции С. благодаря быстрому охлаждению стенок значительно ускоряется. В е н-тил и ров а иная С., получаемая за границей распылением, благодаря своей высокой дисперсности и чистоте получает большое распространение. Для специальных целей (фармацевтическая, резиновая и другие виды пром-сти) за границей выпускается на рынок коллоидная С. Институтом прикладной минералогии получены также благоприятные результаты по производству коллоидной (осажденной из растворов) С. Рафинированная С. содержит 99,9% чистой серы.
Получение химически чистой С. Для полной очистки С. от примесей прибегают к повторной перекристаллизации С. из растворов или к возгонке под вакуумом. Во избежание адсорбции SO2 (образующегося при возгонке) вакуум держат до полного охлаждения С., однако полная очистка от следов Fe и Ag путем дистилляции не всегда достижима, а потому метод перекристаллизации является более падежным. Прежде перекристаллизацию С. производили из раствора в OS2, причем выпадающие кристаллы С. отпрессовывали между слоями фильтровальной бумаги и сушили при 80°. В настоящее время в качестве растворителя применяют, от к-рцго легче освободить кристаллы (непродолжительным нагреванием до 60°). Гаслингер предложил получать чистую С. осторожным окислением H2S. Метод этот представляет известный интерес, но требует весьма тщательной очистки ЫгЗ.
Применение и промышленное значение С. Мировое производство С. неуклонно растет с каждым годом, достигая в настоящее время 3 млн. тонн в год. Главная масса С. добывается из самородных серных руд (США, Италия). Из серусодержащих химич. соединений добывается всего около 1—1,5% общего количества С., однако перед этими видами серного сырья открывается большое будущее. Одним из главных потребителей С. является лесобумажная промсть, которая потребляет С. для производства сульфид-целлюлозы. С. х-во потребляет громадные количества С. в качестве инсектисида и фунгисида для опыливания растений и для предохранительных окуриваний. Основная химическая промсть потребляет С. гл. обр. для производства сероуглерода, хлористой С., гипосульфитов. Резиновая промсть потребляет значительные количества С. и хлористой С. для вулканизации каучука и получения белого фактиса. С. также находит применение в производстве спичек, дымных ов, кислотоупорных цементов как изолятор, в текстильной и костеобрабатывающей пром-сти для производства серной кислоты (Америка), в лакокрасочной пром-сти, в медицине для дезинфекции, для изготовления пластырей, мазей и тому подобное. С. дает очень прочную замазку, применяемую для производства плавиковой к-ты, применяется для грануляции меди в производстве медного купороса, при строительных работах для вмазывания железа в бетон и для закрепления болтов и анкеров в натуральном камне. Большое значение С. имеет в военной химии, являясь основным сырьем для получения нек-рых О. В. (), а также чатых и горючих составов, что ставит серную промсть н ряд важнейших факторов обороны страны.
Лит.: Лукьянов И., Курс химич. технологии минеральных веществ, М., 1929; Будников П., Химическая технология минеральных веществ, Иваново-Вознесенск, 1927; «Сера», Сб. статей акад. Ферсмана, Вло-давца и др.; «Материалы КЕПС», Л., 1926, 59; Щ е р б а-ков Д., «НИ», т. 2, Л., 1927; М улерт Ф., Сера в угле, пер. с нем., М.—Л., 1932; К о η р а и с к и й, Плавка Дагестанских руд самородной серы в калькаронах, «ГЖ», 1881, ч. 3; Рабчинский И., Сера, М.—Л., 1932; Менковский М., Технология серы, «Труды
Института прикладной минералогии», ч. 1, 1933; Вопросы серной промышленности СССР, М., 1932; «ЖХП», 1931, 1, 2, 11, 12, 11, 1932, 5; Богданович К., Рев-га р т е н В., Нацкий А., Сера, «Естеств. производительные силы России», П., 1918, вып. 18; Мелко в с к и и М., Переработка серных руд, М.—Л., 1933; G a t t о, Trattamento mineralurgico dei minerali di solfo, Torino, 1928; Ullm. Enz., 2 Auli., B. 9; Chemische Techno-logie d. Neuzeit, hrsg. v. 0. Dammer, 2 Aufl., B. 3, Stg., 1927; B run f aut, Dc rexploitation des soufres, P., 1874; M u s p r a t t, Enzyklopadisches Handbucli d. technischen Chemie, 4 Aufl., B. 7, Brschw., 1900; G meli n-K r au ts, Handbuch d. anorganischea Chemie, 7 Aufl., В. 1, Abt. 1, Heidelberg, 1906; M e 1 1 о r, A Comprehensive Treatise on Inorganic a. Theoretical Chemistry, Y, 7, L., 1927. M. MeaifOBCBuu.