 > Техника, страница 80 > Сероуглерод
> Техника, страница 80 > Сероуглерод
Сероуглерод
Сероуглерод, CS2, бесцветная, легко подвижная жидкость с характерным запахом. Обычно С. вследствие присутствия примесей обладает своеобразным запахом, напоминающим запах редьки.
Физик о-х имическиесвойстваС.: 1°отв.—116°, 1°^ -112,8°, t un_ (при 760 миллиметров) 46,25% £>2=1,2922, £>|°=1,2603; плотность пара 2,63; уд. теплоемкость (при 30°) 0,240 Cal. Упругость пара при 20° 298 миллиметров, при 30° 435 миллиметров, при 40° 618 миллиметров, при 50° 657 миллиметров. Скрытая теплота парообразования (i°KUn. 46,1°) 83,8 Cal; коэфи-циент преломления=1,6315; диэлектрич. постоянная (при 20°) 2,64. Растворимость в воде (з С. в 100 г Н20):
0° 010° 20° зо5
0,258 0,239 0,201 0,195
При г° ниже 30° устойчив гидрат 2CS2 · Н20. При действии солнечного света С. желтеет, что обычно приписывают выделению серы по схеме nCS2=(CS)n + nS, и образует полимеры. С. горит на воздухе и легко воспламеняется при соприкосновении с нагретыми металлич. поверхностями. Т. к. смеси его с воздухом ают (даже при содержании 0,063 e С. в 1 л воздуха), то С. в пожарном отношении крайне опасен. Будучи эндотермич. соединением, С. ает и в отсутствии воздуха (вследствие детонации или даже удара). С.—хороший растворитель (для жиров, масел, серы, иода, смол, каучука и тому подобное.), однако вследствие его опасности в пожарном отношении и сильной ядовитости вытесняется другими растворителями, например трихлорэтиленом. Конц. H2S04 и HN03 с CS2 не реагируют. При комнатной г° С. почти не реагирует с Fe, Си, Zn и другими металлами. При 400° С. реагирует с платиной с образованием Pt2CS2. Со щелочами и сернистым натрием С. дает тиокарбонат:
3CS2 + 6NaOH=2Na2CS3 + Na2C03 + 3H20;
CS2 “Ь Na^S=Na2CS3;
поэтому NaOH не годится для промывания С. Со ами в присутствии щелочей С. дает ксантогенаты, например
CS2 + С2Н5(Шα= NaS · CS · OC2H5.
На этой реакции (образование ксантогената целлюлозы) основано применение С. в производстве вискозы (искусственное волокно). При действии хлора или хлористой серы образует четыреххлористый углерод.
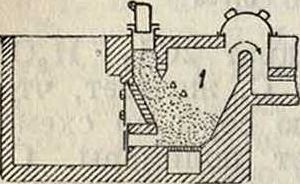
С. образуется при взаимодействии S и С при t° красного каления. Этот метод применяется и в технике. Кроме того С. получается при прокаливании угля с сульфидами, при нагревании СС14 с сульфидами и СВг4, с серным цветом, при сухой перегонке каменного угля и при нек-рых других реакциях (смотрите ниже). В основе современного производства С. лежит прежде всего пропускание паров серы над раскаленным углем или коксом, причем реакция протекает (при t° 800—900°) по ур-ию C+2S=CS3—26 Cal. При этом процессе используется обычно 85-Р 90% серы. Технически этот синтез осуществляется в печах нескольких типов: в старом (ретортном) с обогревом за счет горючих газов и в ряде новых — в электрич. печах по методам Тейлора, Шульца и др. Электрич. печи привились гл. обр. в Америке и понемногу распространяются и в Европе. Ретортные установки с многими небольшими ретортами заменяются ретортами укрупненного типа. Значительным распространением пользуется аппарат Эккельта (фигура 1). Отдельные детали аппарата: 1 — газогенератор, 2—канал для газа, 3—канал для воздуха, 4—реторта (шамотовая). Уголь прокаливается за счет проходящих газов и вводит-
ся в реторту через 5, 6, 7. Сера поступает в воронку 8 и по шнеку — в газообразиватель 9. Пары серы направляются" в реторту и вступают в реакцию с углем.
Образовавшийся в результате реакции С. отводится из холодильника 10 в приемники с водой 11 и 12. Некон-денсирующиеся го-
Флг. i.
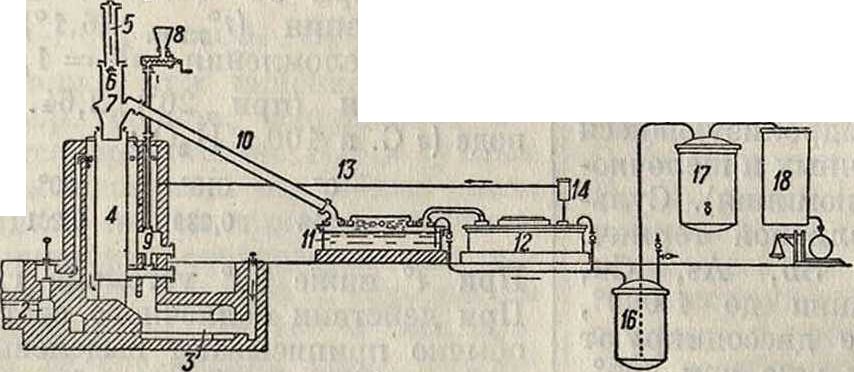
рючие газы, в том числе и COS, через трубопроводы 13 и 14 передаются в топку, а оставшийся уголь удаляют при помощи насадки. Из приемников С. накачивается в сосуд 16, а оттуда в ректификационный аппарат 17 (с холодильником 18), причем H2S удаляется. Остающаяся в ректификационном аппарате сера расплавляется перегретым паром и выпускается из прибора, после чего м. б. возвращена в производство. Сероводород сжигают либо до серы (смотрите Сера) либо до S02 (для получения H2S04). Для того чтобы воспрепятствовать образованию сероводорода, Эккельт предложил пропускать через печь углекислоту. Вследствие реакции со3 + h2s=со + s + н2о и вследствие образования сероводорода потеря серы по данным Эккельта резко уменьшается.
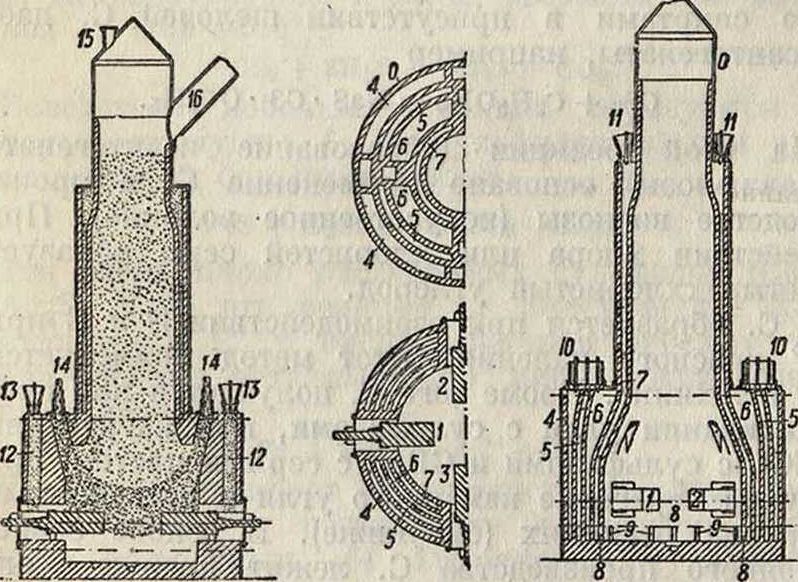
Из олектрич. печей большое распространение получила печь Тейлора (фигура 2). Печь выкла-
Фигура 2.
дывают из огнеупорных материалов и окружают железным кожухом О. Обогрев обеспечивается четырьмя электродами (на фигуре только три: 1, 2, 3), изолированными от кожуха асбестом или слюдой. Внутри печи имеется несколько кольцевых каналов 4, 5, 6, 7, сообщающихся с печью при помощи отверстий 8 и 9. В каналы сера поступает через воронки 10 и 11, т. ч. теплота излучения расходуется в значительной мере на подогрев и плавление серы. Для охлаждения концов электродов устроены особые каналы 12, наполняемые серой через Еоронки 13. Для предохранения электродов от разрушения через трубки 14 вводят куски графита от дуговых углей. Наполнение шахты углем производится через 15. При пропускании тока нижняя часть массы разогревается,
и сера начинает реагировать с углем (с Графитом реакция идет гораздо медленнее). Поднимаясь сквозь уголь, С. охлаждается и через насадку 16 направляется в холодильники. Регулировка процесса может производиться увеличением количества вводимой серы, которая как непроводник уменьшает количество проходящего тока. Размеры печи следующие: диаметр нижней части около 5 м, в шахте 2,5 м, верхняя часть 1,7 м; высота печи 12 метров Дневная продукция равна 4,5 тонн О получении С. из угля и сульфидов (пирита и др.) см. Сероводород.
Получение С. из сероводорода и угля также было предметом технология. исследования. По Вальтеру реакция 2H2S+C=CS2+ 2Н2при высокой t° протекает почти количественно. Получение С. из COS исследовано Штоком, при-, чем оказалось, что при высокой t° имеет место реакция 2COS=С02 + CS2(реакция эндотермична). В 1924 г. был взят патент на получение С. по аналогичному методу. Для получения С. по этому методу смесь СО и паров S пропускается при 400—600° в присутствии

Фигура 3.
катализаторов. Существует еще воз-мощность получения С. из сульфатов (Na2S04, CaS04 и др.): по Regi и Desjardin действием кремневой кислоты при высокой f на сульфаты и последующим восстановлением S02 углем; возможно получение С. при действии СО на CaS04 при t° 900° (Завадский,
Коссак, Нарбут).
ОчисткуС. производят дистилляцией. Сама по себе дистилляция С. не дает хорошего продукта, и потому С. предварительно обрабатывают различными веществами. Для такой предварительной очистки С. предлагались различные вещества: едкое кали, известковая вода, закись железа, белильная известь и хлорная вода, нитрат свинца, бром с последующей дистилляцией над ртутью, раствор перманганата калия, безводная и водная сернокислая медь, свинцовые белила. Для дистилляции С. предложена различная аппаратура. Аппарат Le-geler’a и Esselman’a (фигура 3) представляет дистилляционную колонну, состоящую из двух концентрических труб 1 и 2, наполненных кусочками керамики ит.п. Технич. С. поступает через 3. Навстречу по трубе 1 поднимаются пары С., нагреваемого в 4. Пары поступают обратно в холодильник 5 через 6. Здесь С.·, конденсируясь, возвращается обратно в колонну, а -ч H2S и другие легко лету-
г- чие примеси удаляются;
^ в 4 собирается понемногу трудно кипящий погон, выпускаемый через 7, сероуглерод же дистиллируется, проходит через трубу 2 и направляется в холодильник через 8. Устройство аппарата Zahn & Со. дано на фигуре 4. Технич. С. после отделения от части серы поступает через 1 в приемник 2, где нагревается
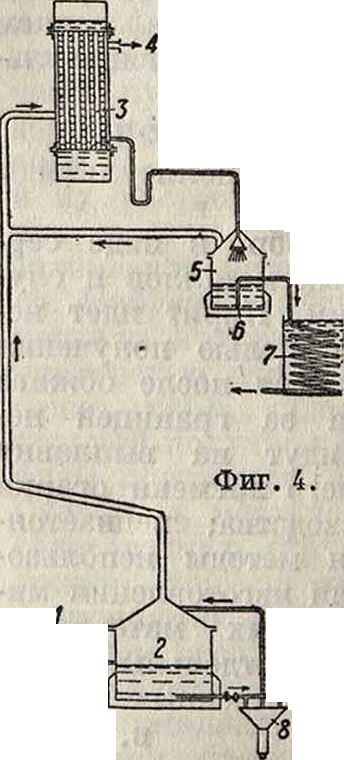
до кипения. Отсюда пары идут в холодильник 3; HjS и другие газы удаляются через 4, а С. стекает в приемник 5, проходя через распылитель 6. В приемнике С. снова нагревается до кипения, и пары его направляются в холодильник 3. Очищенный С. сливается через холодильник 7. Тяжелые погоны, содержащие серу, поступают из 2 в сосуд 8 (с паровым или иным обогревом и внутренними перегородками), где С. испаряется, а сера конденсируется. Удаляющийся из аппарата сероводород смешивается с воздухом и поступает в печь Клауса; сера поступает в камеру, где образует серный цвет; жидкую серу удаляют из печи.
С. применяется в производстве искусственного волокна, для получения СС14, ксантоге-натов, для борьбы с вредителями с. х-ва (суслики и тому подобное.), для протравления семян, для вулканизации каучука и отчасти как растворитель (вытесняется в последнее время трихлорэтиленом); хранить С. следует с осторожностью— опасен в пожарном отношении и сильно ядовит.
Полимер С. (CS)n. При освещении ультрафиолетовыми лучами помещенного в кварцевое стекло четыреххлористого углерода, содержащего небольшое количество С., Doran а. Gillau удалось получить с помощью лучей не короче 275 та небольшое количество краснокоричневого порошка, состав которого соответствует (CS)n; порошок нерастворим в воде, бензоле, немного растворим в пиридине, хорошо растворим в растворах NaOH, NH4OH и в конц. H2S04 с образованием коричнево-красной жидкости. (CS)n образуется в результате медленного разложения CS2 под влиянием света; это же вещество является продуктом действия на CS2 активного азота (наряду с азотистой серой).
Лит.: К a.u s с h О., Sctrwefelkohlenstoff, В., 1929; S t о с к А., «В», 1924, В. 57, р. 719; С о ш a i 1 1 e, «CR», 1868, t. 66, р. 1273; D о г a n a. Gillau, «J. СЬ. I.», 1929, V. 47, р. 259; Muhlert F., Der Kohienschwe-lel, 1930. Б. Ормонт.