 > Техника, страница 80 > Серы соединения
> Техника, страница 80 > Серы соединения
Серы соединения
Серы соединения. Сера способна давать соединения с большинством других элементов — с кислородом, водородом, галоидами, металлами, амфотерными элементами — вплоть до азота. Некоторые С. с. играют огромную роль в народном хозяйстве как необходимейшие реактивы, сырье и полуфабрикаты.
В теоретич. отношении свойства С. с. и их состав в значительной мере определяются свойствами самой серы как элемента. Сера образует соединения двух типов: какшести-валентная (по кислороду положительная валентность) и как двувалентная сера (по водороду—отрицательная валентность). Для нее оказываются стабильными не только те многочисленные конфигурации валентных электронов, при которых максимальная главная валентность оказывается далеко не достигнутой, но и такие, в которых последняя (за счет побочных связей) как бы превзойдена. Особенным разнообразием в этом отношении отличаются кислородные С. с. от гипотетич. сульфоксиловой кислоты H2S02 или окиси серы S203 до надсерной к-ты, кислоты Каро и недавно открытого смешанного ангидрида обеих этих кислот ЭзОц. Между кислородными и водородными С. е. усматривается (еще со времени Вернера) в отношении проявления побочных связей нек-рый—формально постепенный—переход от сульфатов к гипосульфитам и полисульфидам, тесно примыкающим к сероводороду:
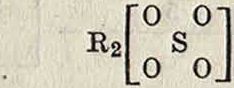
R2
Ό
S
S
переход, с точки зрения современных взглядов на природу валентности имеющий особый интерес. Водородные С. с., присоединяя за счет побочной связи серу, переходят в полисульфиды, присоединяя кислород,—в сульфаты. Сходство и различие этих соединений не исчерпываются внешним сходством или различием структурно-координационных ф-л и представляют область, интересную для исследования при помощи современных электрохимических, оптических и других методов изучения вещества. Ряд H2S—S— —S02—SO3 также представляет своеобразный интерес. В ряде реакций широко проявляются (и используются) окислительно-восстановительные свойства S и S02, восстановительные—сероводорода и окислительные—серного ангидрида; большая часть этих реакций легла в основу важнейших технологич. процессов и всесторонне изучена с тебретич. и технологич. стороны (смотрите схему, ст. 635— 636). В этих реакциях имеет место ряд равновесных систем;
2H2S+02 2H20+2S; S+02 ^ S02; 2S02+02 ^ 2Л03;
2H2S+S02 2H20+3S
и t. д., получивших огромное прикладное значение. Известен целый ряд соединений S с галоидами. Одно из них, SFe, интересно не только тем, что оно—один из тяжелейших газов, с трудом конденсирующийся, несмотря на большой мол. вес, но и тем, что SFe—единственное С. с., в к-ром атом S (за счет гомеополярной связи) одинаково прочно удерживает вокруг себя все шесть атомов F, образуя вполне устойчивую молекулу, где максимальное валентное и максимальное координационное числа серы совпадают. Другие С. с. этого ряда обладают сильными окислительно-восстановительными свойствами, активно участвуют во многих реакциях и значительное количество процессов катализируют. Обладая низкими диэлектрич. постоянными, они в то же время легко образуют многочисленные комплексные соединения и являются хорошими растворителями не только для веществ с молекулярной решеткой, но и для ряда солей—особенно иодидов. Еще в большей степени эти свойства выражены у оксигалоид-ных соединений; окислительная способность их чрезвычайно велика и всесторонне используется в технике. Исследования над сероуглеродом позволили в свое время опровергнуть неверное по существу положение Вертело, что теплота реакций служит мерой химич. сродства: сероуглерод, образующийся е большим эндотермич. эффектом, довольно устойчив. С технологич. точки зрения С. с.— важнейшие и интереснейшие объекты (смотрите схему).
Кислородные С. с. Окислы и кислородные кислоты серы весьма многочисленны. Низшим окислом является SO (?), затем следуют: окись серы S203, двуокись серы S02, серный ангидрид В03, ангидрид надсерной кислоты S20, ангидрид кислоты Каро S04. Им соответствуют кислоты: сульфоксиловая H2S02, гидросернистая H2S204, сернистая H2S03, серная H2S04, надсерная H2S208 и кислота Каро H2S05. Кроме того существуют так называемые тоновые кислоты: тиосерная, или серноватистая, ки слота H2S203, дитионовзя H2S2<Je, тритионо-вая H2S306, тетратионовая H2S40„, пентатио-новая H2S30„ и гексатионовая H2S606. Описан (J. Maisin) также окисел S3On смешанный ангидрид кислоты Каро и надсерной к-ты.
Сульфоксиловая кислота H2S02. Наименее изучена; известна ее цинкован соль ZnS02 (?); получаемая в эфирных растворах S02C12 восстановлением при помощи цинка:
S02Cl2+2Zn=ZnCl2+ZnS02(?), но в твердом состоянии не выделенная. Ангидрид сульф-окисловой кислоты SO(?) также не выделен.
Окись серы S203 получается при действии серы на серный ангидрид S03. Представляет ли это вещество раствор серы в S02 или индивидуальное соединение—во-
Технологическая связь между производствами H2S—S—S02—SO3 и соответствующими кислотами.
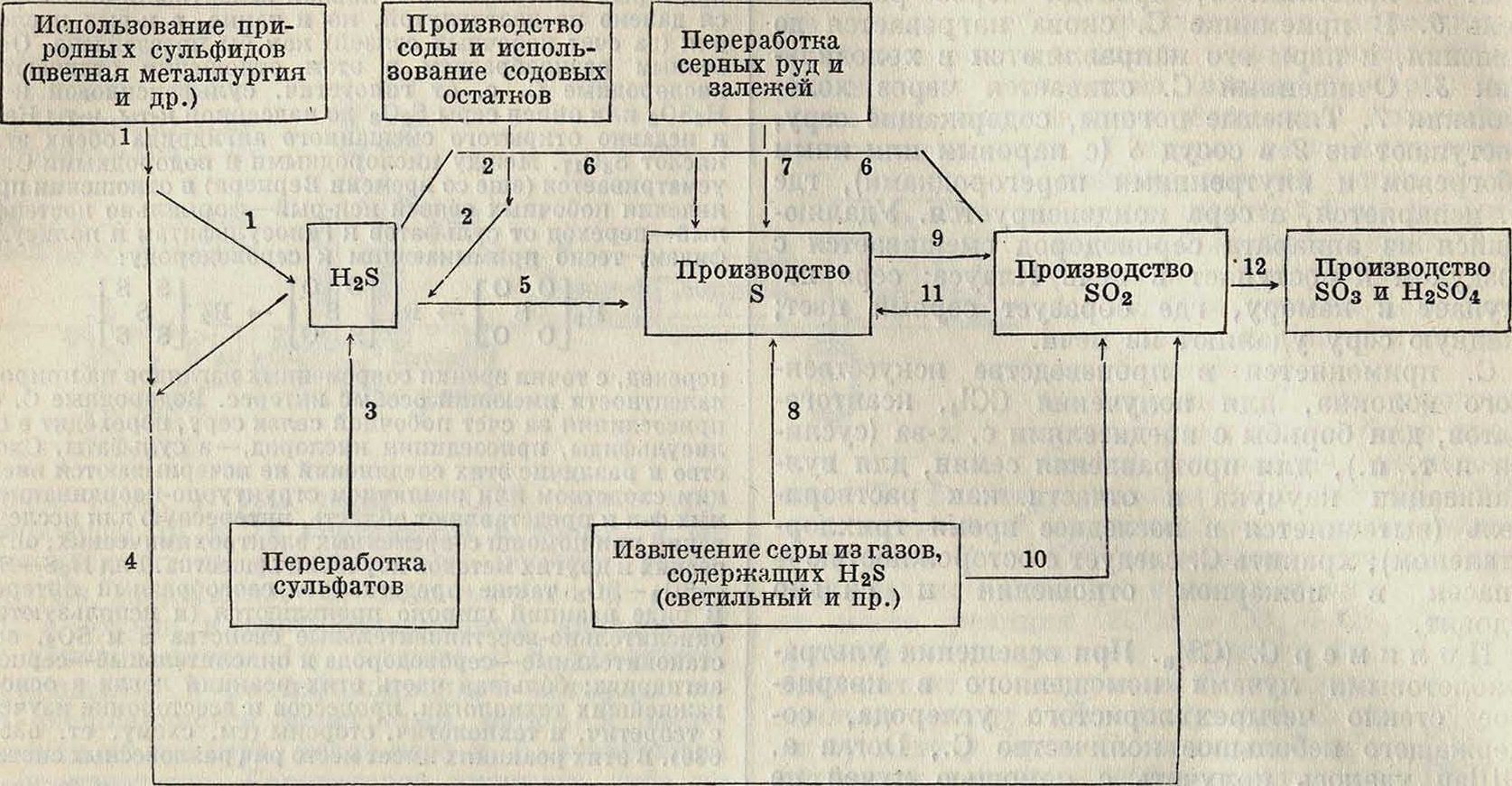
На схеме: 1 и 2. Метод Costeanu и др. 3. Метод BASF и др. 4. Производство H2S04 и цветная металлургия. 5. Метод Claus-Chance. 6. Взаимодействие H2S и SO2 (Engelgardt и др.). 7. Выплавка из руд различными методами. 8. Окисление H2S на окиси железа, активированном угле и т. д. 9. Сжигание S. 10. Обжиг железной массы для извлечения остатков S в виде SO2 (смотрите п. 8). 11. Восстановление S02 окисью углерода, генераторным газом, углем, водородом и тому подобное. 12. Контактный, камерный, башенный методы. нрос еще не решенный. S2O3—синеватые кристаллы, нестойкие и быстро распадающиеся на S и SO3· В SO3 окись серы растворима мало; в дымящей серной к-те растворяется с синей окраской. С водою S2O3 образует H2SO3, H2SO2, H2S60e и др. Гидросернистая кислота H2S204 дает соли—гидросульфиты (смотрите), которые получаются при действии сернистого ангидрида SO2 на цинк (или гидрид калия) в гольной суспензии
Zn + 2S02=ZnS204
или
2КЫ + 2S02=K2S204 + H2.
Двуокись серы (сернистый ангидрид, с ернистыйга в) S02 известна с глубокой древности, одно из наиболее изученных химических соединений, образуется всюду, где (при доступе воздуха) имеются залежи серы или ее выделения, особенно при высокой f. При сжигании каменного угля почти вся его сера переходит в S02; в небольшом количестве S02 содержится в воздухе городов и особенно фабричных районов. В некоторых производствах (наир, в цветной металлургии) наблюдается выделение S02 в огромных количествах (обжиговые газы), причем до сих пор эти газы многими заводами выпускаются на воздух, отравляя окрестности. Получается S02 при сжигании S или HjS в избытке воздуха; вся сера количественно переходит в S02, дальнейшее же окисление S02 в S03 требует присутствия катализаторов. При прокаливании сульфата (вследствие термической диссоциации) имеет место образование S02. В присутствии угля, серы и нек-рых металлов сульфаты, и особенно серная кислота, восстанавливаются до сульфитов, выделяя SO 2 (при сильном восстановлении — до сульфидов). В частности H2S04 восстанавливается серой и углем при 400°;
H2S04+C=H20+S02+C0; 2H2S04+C=2S02+2H20+C02.
Для получения S02 из сульфатов путем прокаливания с углем предложено [*] восстанавли вать сначала часть сульфата до сульфида, наир. BaS04 + 4С=BaS -f 4СО.
При этом BaS сплавляется с избытком BaS04; 3BaS04 + BaS=4ВаО + 4S02.
Уголь м. б. заменен железом. Для получения чистого S02 в лабораториях нагревают H2S04с медью или исходят из элементов.
При обыкновенной t° и нормальном давлении S02—бесцветный газ с своеобразным запахом. Плотность (по воздуху) /1=2,2639. Вес 1 л S02(при 0° и 760 миллиметров) равен 2,9267 г. Конденсируется SO2 очень легко и при нормальных условиях дает заметные уклонения от газовых законов; t°Kun. (760 миллиметров) —10°, 1°пл—72,5°; критик. темп-ра +157,24°, критич. давление 78 atm, критич. плотность 0,52. Теплопроводность S02при 0° 1,95 -105 cal/c-и ск. °С. Уд. теплоемкость (средняя для интервала 16+202°)=0,1544, мо-лекулярная= 9,891. Коэф. преломления газообразного S02 nD =1,000676. Диэлектрик. постоянная (при 0°) е=1,0095. SO2 диамагнитен. Молекулярная теплота образования:
®(тв.) + Ог(газ) = ®°2(газ) + 70 СаВ Ί· S(ras) + °2(газ)=so2(ra3) + 838 Са1·
Теплота конденсации (испарения) S02(ra3) — — й02(шидк.) + 6 Cal. Теплота испарения на 1 г 92 cal (при 0°), 96 cal (при—10°). Упругость пара S02:
| Темп-ра
(°С) |
Давление (мм Hg) | Темп-ра со | Давление
(atm) |
| -90 | 2,5 | 0 | 1,53 |
| -50 | 87 | 33,5 | 4,80 |
| • -20 | 478 | 54,6 | 9,1 |
| —10 | 762 | 72,2 | 16,10 |
| — 5 | 947 | 105,2 | 31,10 |
Уд. в жидкого S02 1,43 (при 0°), 1,49 (при —20°), 1,38 (при +20°). Плотность насыщенного пара и жидкого S02:
| Температура
(°С) |
Плотность пара | Плотность жидкости |
| 34,9 | 0,01553 | 1,3379 |
| 129,75 | 0,1593 | 0,9560 |
| 154,9 | 0,402 | — |
| 155,0 | 0,6370 |
Средняя уд. теплоемкость жидкого S02 (в интервале —20,6-Р + 9,8°) равна 0,3178. Коэф. преломления nfj=1,342. Молекулярная рефракция (по формуле Lorentz — Lorenz’a) 9,79. Диэлектрическая постоянная жидкого S02 14 (при 20°) и выше. Магнитная проницаемость удельная (при 16°) 2,97 · 107. Жидкий S02— хороший растворитель для J, Cl, Вг, S, Р, H2S04 (немного), НС1, S03 (очень хороший). Вода растворима мало. Растворяются иодиды и бромиды щелочных металлов (первые с желтооранжевой, вторые с зеленоватой окраской). Многие органич. вещества хорошо растворимы в жидком S02. Уд. электропроводность (0,4-ί-0,9) · 107 (при 0°), то есть близка к электропроводности воды. Растворы в жидком S02 иода, серы, фосфора, РС13, AsCl3, SbCl3 и др. не проводят тока; растворы Cl, Br, S2Br2, SbCls, HG1, HBr, иодидов щелочных металлов хорошо проводят ток. S02 хорошо адсорбируется углем и другими пористыми телами. Древесный уголь адсорбирует при атмосферном давлении 50-f-100 см“ S02 на 1 г угля. Довольно значительна адсорбция S02 на асбесте и стекле. Уд. в водных растворов S02:
| % S02 | Уд. вес | % so2 | Уд. вес |
| 1 | 1,0056 | 6 | 1,0328 |
| 2 | 1,0113 | 7 | 1,0377 |
| 3 | 1,0158 | 8 | 1,0426 |
| 4 | 1,0221 | 9 | 1,0474 |
| 5 | 1,0275 | 10 | 1,520 |
Растворимость S02 в воде при разных 1°:
| Темп-ра (°С) | Растворимость | |
| объёмы SO2 на 1 объём воды | вес SO2 (г) на 100 г воды | |
| 0 | 79,789 | 22,83 |
| 10 | 56,647 | 16,21 |
| 20 | 39,374 | 11,28 |
| 30 | 27,161 | 7,80· |
| 40 | 18,766 | 5,41 |
Теплота растворения газообразного S02 (при 25°) 7,5 Cal(SO2(ra3)+250H2O=SO2 aq+7,5 Cal), для жидкого S02 известна не очень надежная величина:
S02(H<TOK.)+a4-S02aq+l,5 Cal.
В технике имеет значение растворимость S02в конц. серной кислоте; 86%-ная серная к-та (близкая по составу к H2S04 · Н20) показывает минимум растворимости.
| Крепость кислоты в % H2SO4 | Объемы SO2 на 1 объём к-ты | Bee S02 (г) на 100 г к-ты |
| 55,1 | 26,4 | 5,13 |
| 61,6 | 25,63 | 9,82 |
| 74,1 | 21,06 | 3,63 |
| 80,2 | 18,87 | 3,21 |
| 85,8 | 17,48 | 2,80 (min) |
| 90,8 | 19,71 | 3,10 |
| 95,5 | 23,66 | 3,69 |
| 98,5 | 25,85 | 4,03 |
S02 — довольно стойкое соединение; однако при действии химически активных лучей на S02 наступает разложение. На свету SO„ и его растворы постепенно разлагаются: 3S02=S+2S03, что обнаруживается прежде всего по выделению серы. Водород восстанавливает S02 даже при 160°, а в присутствии платины — и при комнатной ί°. При действии высокой «° (180°) растворы S02 в воде (в запаянных трубках) разлагаются, причем также образуются сера и серная кислота. Термическая диссоциация:
S02 =— S2 + О, практически не имеет места я при 1° в 1 500°. При действии искрового разряда S02 распадается на серу и S03. Как химич. реагент S02 проявляет восстановительные и окислительные свойства. Реакция его окисления (S02 + у 02=S03) лежит в основе производства серной к-ты; восстановительное действие S02 используется во. многих технологич. синтезах. Непосредственно газообразный S02и его растворы с кислородом реагируют крайне медленно; однако нек-рые соли, наир. CuS04, ускоряют заметным образом протекание этой реакции. В присутствии окислов тяжелых металлов S02 дает сульфиты и дитионаты, при окислении воздухом медленно переходящие в сульфаты. Газообразный S02 при высокой температуре реагирует с оки металлов различным образом: он восстанавливает Fe203 до Fe304 (окисляясь до S03) и окисляет FeO (восстанавливаясь до S). В равной мере S02 окисляет SnO (но не восстанавливает Sn02), CuO восстанавливает в Си20 по ур-ию: 3 CuO+S02= =Cu20+CuS04. Если элемент имеет несколько окислов, то как правило высшие из них окисляют S02; в свою очередь S02 окисляет низшие окислы S02, отнимает кислород от перманганатов, бихроматов, хроматов, хлоратов, нитратов и HN03, окисляясь до S03. Растворы азотной кислоты или окислов азота в [серной к-те также быстро окисляют S02 (производство серной кислоты по камерному методу). В присутствии щелочей окисление S02 идет обычно быстрее. Галоиды также являются окислителями для S02, образуя (в водных растворах) галоидоводородную к-ту и H2S04. Как окислитель S02вступает в реакции с низшими оки элементов и с соответствующими им солями (FeCl2, CuCl, HgCl). Сероводород окисляется S02 до серы; реакция 2H2S+S02=r2H20+3S обратима; следы воды ускоряют ее протекание; при низких «° она идет целиком слева направо. При высоких f S02 окисляет С в СО; однако реакция эта равновесная и при понижении г° до красного каления С02 восстанавливается действием S02 до СО с образованием S03, причем кроме СО образуется и COS (вследствие побочной реакции СО с 02). Реакция восстановления S02 углеродом и СО также представляет большой практический интерес, т. к. на ней м. б. основано извлечение серы из обжиговых газов (смотрите Сера). Водород восстанавливает SO., при 300°. Восстановление идет до S или H2S“b зависимости от условий реакции и присутствия катализаторов. Галоидоводороды восстанавливают S02 до S с образованием воды и галоиды (реакция обратима). Металлы Mg, Cd, Си и др. восстанавливают S02, причем образуются сульфиды. При действии Zn на водные растворы S02, например в присутствии NaHS03, образуются гидросульфиты (в данном случае натрия):
Zn+2NaHS03+H2S03=Na2S204+ZnS03f2H20.·
При нагревании до 150° в запаянной трубке с водой S02 окисляется, выделяя серу 3S02 + 2НаО - 2H2S04 + S; реакция эта обратима.
S02 широко применяется в технике: в производстве серной к-ты, при изготовлении сернистокислых щелоков (в бумажной промышленности), при получении селена, теллура, золота, сульфитов, для дезинфекции (уничтожения паразитов) и консервирования, как растворитель жиров и масел (жидкий S02), при очистке нефтепродуктов и т. д.
Сернистая кислота H2S03 известна лишь в виде растворов и получается растворением SO2 в воде. Т. к. она образует соли типа R2S03, то есть ведет себя как двуосновная к-та, · то строение ее солей изображается координа-
~ °1
OS
о ционной ф-лой R2
. Однако практически диссоциация H2SOa идет гл. образом по схеме H2S03=H -f- HSO3, тогда как реакция HS03==H 4- SO3 почти не имеет места; в виду этого строение H2S03 схематически иногда изобра-Н О
жают так: Н
S
О 0
то есть лишь один атом водорода удерживается ионогенной связью.
Константа диссоциации H2S03=Н" + H’S03, /fj=0,0174; константа диссоциации HS03=H+-+S03, Я2=1 -ΙΟ-7. Теплоты нейтрализации H2S03при 18° (Cal):
NaOHaq 2NaOHaq 4NaOHaq KOHaq 2KOIIaq 16,3 29,2 29,3 16,6 31,8
Mn02 и РЬ02 окисляют H2S03 с образованием сульфатов Μη и Pb. Перекиси щелочных и щелочноземельных металлов окисляют H2SOs до H2S04 и дают соответствующие сульфаты.
H2S03 образует соли, сульфиты (смотрите).
Тиосерная, или серноватистая, кислота H2S203 неустойчива, но соли ее, тио-сульфаты, или гипосульфиты, довольно прочны (смотрите Гипосульфит).
Политионовые кислоты. Дитиоковая к-та H2S203 обычпо рассматривается как продукт соединения двух радикалов IIS03. Опа получается при осторожном окислении H2S03 твердыми окислителями [Mn02,Fe(0H)3и др.); очень стойка по отношению к окислителям и не реагирует с хлором и азотной к-той, а также не присоединяет серы. Высшие тионовые кислоты H2S2Sn06 (где п<4) обычно рассматриваются как производные H2S206> в которой сера удерживается по типу углеродпых цепей: HS03— Sn—S03H; подлинная структура этих к-т еше не выяснена. Политионовые кислоты гораздо менее стойки по сравнению с H2S203. Получаются они наир, действием окислителей на гипосульфит:
2Na2S203 -· 2J=2NaJ -1- Na2S403.
В зависимости от выбора окислителя получаются соли той или иной политионовой кислоты.
Серный ангидрид, трехокись серы S03, окисел шестивалентной серы; не м. б. получен непосредственно из элементов без помощи катализаторов. Получение S03 термич. диссоциацией сульфатов практически сильно усложнено тем обстоятельством, что для большинства сульфатов диссоциация наступает при г°, при которой и S03 диссоциирует по схеме: 2S03 -» 2S02-f02. Основные пути получения S03 следующие: 1) окисление S02 до S03 в присутствии окислов азота (смотрите Серная кислота, Башенный и камерный процессы);
2) окисление S02 в присутствии катализатора, находящегося в твердой фазе (контактный процесс); 3) окисление S02 с помощью озона [х] при комнатной ί°; 4) действие ультрафиолетового света на смесь S02 и кислорода (при t° 300°); 5) окисление S02 галоидами, в частно сти хлором: S02 + 2Н20 + С12=H2S04 + 2НС1;
6) термическое разложение сульфата железа Fe2(S04)3. Реакции. 8—6 промышленного значения не имеют. S03 существует повидимому в нескольких (не менее двух) изомерных или полимерных модификациях: льдовидной и двух (?) асбестовидных, хотя число, привода и свойства этих модификаций до сих пор еще окончательно не установлены и даже самый факт их существования как химич. индивидуумов до настоящего времени является спорным. Уд. в S03 (в жидком состоянии):
(°. 11· 16° 25° 40° 50° 100°
Уд. В. 1,944 1,940 1,904 1,833 1,781 1,529
<°пЛ. 16,8° (Smits нашел для льдовидной модификации ί°ηΛ 16,8°, для асбестовидной I—82,5° и для асбестовидной II—62,2°); t°Kun равна 44,S° (при 760 миллиметров) t°Kpum=218,3°; критическое давление 83,8 atm, критическая плотность 0,633. Плотность пара S03 равна 40 (кри 22,8°), что указывает на отсутствие полимеризации SOs в парах. Теплоты образования S03:
®тв. 60 "Ь 1,602S02ra3 + °502газ
= S03 тв. +103 700 Cal=S03 ж. +103 240 »
= S03 газ. + 91 000 »
= S03 aq +142 410 (141000) Cal=S03 тв. + 34 400 Cal=S03 ж. + 32 160 »
= S03 газ.+ 22 600 »
Теплота плавления льдовидной модификации 1,8 Cal/моль, асбестовидной I—2,9 Cal/моль, асбестовидной II—6,2 Cal/моль. Теплота возгонки тех же модификаций —соответственно 11,9, 13,0 и 16,3 Cal/моль. Теплота испарения жидкого S03150,9 cal/a, 12,072 cal/г-атом. Поверхностное натяжение γ жидкого S03 при 19° 34,17, при 44,9° 29,47. Коэфициент преломления reD =
= 1,40905, для газообразного S03 «D=1,000737 (при 0° и длине волны 589 ту). Диэлектрическая постоянная ε (для Я=84 при 19°) 3,64. S03 при нагревании диссоциирует на S02 и 02;
, iscbia гг>2]2
константа диссоциации кс——при различных температурах:
1° 528° 627° 727° 832“ 897°
fc.102 1,55-ΙΟ"3 3,16. ΙΟ"2 3.54.10-1 2,80 8,16
Пары S03 с парообразной или жидкой водой дымят на воздухе и образуют H2S04; S03 способен действовать как окислитель и как дегидратирующий агент. Отнимая воду от органических веществ, S03 обугливает их. Окислительная способность S03 характеризуется выделением иода и. брома из HJ и НВг, окислением фосфора и нек-рых металлов. S03 дает ряд соединений с кислотными оки, например NOa-S03, As203· •S03, Ρ2Οδ· 3SOs, Se02· S03 и т. д., дает продукты присоединения с Se, Те, J (SeS03, TeS03, JSO3), то есть максимальное координационное число серы для S03, равное 4. Присоединяя воду, S03 образует серную кислоту (смотрите).
Соли серной кислоты (сульфаты). Серная кислота образует средние соли типа R2S04 и кислые — RHS04. О нахождении сульфатов в природе "м. Сера. В технике и лаборатории сульфя гм получают растворением металлов, их окислов и карбонатов в кислоте, а также обменным разложением, причем либо получаемый сульфат должен быть менее растворим, чем исходный, например
Na2S04 + Ba(N03)2=2NaN03 + BaS04, либо меньшей растворимостью должен обладать второй продукт реакции, например
CaS04 + (NH4)2C03=СаС03 + (NH4)2S04.
Последняя реакция имеет большой технич. ин-
терес. Наконец сульфаты можно получать окислением сульфидов и сульфитов. Из нейтральных сульфатов многие плохо растворимы в воде. Основные соли нек-рых хорошо растворимых сульфатов также мало растворимы и выпадают при разбавлении или нагревании их растворов вследствие гидролиза (например основные соли Bi, Cr, Hg). Кислые сульфаты обычно хорошо растворимы. Температуры заметной термин. диссоциации сульфатов лежат довольно высоко (свыше 700—800°) кроме Fe2(S04)3(при 600° упругость разложения р=26 миллиметров, при 650° она равна 116 миллиметров, при 700° — 445 миллиметров). Кислые сульфаты при нагревании легко распадаются на к-ту и средний сульфат:
2KHS04=K2S04+ Н20 + SO3.
Сульфаты дают ряд двойных солей, например квасцы (смотрите). Кристаллогидраты известны почти для всех сульфатов. Нек-рые из сульфатов называются к у п о р о с а м и, напр медный купорос CuS04-5H20, железный купорос FeS04· -7Н20 и цинковый купорос ZnS04-7H20.
Нитроз и лсерная кислота H0-S0.2· •О-NO образуется при изготовлении H2S04 по камерному способу (смотрите Серная кислота)·, реакция (по Lunge) протекает по следующему уравнению:
N2O3 + 2H2SO4=2NO2S02OH-|-Il20.
Для получения твердой нитрозилсерной кислоты пропускают в сильно охлажденную азотную к-ту S02 до застывания массы. Высушивается масса при 20—30° или в вакууме. Твердая ни-трозилсерная к-та — ромбические кристаллы, плавящиеся при 73° с образованием ангидрида нитрозилсерной кислоты NO„ · S02 · OS02 · N02, a выделяющаяся вода разрушает часть нитрозилсерной к-ты. Нитрозилсеркая к-та растворяется в конц. H2S04. Она является сильным окислителем, в частности для S02; с РС15 реагирует с образованием хлорсульфоновой к-ты: N02S020H + PC15=C1S020H + NOC1 + POCI3;
с водой распадается на серную и азотистую кислоты:
no2so2oh+h2o=h2so4+hno2.
Нитрозилсерная к-та, как полагают, представляет таутомер, реагируя то как нитро- то как нитрозосоединение. Ее состав характеризуют обычно ур-ием:
no2so2oii s onoso2oh.
Соли нитрозилсерной кислоты неизвестны; ангидрид ее получается также действием S03 на N0:
2NO + 3SO3 —Ν02 ·S02 * О · S02*N02 + S02;
он образует белые кристаллы с 1°пл. 217° и Скип. 360°. Известен хлорангидрид нитрозилсерной кислоты N02S02C1, получаемый из NOC1 и S03: белая масса, разлагающаяся при нагревании и растворимая в олеуме.
Надсерная кислота H2S208. Химизм образования аналогичен химизму образования дитионовой к-ты, только электрон отнимается здесь не от НВ03-иона, а от HS04-nona. Получается электролизом серной кислоты (смотрите Перекиси). С водою надсерная к-та дает к-ту Каро:
H2S208+H20=H2S04 + H2S05. Кислота Каро H2S05 получается также действием перекиси водорода на надсерную к-ту: H2S208 + H202=2H2S05.
Обе последние кислоты являются окислителями (смотрите Перекиси).
Галоидные С. с. Сера, соединяясь с галоидами, образует обычно вещества типа S2R2. Кроме того известны соединения типа SR„ и SR4. Существование соединений типа SR2 пока сомнительно.
С фтором сера образует два соединения—S2F2 и SF8. Фтористая сера S2F2 получается при сплавлении серы с фтористым серебром при ί°ηΛ. серы.
2AgF+3S-Ag2S+S2F2.
S2F2—тяжелый бесцветный газ с запахом хлористой серы; водою разлагается, выделяя S02, HF и S. Мол. в газа 93, а при более высокой 1° лишь 86; обе величины заметно меньше, чем зто следует из ф-лы S2F2. При низкой (° застывает в кристаллы, плавящиеся при—105,5°. Уд. в жидкой S2F2 при—100° равеп 1,5. Шестифтористая сера SFr, образуется из элементов с выделением тепла (в медной трубке): бесцветный, не имеющий запаха, химически инертный, тяжелый газ, уд. в 5,03. Замерзает в кристаллич. массу с СПл. —55°. В жидком состоянии SFg стабильна лишь при повышенном давлении. Уд. в жидкой SF« D-S0 =1,31. SF6 мало растворима в воде; несколько лучше в е. В воздухе не горит. При 1°, близких к (°пл., реагирует со щелочнымс и щелочноземельными металлами; с H2S медлепно выделяет серу:
SF6+3H2S=3H2F2-|-4S.
Соединение интересно своей малой реакционной способностью и той прочностью, с которой удерживаются, очевидно за счет главной валентности, все шесть атомов F.
Соединения серы с хлором. Известны хлориды S2C12, SC12(?) и SC14. Наиболее постоянным из них является S2CI2; два других хлорида гораздо менее прочны, причем существование SC12 подвергается сомнению. Однохлористая (обыкновенная хлористая) с е-р a S2C12 получается при действии С1 на расплавленную серу. В технике эта реакция проводится в железных реакторах при 125—130°. Для этой же цели применяется иногда раствор S в хлористой сере, на к-рую действуют хлором на холоду. Кроме этого S2C12 получается при взаимодействии хлористого фосфора и серы по следующему уравнению:
PC15 + 2S=S2C12 + PC13
и сульфурилхлорида с серой по уравнению:
S02C12 + 2S=S2C12 + S02
в присутствии А1С13. Хлористая сера получается также при действии хлора на сульфиды, например
5BaS+4Cl2=BaS5+4BaCl2; BaS5+Cl2=BaCl2+5S; S2C12 желтая жидкость с неприятным запахом, Спл. —80°, Скип. 137,7°. Уд.‘в. 1,70941. Теплота образования 14 260 C.al (2Sa + Cl2(ra3^=S2Cl2(ra3j + 14 260 Cal). Плотность пара Л=4,70. Коэф. преломления nD=l,65298. Диэлектрич. постоянная (для А=схэ) при 12° равна 5,3; S2C12 хорошо растворяет (особенно при нагревании) серу, а также С12 и Вг2. В воде S«C12 нерастворима и быстро гидролизуется по ур-шо: ч
2S2C12 + 2H20=S02+ 3S+4HC1; гидролиз протекает в несколько стадий и сопровождается побочными реакциями. S2C12 является прекрасным растворителем для ”CS2, S02, H2S, Вг, J, хлоридов As, Sb, Sn, Cd, Hg. углеводородов и т. д. S2Cla ядовита, хотя и несколько. менее, чем сероуглерод. Применяется хлористая сера при вулканизации каучука холодным способом, для получения четыреххлористого углерода (несколько устаревший метод), этиленхлоргидрпна из гликоля, дихлор-гидрина из глицерина, для получения уксусного ангидрида и т. д. В войне 1914—18 гг. S2C12применялась в производстве а (смотрите) и хлористого а [*·]. S2C12 м. б. применена для извлечения серы из полисульфидов, например
BaS3 + S2Cl2=BaCl2 + 5S.
Т. 9. т. XX.
21
Ранее она применялась также для борьбы с вредителями в сельском хозяйстве.
Четыреххлористапсера SCI4, темнокоричневая жидкость, полученная Руффом (Ruff) действием С12 на S2CI2 в запаянной τρνΟκε. Замерзает в кристаллы, плавящиеся при —31°. При комнатной (° диссоциирует на С12 и S«CI2. Водою гидролизуется, образуя SO2 и HCI. Легко образует комплексные соединения типа SCljMeCln, где Me=Sbv, Snlv, Fe111, Ti, J. Получается кроме того |3] действием а на S02:
S02+2C0Cl2=SCl4-b2C02.
Двухлористая сера, коричнево-красная жидкость, по составу приблизительно отвечающая формуле SCI2. получающаяся при действии избытка хлора на S2C12; применяется при синтезе азотистой серы.
Из соединений серы е бромом известен лишь низший тип—бромистая сера S2Br2, полученная растворением серы в жидком броме. Красная жидкость уд. в 2,6355 (при 20°), 1°тг—16°, i°Kun, +54°. Разлагается водой аналогично S2C12. Употребляется в органическом синтезе для бронирования.
Соединения серы с иодом с достоверностью не известны.
Оксигалоидные соединения. Сера образует ряд оксигалоидных соединений типа SOCl2 и S02C12. из которых наибольшее значение имеет х л о-р и с т ы и с у л ь ф у р и л (сульфурил-хлорид) S02C12. Последний образуется при непосредственном соединении S02 и С12. Равновесие S02+C12= S02C12 при обычных темп-ре и давлении смещено в сторону образования S02C12, тем не менее взаимодействие имеет место лишь в присутствии катализаторов или химически активных лучей. Катализаторами служат активный уголь, уксусный ангидрид или камфора. Реакция над камфорой идет при комнатной г° с достаточной скоростью. По методу BASF [*] камфору растворяют в жидком S02 и вводят жидкий хлор. По англ, методу в реактор загружают некоторое количество готового S02C12 и в качестве катализатора — порошкообразный активный уголь, непрерывно взмучиваемый (механич. перемешиванием) в жидкой реакционной среде, затем пропускают непрерывный ток хлора и S02, выпуская время от времени образующийся S02C12 через фильтр. Дистиллированный S02C12 почти бесцветен, но при стоянии, особенно на свету, желтеет вследствие диссоциации и образования свободного С12. Для получения возможно более чистого S02C12 удаляют (по Вальдену) продукты разложения пропусканием инертного газа, например С02. Хлористый сульфурил — бесцветная, слабо дымящая жидкость с уд. в П" =1,70814 и t°hun. (при 760 миллиметров) 69,3°. Темп-pa замерзания определена ненадежно (от—63° до—46°). Теплота образования при синтезе: в02(газ) + СГ(газ)== 802С12(ж.) + 18 700 Cal. Теплота образования из элементов 89,540 Cal [8(тв.) + 02(газ)+С12(газ)== 80аС1;(ж.) + 89,540 CalJ. Средняя уд. теплоемкость (в интервале 15 — 63°) 0,233. Коэф. преломления лв,= 1,44375. Электропроводность S02C12 очень мала. 802С!2 является растворителем для ряда иодидов (Rb, Cd, Hg, Sn, As), для FeCl3, углеводородов и т. д. S02C12 хорошо смешивается с жидким S02; S02C12 гидролизуется водой (холодной) сравнительно медленно, с присоединением сначала одной,а затем и второй ОН-группы и отщеплением НС1; S02C12 обладает сильным хлорирующим действием, к-рое усиливается в присутствии катализаторов; так, в присутствии А1С13, S02C12хлорирует растворенную в нем серу при обычной ί° (в отсутствии А1С13 процесс протекает при 200°). Натрий, цинк, ртуть, сурьма, и фосфор (до PG13) хлорируются S02C12 уже при комнатной 1°. Окислы металлов не реагируют обычно с S02C13 при комнатной ί° (кроме окислов Hg и РЬ). В органич. синтезе S02CI2
применяется для производства уксусного ангидрида из уксусной кислоты и в ряде реакций хлорирования. В военно-химическом деле S02C12 имел некоторое применение при снаряжении химических снарядов, в которых он играл роль растворителя для О. В. и ды-мообразователя.
Хлористый т и о н и л (тионилхлорид) SOCI2 получен впервые действием S02 на РС15; образуется также при действии С120 на серу; обычно же получают SOCl2 окислением двухлористой серы серным ангидридом:
SC12 + S03=S0C]2 + S02.
Во избежание потерь хлора на герм, ф-ке Grisheim применяется не SC12, a S2CI2, и выпадающая сера регенерируется в виде S2CI2:
3S2Cl2 + S03=3S0Cl2-HS; 4S + 2CI2=2S2C12;
SOCI2 — бесцветная жидкость с неприятным запахом, напоминающим S02. Уд. вес 1,675. Температура замерзания —105°, (°кгт. 78,8°, теплота испарения 54,5 cal/a или 6 480 cal/мол. Средняя уд. теплоемкость (между 17 и 60°) 0,243. Теплота образования 47 200 Cal.
s(TB.)-r0>5O2(ra3)+C!2;ra3)=soc|2;>K.)+47 ^00 Cal. Коэф. преломления пв == 1,5271. Водою SOCI2 легко гидролизуется:
S0Cl2 + H20=S02 + 2HCl.
SOCI2 обладает хлорирующим и окислительным действием. Так, Se, Sb, Zn окисляются SOCI2, причем образуются соответствующие высшие хлориды. Железо хлорируется но ур-ию
2Fe+4S0CI2=2FeCl3+2S02 + S2Cl2 (в присутствии избытка железа получаются FeCl2 и FeS). Олово с избытком SOCI2 дает S11CI4; сурьма, золото и нек-рые другие металлы реагируют с SOCI2 в интервале i° 20—200°. Окислы металлов хлорируются SOCl2до безводных хлоридов; эта реакция представляет технич. интерес. НВг и Ш реагируют с SOCl2, причем первый образует SOBr2 и HCI, а второй—S02, HCI, J2 и серу. ΝΗ3 и H2S реагируют с SOCI2 более сложно. SOCI2 с А1С13 и ΛIВгз дает комплексные соединения — 2А1С13-•SOCI2 и 2А1Вг3SOBr2. С органич. соединениями S0C12вступает в разнообразные реакции.
Оксихлорид серы S203Cl4—единственное твердое соединение серы типа хлорокиси. Получается при пропускании влажного хлора в смесь S2C12 и С12 или действием хлорсульфоновой кислоты на SCI4:
S02C1(0H) + SC14 — S2O3CI4 + HCI; игольчатые кристаллы со своеобразным запахом; ί°ηΛ57° (с частичным разложением). При хранении разлагается постепенно (S203Cl4.-=S0Cl2 + S02Cl2), водой — быстро.
Хлорсульфоновая к-т а С1803Н, бесцветная, сильно дымящая на воздухе жидкость, при сильном охлаждении застывающая в твердую массу, плавящуюся при —81—80°; t°Kun. (сопровождающаяся частичным разложением) 155—156° (при 14 миллиметров давления); Dia=1,776. С водой разлагается со ом на НС1 и Н2804; с Те дает красную, с Se зеленую окраску. При нагревании с Н2804 дает S02, HCI, H2S04 и S2C12, с 100%-ной Н202 разлагается на к-ту Каро и надсерную к-ту; сульфирует ароматич_ соединения. С ее помощью из ароматич. углеводородов получают хлориды серной к-ты. Соли ее, например ClS03Na, получают нагреванием кислоты с хлористыми металлами, например с NaCl. К-ту получают из пиросерной к-ты, вводя в нее сухие пары НС1. Целесообразнее всего действовать НС1 на газообразный S03 в реакционных башнях или пропускать газ в готовую C1S03H. Применяется как контактное вещество при изготовлении сахарина, при ацетилировании целлюлозы. Смесью C1S03H (60%) с SG3 (40%) во время войны пользовались для получения дымовых завес.
Т и о н и л б р о м и д SOBr2, оранжевая жидкость, в;8=2,68, (°кип. (при давлении 400 ж.и)-^68°, f°3acm. 50°; уд. в (при 18“) 2,68.
Азотистая сера, или сернистый азот, N4S4. В настоящее время этому соединению приписывают циклич. структуру—с чередованием атомов S и N в восьмичлен-ном цикле (—N—S—)4- УД· вес N4S4 2,24; 1°пЛм 178°; ает от удара, трения и при нагревании до 207°; при поджигании горит без а; растворима в бепзоле-хлороформе, CCI4, ах, CS2 и. жидком, аммиаке. Но-
лучается пропусканием сухого NH3 в раствор S2CI2 в бензоле при охлаждении; перекристаллизовывается Г» | из CS2 или ССЦ. Употребляется в запалах, наир, для тринитроа, в смеси с азидом свинца feJ. Было выделено также аналогичное соединение, соответствующее гидриду сернистого азота (HSN), также с циклич. структурой (—N—SH—)4.
Из роданилов серы известны S2(CSN)2 и S(CSN)2 — твердые бесцветные кристаллич. вещества.
Лит.: I) Г. П. 223274; 2) Ullm. Enz., В. 10, р. 143 3) Г. П. 284935; «) Г. П. 138531; *) W а I b i n g, «Z anorg. Ch.», Lpz., 1908, v. 57, p. 281; e) W 0 h 1 e r, «Z ang. Ch.», 1911, v. 24, p. 2089. См. также Сера в Сер пая кислота. В· Ормонт