 > Техника, страница 81 > Смачивание
> Техника, страница 81 > Смачивание
Смачивание
Смачивание, явление, наблюдаемое на границе соприкосновения трех фаз, одна из которых является обычно твердым телом (фаза 3), а две другие—жидкостями или жидкостью и газом (фазы 1 и 2, например вода и бензол или вода и воздух). Поверхность раздела фаз 1 и 2, г. е. жидкая поверхность раздела, пересекает твердую поверхность по некоторой линии, назы-
стью, чем водой, и потому называется гидрофобным. Для него а13 > σ23. Кроме рассмотренного явления С. в собственном смысле слова (его можно назвать С. при растекании) можно различать еще С. при прилипании иС.при погружении. Прилипание поверхности жидкости к твердой поверхности играет особую роль в процессах склеивания, С. же при растекании имеет большое технич. значение при лакировании (и вообще покрытии жидкими пленками), в моющем действии, при защите растений покрытием их листвы растворами инсек-тофунгисидов и т. д. С. при погружении называется явление, наблюдаемое при погружении твердого тела, раньше находившегося в воздухе, в какую-либо жидкость (или, вообще говоря, при погружении тела (3) в одну из двух жидкостей, (1) или (2), если раньше оно находилось целиком в другой жидкости). Этот случай представляет особенный интерес, когда твердое тело является порошком, то есть когда поверхность S соприкосновения его с жидкостью весьма велика. Полное изменение энергии Е при С. погружением, выделяющейся· в виде тепла, называется теплотой С.
42з=-(#2з-#з)£; qi3=-(E13-E,)S. Обычно, когда теплоты С. измеряются при погружении порошка из сухого воздуха (2) в жидкость (1), Е23 < Е3, q23 > 0, так как при С. поверхностная энергия порошка Е3 понижается до Е?1 з за счет заполнения некомпенсированных сфер действия поверхностных молекул твердого тела. При этом для гидрофильных порошков, у которых поверхностная энергия на границе с водой меньше, чем на границе с неполярной углеводородной жидкостью (В > 0), теплота С. водою q13 получается значительно большей теплоты С. бензолом или гептаном
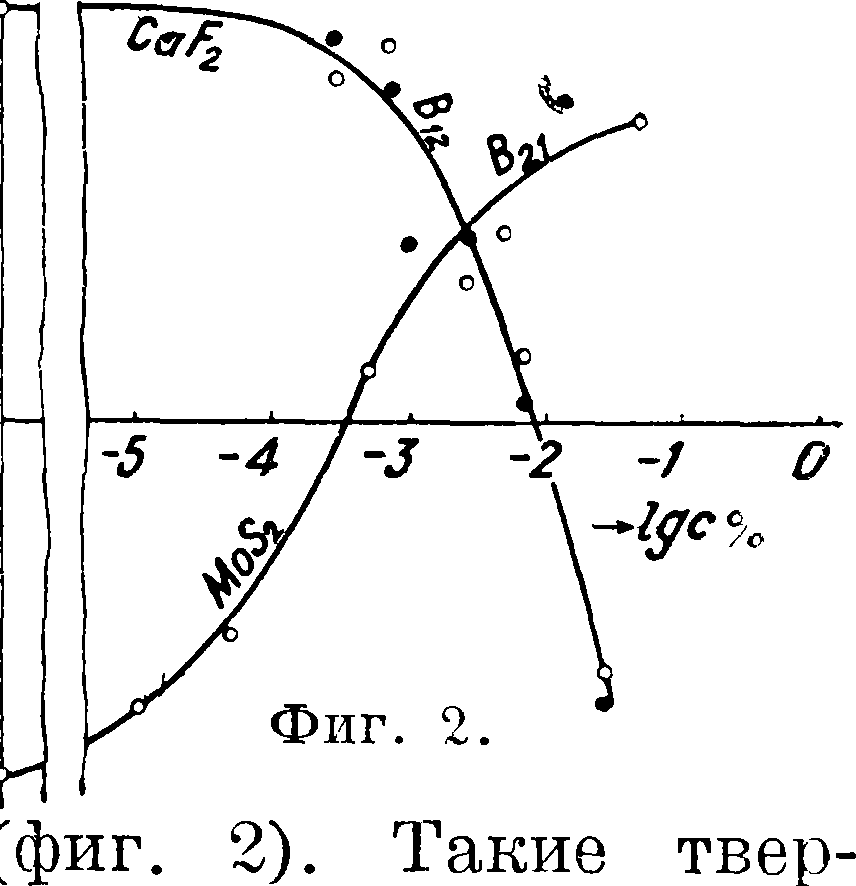
(бензином) #23. Отношение ^13=/3^1 называется термической характеристикой С.; β > 1 для гидрофильных тел; для гидрофобных же тел наблюдается обратное: q23 > #13 и β < 1. Для тех и других порошков наибольшие теплоты смачивания получаются при погружении в жидкости промежуточной полярности (смотрите) вследствие того, что в этих случаях разность полярностей «порошок — жидкость» будет наименьшая.
Классифицируя все твердые тела по значениям избирательного С. можно представить свойства поверхностей твердого тела точкой в диаграмме смачивания.
Диаграмма С. β<± β>1
-1 Б < О О Б > 0 +1
Гидрофобные Гидрофильные поверхности поверхности
Все гидрофильные тела попадут при этом в правую часть диаграммы (таковы — слюда, кварц и другие окисленные минералы), гидрофобные же—в левую часть (тальк, молибденит, графит). Металлы займут промежуточное положение. в значительной степени связанное с электрическим состоянием и окисленностью их поверхности. Из (1) видно, что твердое тело имеет наименьшую разность полярностей, то есть наименьшее различие в интенсивности между-молекулярных сил на границе с той жидкостью, которая лучше его смачивает (для гидрофильных тел—с водою, для гидрофобных—с неполярными углеводородами). В связи с этим на границе с жидкостью, лучше смачивающей (избирательно) данное твердое тело, молекулярные силы, действующие на частицы пограничного слоя, наиболее полно компенсированы, что соответствует наименьшему избытку свободной энергии этого слоя. Избирательное С. есть процесс, связанный при t= Const с уменьшением свободной энергии системы из участвующих в нем трех фаз. Растворимость твердого тела также больше в той фазе, которой оно лучше смачивается: гидрофильные тела лучше растворимы (истинно или коллоидно), то есть лучше пептизируются, в воде, чем в углеводородной среде. Таковы гетерополярные кристаллы солей, гидрофильные коллоиды (желатина). Обратное явление наблюдается для гидрофобных тел — гомеополярных кристаллов типа твердых углеводородов—парафин, олеофильные коллоиды (каучук).
С. растеканием возникает во всех случаях, когда образуется линейная граница соприкосновения трех фаз (1,2,3)—п е р и м е т р С., то есть когда поверхность раздела «жидкость (1)—*
жидкость (2)» или «жидкость—газ» приходит в соприкосновение с поверхностью твердого тела (3), пересекая ее. При этом свободная поверхностная энергия <т12 на жидкой поверхности раздела не вызывала никаких односторонне-направленных сил до тех пор, пока поверхность (1, 2) была замкнутой. При образовании же периметра С., ограничивающего свободную поверхность (1, 2), σ21 дает направленную силу, действующую по периметру нормально к нему и в плоскости, касательной к (1, 2). Величина проекции этой «силы Сона плоскость, касательную к твердой поверхности в данной точке периметра С., дается соотношением:=σ12 · cos θ=σ12 В (в дин /см длины периметра). Эта сила м. б. названа флотационной силой и играет большую роль в осуществлении процессов флотации (смотрите) полезных ископаемых, основанных на их селективном несмачивании и имеющих громадное технйч. значение (смотрите Капиллярные явления). Величина С. весьма чувствительно зависит от образования адсорбционных слоев на смачиваемой твердой поверхности, то есть от концентрации поверхностно-активных веществ в окружающей среде. Эта зависимость имеет большое технйч. значение, т. к. количественно определяет действие смачивателей, то есть поверхностно-активных веществ (к о н т а кто в), улучшающих смачиваемость данной (гидрофобной) поверхности водной средой при крашении, а также и обратное действие флотационных реагенто в—понижение или задержку ими С. твердой поверхности водной средой. Механизм таких влияний состоит в следующем: если твердое тело первоначально не смачивается водой, то есть лучше смачивается какой-либо· углеводородной жидкостью, например керосином, бензолом в присутствии воды, то есть является гидрофобным, то при адсорбции к твердому телу поворачиваются неполярные углеводородные части адсорбирующих молекул, а их полярные группы (карбоксилы, гидроксилы) ориентируются вглубь водной среды, имея к ней большее сродство и покрывая всю поверхность как бы гидратированной пленкой, создающей постепенный переход—«мостик»—между обеими фазами, то есть в“аюв улучшающей сма- +0К чиваниеводнойсре- +06дой. Те же самые по- ’ верхностно - актив- * о,4 ные вещества, ад-сорбируясь на гид- * * рофильной поверх- о ности, то есть на по- Λ-02
верхности твердого · тела, первоначаль- -о,4 но смачиваемого во-дой, вызывают ее ~0,6< несмачивание ( дые тела имеют обычно высокополярную структуру—междумо л екулярные силы их весьма значительны; они представляют собой обычно гетерополярные кристаллы, решетка которых построена из разноименных ионов (таково большинство минералов). При адсорбции на их поверхности полярных молекул полярные группы последних поворачиваются к минералу, а углеводородные части, обращаясь наружу, покрывают минерал, несмачиваемый водой, пленкой, представляющей собою как бы тончайший слой парафина. Образованием подобных же адсорбционных слоев, но полярными группами
Таблица 1Т еплоты смачивания q в cal/г [з].
| Порошок | Порошок+ вода (д13) | Порошок + углеводород («2 з) | β |
| Двуокись кремния (S i О 2 из силикагеля). | 11,1 | 6,1 | 1,8 |
| Уголь из сахара, обеззоленный по Дубинину *. | 11,2 | 30,0 | 0,37 |
| * Тот ше уголь-fi-амиловый : <2=38,1; тот ше | |||
| уголь+ я-масляная к-та: | <2=43,9. | ||
наружу обусловлены между прочим и моющие свойства поверхностно - активных веществ— смачивателей, которые, адсорбируясь на жирной поверхности или на поверхности твердых частиц «загрязнения», улучшают их смачивание водной средой, в то же время пептизируя их, то есть препятствуя их прилипанию друг к другу и к твердым поверхностям.
Влияние адсорбционных слоев на С. и гистерезис С. При образовании периметра С. краевой угол Θ, вообще говоря, не соответствует равновесному условию, выражаемому основным ур-ием
CTl2 COS=σ23
но зависит от времени существования периметра, гладкости твердой поверхности, порядка С., концентрации поверхностно-активных веществ в окружающей среде и t°. Такие задержки в достижении равновесных значений С., обусловленные своеобразным трением при перемещении периметра С. по твердой поверхности, носят общее название гистерезиса С. и имеют основное значение во всех процессах С. и их применений. Только для жидких границ раздела «жидкость (1)—жидкость (2)—газ или 1жидкость (3)» гистерезис С. обычно=0 [·] в Эйду предельной подвижности периметра. Для квази-равновесных случаев избирательного С.
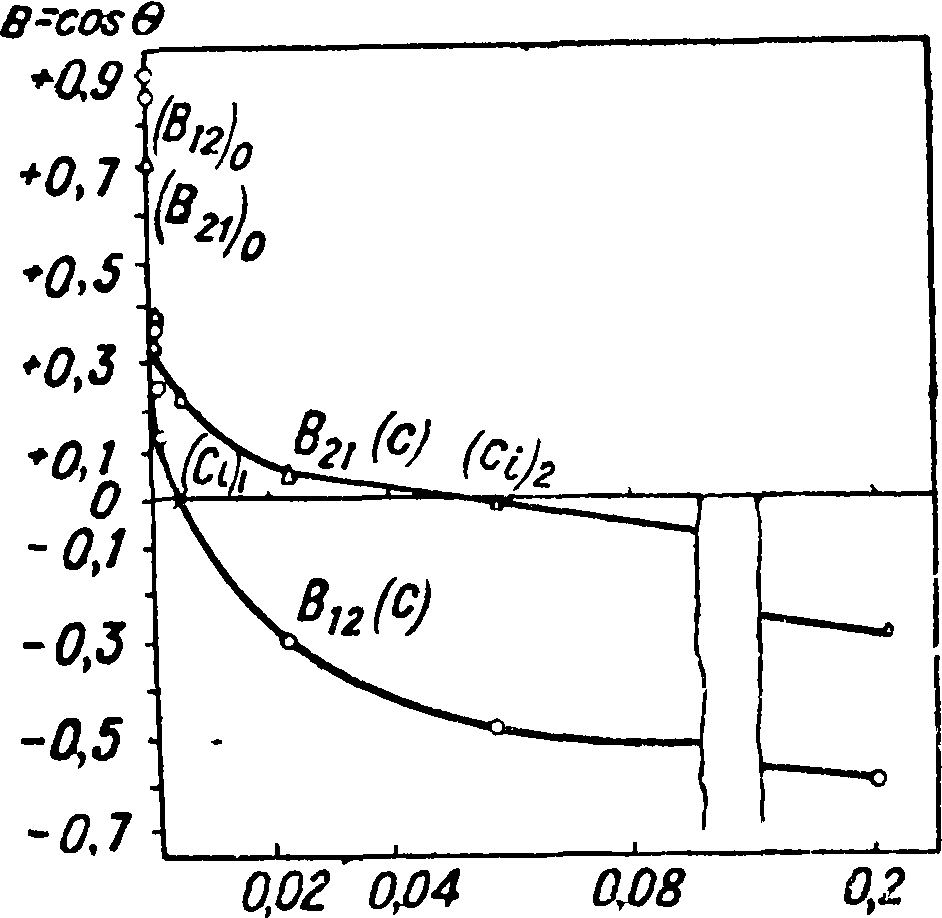
на границе твердое тело J угл^д^ор°^ особенно удобно изучать явления гистерезиса краевого угла в присутствии адсорбционных слоев на твердой поверхности, измеряя величину, названную нами «статическим гистерезисом смачивания» и даваемую разностью двух значений С. (В21~В12), получаемых при различном порядке С. твердой поверхности жидкостями (1) и (2). В21 измеряется при погружении твердого тела в жидкость (1) и при нанесении затем на его поверхность капли жидкости (2). При обратном порядке С. (В12) тело (3) сначала погружается в жидкую среду (2) и затем на его поверхность наносится капля жидкости (1). Рассмотрим изменения С. В с концентрацией поверхностно-активного вещества, адсорбирующегося на твердой поверхности (3), то есть характер т. н. изотерм избирательного С., и процессы, приводящие к статич. гистерезису, отдельно для случаев гидрофильных и гидрофобных поверхностей.
I. Гидрофильные поверхности, В0>0. В отсутствии поверхностно-активного вещества (при с=0) всегда имеем
В12 < В 21 И (В1а < В i ^ B2i)c=_Q
(В21 Bi^)c==Q^ 0.
Действительно, в случае (1, 2) (фигура 1) расплыванию капли воды отвечает уменьшение краевого угла θ12, то есть увеличение С.: В12=cos θ12. Это расплывание капли происходит, вообще говоря, не вполне до равновесного значения Bit так как этому препятствуют силы трения, действующие по периметру, и задержки вследствие неровностей и трещин на неидеально гладкой твердой поверхности. В случае же (2,1) расплыванию капли углеводородной жидкости отвечало бы увеличение угла д21, то есть уменьшение В21=COS 021.
При введении в систему поверхностно-активного реагента, равновесно распределяющегося между обеими жидкими фазами (1) и (2), он адсорбируется гидрофильной твердой поверхностью преимущественно из неполярной углеводородной среды,
причем полярные группы в достаточно насыщенном адсорбционном слое ориентируются к твердому телу, а углеводородные части молекул поворачиваются во внешнюю среду, вызывая уменьшение С. водой, то есть создание н а-масливания твердой поверхности—покрытие ее как бы тонкой парафиновой плеткой. В случае, обозначаемом нами (2, 1), когда твердая поверхность (3) предварительно погружена в водную среду, адсорбционный слой полярных молекул формируется на твердом теле лишь в весьма слабой степени с неясной, неполной ориентацией. При поднесении затем снизу капли углеводородной жидкости на поверхности раздела этой капли с водной средой (2|1) ориентация адсорбированных молекул реагента (могущего играть при этом роль стабилизатора—эмульгатора) та же, что и на образующейся поверхности (2|3) контакта капли углеводорода с твердым телом (минералом). Капля (2) будет поэтому несколько расплываться по твердой поверхности (3) почти вплоть до равновесного значения Вь все же немного не достигая его из-за наличия трения и задержек по периметру (гистерезиса). Все же мы будем иметь В21 > Вг·, хотя разность Да — В{= b21, измеряющая задержку в достижении равновесного значения Вг·, и будет невелика. Иное будет происходить в случае В12 при предварительном погружении поверхности минерала (3) в неполярную углеводородную среду (2). При этом твердая поверхность еще до капания на нее сверху капли водной жидкости (1) оказывается покрытой адсорбционным слоем, сформировавшимся на ней в оптимально благоприятных условиях. Поэтому растекание капли (1) по адсорбционному слою должно встретить здесь особенные препятствия и остановиться, значительно не достигнув равновесного значения Вг·, что усугубляется также обратной ориентацией адсорбированных молекул на границе капля—среда (1, 2) по сравнению с твердой поверхностью (1, 3). Разность δ 12 — в В12 > 0,
измеряющая в этом случае гистерезис, оказывается действительно весьма значительной. При увеличении концентрации с поверхностно-активного реагента по мере насыщения адсорбционного слоя, как мы уже видели, обе смачиваемости В21 и В12 всегда убывают, переходя в точке инверсии С. c^ci через значение В=0, то есть изменяя знак. Однако понятно, что инверсия для В12 наступает у гидрофильных поверхностей раньше (при cj·), чем для В21 (при с}):
Сг < С i·
Разность
В21 — В12=b 21 4- b12,
являющаяся всегда положительной величиной и называемая нами статическим гистерезисом С., с возрастанием концентрации С. растет, достигая наибольшего предельного значения при полном насыщении адсорбционного слоя. Величины b, измеряющие степень не-достигнутости равновесных значений, дают меру своеобразного статич. трения по периметру при растекании капли. Это трение наибольшее при растекании по адсорбционному слою в условиях В12.
Статический гистерезис дает в наших опытах вполне воспроизводимые значения (В21--В12), заметно не изменяющиеся со временем; однако несомненно, что с течением времени в резуль-
тате весьма медленной кинетики расплывания капли могли бы наступить значения, более близкие к равновесным. При равновесии капли в отсутствии трения по периметру (когда ги-стерезис=0)
&2Z = <*18 ^12 COS ® ·
Когда же достигнуто «равновесие» растекающейся капли при наличии трения
<?23= σΐ3 + σΐ2 cos 012 + Α12и
σ23 = а13 Η" σΐ2 C0S ®21 Η" ^2l>
здесь Δ12, Δ21—силы статич. трения по периметру (в дин/сж), причем А12=b12о12 и А21=b21о12. Когда растекающаяся капля еще не достигла состояния «равновесия», сила F, вызывающая дальнейшее растекание капли, дается ур-ием
#12 = (°23 ^13) а12 COS Θ12
и
F21 = (о’гз <Кз) σΐ2 COS $2j,
в к-ром <т13 и σ23 постоянны в процессе растекания и только cos 012 (cos 021) величина переменная. Θ уменьшается, a cos Θ увеличивается, и следовательно при растекании капли сила F непрерывно убывает, и растекание может происходить лишь до тех пор, пока F еще остается больше, чем сила трения, т. e. пока#>/1. При значении же 0ί2=θ12, определяемом условиями F12=z112 и F21=A2l9 растекание прекращается (сила, его вызывающая, уравновешивается по периметру статич. трением), и так. обр. В12 и Β2ίотвечают квази-равновесным условиям. В отсутствии адсорбционных слоев и на достаточно гладких (например на жидких) поверхностях мы имеем А=0 и значение С. соответствует тер-модинамич. равновесию
Аю — А9 i
-«12=^21=0, #=0, В12^В21=В£
<^23~σ13
На недостаточно гладкой поверхности А>0. При образовании адсорбционного слоя А всегда растет с концентрацией поверхностно - активного реагента, стремясь к максимальному предельному значению при насыщении слоя. Углы, соответствующие остановкам растекания вследствие трения по периметру капли в условиях
Концентриииясг-мол^п£#,^0?8керосине (1,2) И (2,1), Т. Θ.
Фигура з. квази-равновесные гистерезисные углы θ12 и 021» непосредственно измеряются в наших опытах, но так как σ23 и σ13 остаются, вообще говоря, неизвестными, то вычислить можно не А12 и А21 в отдельности, а лишь их сумму (фигура 3):
^12+^21
σ12
Во
12*
II. Гидрофобные поверхности (В0<0). В отсутствии поверхностно-активного реагента (при с=0)
#12 « #* < В?1.
При введении поверхностно-активного вещества молекулы его адсорбируются на гидрофобной поверхности (3) преимущественно из водной среды (полярной) (1), соответственно большей разности полярностей σ12 > σ23, причем ориен тация в адсорбционном слое, приближающемся к насыщению, отвечает поворачиванию полярных групп во внешнюю среду. Поэтому избирательное С. гидрофобной поверхности всегда растет при насыщении адсорбционного слоя при переходе через 0 в точке инверсии, меняя знак от (—) к (+).
Гистерезис значительно больше для Β2χ, так как растекание капли против уже образовавшегося адсорбционного слоя сильно затруднено. Возрастание В с концентрацией и наступление точки инверсии оказываются значительно резче выраженными в том случае, если гидрофобная поверхность (3) предварительно «подготовлена» к погружениям в водную среду, то есть образованию на ней адсорбционного слоя при наиболее благоприятных условиях
#12 #21 > 0*
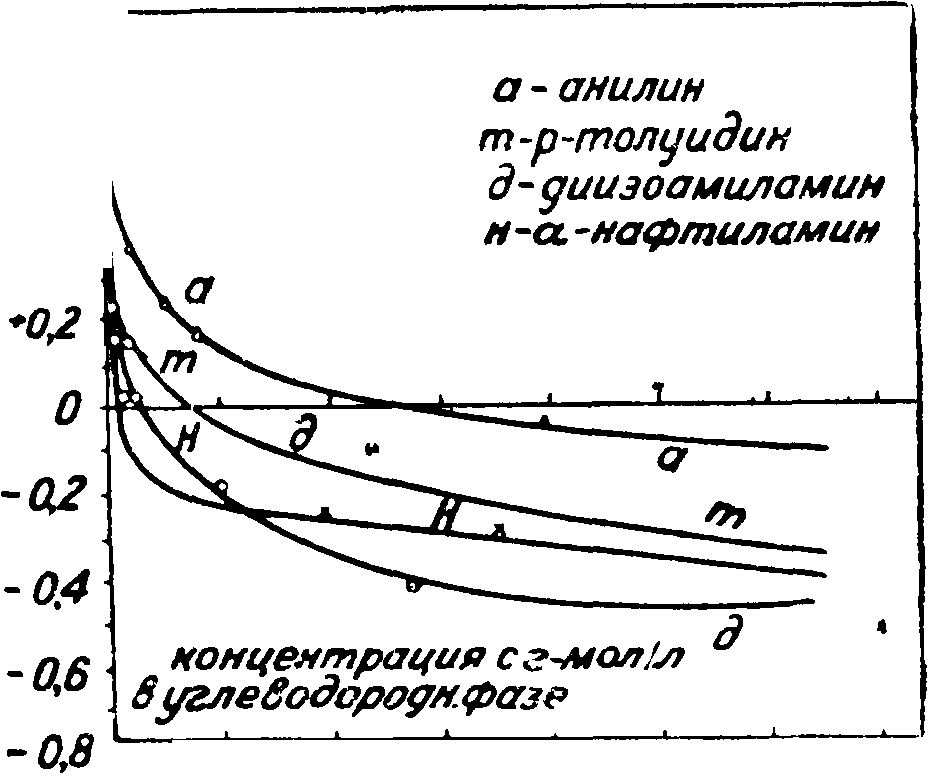
Изотермы. Кривые, дающие зависимость смачиваемости от концентрации B=f(c) (фигура с> 3, 4), мы называ- в^вгемизотермами *ол|
*0.6 I
*0.4 I
С. Исследовав их в разнообразных случаях, мы можем вкратце сформулировать полученные результаты относительно вида этих кривых слод. обр.
1. Как мы видели выше, избирательное С. убывает с с если при с=0
OJ QJ Q3 0,4 45 0.е а? Фигура 4.
оно положительно (В0 > 0), и возрастает с с при В0 < 0, то есть:
#о
2. Все изотермы м. б. разделены на два типа:
1) изотермы, дающие инверсию С., т.е. переходящие через В=0 при конечной концентрации реагента—имеющие точку инверсии с=с£(0 < с£ < оо)} в которой В переходит через #== 0. Когда при 0 < с < ci9 В0> В >0, а при с > сг·, В < 0, мы имеем типичные флотореагенты; в обратном же случае, когда при 0 < с < с£, В < 0, а при с > с£ В > 0, реагент играет роль смачивателя. К этому типу изотерм относятся: а) все изотермы избирательного С. на границе твер1 углеводород ^ ч
для случаев В12=/12 (с)
дое тело
. водная среда и #2i=/21(c); б) изотермы смачиваемости для абсолютно гидрофобных твердых тел типа парафина, то есть изотермы для границы твердое тело 1^т;-;;„в!13^ух____, когда В0 < 0 (в равнове-
водныи раствор сии)—для обоих случаев В12 и В21, и в) изотермы С. типа В12=/12 (с) (при В0 > 0) для обычно гидрофильных твердых тел (минералов) на границе твердое тело 1—и раствор При нанесении воздух на их поверхность капли водного раствора поверхностно-активного реагента, полярные группы ориентирующихся молекул которого химически реагируют с поверхностным слоем тела, или при предварительной обработке твердой поверхности водными растворами такого реагента в различных концентрациях и последующем нанесении капли соответствующего раствора или чистой воды. Все указанные виды изотерм дают точку инверсии, причем в последнем случае при образовании адсорбционно-химич. соединений на твердой поверхности
fi лежит в области весьма малых концентрации (порядка 0,001-1-0,01% даже для не очень высоких гомологов). 2) Изотермы, не дающие точки инверсии. Эти изотермы лежат целиком в области положительной смачиваемости В0> В > 0. Сюда относятся изотермы вида В21=
= /«(с) для границы твердое тело раствор
и изотермы вида В12=/12(с) для того же случая, когда поверхностно-активный реагент не реагирует химически с поверхностью минерала. Предельное значение смачиваемости, достигаемое при этом lim В=Blt Вг> 0, ив
С—>оо частном случае мы можем иметь Вг=0; тогда надо считать, что сг-= оо—точка инверсии отдалена на оо.
3. Довольно резко изменяясь с концентрацией в начале кривой (при малых с), когда адсорбционный слой еще далек от насыщения, рюотермы С. вполне аналогично адсорбционным изотермам становятся пологими при насыщении адсорбционного слоя, определяющего условия С., и при полном насыщении (при предельно полной ориентации молекул реагента) достигают предельного значения Вг=lim В; как мы с—>со видели выше, для изотерм первого типа, с точкой инверсии В0· В, < 0, Вг и Ва имеют разные знаки, для изотерм же второго типа Bl9 как и В0, больше 0.
4. В области ненасыщенных адсорбционных слоев при малых с кривые B^f(c) обычно не имеют точки перегиба и в этом простейшем и наиболее часто встречающемся случае сохраняют, как и изотермы адсорбции, постоянный знак кривизны на всем протяжении. При этом, если в» > о, ^ < О, Тс (--жг) < о, Т. е. -я7Г > о,
< о,
02 В
дс дВ
дс )
> 0 и < 0, то есть вторая
0С2
дс
Ос2
| реагента, | т. к.: | ||
| to
о 1 о |
_В_о^ _ | (дВ. | 1 |
| £
1 о |
ч ~ | UcJo’ | Во |
производная сохраняет вдоль всей кривой тот же знак, что и В». При этом максимальное абсолютное значение флотационной активности IдВI „ I ОБ I
I д~ отвечает началу кривой, то есть=шах.
5. Точки инверсии обычно для достаточно флотактивных реагентов лежат в области резкого, почти линейного хода кривых В(с) вдалеке от насыщения адсорбционных слоев, и потому —= а можно принять за меру флота-
ционной, или коллекторной, активности или смачивающего действия
Флотактивность а,
г дВ
К дс )о “ а
( дВ 1
. или —1-^7-gj, для поверхностно-активных веществ, химически не реагирующих в адсорбционном слое (неспецифичных для данного минерала), пропорциональна их поверхностной активности G0=
= — на какой-либо нейтральной поверхности раздела, например поверхности «водныйраствор i воздух», или следовательно обратно пропорциональна растворимости реагента в воде. Эти закономерности особенно хорошо оправдываются для членов одного итого же гомологии, ряда: из этого следует, что с удлинением нормальной углеводородной цепи молекулы (в гомологии. ряду) на 1 звено—СН2—флотактивность должна возрастать в 3—3,5 раза, как и поверхностная активность, согласно правилу
Траубе. Для нахождения зависимости В от с то есть ур-ия кривой В=/(с), следует установить связь между смачиваемостью и величинами, характеризующими состояние поверхностных слоев: σ— поверхностным натяжением или
Г—адсорбцией. Каждой данной степени покрытия поверхности адсорбированными молекулами поверхностно-активного реагента, то есть каждой данной средней ориентации этих молекул, отвечает свое значение В, причем изменение В сравнительно с начальным значением В0 для чистой поверхности можно считать пропорциональным степени адсорбционного покрытия поверхности:
В=Ватк.^·, (2)
здесь к—коэф. пропорциональности, a=х—
относительное покрытие поверхности, изменяющееся от х=0 (Г=0) при с=0 (В=В0) до х=1 (Г=Г оо=пределу адсорбции) при с -> оо
jn
(В=В0 т к=Вх). Подставляя в (2) для ^ - х значение из уравнения изотермы адсорбции Лангмюира
k=(3)
находим:
В - В0 т Тс или, т. к. из предельного условия при ж=1 и ft=Во т Ви
В=В0Т(В0-В1)
(4)
адсорбционную активность -=а в ур-ии (4) можно заменить через флотактивность а7=—
се или через концентрацию сг· в точке инверсии, воспользовавшись условием: при с=сг· В=0, то есть
Во — (В0 — Βχ) - с/
Отсюда
Ч + α
Вх
" Во
= 0.
Это соотношение связывает адсорбционную активность --=а по уравнению (3)
(
дГ Г о» _ л дв)о ~ « ” 00
ИЛИ
r = _L (<ЗГЛ -’ ~ Гт ас о дс /о с флотационной активностью или смачивающим действием α= —(б^)0, показывая, что эти величины пропорциональны друг другу Во „/.
α= ·
в а и а имеют размерность, обратную концентрации [сТ1, то есть размерность разведения V=-9
и выражаются в л/моль. Окончательно ур-ие изотермы С. принимает следующую форму:
в=в0 - (в0 - во
Βι
с п~ ci
в О
(5)
В0-В Во
Βρ — Βι BqC — BiC{
Это ур-ие не содержит ни одной произвольной постоянной: по экспериментально найденным
£0i ct и Вг можно вычислить с помощью (5) В для любой с то есть построить теоретическую изотерму. Таблица 2 и 3 показывают, что уравнение (4)
Таблица 2, — Малахи т—в. одный раствор геп-типовой к-ты- воздух. В0=+ 0,955, Вх=-0,70, сг-= 0,0018% (В=0).
| 1 с моль /л | Вэ
(эксгхер.) |
вв
(вычисл.) |
Отклонение Вэ ~ Вв |
| 1
I 1 8-10-5 |
+0,90 | + 0,870 | + 0,03 |
| ! 16-10-5 | + 0,80 | +0,793 | + 0,01 |
| 4-10-4 | + 0,61 | + 0.601 | + 0,01 |
| 9,6-10-4 | + 0,35 | + 0,302 | + 0,05 |
| 1,61-10-3 | + 0,10 | + 0,085 | + 0,01 1 |
| 4-10-3 | -0,29 | -0,255 | -0,03 1 |
| 1·χ0-* | -0,19 | -0,188 | ! -0,00 1 |
| 1,6-10-2 | -0,61 | -0,561 | 1 -0,05 |
или (5) действительно хорошо подтверждается нашими измерениями в самых разнообразных случаях.
Лит.: !) Наумов В., Химия коллоидов, 3 изд., Л., 1932; а) Т а > Оман А., Лабораторные работы по физико-химии коллоидов и теории флотации, М.—Л., 1932; его же, «Журнал физ. химии», М., 1930, т. 1, 4ΐό; 3) РебиндерП.и КраюшкинаЛ., «Жури, ирикл. физ.», М., 1929, т. 6, стр. 153; 4) FuchsN., «Koll. Ztsclir.», В. 52, р. 262, Dresden, 1930.—Р е б и н-д е р П., «Жури. физ. химии», М., 1930, т. 1, 4H5; Л и-пец М. и Римская М., «Цветные металлы», М., 1931; их же, «Журнал физ. химии», М., 1930, т. 1, 4ΐό; Липец М., Ребиндер П. и РимскаяМ., там же, М., 1931; D и р г έ, Theorie m^canique de la cha-leur, P., 1869, p. 393; Freundlich H., Kapillarche-mier B. 1, 4 Aufl., Lpz., 1932; Hoffmann, «Ztsclir f phys. Chemie», Lpz., 1913, B. 83, p. 393; К e i n d e r s, «Ann. der Physik», Lpz., 1888, B. 35, p. 561; «Koll. Ztsclir.», Dresden, 1913, B. 13, p. 235; D a 1 1 w i t s-W egner, «Koll. Ztsclir.», Dresden, 1926, b. 38, p. 193; Bier-b г а и e r C., «Ztsclir. f. teclm. Phys.», Lpz., 1929, B. 10, p. 139; A d a m N., Physics and Chemistry of Surfaces, p. 167, Oxford, 1930; В a r t e 1 1 а. О s t e r h о f, Colloid Symposium Monograph, у. 5, p. 113, 1927; Ah let t «Philos. Mag.», L., 1923, v. 46, p. 244; N i e t z, ibid., p. 255; RehbinderP. u. KrajuschkinaL., «Ztschr. f. phys. Chemie», A, Lpz., 1929, B. 142, p. 151; Adam a. Jessop, «Journ. Chem. Soc.», L., 1925’ p. 1865; Pockels A., «Phvsik. Ztschr.», Berlin, 1914, B. 15, p. 39. П. Ребиндер.