 > Техника, страница 81 > Сода
> Техника, страница 81 > Сода
Сода
Сода, общее название различных по химич. составу продуктов, производных натрия. Наибольшим распространением из них пользуется кальцинированная С. (natrium carboni-cum, kalzinierte Soda, Soda ash, carbonate de soude) Na2C03, белый мелкий порошок с уд. в 2,53; Ь°пл. 852; образует гидраты с 1,7 и 10 ч. Н20; растворима в воде с выделением тепла; от действия к-т выделяет С02 с шипением. Растворимость в 100 вес. ч. Н20 составляет:
1°. 0° 15° 30° 35,5° 50° 100°
Вес. ч. 7,1 16 49,9 51 47,5 45,1
При t° выше 32° выпадает из насыщенного раствора Na2C03 · Н20. Эти кристаллы теряют воду при t° 87—100°; при ί° ниже 32° выпадает из насыщенных растворов Na2C03 · ЮН20 с уд. в 1,47. Состав кальцинированной С. по стандарту (ОСТ 55): Na2C03 не менее 98%, NaCl не более 1%, Na2S04 не более 0,1%. Б. ч. ее приготовляют по аммиачному способу (смотрите ниже), хотя изредка встречается (за границей) и леблановская, примерный состав которой: Na2C03 83—84%, NaOH 0,734%, NaCl 3,34--43,5%, Na2S04 9,54-10,2%. В СССР и Германии качество С. обозначается в %Na2C03, во Франции—в градусах Декруазилля (соответствуют количеству H2S04—моногидрата, необходимого для усреднения), в Англии—в градусах Ньюкэстля (соответствуют %-ному содержанию Na20, причем вес полумолекулы принимается=32) или в градусах Гзй-Люссака (вес полумолекулы принимается не 32,^а 31). Применяется: в силикатной (стекольной), жировой, текстильной, красочной и бумажной пром-стях, в ряде химич. производств, для очистки воды и в домашнем обиходе для стирки и мытья. Упаковывается в деревянные (иногда фанерные) бочки по 150—500 килограмм или в мешки по 80 килограмм. В последнее время входит в практику погрузка в вагоны внавалку с применением механизации (пневматич. методом). При хранении в сырости слеживается и частично переходит в кристаллическую С. (смотрите ниже). В пожарном отношении безопасна. В значительном количестве поступает на рынок в мелкой расфасовке в бумажных или картонных пакетах по 400—500 г, иногда с примесью мыльного порошка и пербората (для повышения моющей способности) или поваренной соли (фальсификация). С. в пакетах в СССР известна под названием «Украинка». За границей в последнее время поступает в продажу кальцинированная С. в гранулированном виде в форме крупинок. Иногда она выпускается также в форме плиток (алкалит и др.).
Следующей важной по масштабу производства и значению формой товарной С. является каустическая С., или едкий натр (смотрите), NaOH; состав ее (по ОСТ 57): NaOH 92— 93%, Na2C03 не более 4%, NaCl не более 3.5%. Экспортный продукт: NaOH 94-4-95%, Na2C03 3,84-4,0% и NaCl 1.04-0.8%. В СССР большая часть каустич. С. производится (по способу Левига) сплавлением кальцинированной С. с окисью железа через феррит натрия, меньшая часть—электролизом поваренной соли и по известковому способу (обработкой содовых растворов негашеной известью). За границей, наоборот, преобладают электролиз и известковый способ. Качество в том и другом случае одинаково, если только не применяется ртутный метод электролиза, к-рый дает каустич. С. исключительной чистоты (96—98% NaOH). Каустич. С.—белая, слегка окрашенная в желтоватый или голубоватый цвет твердая масса, уд. в 2,13, t°nJl 322°, легко поглощающая воду и поэтому расплывающаяся на воздухе. Легко растворяется в воде с выделением тепла. Вследствие своей гигроскопичности должна храниться в герметически закрытой посуде. Сильная щелочь, жадно соединяющаяся с к-тами. Разъедает кожу, ткани, обмыливает жиры, действует на стекло, фарфор и органич. вещества, легко поглощает С02 и переходит при этом в кальцинированную С.; разъедающе действует на слизистые оболочки, опасна для глаз при раскупорке барабанов; находит большое применение в мыловаренной, текстильной и бумажной пром-стях, в производстве искусственного шелка (вискозы), в красочной и фармацев-тич. пром-стях, резиновом и спичечном производствах, в коксобензольной, лесохимической, нефтяной и пищевой пром-стях и для очистки воды; упаковывается обычно в железные барабаны емкостью 32—400 килограмм. В мелкой расфасовке— в банках в виде палочек. Упакованный товар должен храниться в закрытых сухих помещениях. В пожарном отношении каустич. С. безопасна. За границей в последнее время входит в продажу каустич. С., измельченная в порошок; упаковывается попрежнему в железные барабаны. Процесс раскупорки и растворения при этом значительно упрощается. За границей сильно распространен также транспорт крепкого раствора каустич. С. (50%-ной) в ж.-д. цистернах. В этом случае плавление и укупорка в барабаны отпадают; это дает такую экономию, которая делает возможным транспорт жидкой щелочи на расстояние до 1 000 км. Качество каустич. С. обозначается в СССР в % содержания NaOH, в Германии—в немецких градусах, соответствующих содержанию щелочи, пересчитанной на кальцинированную С. (100%NaOH== 132 немецким градусам), в Англии—в градусах Ньюкэстля, как и для кальцинированной С. (100% NaOH =- 78,52 градуса Ньюкэстля), во Франции—в градусах Декруазилля (100% NaQH^ 122,58 франц. градуса). В нек-рых химии. производствах (например в производстве ультрамарина) применяется особый сорт кальцинированной С., т. н. специальная, или т я-ж е л а я, С.; обычный состав ее: Na2C03 97%, NaOH 2,25%, NaCl 0,20%. Ее приготовляют из осадков, получаемых на фильтрах при фильтрации каустич. щелоков в процессе выпуска их в вакуум-аппаратах.
Кристаллич. С.—продукт кристаллизации из водных растворов кальцинированной С.; большие моноклиноэдрич. призмы; по химич. составу это десятиводная С. Na2C03 · ЮН20, уд. в 1,463. Обычная чистота ее 97%. Легко теряет часть воды на воздухе и становится непрозрачной. При 34° плавится в своей кристаллизационной воде. Известна также в продаже одноводная С. состава Na2C03-H20.
Двууглекислая, или очищенная, С., бикарбонат — кислая угленатриевая соль NaHC03; белый, пушистый порошок кристаллического строения со слегка солоноватым и слабощелочным вкусом, уд. в 2,16; при обработке к-тами выделяет С02 с шипением, при нагревании легко разлагается, переходя в кальцинированную С. с выделением С02. В воде растворяется:
t°.. 0° 15° 30° 50°
Вес. ч. 6,9 8,9 11,1 14,5
Рн=8,4 для 0,1 мол. раствора. Состав ее (по ОСТ 58): NaHCOg не менее 98%, Na2C03 не более 1,4%, NaCl не более 0,05%, влаги не более 1,0%. Применяется она гл. обр. для производства искусственных минеральных вод и шипучих прохладительных напитков, в медицине, в домашнем хозяйстве, для хлебопечения вместо дрожжей, в кондитерском деле и для приготовления массы зарядки огнетушителей. Упаковывается преимущественно в фанерные бочки вместимостью 50 килограмм. Хранить ее нужно в закрытом сухом помещении, т. к. во влажном воздухе она изменяется, выделяя С02и переходя мало-по-малу в кальцинированную С. Имеется в продаже и в мелкой расфасовке. В пожарном отношении сода не только безопасна, но действует как хорошее огнетушительное средство.
Кроме указанных сортов С. в торговле (за границей) встречается еще полуторная сода, или трона (ура о),—смесь средней и кислой угленатриевых солей, имеющая состав: Na2C03·NaHCOg-2Н20 (содержит 47% Na2C03 и 37% NaHCOg). Известна в продаже также натронная известь (смесь едкого натра и извести) состава NaOH-CaO.
В СССР (Сибирь) в продаже встречается кальцинированная сода, добываемая из содовых озер; она представляет собою мелкий порошок сероватого цвета состава: 94,7% Na2C03,
0,35% Na2S04, 0,3% NaCl, получающийся при прокаливании соды-сырца в печах. Высушенная сода-сырец в смеси с кальцинированной С. идет также в продажу в расфасованном виде под названием «Сода-Сибирячка».
Лит.: Сед лис В. О., Химич. товары и строительные материалы, Л., 1928; Рубцов В. И., Курс общего товароведения, М.—Л., 1930; Гуревич Е. и С., Спутник практика, М.—Л., 1930. Б. Сасс-Тисовский.
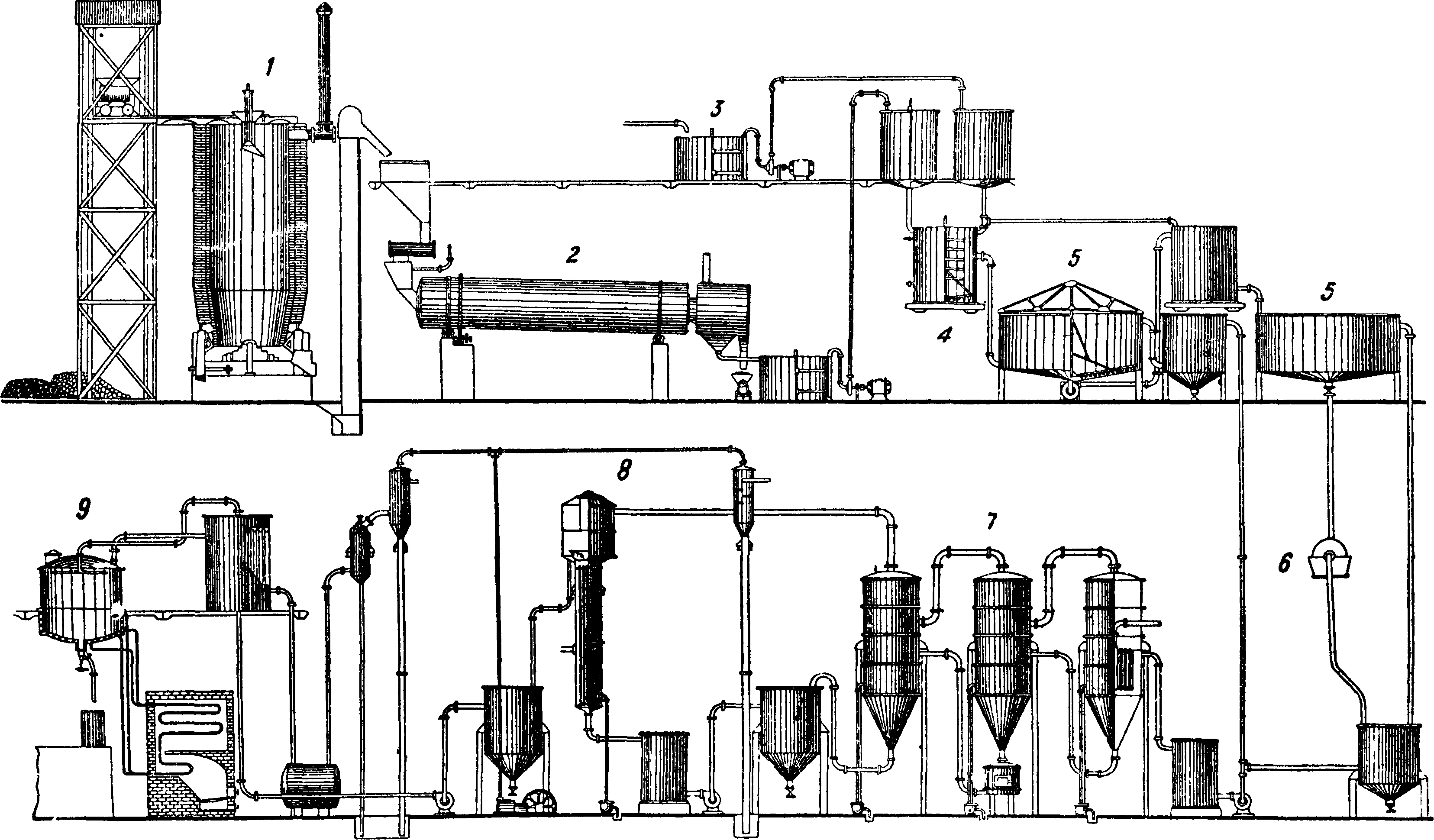
Содовое производство. Содовая промсть обнимает производство основных содовых продуктов: кальцинированной С., каустич. С. и бикарбоната; в качестве побочных продуктов м. б. получены: кристаллич. С., нашатырь, бикарбонат аммония и др.
В истории развития производства С. различают 4 периода. Первый период обнимает эпоху, начиная с древнейших времен до 10 века, когда С. добывали гл. обр. из естественных, т. н. содовых, озер, преимущественно в Египте, Америке, Центральной Азии и др. Из этих озер могут выкристаллизовываться следующие соли:
1) Na2C03 · NaHC03 · 2Н20—т. н.трона, или у р а о,
2) Na2CO3-10H2O—С., или н а т р о н, и 3) Na2C03-H20— т.н. термо натрит; чаще всего из озер выделяется трона. При соответствующей обработке троны фильтрованием и прокаливанием получается С. хорошего качества. В озерах Сибири садка С. происходит осенью и зимою; на дне образуются слои троны до 200 миллиметров, ее извлекают, и после обработки получают продукт с содержанием до 94 % Na2C03. Часто С. образует слой кристаллов над льдом (Доронинское озеро); кристаллы собирают и затем прокаливают. Состав рапы Доронинского озера в г/л- NaaCOs 44,17, NaHC03 29,13, Na2S03 0,76, NaCl 14,92.
Второй период развития производства С. обнимает эпоху от 10 в до 1800 г. В этот период С. получали из золы растений, произраставших на солончаковых почвах, преимущественно на юге Испании. В качестве С. сбывалась или зола или продукт ее выщелачивания с последующей кристаллизацией (т. н. б а р и л ь я) с содержанием 25—35% Na2C03.
Третий период—леблановской соды (метод предложен Лебланом в 1791 г.)—продолжался весь 19 в.; это был первый способ синтетич. получения С. из поваренной соли, известняка и угля.
Четвертый период развития содового производства начинается в конце 19 века, когда леблановский способ производства С. стал вытесняться новым, так называемым аммиачным,- аммиачный способ Сольвея до настоящего времени остается почти единственным способом получения С. во всем мире.
Технология производства содовых продуктов. Основное сырье для производства кальцинированной С.—поваренная соль и известняк. Получение кальцинированной С. осуществимо на практике гл. обр. по процессу Леблана и процессу Сольвея. Способ Леблана в настоящее время не применяется, однако не исключается возможность его частичного возрождения в СССР. Процесс этот заключается в проведении следующих химич. превращений. 1) Получение сульфата натрия Na2S04 из NaCl и H2S04 (смотрите Сульфат)
Фигура 1.
| ! | |
| ЮРсгго | Ifl |
при одновременном получении соляной кислоты по реакции 2NaCl + H2S04=Na2S04 + 2НС1.
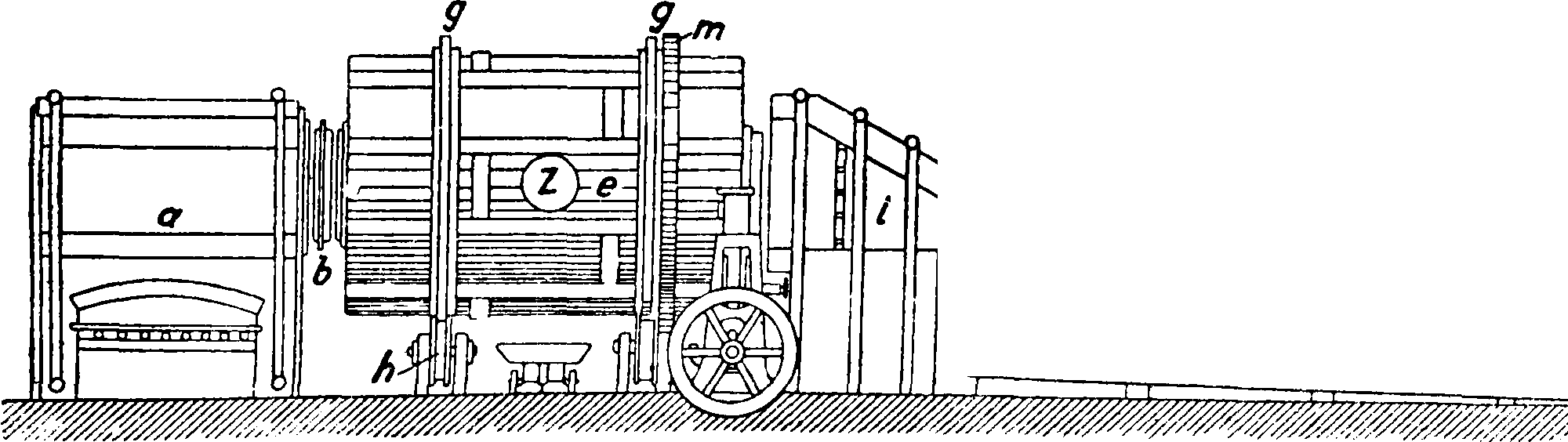
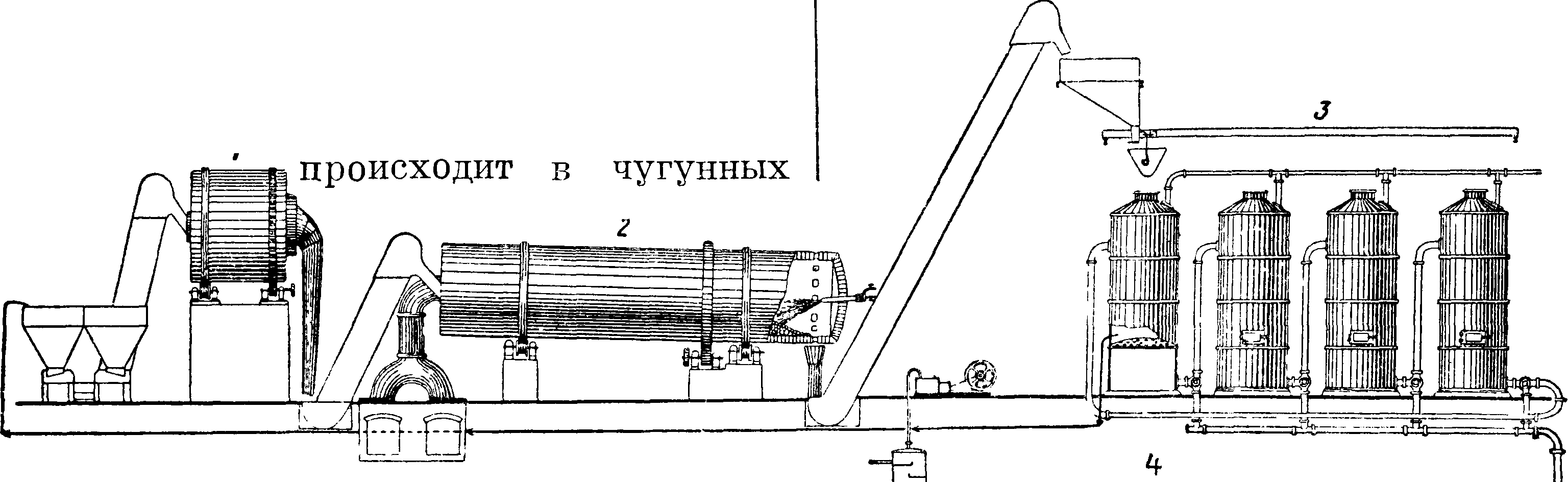
2) Полученный сульфат натрия смешивают с углем и известняком (или мелом); при прокаливании этой смеси происходят следующие основные реакции: 1) Na2S04+2C= 2C02+NaaS; 2) Na2S+ СаС03=CaS+Na2C03. По Леблану для получения 150 ч. соды берется 100 ч. безводного сульфата, 100 ч. известняка и 50 ч. угля. Обе реакции проводились одновременно вт. н. содовых печа х—ручных в первой половине 19 в и механич., т. н. ных, во второй половине 19 в (фигура 1).
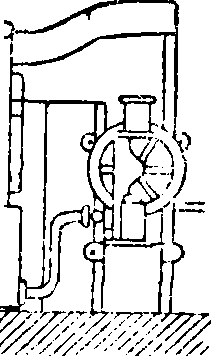
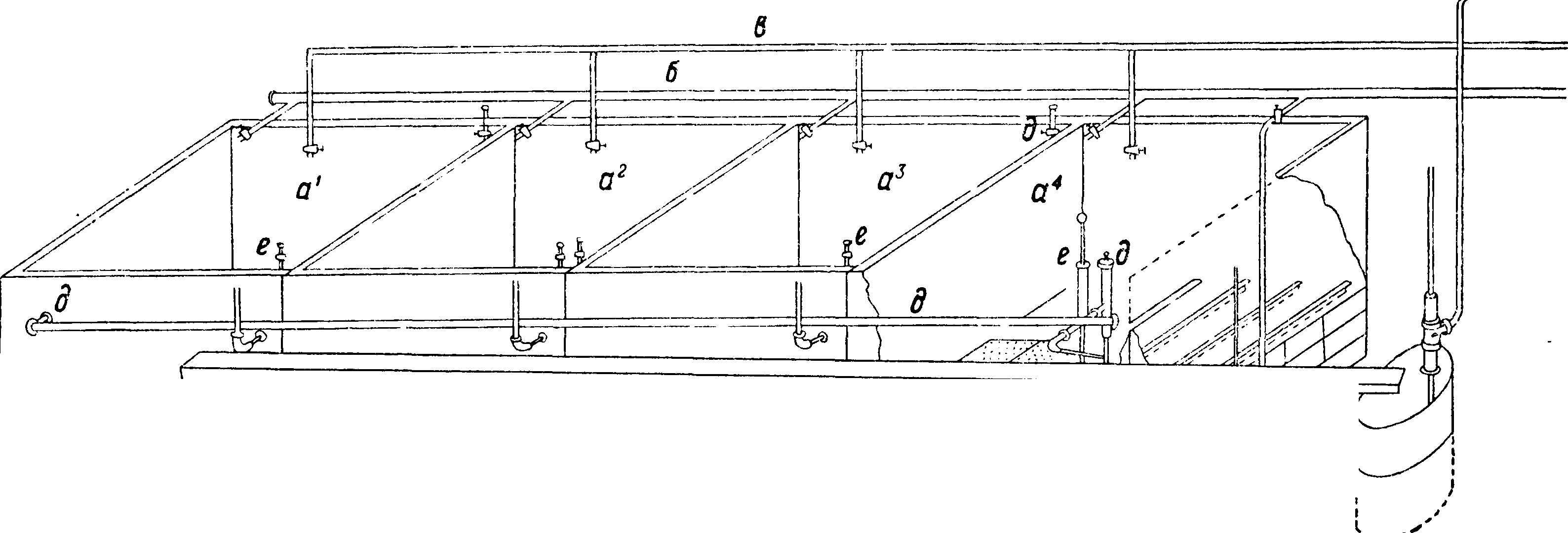
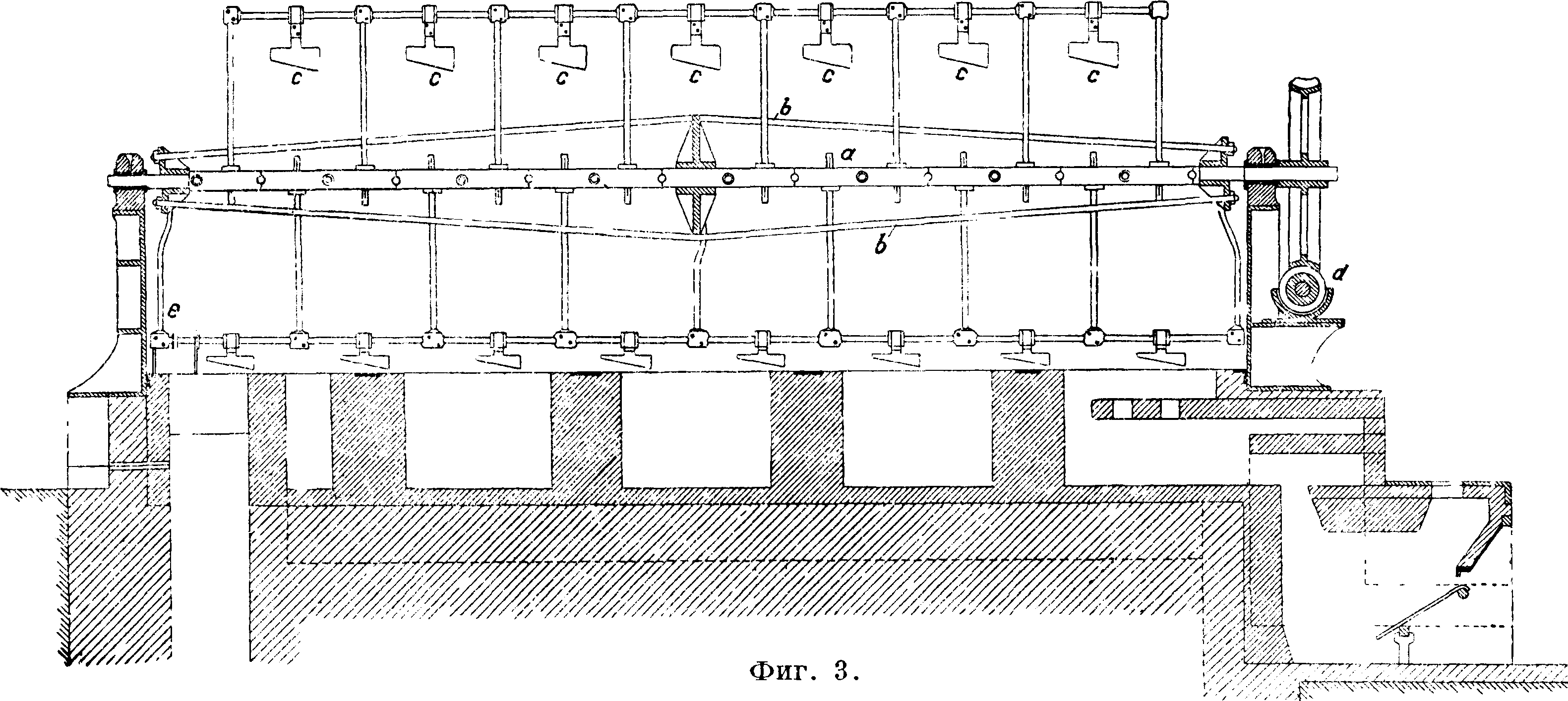
ного железа и выложена изнутри огнеупорными кирпичами. Цилиндр вращается на двух охватывающих его кольцах д, д, опирающихся на фрикционные колеса h,h, и приводится в движение зубчатым колесом т; загрузка и разгрузка цилиндра производятся через отверстие z. Топочные газы проходят через печь и по выходе· из печи, пройдя пыльную камеру г, используются для выпаривания воды из растворов соды—с одовых щелоков. Получающаяся в печи масса, сырой содовый плав, содержит 36—45% Na2C03, 27—33% CaS, кроме того в нем содержатся СаС03, СаО, уголь и др. Плав обрабатывается водою в ряде последовательно включенных ящиков—в ы щ е л а-чивателей Чанкса (фигура 2), обыкновенно 4—6 железных ящиков (αΐ5 α2, а3, «4), снабженных приводной трубкой для воды б, паропроводом в, выпускным краном г,трубами д для перевода щелока из одного ящика в другой и трубами е для спускания насыщенного щелока в спускной жолоб к; в аппарате остается отброс—сернистый кальций. Крепость спускаемого щелока, полученного из последнего аппарата, составляет ок. 27—30° Be с содержанием около 250 г Na2C03, 50 г NaOH в л; остальное—NaCl,Na2S04, Na2S, Na2S03,Na2S203, Na4Fe-(CN)6 и др. Полученный щелок после отстаивания и предварительной карбонизации поступает на выпаривание в железные чрены. При выпаривании выпадает сода Na2C03· Н20 (с примесями); сода на фильтре отделяется от маточной жидкости, т. н. красного щелока, содержащей NaOH и др.; этот щелок употребляется для получения NaOH по известковому способу. Оставшаяся на фильтре сырая соль Na2C03 · Н20 прокаливается в прокалочных горизонтальных железных печах с наружным обогревом (печи Телена, фигура 3); на вращающейся горизонтальной оси а укреплены параллельно 4 стержня b с насаженными на них скребками с с косо поставленными лезвиями; ось приводится в медленное
| Её | i | .г$У .А. | : J г?/.! 1. | |
□7“
ная печь на 25—30 тонн соды расходует на обогрев 0,5—0,65 тонн угля на 1 m сульфата. Для нагревания массы в печи употребляется уголь, сжигаемый в топке а, находящейся вне печи и соединенной с ней посредством кольца b цилиндрич. печь е сделана из котель вращениечервяч- ; фиг
ным колесом cl I при этом скребки скользят по полукруглому дну чрена и мешают пригорать выкристаллизовавшейся С. и в то же время сгребают ее к концу чрена, от куда она сбрасывается лопатой е в подставленные ящики. В результате получается С. с содержанием ок. 90% Na2C03.
В содовый комбинат Леблана обычно входили следующие производства: 1) серной к-ты, 2) Сульфата, 3) соляной к-ты, 4) хлора, 5) бе-
нравляют после промывки в печи-сушилки для превращения в соду по реакции: 2NaHC03== Na2C03-f C02-f Н20. Расход сульфата на 1 тонна соды составляет 1,6 ш. Выделяющийся при карбонизации газ с содержанием около 36% H2S используется либо на получение серы либо
л ильной извести, 6) азотной к-ты, 7) серы из отброса производства, содержащего CaS. Переработка отброса осуществлялась по способу Чанкса и Клауса. По этому способу отвал смешивается с водой в тесто и накачивается в ряд вертикальных цилиндров, через которые последовательно пропускается газ известково-обжигательных печей. При этом происходят следующие реакции: CaS + С02 + Н20=СаС03 + Н- H2S; CaS-f H2S=Са (SH)2; Ca(SH)2+C02+ -f H20=CaC03+2H2S; CaC03—отброс, а газ с содержанием до 36% (объёмных) H2S идет на регенерацию серы по реакции 2H2S-f-02== 2H20+2S в присутствии катализаторов в печах Клауса (смотрите Сероводород и Сера) или на окисление до S02 по реакции: 2H2S-b302== 2H20+2S02, причем S02 идет дальше на производство H2S04.
Результаты работы леблановских з-дов приблизительно следующие; 100 ч. пирита -f- 1,88 ч. селитры дают 70 ч. огарков + 136,3 ч. серной к-ты; 136,3 ч·. серной кислоты + 160,35 ч. хлористого натра дают 176,38 ч. суль-фата + 274,4 соляной кислоты уд. в 1,16; 176,38 ч. сульфата+ + 67,02 ч. угля + 123,46 ч. известняка дают 134,05 ч. соды+111,12 ч. отброса; 111,12 ч. отброса дают 10 ч. серы; 274,4 ч. соляной кислоты + 47,45 ч. двуокиси марган-ца + 36,8 ч. извести дают 65,45 ч. белильной извести.
I. Получение кальцинированной С. из сульфата. В СССР способ сводится к получению кальцинированной С. из естественного сульфата на базе мирабилита Карабугазского залива по схеме, представляющей комбинацию способов Леблана и аммиачного. Первоначальное сырье—мирабилит (глауберова соль), выбрасываемый зимою на берег залива,—содержит 96—99% Na2S04 - ЮН20. Летом при t° 35° мирабилит на берегу залива обезвоживается теплом солнца и превращается в безводную соль с содержанием до 99% Na2S04. Безводный сульфат восстанавливается до сернистого натрия (смотрите); полученный плав растворяется в воде, и после фильтрования раствор с содержанием ок. 125 г Na2S в л отправляется на карбонизацию в кар-бонаторы или в карбонизационные колонны, где процесс протекает по следующей схеме: 1) Na2S+H20=NaHS + Na0H; 2) NaHS-f СО,+ + H20=NaHC03+H2S; Na0H+C02=NaHC03. Выпавший бикарбонат отфильтровывают и от-
на получение сернистого газа и серной кислоты. Превращение Na2S04 в Na2C03 можно осуществить также по методу Сольвея карбонизацией аммиачного раствора сульфата по реакции: Na2S04 + 2NH3 + 2С02 + 2Н20=2NaHC03+(NH4)2S04. Существуют и другие способы переработки Na2S04B соду (смотрите ниже).
II. Получение С. из поваренной соли (способ Сольвея). В этом способе употребляют естественный или искусственно приготовленный рассол с содержанием ок. 310 г
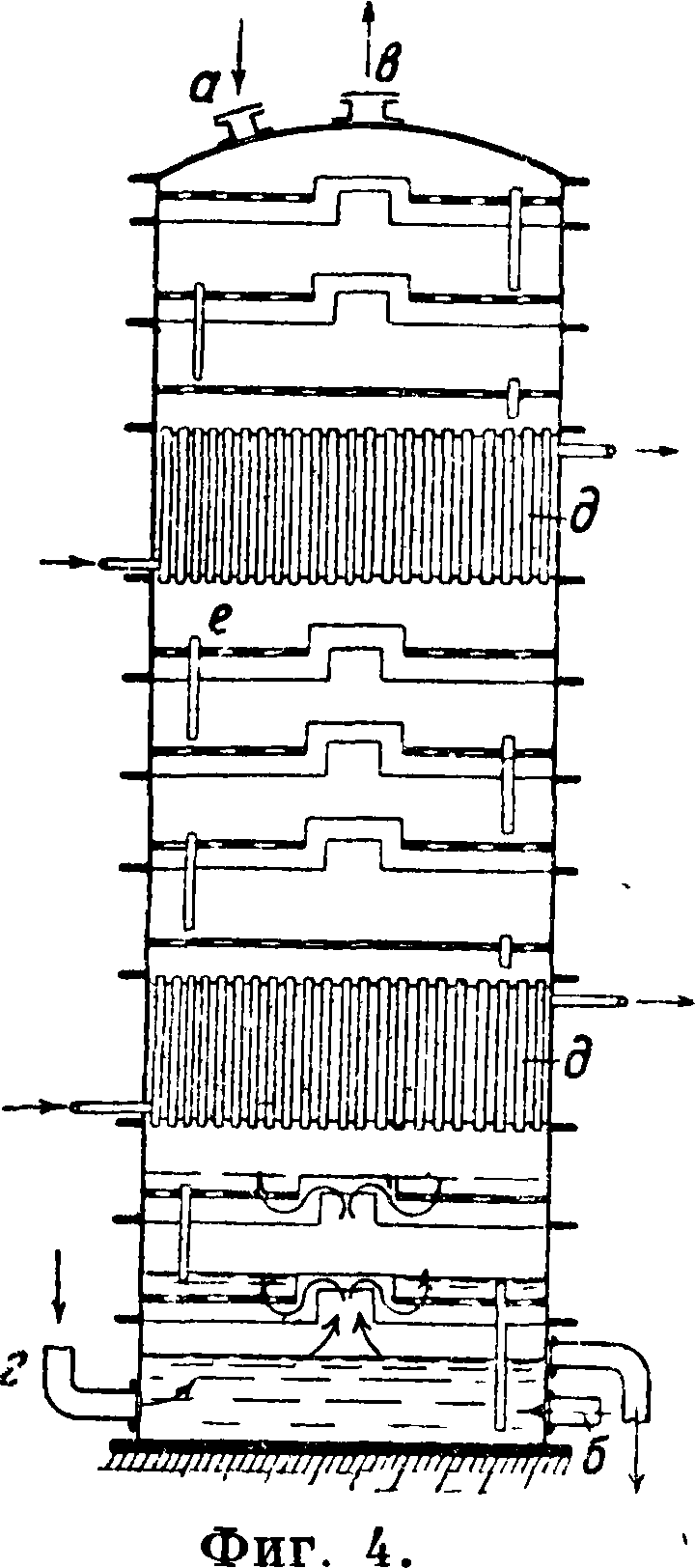
NaCl в л, к-рый насыщается в промывателях и при охлаждений в абсорберах газообразным аммиаком до содержания ок. 90 г NH3 в л (фигура 4: а—вход соли, б—вход паров аммиака, в— выход их, г—вход газов, содержащих С02, д— холодильные кольца). Рассол, идущий на абсорбер, содержит и другие соли. Примерный состав рассола (в г):
NaCl MgS04 CaS04 MgCl2 Са(НС03)2310 5,14 0,8 0,6 0,3
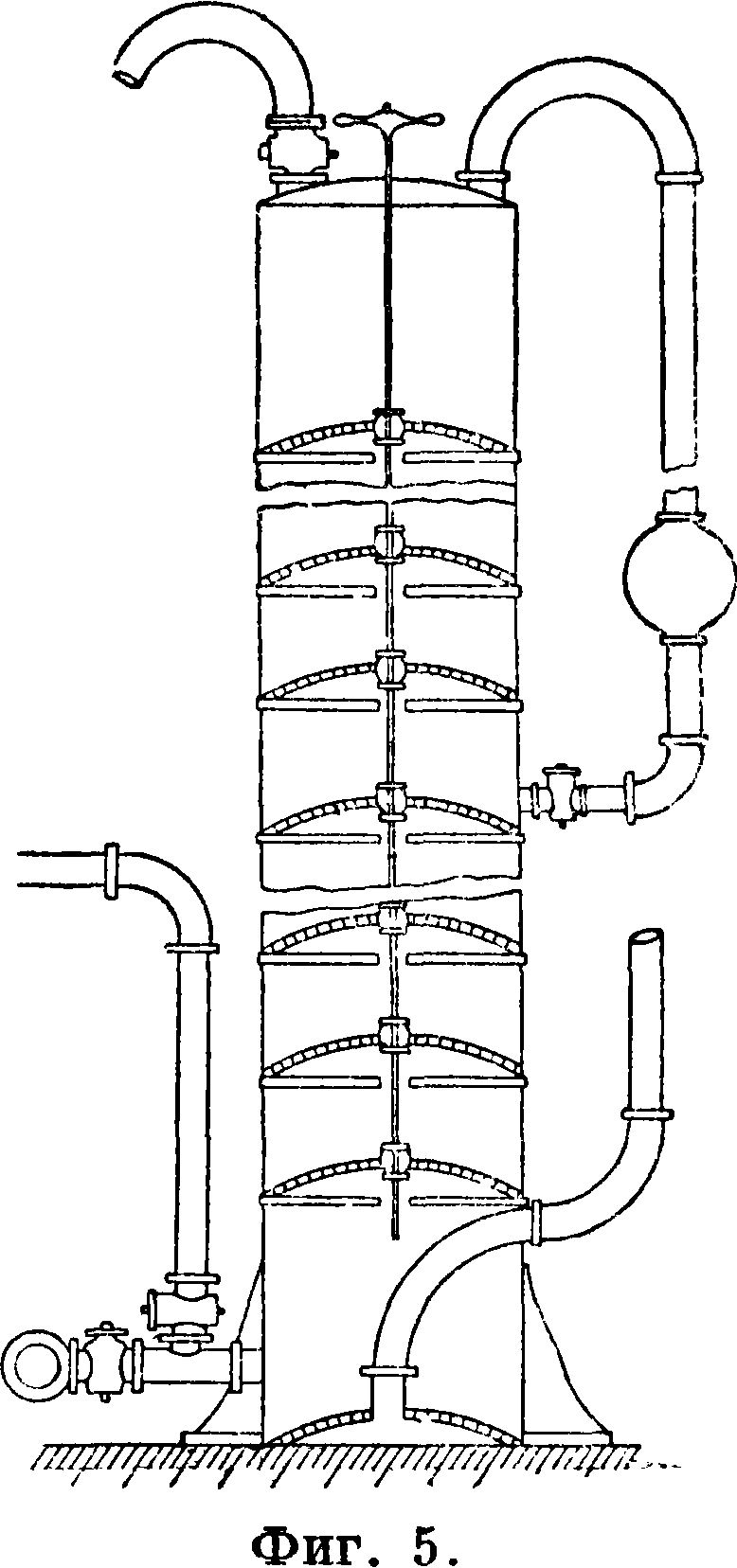
Газ NH3 содержит обычно и С02; в присутствии воды он реагирует так: NH3-{- Н20=NH4OH; 2NH3+C02+H20=(NH4)2CC)3. Эти вещества в свою очередь реагируют с солями Mg и Са рассола, образуя осадки Mg(OH)o и СаС03 по реакциям: CaS04+(NH4)2C03=CaC0, + (NH4)2S04; MgS04+2NH40H=Mg(0H2) + (NH4)2S04. Осадки в количестве ок.0,15 тонн на 1 тонна С.отделяются в отстойниках—дозерах, а осветленная жидкость после охлаждения идет на карбонизацию. Охлажденный аммиачный рассол поступает на карбонизацию в одну или в две (принцип «форкар-бонизации») карбонизационные колонны Соль-вея (фигура 5), куда снизу подается газ с содержанием в среднем 45% СО о. При этом происходят процессы: 1) 2NH4OH+ С02= (NH4)2C03+ Н20;
2) (NH4)2C03 + Н20 + СОо=2 NH4HCOs;
3) NH4HC03+NaCl=NH4Cl + NaHC08; полученный бикарбонат выпадает в осадок, как наименее растворимое соединение. Действительно, главная реакция карбонизации (3) как равновесная идет в направлении, при к-ром выделяется наименее растворимая соль, каковой всегда является NaHC03. Ниже приведены данные растворимости этих солей в воде при 15° и при 30°.
15е 30° 15° 30°
NaCl. 358 г 360 г NH4HC03. 186 г 270 г
NH4C1. 355 » 416 » NaHC03. 88 » 110 »
Для суждения о выходах NaHC03 по сырью NaCl или по NH3 введены понятия процента утилизации Nan NH3 Федотьевым Π. Н., впервые изучившим теорию процесса. На практике процент утилизации Na редко превышает 70-
-I7S00-
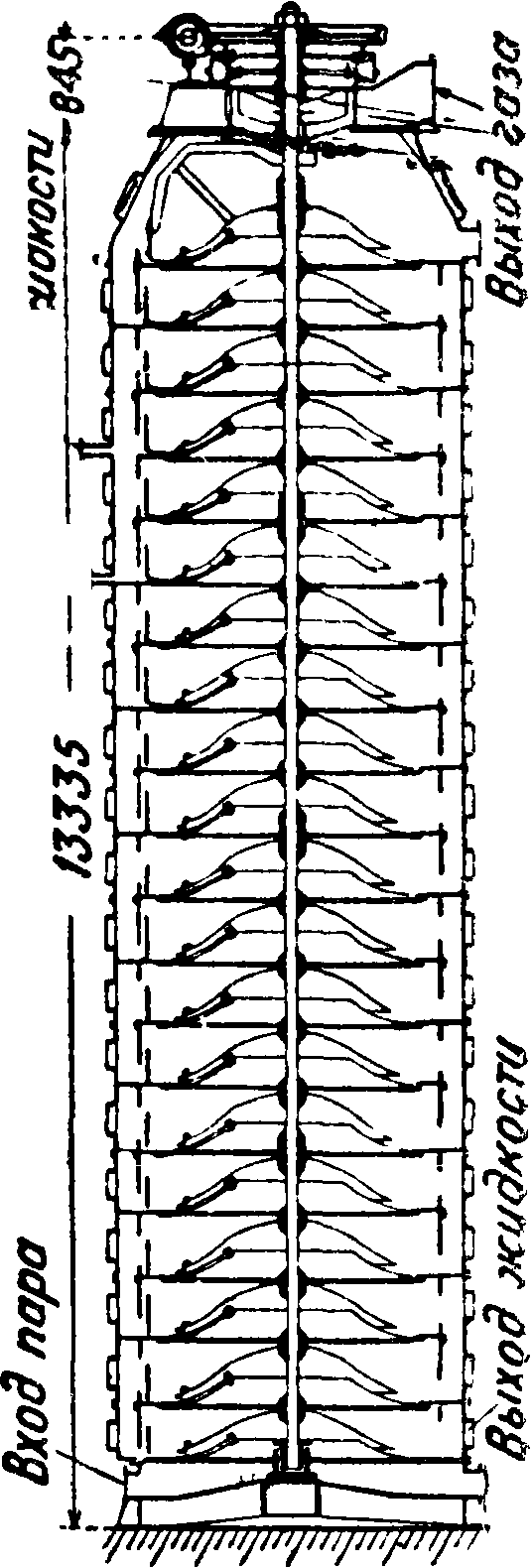
нагревание жидкости для термической диссоциации легко разлагаемых солей аммония по реакциям: 1) NH4HC03-NH3+ С02 + Н20; 2) (NH4)2C03= 2NH8+C02+H20;3) 2NaHC03=-= Na2C03+H20+C02, а затем после смешения с известковым молоком и основная реакция выделения NH3 из NH4C1:
(4 2NH4C1+ Са (ОН)2=СаС12 +
+ 2NH3 + 2Н20; аммиак охлаждается до 60° и уходит на абсорбцию.
Углекислый газ получается обжигом известняка (или ме-ла) с углем в известково-обжи- ^ гательных печах шахтного ти- | па: при этом идут процессы С+02=С02 и СаСОя= СаО +
+ С02; содержание С02 в газе:
35-f-38% по объёму (смотрите Углекислота и Известь). Расходные коэф-ты нат 98 %-ной соды: поваренной соли 1 700 кз (около 5,5 метров рассола), (NH4)2 S04 5-f--р8 килограмм для восстановления по терь NH3; известняка 1 300 килограмм пара ок. 2 т, топлива 0,5 тонн воды на охлаждение 80 м3; расход энергии 65 kWh. Процесс осуществляется в системе
Фигура 7.
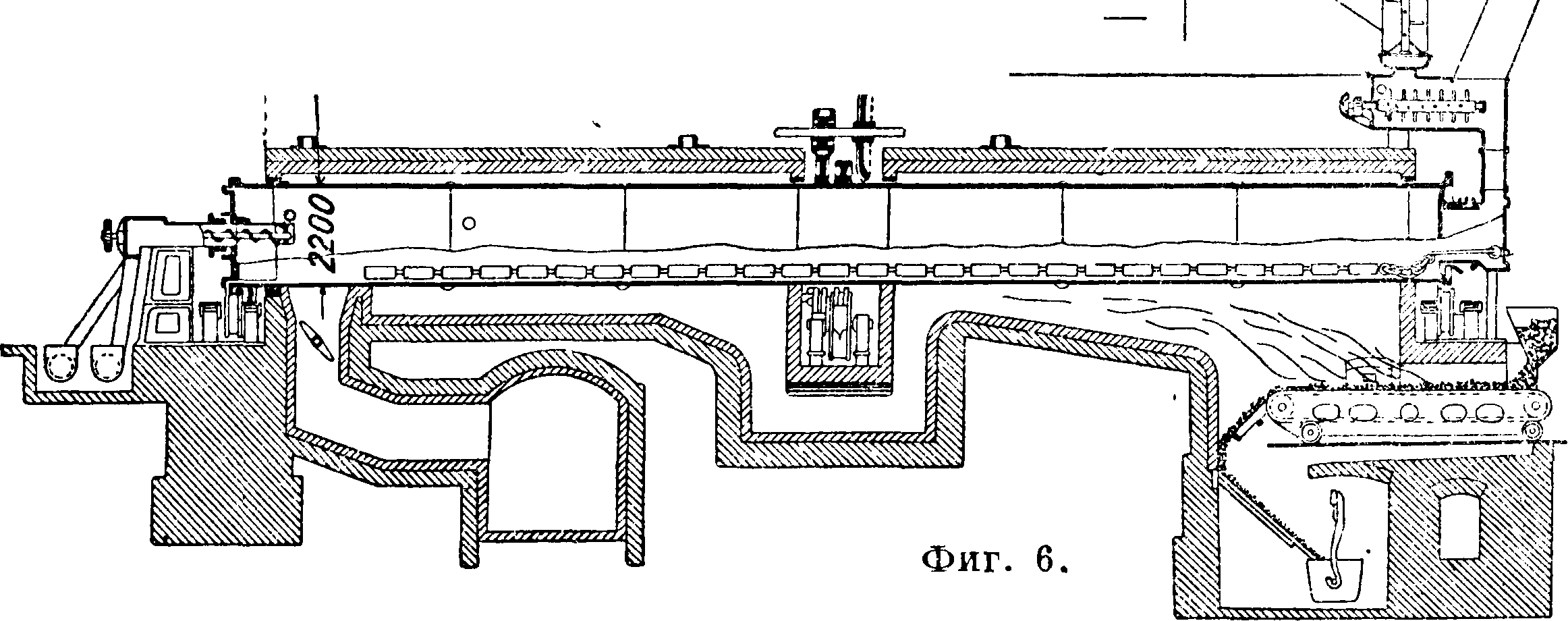
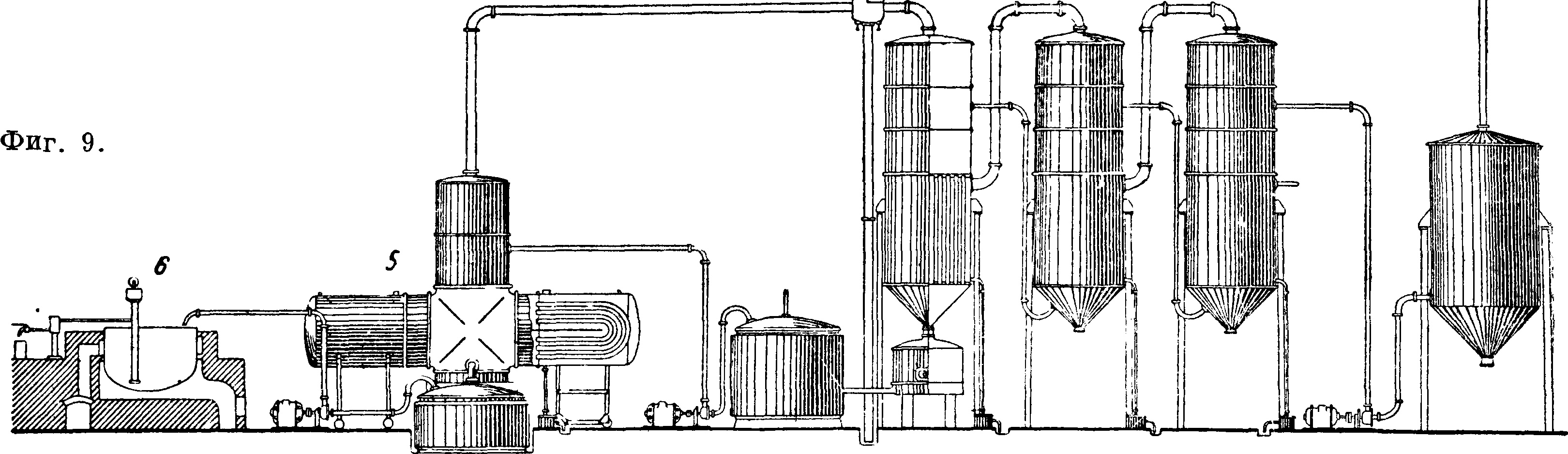
72. Для обеспечения хорошего фильтрования процесс ведут при t° в 62° в карбонизационной колонне. Отфильтрованный сырой бикарбонат с содержанием 15—18% Н20 после смешения с кальцинированной С. поступает в сушилки (фигура 6), где из бикарбоната получается кальцинированная С. по реакции: 2NaHC03 =
= Na2C03-f С02 + Н20.
Газ сушилок после отделения пыли, охлаждения и отмывки от NH,
стандартизованных аппаратов, т. н. элементах Сольвея, рассчитанных на производство 120-Р250 тонн кальцинированной С. в сутки. На фигуре 8 изображена общая схема содового з-да: 2, 2, 3, 4—холодильники, 5—скруббер, 6 — диссольвер, 7—подъемник, 8—бункер, 9— мешалка, 10—перегонный аппарат, 11—обогреватель, 12— холодильник, 13—резервуар, 14—насос, 15—резервуар, 16— скруббер.
III. Производство каустической С., едкого натра, NaOH. Производство ведется по трем способам. 1. Ферритный способ (Левига). Твердая кальцинированная С. смешивается с окисью железа и прокаливается при t° ок. 1 200° в горизонтальных вращающихся печах «тамбурах»; при этом образуется малостойкий по отношению к воде феррит натрия по реакции: ^Νλ2003 —(-=NB,2*F62^4 Т CO2 ·
После охлаждения до 100° феррит поступает в систему диффузо-
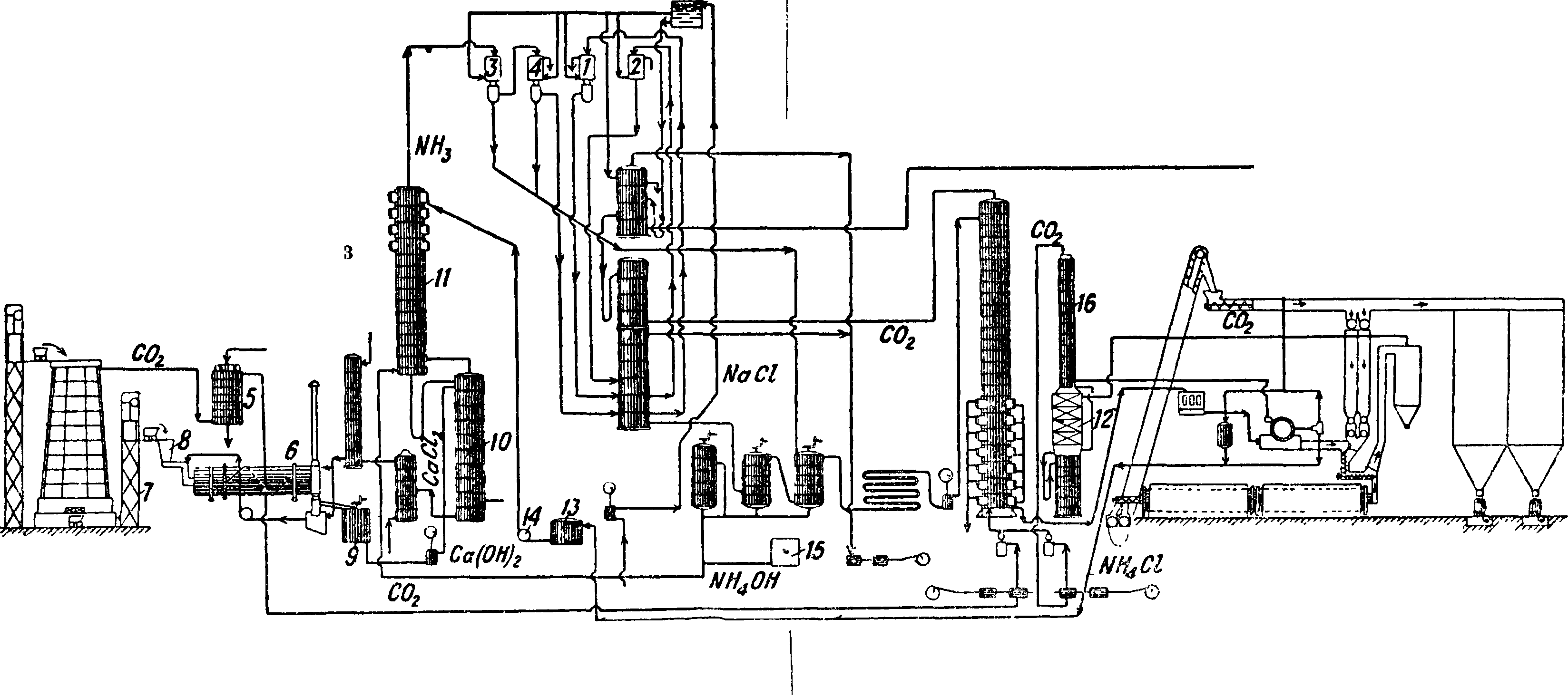
идет на карбонизацию вместе с газом известковых печей. Маточная жидкость из колонн идет после подогрева и смешения с известковым молоком на дистилляцию аммиака в аппаратах дистилляции (фигура 7), где происходит сначала
Фигура 8.
ров, где он горячей водою разлагается последующей схеме: Na2Fe204 + Н20=2 NaOH + + Fe203. Остающаяся на решетке диффузора окись железа идет вновь на смешение с содой, а раствор около 27% едкого натра с концентрацией до 400 г NaOH в л. поступает после отстаивания в декантерах на выпарку в многокорпусных аппаратах—чаще всего в
3-корпусных аппаратах. Здесь раствор упаривается в среднем до 52% (ок. 1 000 г влаги), после чего получение твердого продукта, содержащего 92% NaOH,
ход материала следующий: кальцинированной С.—1,34 ж; извести—0,8 ж; пара—5,5 ж; угля
горшках с подогревом голым огнем или в аппаратах Фредеркинга, подогреваемых перегретой водой или паром высокого давления при t° ок. 350° [фигура 9: 1—мешалки для соды и окиси железа, 2—тамбур, 3—диффузоры, 4 и
5— выпарные аппараты (трехкорпусный и однокорпусный), 6—плавильный горшок]. Halm каустической С. расходуется: кальцинированной С.—1,33 ж; окиси железа—0,2 т; мазута для тамбуров—0,46 т; угля для горшков — 0,44 т, пара—2,8 т; энергии ~ 48 kWh.
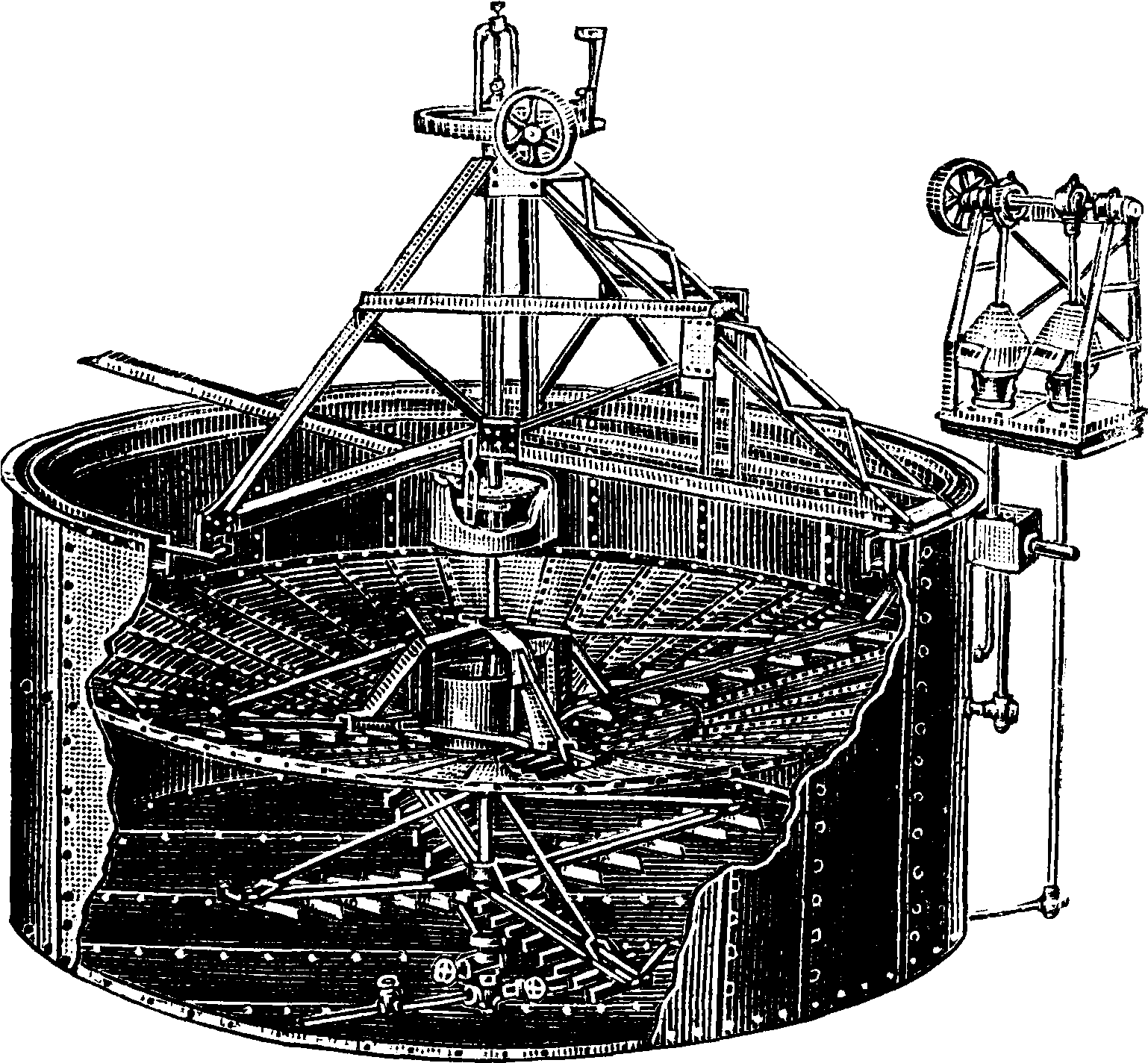
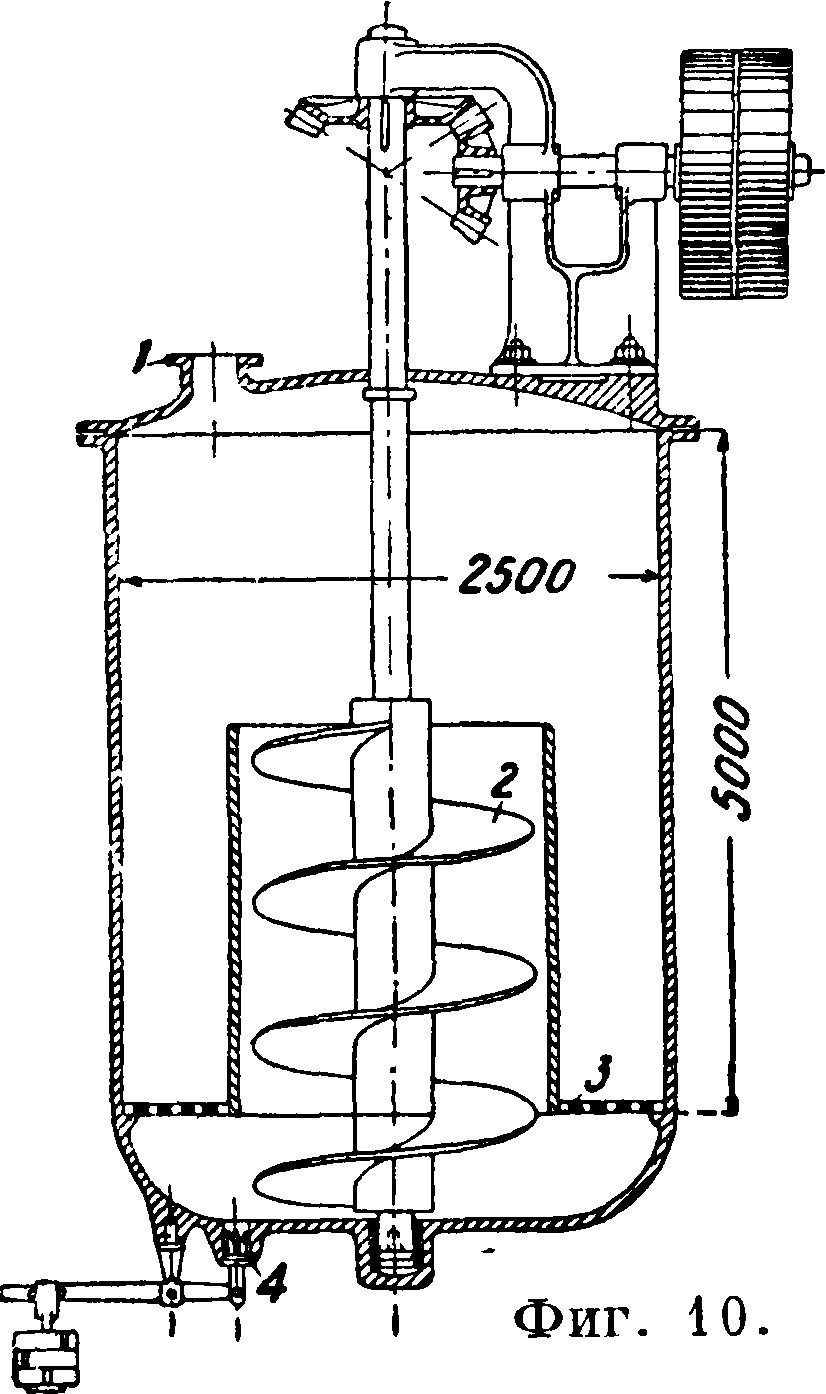
2. Известковый способ заключается в том, что раствор, содержащий 10—12% кальцинированной С., полученной растворением в воде кальцинированной соды или нагреванием смеси бикарбоната с водою и паром для декарбонизации раствора, смешивается при -нагревании до 90-7-100° с известковым молоком в каустицерах (фигура 10); 1—вход Na2C03, 2— шнек, 3—дырчатое дно, 4—выход NaOH. При этом происходит реакция каустифика-ц и и: Ca(OH)2-f Na2C03=CaC03-f 2NaOH. Выпавший СаС03 отделяется отстаиванием и отмывается от NaOH в аппарате Дорра (фигура 11). Щелок из сгустителя, содержащий 12% NaOH, идет на выпарку в вакуум-аппараты и затем в котлы или аппараты Фредеркинга до получения твердого каустика, как и по способу Левига (фигура 12: 1—известково-обжигательная печь, 2—гаситель извести, 3—бак с содовым раствором, 4—каустицер,5—сгустители Дорра,
6— фильтр, 7—трехкорпусный выпарной аппарат, 8—однокорпусный выпарной аппарат, 9—котел Фредеркинга). На 1 ж каустич. С. рас-
для горшков—0,40 ж; электроэнергии—25kWh.
3. Электролитический способ (смотрите Ебкий натр и Хлор). Для производства бикарбоната NaHC03 кальцинированную С. растворяют в воде при нагревании, раствор отделяют от мути на фильтрпрессах и в колоннах, карбонизируют его газом известково-обжигательных печей; реакция протекает следующим образом: Na2C03+C02+Н20 - 2NaHC03. Можно вести процесс и так: технич. бикарбонат разлагается паром до С. в декарбонаторах, минуя т. о. растворение кальцинированной С. Осадок бикарбоната промывают, отфильтровывают, отфуговывают на центрифугах и сушат
Фиг .11.
горячим воздухом при 70°, измельчают и упаковывают в бочки. На 1 ж бикарбоната с содержанием 97% NaHC03 расходуется технич. бикарбоната—1 225 килограмм,газа (100% С02)—520 килограмм, пара мятого—1,5 ж; электроэнергии—110 kWhsводы технич.—23 .м3: в случае употребления кальцинированной С. расход ее 0,7 ж.
Значение содового производства в хозяйственной жизни страны. Потребление кальцинированной С. в различных отраслях промышленности СССР на 1931 г. следующее (в %): текстильная—4,86, искусственного шелка—0,09; силикатная — 53,26; бумажная—! ,70; коже-
Лит.: Любавин Η. Н., Технич. химия, т. 2, 1899; Федотьев П., Химико-технологич. очерки, 1930; С а с с-Т и со в ский Б. А., Производство соды, вып. 1, Кальцинированная сода, М.—Л., 1932; е г о же, Спутник содовика, М.—Л., 1932; Кирх н ер 10., Производство соды по способу Сольве, пер. с нем., М.—Л., 1932; Лукьянов Н., Минеральная технология, т. 2, Производство щелочей, М., 1924; Федотьев И., Содовое дело и связанные с ним производства, СПБ, 1898; его же, Технич. анализ минеральных солей, ч. 1—5, Л., 1922—26; его ж е. Аммиачно-содовый процесс с точки зрения учения о фазах, «Изв. СПБ. Полит. Ин-та», т. 1, СПБ, 1904; «НИ», т. 2, Л., 1926; Lunge С., Handbuch der So-daindustrie und ihre Nebenzwei-
Фигура 12.
венная—0,64; жировая—10,36;металлическая— 2,12; анилокрасочная — 1,97; лакокрасочная— 1,27; лесохимическая—0,16; медико-фармацевтическая—0,43; прочие химич. производства— 0,20; сахарная—0,25; крахмально-паточная— 0,07; винокуренная—0,01; прочие пищевые производства—0,13; кино-фотографическая— 0,08; полиграфическая—0,21; прочие отрасли пром-сти—0,6; транспорт—0,55; земледелие— 0,17; торговля—7,00; кооперация—13,64; прочие потребители—0,17. Потребление кауетич. С. в %: в производствах текстильном и искусственного шелка—26,6%, в мыловаренном— 22,5%; в анило- и лакокрасочном—ок. 5%; в коксобензольном—ок. 1,8%; в химич. промышленности—ок. 3%; в нефтяной—ок. 8%; кооперация—ок. 21%, торговля—ок. 9% и прочие.
Размеры содового производства в СССР и з а границей. Мировое производство кальцинированной С. составляет ок. 5 000 000 ж и в СССР—400 000 ж. Производство кауетич. С. достигает в СССР 130 000 ж, а бикарбоната—37 000 ж.
Дальнейший путь развития производства С. (в СССР) намечен по следующему плану: 1) увязка содового производства с синтезом аммиака: при питании аппаратов абсорбции синтетич. аммиаком из маточных жидкостей NH3 не регенерируется, а выделяется NH4C1 в виде твердой соли (з-д превращается в нашатырно-содовый). Предположено отбросную С02 при получении Н2 для синтеза методом конверсии употреблять на карбонизацию аммиачного рассола; тогда отпадает ряд цехов: ди-стилляционный, известково-обжигательных печей и приготовления известкового молока. 2) Увязка с сернокислотной промстью по линии получения соды и серной кислоты из карабугазского мирабилита. 3) Увязка с калийной промышленностью: при обработке калийных месторождений (в Соликамске) получается как сильвинит KCl-NaCl, так и много отбросов поваренной соли, содержащих КС1. При обработке этих растворов по аммиачному способу получается азотно-калийное удобрение, известное под названием потазот, с содержанием NH4C1 около 65% и КС1 около 30%.
ge, 3 Aufl., В. 131, Brschw., 1909; Schreib Н., Die Fabrikation der Soda nach demAmmoniakverfahren ,B .,1905; Gmelin Handbuch der anorganischen Chemie, 8 Aufl., 1928, B. 21; Ullmanns Enzyklopadie der technischen Chemie, 2 Aufl, B. 8; Lunge-Berl, Chemisch-technischc Untersuchungsmethoden, 7 Aufl., B. 1, B., 1921; L u n-g e-B e r 1, Taschenbuch fiir d. anorganisch-chemische Grossindustrie, 7 Aufl., B., 1930; Fedotieff P. u. Kolossoff A., Die 3 Form des Ammoniak-soda-verfahrens, «Ztschr. f. anorg. u. allg. Chem.», 1923, B. 130; Нерудные ископаемые, изд. Академии Наук, т. M, Л., 1926; Вольф ков и ч С., Белопольский А., Лебедев Б., К вопросу об использовании природного сульфата, «Журн. прикл. химии», М., 1931, т. 4, 2—3; Макаров С., Физико-химич. исследования садки соды, там же, 1930, т. 3, 3; Юшкевич П., У р а з о в А., Соловьева Л., Лабораторное изучение отдельных стадий аммиачно-содового процесса, «Журнал химич. пром-сти», 1929, 1930, 1931 ; Ост 1., Химическая технология, пер. с нем., Л., 1927, вып. 4; Карабугазская проблема, 1-я Всесоюзная конференция по Карабугазу, 1931; «Карабугаз», сб., Л., 1928; D а т-т е г О., Chem. Technologie der Neuzeit, 2 Aufl., В. 3, Stg., 1927. M. Некрич.