 > Техника, страница 81 > Соляная кислота
> Техника, страница 81 > Соляная кислота
Соляная кислота
Соляная кислота, раствор хлористого водорода НС1 (смотрите Хлора соединения) в воде; получается С. к. главным образом как побочный продукт при производстве сульфата (смотрите). Раньше сульфатные заводы выпускали НС1 в воздух, чем причиняли вред населению и растительности (при содержании в дождевой воде 0,00001% НС1 листья покрываются пятцами и постепенно отмирают). По англ, закону 1863 г. з-дам было вменено в обязанность не выпускать на воздух газы с содержанием НС1 более 0,0000003% по объёму, то есть выпускаемые в атмосферу газы не должны содержать более 0,457 г в м? при 15° и 760 миллиметров; общая кислотность отбросных газов не должна превосходить эквивалента 9,15 г S03 в 1 м3 (условно, пересчитывая все кислоты на S03). В настоящее время поглощение НС1, выделяющегося из сульфатных печей, поставлено настолько совершенно, что в 1 мг газа, выходящего в воздух, содержится менее 0,454 г НС1.
В технике процесс улавливания НО производится пропусканием печных газов через ряд больших керамических кислотоупорных баллонов с водою и через поглотительные башни. Количество НС1,к-рое поглощается водой, зависит: от концентрации НС1 в газах, от величины поверхности поглощения, от 1° газов и воды и от давления. В табл. 1 приведены кон-
Таблица 1К о н ц е н т р а ц и я НС1 (в %) в С. к., полученной поглощением НС1 водой при различных условиях.
| Темп-pa по | Содержание НCl в газах в % | ||||||
| глощения, °С 1
j |
5 | ! 10 | 20 | 30 | 50 | 70 | 90 |
| 1
5 1 |
ЗВ.8 | 36,1 | 38,6 | 40,0 | 41,9 | 43,2 | 44,1 |
| 10 j | 33,2 | I 35,5 | 38,0 | 39,4 | 41,3 | 42,5 | 43,4 |
| 35 1 | 32,6 | 34,9 | 37,3 | 38,7 | 40,6 | 41,8 | 42,7 |
| 20 1 | 32,0 | i 34,2 | 36,6 | 38,0 | 39,9 | 41,1 | 42,0 |
| 25, | 31,3 | I 33,6 | 35,3 | 37,4 | 39,2 | 40,4 | 41,3 |
| ВО { | 30,4 | 32,9 | 35,2 | 36,5 | I 36,4 | 39,6 | 40,6 |
| 40 i | 29,2 | 31,5 | 34,8 | 35 Л | 37.0 | 38 Л | 39,0 |
| 50 j
1 |
28,0 | I 30,0
i |
32,2 | 33,6 | i 35.4
! |
36,5. | 37,4 |
центрации НС1 в С. к., полученной поглощением НС1 водой при нормальном давлении, различном содержании НС1 в газах и различных f°. Для совершенного поглощения НС] водой необходимо, чтобы вода имела возможно низкую t°; поэтому пользуются баллонами большой емкости, с большой поверхностью охлаждения. Для увеличения поверхности соприкосновения НС1 с водой последнюю пропускают в поглотительных башнях навстречу *НС1 номерно распределенной струи.
Фигура Л
Фиг.
G
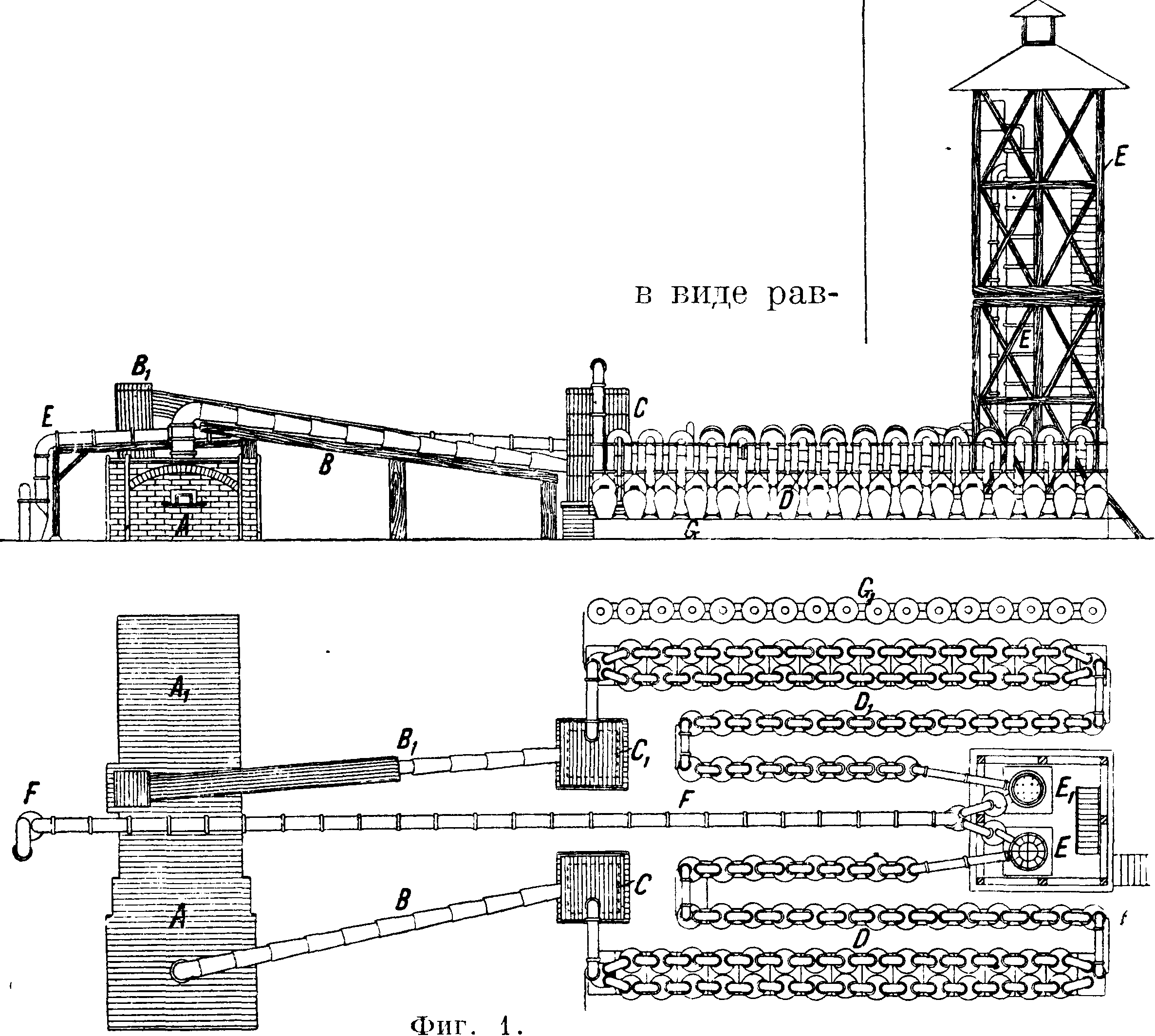
На фигуре 1 показана конденсационная установка для НС1 при муфельной сульфатной печи. Газ из печи ААг отводится по двум трубам: по В проходит газ из чаши (он содержит 15-7 25% НС1), по Вг идет газ из муфеля (содержит ок. 10% НС1). Эти газы поступают в две башни
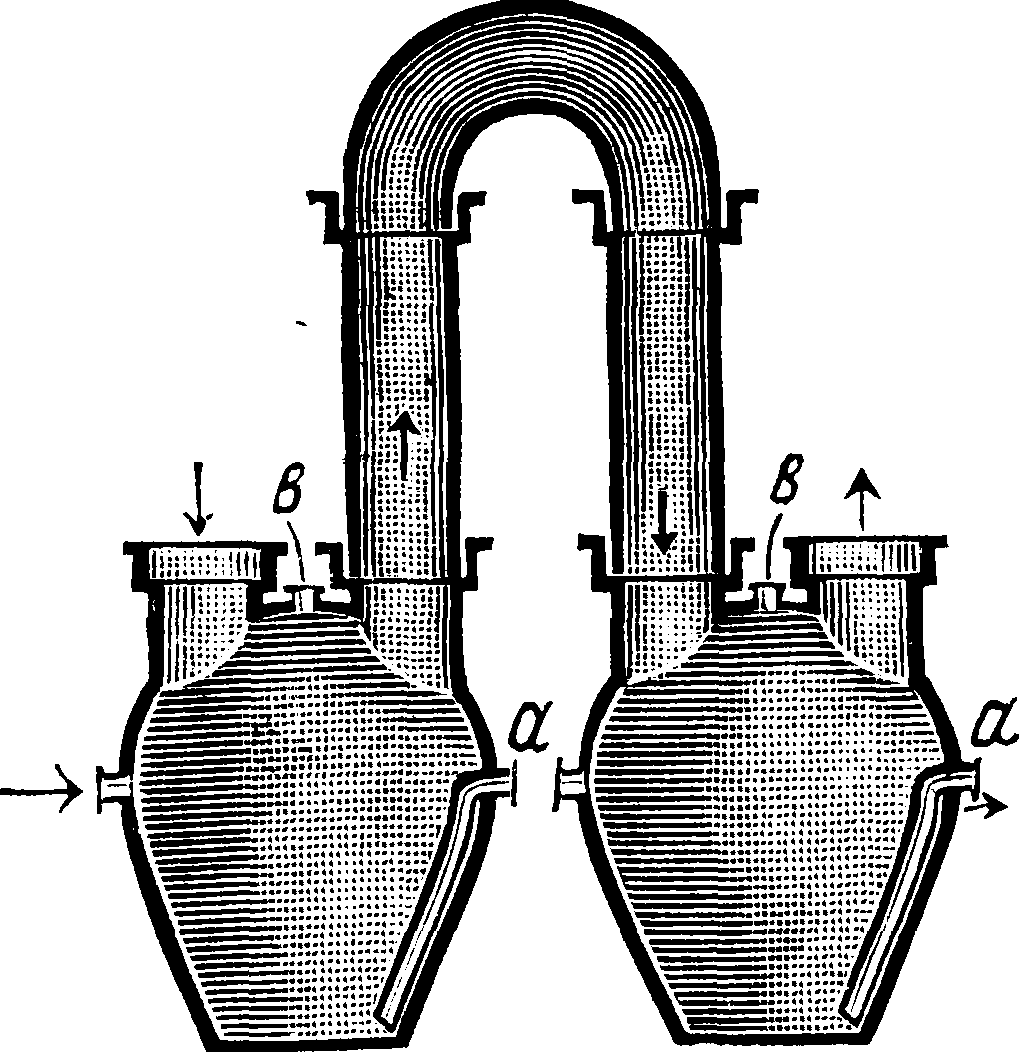
С и Сх из просмоленных песчаниковых плит. Башни в верхней части насажены кислотоупорными керамич. плитками и служат для первоначального охлаждения газов и освобождения от пыли и примеси H2S04. Газ входит снизу и, пробиваясь между кислотоупорными плитками,встречает ток воды, падающей сверху вниз. Труба Βχ (не шире 0,9 м) из просмоленных песчаниковых плит служит для отвода горячих муфельных газов (ί° их 300—350°); труба В служит для отвода менее горячих газов, выделяющихся в чаше, и строится из составных керамич. труб. Из башен С и Сггазы направляются в два ряда параллельно расположенных, с нек-рым уклоном в сторону печи, кислотоупорных керамич. баллонов I) и Όχ типа вульфовых склянок. Эти баллоны (числом ок. 60) соединены между собою Л-образными керамич. трубами (фигура 2: а—сифоны для переливания жидкости из одного баллона в другой, с—отверстия для наливания воды). Высота баллона около 1 м, дпам. около 0,8 м, емкость 300—350 л. Через баллоны и сифонные трубки а навстречу газам непрерывно течет вода; готовая С. к. стекает из ближайшего к промывной башне баллона в ряд сосудов G и Стг (фигура 1). НС1 б. ч. пропускают над жидкостью, так что поглощение газа происходит вследствие поверхностного соприкосновения его с поступающей навстречу газам кислотой. Для окончательного улавливания газа последний направляют в орошаемые водой поглотительные керамические башни Е и Еъ наполненные внизу кислотоупорными плитками, а вверху—кусками кокса. Из поглотительной башни (часто ставят 2 такие башни подряд) газ направляют через контрольный баллон в длинную керамическую трубу F и дымовую трубу. Из последней поглотительной башни получается слабая С. к.
5—8° Be, применяемая вместо воды для поглощения НС1.
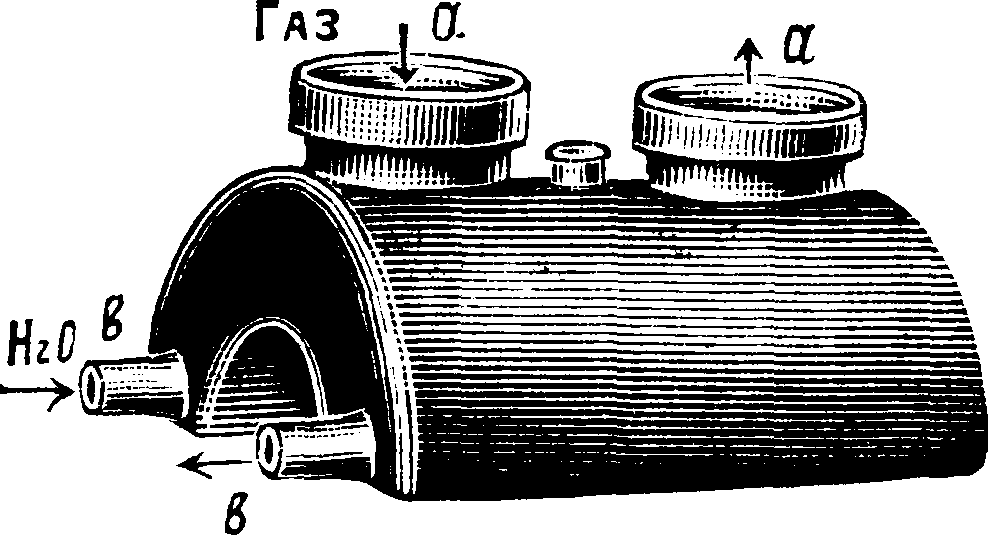
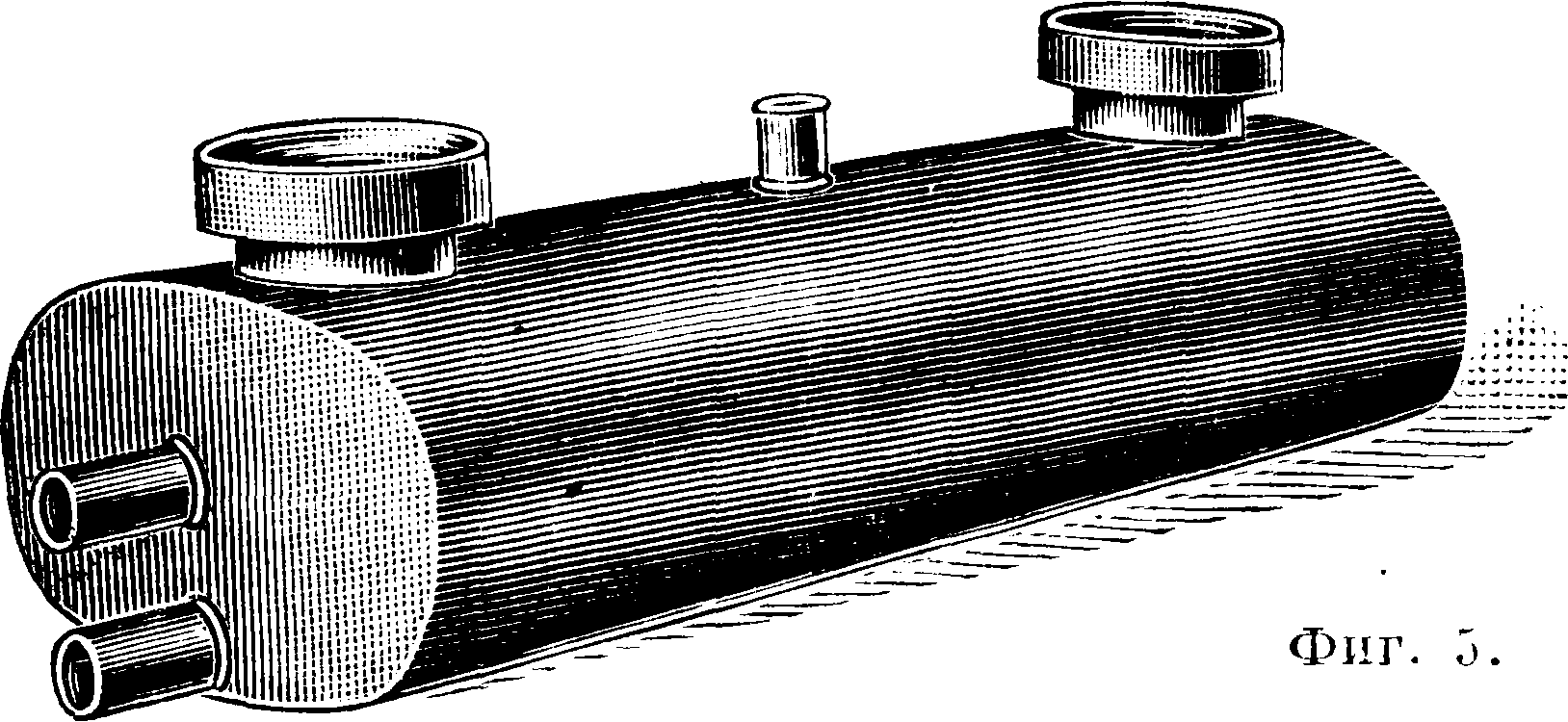
Баллоны другого устройства ,(фигура 3) предложены Целляри-усом (Cellarius). Газ направляется по трубам а, жидкость же переливается по трубам b и удерживается в баллонах в небольшом количестве. Для большего охлаждения эти баллоны погружаются почти до верха труб а в холодную воду; они удобны в том отношении, что занимают мало места и уход за ними проще. На фигуре 4 показана установка для поглощения НС1 баллонами Целляриуса. НС1 по составной керамич. трубе b направляется в пылеотделитель с (ящик из каменных плит с перегородкой, не доходящей до дна), затем поступает в баллоны Целляриуса е, находящие
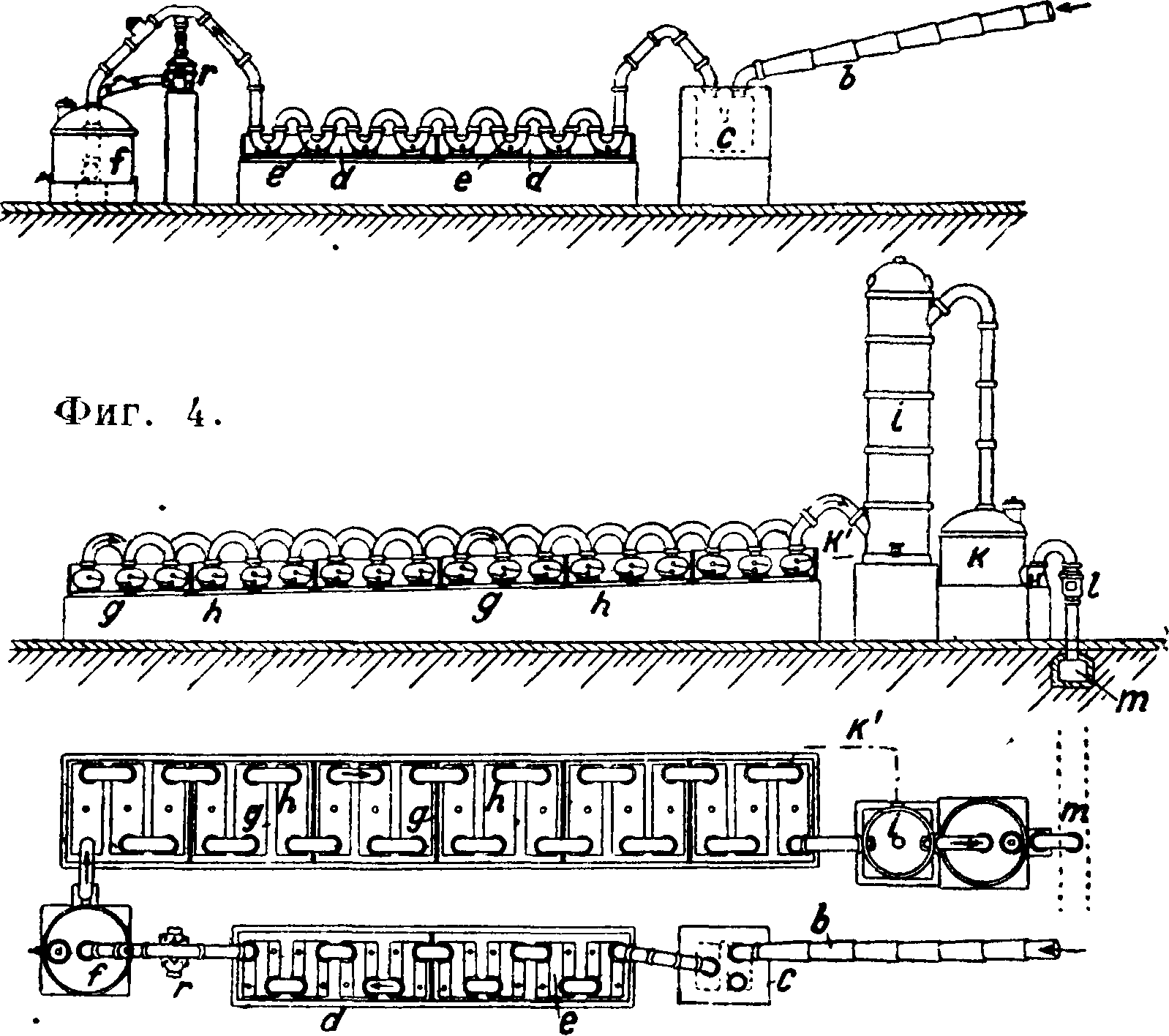
ся в деревянном ящике d п охлаждаемые проточной водой, далее в эксгаустер г и в керамич. фильтр (насажен коксом или мелким гравием). Очищенный и охлажденный газ направляется в систему баллонов /г, находящихся в деревянном ящике д с протекающей холодной водой (баллоны системы Мейера, типа Целляриуса, отдельно на фигуре 5), а отсюда поступает в керамич. башню i (насажена коксом или кислотоупорными керамическими цилиндриками или же шарами), орошаемую холодной водой. Получаемая из этой башни слабая С. к. поступает по к в баллоны вместо воды для поглощения НС1. Образующиеся брызги кислоты улавливаются в фильтре к (наполнен коксом); I—контрольное оконце, т—боров дымовой трубы. В сутки по
лучается ок. 300 килограмм С. к. 24° Be (39,1% IIC1). Для поглощения НС1 Фришер предложил способ, при к-ром НС1 пробулькивает через слой к-ты. Для более совершенного поглощения НС1 абсорберы все время орошаются сверху водой. Система Фришер а занимает сравнительно мало места, но требует повышенного расхода энергии на просасывание газа через к-ту посредством вакуум-насоса.
Техника получения С. к. за последнее время сделала крупные успехи благодаря применению керамич. изделий, стойких к резким изменениям t° и действию к-т. Так. для установок с большой производительностью конденсация НС1 метров б. произведена в керамич. трубах большой длины (до 100 м) и высоких, сделанных из каменных плит башнях (англ, система), насаженных коксом. При переработке в сульфатной печи 7 ж NaCl в сутки устанавливают две башни. Первая из них строится высотою 10-У11 метров с основанием в 3,2 м2, а вторая—18-У-20 метров высотою с основанием в 4,8 м2. Вторая, более высокая башня, орошаемая холодной водой (т. н. холодная башня), дает слабую С. к., которая насосом передается для орошения первой, меньшей башне (т. н. горячая башня); при этом получается С. к. крепостью ок. 18° Be. При хорошей работе установки улавливают до 99,70% всего НС1, выделяющегося из сульфатной печи. Из 100 ч. NaCl (97%-ного) получается 180-f-187 ч. Г. к. 20° Βό, что отвечает 95-у97% теоретического выхода.
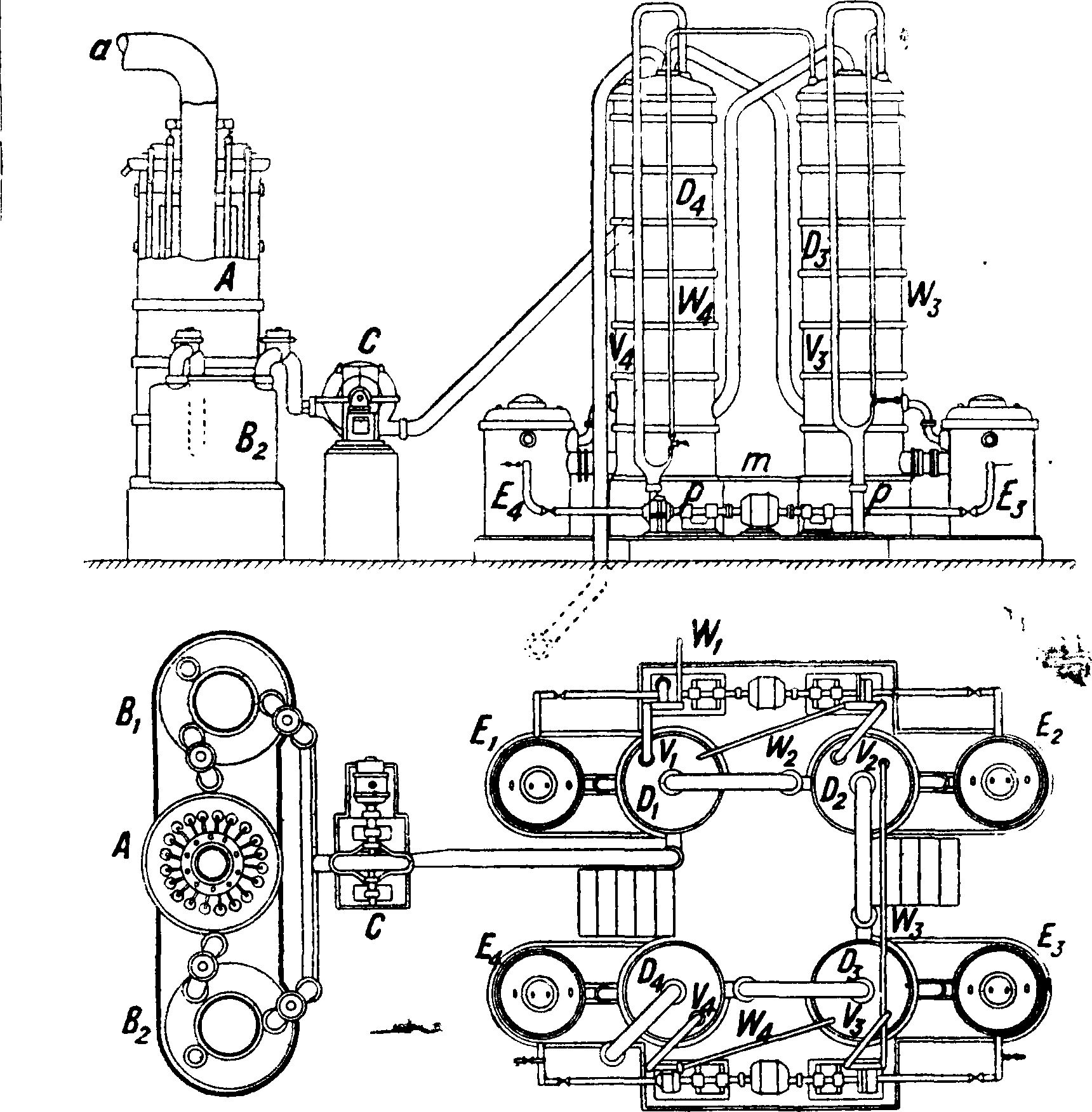
Башенная поглотительная установи а по Цирену (V. Zieren) показана на фигуре 6. Она состоит из 4 последовательно соединенных низких (5 метров высотою) абсорбционных башен D2, D3, D4, сделанных из шамота. Газ через а поступает в охладительную башню
Фигура 6.
А, затем в один из фильтров Вг или В2, где он освобождается от пыли, серной к-ты, железа и большей части а. Вентилятор С передает газ через четыре абсорбционные башни Dx—£>4, насаженные кислотоупорными керамическими кольцами. Башня D4 омывается свежей водой; из нее выходят газы, уже свободные от НС1. Стекающая вода, пройдя через холодильники Ег—Е4, насосом р по трубе V 4 перекачивается обратно на ту же башню. После многократной циркуляции стекающая жидкость по трубе W4 перекачивается на башню D3, где происходит такая же циркуляция. Пройдя затем башни D2 и Dl9 образующаяся С. к. (22° Be) отводится по трубе БД. Постоянное охлаждение стекающей кислоты предохраняет шамотные материалы от разрушения. Эта установка занимает мало места и дает возможность получать С. к. одинаковой крепости как из высокопроцентных хлористоводородных газов меха-нич. печей, так и из разбавленных газов. Для перекачивания С. к. применяются каучуковые или «мембранные» насосы с каучуковой перегородкой; употребительны также насосы, сделанные целиком из кислотоупорного керамич. материала, или насосы Феррариса из ферросилиция. Для передачи кислоты можно пользоваться и керамич. толстостенными монтежю (смотрите).
Получение С. к. из хлористых магния, кальция и аммония. Попытки получения С. к. из хлоридов Mg, Са и NH4, являющихся отбросами различных химич. производств, не имели до сих пор большого практического значения. Хепке (Нерке)!1] предложил для переработки хлористого магния применять вращающуюся печь; для разложения он брал оксихлорид магния MgO-MgCl2, который не так легко плавится. Измельченный продукт поступает в непосредственно обогреваемую печь с футеровкой из жженой магнезии или из магнезитового кирпича. Реакция ведется при возможно низкой ί°. Схема реакции [2]:
Mg0-MgCl2 + H20=2HCl + 2Mg0.
Получение С. к. при хлорировании органических и др. соединений. С. к. может быть получена как побочный продукт при хлорировании органич. соединений. В связи с производством чатых и красящих веществ, где процессы хлорирования широко применяются, этот новый источник С. к. приобретает нек-рое экономии, значение. С. к., получаемая этим путем, не содержит а, селена, серной кислоты и других минеральных загрязнений, но содержит нек-рые органические примеси, во многих случаях нежелательные. Предложено [3] пропускать сухой хлор под давлением и при высокой f° через жидкие органич. вещества (парафин, смолы, стеариновую к-ту и тому подобное.), протекающие по ступенеобразно расположенной нагреваемой посуде. Этот способ однако не вошел в практику, так как получаемые при этом хлорированные продукты не имеют применения. В больших количествах НС1 образуется при получении хлораля, монохлоруксусной кислоты, хлорбензола, при хлорировании а, окислении изоборнеола в камфору и т. д. При действии хлора на целлюлозу, бумагу и торф при 150—350° хлор соединяется с водородом органич. веществ и дает НС1. При низкой ί° кроме того получаются различные органич. продукты, как наир, уксусная к-та, а при высокой t°— С02 [4]. Для образования НС1 хлор можно проводить также через слой каменного угля без всякого подогрева [5]. Нагель предложил [6] вводить попеременно смесь хлора с водяными парами и хлора с воздухом в генераторную шахту, наполненную коксом. Для получения необходимой ί° следует время от времени продувать воздух. Лоренц вводит смесь хлора с водяным паром в шамотные реторты, наполненные коксом и древесным углем; происходящая при этом реакция протекает в две фазы;
С + Н20+С12=2НС1 + С0 +16 070 Cal,
С0+Н20 + С12=2НС1 + С02 +54 420 Cal.
Уголь в этом процессе утилизируется почти целиком. Вторая часть реакции практически не проходит полностью—остается часть несгоревшей СО [?]. Две печи работают по этому способу в Италии; крепость получаемой С. к. 20—23° Вё [в].
Синтез С. к. При электролитич. методах получения солей и едких щелочей выделяется в значительных количествах как побочный продукт хлор, к-рый можно использовать для получения С. к. путем соединения его с водородом. Реакция соединения водорода с хлором сильно экзотермична. и для того, чтобы вызвать этот процесс, достаточно весьма непродолжительного освещения. Главное внимание было обращено на то, чтобы эту реакцию сделать безопасной и чтобы не оставался избыток того или другого газа (остающийся свободный водород значительно удорожает производство, а хлор загрязняет кислоту). Робертс (Roberts) предложил [9] проводить газы (в молекулярных количествах) через особые трубы в помещение для сжигания, где они непосредственно соединяются, спокойно и равномерно сгорая в С. к. Выделяющееся при реакции большое количество тепла предложено использовать проведением газов из камеры сжигания в газовый, мотор, соединенный с электрогенератором [10]. Т. о. можно получить бблыную часть тока для электролитического процесса. Чтобы сделать соединение водорода с хлором безопасным, Г. и В. Патаки (Н. u. W. Pataky) предложили С11] проводить смесь обоих газов через нагреваемые на водяной бане аппараты, наполненные размолотым древесным углем. Газы соединяются при этом в НС1 на поверхности угля, не вызывая детонации смеси. Этот способ уже применяется в технике.
Очистка продажной С. к. от примесей (серной к-ты, а, железа, сер нистой к-ты, хлора и других) часто производится на особых заводах. Чтобы получить С. к., свободную от серной к-ты, к ней прибавляют ВаС12 и образовавшийся BaS04 отделяют; или ее обрабатывают крепкой серной к-той, благодаря чему t° смеси сильно повышается и выделяется НС1, который улавливается дистиллированной водой. Свободную от а С. к. лучше всего получать при помощи серной к-ты, не содержащей а. Кроме того можно удалять сероводородом (в виде As2S3) или хлористым оловом
6HCl + 3SnCl2 + As203=As2 + 3H20 + 3SnCl2или хлористым ванадием. Железо можно осаждать фосфорной к-той. Химически чистая соляная кислота получается перегонкой в платиновых аппаратах и обыкновенно готовится крепостью в 23° Βό, что отвечает удельному весу 1,19 или 37,23% НС1.
Свойства С. к. При нагревании конц. С. к. выделяется газообразный НС1, но когда концентрация НС1 доходит до 20,2%, то этот раствор перегоняется уже без изменения состава при постоянной t°Kun= 170°. Если нагревать слабую С. к., то отгоняется гл. обр. вода, а затем, когда концентрация достигнет 20,2%, получается конц. С. к. с постоянной t°Kun. (предполагают, что С. к. с постоянной t°Kun, является соединением НС1+8Н20).
С. к., получаемая как побочный продукт при производстве сульфата,—окрашенная в желтый цвет жидкость, с резким запахом и содержит различное количество НС1; она обыкновенно заключает в себе примеси S02, H2S04, N203, FeCl3, Cl, хлориды Se, AsCl3 (иногда в довольно значительном количестве, а именно до 5,18 а As в 1 килограмм к-ты), S, Sb, Са, Na, Br, J и органич. вещества. К-та, получаемая из чаши, содержит 0,2—0,3% S03, и железо, от которого гл. обр. зависит желтый цвет кислоты (хлор и органич. вещества также способствуют окраске к-ты). К-та из муфеля содержит 1—2% S03; Se содержит больше, чем предыдущая, но меньше As и Fe. Продажная технич. С. к. готовится гл. обр. крепостью 18—22° Be. Стандарт для технической С. к. в СССР установлен следующий: уд. в 1,141—1,144 (18° Be4z0,2° Be), содержание НС1 27,5% (±0,3%), а не более 0,015%, Fe -f А1 не более 0,03%, серной кислоты (S03) не более 0,6%. Соляная кислота может иметь слабо желтый цвет.
Таблица 2. — Состав (в %) и уд. в соляной кислоты.
| Вещества, входящие в состав соляной к-ты, и уд. вес ее | Кислота из чаши пламенной печи | Кислота из пода пламенной печи | Кислота, ί служащая для пр-ва хлорной извести |
| H2S04. | 0,110 | 3,680 | 0,490 |
| Fe203. | 0,020 | 0,008 | 0,020 |
| ai2o3. | 0,006 | 0,170 | 0,009 |
| СаО. | 0,007 | 0,043 | 0,021 |
| MgO. | Следы | 0,013 | 0,010 |
| Нелетучего состава | 0,120 | 0,780 | 0,430 |
| НС1. | 28,330 | 21,080 | 27,050 |
| Уд. в при 15°. | 1,144 ! | 1,140 | 1,138 ί |
С. к. растворяет большинство металлов (за исключением благородных) и их окиси. В первом случае образуются хлориды и выделяется водород, а во втором образуются хлориды и вода. Свинец например быстро растворяется в горячей конц. С. к. Более стойким является твердый свинец, содержащий сурьму. На железо при высокой t° С. к. действует едва заметно. Из многих солей С. к. вытесняет к-ты, как например фосфорную, борную, угольную, кремневую. Т. к. цена С. к. обусловливается уд. весом, то ее иногда фальсифицируют, прибавляя хлористый кальций, к-рый повышает ее плотность. Таблица 3 показывает содержание НС1 в чистой С. к. различного уд. в (Lunge u. Marchlewski).
Таблица З.-С одержание НС1 в С. к. различной концентрации.
| Уд. в. | г НС1 в | г НС1 в | Уд. В. | 8 НС1 в | 8 НС1 в | ||
| при | °Вё | 100 г | 100 см3 | при | °В0 | 100 8 | 100 сантиметров 3 |
| 15° | к-ты | к-ты | 15° | к-ты | к-ты | ||
| 1,010 | 1,4 | 2,14 | 2,2 | 1,110 | 14,2 | ! 21,92 | 24,3 |
| 1,020 | 2,7 | 4,13 | 4,2 | 1,120 | 15,4 | 23,82 | 26,7 |
| 1,030 | 4,1 | 5,15 i | 6,4 | 1,130 | 16,5 | 25,75 | 29,1 |
| 1,040 | 5,4 | 8,16 | 8,5 | 1,110 | 17,7 | 27,66 | 31,5 |
| 1,050 | 6,7 | 10,17 ! | 10,7 | 1,150 | 18,8 | 29,57 | 34,0 |
| 1,060 | 8,0 | 12,19 | 12,9 | 1,160 | 19,9 | 31,52 | 36,6 |
| 1 1,070 | 9,4 | 14,17 1 | 15,9 | 1,170 | 20,9 | 33,44 | 39,2 |
| j 1,080 | 10,6 | 16,12. | 17,4 | 1,180 | 22,0 | 35,39 | 41,8 |
| 1 1,090 | 11,9 | 18,11 ! | 19,7 | 1,190 | 23,0 | 37,23 | 44,3 |
| 1,100 | 13,0 | 20,01, | 20,0 | 1,200 | 21,0 | 39,11 | ! 46,9
1 |
Хранение и транспорт С. к. Хранение С. к. производится обычно в деревянных баках или цилиндрах, выложенных резиной [12]. Наши исследования показали, что можно хранить С. к. в деревянных баках, пропитанных раствором каучука в бензине или смесью этого раствора со смолой. Для транспорта применяют стеклянные бутыли на 70 л и керамич. кислотоупорные сосуды емкостью ок. 1 ж3.
Применение С. к. Соляная к-та 18—22° Be имеет большое применение в химич. промышленности—при производстве красителей, в металлургии, в производстве клея, для приготовления хлористого цинка и других солей, уксусной к-ты, углекислоты, для оживления костяного угля, для получения хлорной извести и т. д.
При испытании С. к. обыкновенно определяют ее уд-, в., содержание НС1 и примесей.
Лит.: !) Г. П. 278106; 2) «Ztschr. f. angew. Che-
mie», Lpz., 1918, 1, p. 95; P итт ер К., «ЖХП», 1925,
3, стр. 78; 3) Am. П. 914233; *) Bornische Elektrizitats A. G., Г. П. 158086; 5) г. П.313875; 6) «Chemiker Ztg», Co-then, 1912, p. 54; 7) Hirschkind W., «J. Eng. Chem.», 1925, y. 17, p. 1071; Roma A., «Giornaie di Chemica Industrial ed Applicata», Milano, 1924; «Des Matiores colorantes», P., 1925, 29; 8) «Chemical Trade Journal and Chemical Engineer.», L., 1924, 2IV, p. 531; ®) Г. П. 194947; l0) Г. П. 301903; η)Γ. Π. 114219; i2) Newitt D.M., «Chemistry a. Industry Review», London, 1924, v. 43, 8.—Б удников П., Химическая технология минеральных веществ, Иваново-Вознесенск, 1927; Вульф-сон 3. и Покришевский И., Сульфатные печи, «ПСХП», 1927, т. 4, 11; Ост Г., Химическая технология, вып. 4, Ленинград, 1927; Лукьянов П., Курс химической технологии минеральных веществ,
4. 1, 3 издание, Москва, 1931; Фокин Л., Обзор химич. промышленности, ч. 1, вып. 1, П., 1921; Lunge G., Handbuch der Sodaindustrie u. ihre Nebenzweige, 3 Aufl., B. 2—3, Brschw., 1909; Meyer Th., Die Fab-rikation von Sulfat und Salzsaure, Halle a/S., 1907; К u s-t e r, t)ber die Sulfat- und Salzsaureherstellung, «Chemiker Ztg», Coethen, 1919, p. 249; Meyer, Salzsaure-kondensation, «Ztschr. f. angew. Ch.», Lpz., 1913, p. 97; Ullm. Enz., y.9; B r a u e r A. u. D’AnsJ., Fortschritte in der anorganisch-chemischen Industrie, В. 1, B., 1921;
Winteler Z., «Elektrochemische Ztschr.», 1888/89, p. 10; Lorenz, «Ztschr. f. angew. Ch.», Lpz., 1895, 10, p. 7; N e u m a η n A. u. M u d f о r d F. G., «Ztschr. f. angew. Ch.», Lpz., 1897; Ам. П. 1420209, «Ch. Ztg», 1922, p. 354; Nagel О., «Ch. Ztg», 1912; Bayer F., Со. Г. Π. 337098, Ан. Π. 189723, «Chemisches Zentral-blatt», Berlin, 1923, 11, p. 725; P о m a G. u. Andre-an i, Konsolidierte Alkaliwerke Westeregeln, Г.П. 313875; Neumann B. u. Domke R., «Ztschr. f. angew. Ch.», Lpz., 1926, 39, p. 368; Waeser B., Syntetische Salzsaure, «Metallborse», Halle a/S., 1923, p. 1035; Waeser B., Schwefelsaure, Sulfat und Salzsaure, Dresden— Lpz., 1927; Neumann B., Chem. Technologie der anor-gan. Industrie в книге Erganzungswerke zu Mussprats en-
zyklopadischen Handb. d. technischen Cbemie, B. 2, Halb-band 2, Brschw., 1927; Ritter C., Die Salzsaure-Indust-rie und Drehofen zur Salzsauregewinnung, «Chem. Apparatur», p. 181, 1924; Laury N., Hydrochloric Acid and Sodium Sulfate, 1927; К ii s t e r, Ueber Sulfat-Salz-saureherstellung,«Chem.Ztg», C6then,1919, Jg. 43, p. 249; Lunge-Berl, Chemisch-technische Untersuchungsme-thoden, В. 1, p. 900, B., 1921; W aeser B., Die Salz-saureabsorption, ihr Mechanismus und die erforderlichen Einrichtungen, «Chemische Fabrik», Lpz., 1928, p. 101; Neumann B. u. Kurz H., Die Reaktion beim Hargreaves Prozess, «Ztschr. f.angew.Chem.», 1929, 47, p. 1085; N e u m a η η B., Salzsaure-Synthesen, ibid., 1924, p. 72; ibid., 1923, p. 317. П. Будников.