 > Техника, страница 81 > Спектры
> Техника, страница 81 > Спектры
Спектры
Спектры (атомные, м о л е к у л я р ны е), совокупность пространственно разделенных гармонических составляющих света, излучаемого атомами и молекулами. С. разделяются на
1) линейчатые, состоящие из отдельных светлых линий на темном фоне, 2) полосатые и 3) сплошные. Полосатые С. при наблюдении с помощью приборов с малой дисперсией (смотрите) имеют вид отдельных светлых полос, разделенных более или менее темными промежутками. Наблюдения с помощью приборов с большей дисперсией показывают, что на самом деле каждая полоса распадается на большое число отдельных тонких линий. Сплошные С. характеризуются действительно непрерывным распределением света, по длинам волн; как правило они испускаются раскаленными твердыми или жидкими телами и тянутся на значительные области. Реже сплошные С. испускаются парами или газами. Со времени Бунзена и Кирхгофа, открывших спектральный анализ, было выяснено, что линейчатые С. испускаются отдельными атомами, в то время как полосатые— молекулами. Каждый атом и каждая молекула имеют свой вполне определенный С. Основная закономерность, которой подчиняются линейчатые С/, заключается в том, что линии располагаются не беспорядочно, но составляют определенные характерные группы, называемые сериями. Частоты линий, принадлежащих к одной серии, м. б. представлены в виде сравнительно простой ф-ии от последовательного ряда целых чисел. Простейший вид эта функция имеет для водорода, частоты всех линий которого охватываются ф-лой Бальмера (1885 г.):
где п2 и пг—целые числа, a R—постоянная, носящая название постоянной Ридберга. Обычно вместо частот линии характеризуются другими величинами: волновыми чи, пропорциональными частотам. Волновые числа равны числу волн, укладывающихся на длине в 1 см. Если v выражено в волновых числах, то
#= 1,097 - IO^ju-1.
При п2=1, пг= 2, 3, 4,. формула (1) дает ряд линий, лежащий в далекой ультрафиолетовой части С. (серия Леймана). При п2=2, пг=3, 4, 5,. получаются линии с длинами волн Я 656-2,80 А (Ηα),*λ 4861,33 А (Н**), Я 4340,47 к (Ну) ит. д., лежащие частью в видимой, частью в близкой ультрафиолетовой области (фигура 1).
Hex. нfi ну нд «о
Фигура 1.
При п2=3, пг=4, 5,. получаются инфракрасные линии (серия П а ш е н а) и т. д. С. ионов, сходных с водородом (ионизованного гелия, дважды ионизованного лития и т. д.), охватываются обобщенной ф-лой Бальмера:
-*·*(;Η)· <Я
где Ζ—атомный номер данного иода. Их серии вполне аналогичны сериям водорода, только благодаря множителю Ζ2 сдвинуты в ультрафиолетовую часть С. В спектроскопии принято отмечать нейтральное состояние атома римской цифрой I, однократную ионизацию цифрой II и т. д.; т. о. формула (2) изображает С. ряда Η I, Не II, Li III, Be IV и т. д. Основными линиями этого ряда являются линии, соответствующие значениям п2= 1, Щ=2; их частоты равны:
v=RZ* или уГi-j/·(3)
Второе выражение показывает, что корни квадратные из частот этих линий растут пропорционально атомным номерам. Эта закономерность вполне аналогична закону Мозли для рентгеновых С. В табл. 1 сравнены наблюденные и вычисленные по формуле (3) длины волн для Η I, Не M, Li III и Be IV:
В общем случае Ридбергом было установлено, что частоты линий, принадлежащих к одной серии, м. б. представлены ф-лой:
v=T2-T1.
Величины Т2 и Тг называются спектральными термами и являются ф-иями от целых чисел. Для водорода и сходных с ним ионов:
T_RZ2
П2
Для других элементов по Ридбергу гр __ RZ2
(П + Я)2 ’
где R, η, Z имеют прежнее значение, а х— поправка, постоянная для каждого данного ряда термов. Терм, характеризуемый данным целым числом п и данной поправкой ж, обозначается символом пх.
У многих элементов линии каждой серии распадаются на несколько б. или м. тесно расположенных линий. Если они распадутся на две, их называют дублетами, если на три,—триплетами и т. д.; в общем случае говорят о спектральных мультиплетах. При мультиплетной структуре линий каждый из термов распадается на ряд термов. В этом случае отдельные значения терма отмечаются индексами. Слева сверху символа х пишется цифра, указывающая наибольшее возможное число различных термов данной группы. Спектральные термы обозначаются символами lzSlt22Pi/a, 22Рз/а, 33_Dl5 33-D2> 33-D3 и т. д. У щелочных металлов Ридбергом было установлено существование трех различных серий; эти серии получили название: 1) главной, 2) первой побочной, 3) второй побочной. Впоследствии Бергман открыл у щелочных металлов в инфракрасной части С. еще одну серию. Линии всех серий представляют собой дублеты, причем эти дублеты очень узки у Li, несколько шире у Na и вообще тем шире, чем больше атомный вес элемента. Главная серия содержит самые яркие и наиболее легко получаемые линии; головная линия главной серии (резонансная линия) является вообще линией наиболее характерной для С. данного элемента. Кроме того линии главной серии обнаруживаются
Таблица 1.—С равнения А,наблюденных и вычисленных по формуле (3).
| . Z | 1
1 1 Элемент | А в А | |
| вычислено | 1 наблюдено | ||
| 1 | Н I | 1 215,68 | 1 215,68 |
| 2 | Не II | 303,80 * | 303,7 |
| 3 | Li III | 135,01 | 135,02 |
| 4 | Be IV | 75,94 | 75,94 ! |
также в поглощении. Символич. серии щелочных металлов обозначаются след, обр.:
Главная серия: v=12SLj2-n*Pij2f 3/J п=2, 3, 4.
2-я побочная: v=22Pij2) 3/2_n2,Sl/3; n=2, 3, 4.
1-я побочная: ν=22Ρ1^> з/2 —/г2Г> з/2, 5/2; я=3, 4, 5.
Серия Бергмана: ν=32Б3/2> (2~n2F5h, ?/<>’ ,г=*» 6 ···
Аналогичные серии испускают ноны, сходные с щелочными металлами, например Mg II, AI III,. Са II, Sc III,. и т. д.
Теоретич. толкование спектральные серии получили в теории Бора. По Бору атом обладает рядом устойчивых (стационарн ы х) состояний, соответствующих различным расположениям электронов, составляющих его оболочку. Находясь в этих стационарных состояниях, атом не лучеиспускает. Испускание линий происходит при переходе атома из одного стационарного состояния в другое, причем при переходе испускается одна линия с монохроматической частотой, определяемой «правилом частот» Бора:
где Wx—энергия атома в начальном стационарном состоянии, a W2—в конечном, h—постоянная Планка, равная 6,55·10-27 эрг. ск. Сериальные термы по Бору пропорциональны энергиям стационарных состояний:
Γ=-χ· (5)
На этом соотношении основан удобный графич. способ изображать возникновение спектральных линий. Значения энергий стационарных состояний атома изображаются в виде уровней внешний электрон. Движению этого электрона по различным орбитам и соответствуют различные энергетич. уровни атома. Самым глубоким уровнем является уровень 12&ι/2; на нем нормально находится электрон. Если электрон благодаря какому-нибудь внешнему воздействию поднят на более высокий уровень, то, возвращаясь обратно, он испускает определенные линии. Легче всего электрон поднять на энергетически ближайший уровень 2 Р. Обратному переходу с уровня 2 Р на уровень 1 S соответствует испускание головной (резонансной) линии главной серии ν=1 S — 2 Р, которая возбуждается ле1че всего. Для испускания остальных линий С. электрон надо поднять на более высокие уровни. Если атом возбуждается к свечению налетающим извне электроном, то скорость этого электрона должен быть достаточной, чтобы при ударе об атом перевести его с нормального уровня на один из более высоких. Скорость "налетающего электрона выражают через потенциал ускоряющего его внешнего поля в V. Потенциал, достаточный для возбуждения линии, называют резонансным, а потенциал, достаточный, чтобы выбить электрон с нормального уровня за пределы атома,— ионизационным. Значение ионизационного потенциала дается энергией наиболее глубокого уровня атома или, в силу установленной Бором пропорциональности между значениями термов и энергией, значением наиболее глубокого терма. Для щелочных металлов это будет терм 1 S; одновременно он дает т. н. «предел» главной серии. В табл. 2 приведены значения резонансных и ионизационных потенциалов для шел очных металлов. о ч>
о
1
I
$
I
*
ts
*
ч»
«3
*
§
ЗГ
5
ζ
s
*
*
о
i
*
- 4S
- 40
-ЗР
-зо
-2S
- 2Р
1S
Фигура 2.
(фигура 2), а возникновение линий в виде вертикальных стрелок, соединяющих те два уровня, при переходе между которыми данная линия испускается. У щелочных металлов в процессе испускания участвует только один самый
Таблица 2 .—3 начения резонансных и ионизационных потенциалов для щелочных металлов.
| Название элемента | Резонансная линия А в А | Резонансный потенциал в V | 1
Ионизационный потен- 1 циал в V i |
| Li | 6707 | 1 I ! i | |
| Na | 5893—5896 | 2,09 | 5,11 |
| К | 7615—7699 | 1,6 | 4,32 |
| Rb | 7947—7800 | 1,6 | ! 4,15 |
| Cs | 1 8521—8943 | 1,45 | ! 3,87 |
Процессу поглощения света соответствуют переходы атома из нормального в более высокие энергетич. состояния. Этим объясняется тот факт, что в поглощении обнаруживаются лишь линии главной серии. За пределом главной серии лежит область сплошного поглощения. При этом поглощении электрон выбрасывается с нормального уровня за пределы атома—происходит процесс фотоионизации. Современная теория атомных С., базирующаяся на представлений Бора об энергетич. уровнях, позволяет разобраться во всех С., включая самые сложные, и связать их строение с периодич. системой элементов. Элементы, стоящие в одинаковых столбцах, имеют сходные С., причем элементы с нечетной валентностью обладают четным порядком мультиплетности (дублеты, квартеты и т. д.), и наоборот. Сложность С. возрастает по мере передвижения по каждой строке табл. Менделеева слева направо. Примером сложного С. может служить Fe, у которого имеется набор триплетных, квпнтетных и сеп-тетных серий. Новая квантовая механика позволяет подойти к проблеме С. не только с качественной, но и с количественной стороны,
давая методы расчета энергия стационарных состояний и интенсивности испускаемых линий.
Молнкулы испускают, как указано, полосатые С." Каждая полоса состоит из большого числа отдельных линий. Эти линии располагаются более густо у одной из сторон полосы, образуя характерный «край». Отдельные полосы собираются в закономерные группы. Группы могут повторяться в различных частях С.,
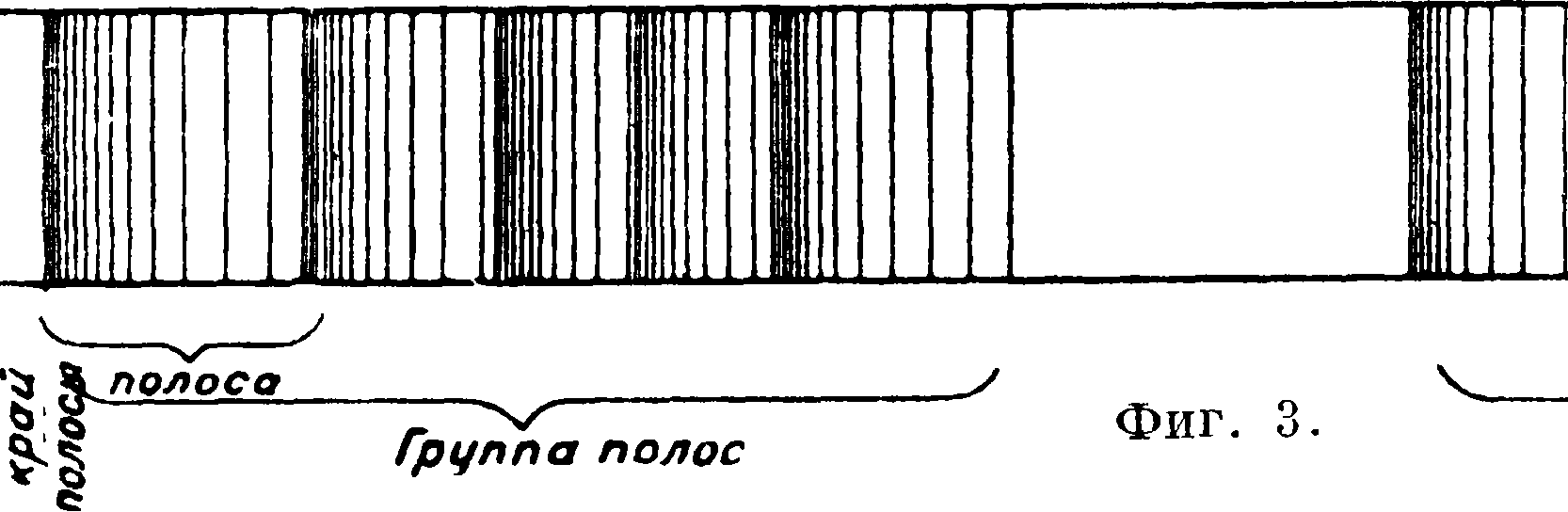
образуя систему групп (фигура 3). Такое наличие тройных закономерностей в молекулярных С. отвечает трем возможным типам движений в молекулах: 1) вращению молекул как целое,
2) колебанию ядер относительно центра тяжести и 3) движению электронов. По современной теории строения молекул этим трем типам движений соответствуют определенные стационарные состояния. Каждое стационарное состояние характеризуется вполне определенным значением энергии, которое м. б. изображено, как и в случае атома, энергетич. уровнем

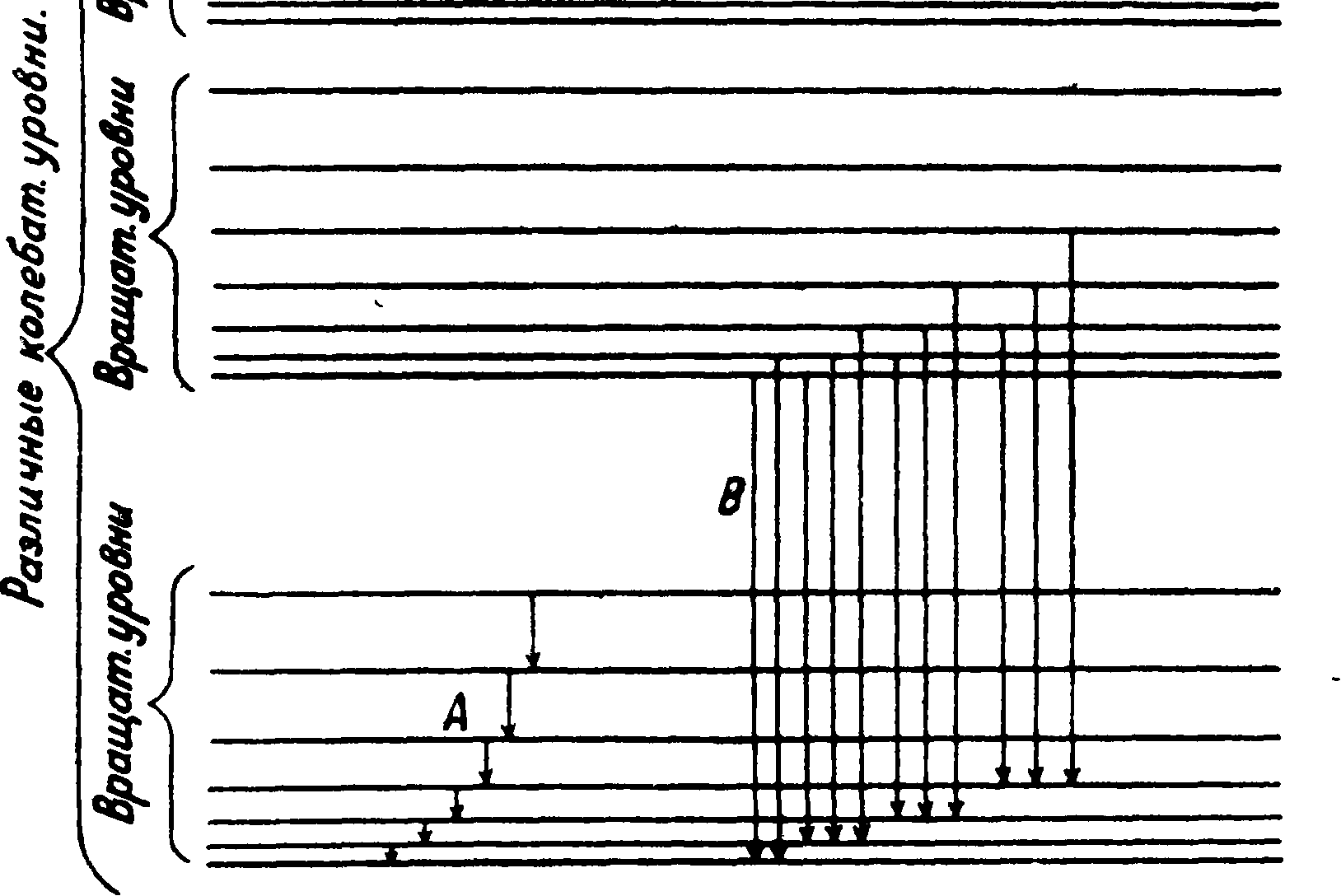
Фигура 4.
(фигура 4). Излучение света происходит при переходе молекулы с одного из уровней на другой, причем испускается отдельная линия с частотой, определяемой приведенным выше правилом частот Бора. При этом следует иметь в виду, что энергия молекул W складывается из трех энергий—энергии движения электронов Wei энергии колебания ядер Ws и энергии вращения молекулы Wr. Наиболее полно в настоящее время изучены С. двухатомных молекул. Их изучение показывает, что из трех энергий молекулы We, Ws и Wr наименьшей является энергия вращения Wr, а наибольшей—энергия движения электронов We. Энергетически наиболее бедным является состоя ние молекулы, соответствующее нормальному расположению электронов и отсутствию всякого вращения и колебания. В этом состоянии молекула обычно и находится (нижний уровень, фигура 4). При сообщении молекуле извне небольших количеств энергии (например при столкновении с другими молекулами при невысоких t°) возбуждаются лишь вращательные состояния молекулы. При переходах между этими вращательными состояниями (Л на фигуре 4) испускается т. н. чисто ротационный спектр, состоящий из отдельных линий, лежащих в далекой инфракрасной части. Теория показывает, что из расположения этих линий можно непо-
/руппа полос средственно вычислить момент инерции молекулы. При сообщении молекуле извне больших количеств энергии возбуждаются и колебательные состояния. На каждое данное колебательное состояние накладываются вращательные. При переходах между различными колебательными состояниями (например переходы В на фигуре 4) испускается С., состоящий из отдельных полощ т. н. вибрационно-ротационный спектр. Наконец может быть изменена и электронная конфигурация молекулы—молекула приведена в возбужденное состояние. В возбужденном состоянии молекула также может совершать колебания и вращаться. Переходам между возбужденным и невозбужденным состояниями соответствует испускание новой группы полос. При увеличении энергии колебаний полосы располагаются все теснее и теснее друг к другу, стремясь к нек-рому пределу. Положе ние этого предела отвечает тому значению энергии колебаний, которая достаточна, чтобы вызвать диссоциацию молекулы, то есть ее распад. Т. о. энергия диссоциации м. б. вычислена из расположения полос. Если молекула колеблется в возбужденном состоянии, то, диссоциируя, она распадается на один нормальный, а другой возбужденный атом. Молекула может распасться и при увеличении энергии вращения, причем и этот процесс сказывается характерным образом на С. молекулы — обычно в виде размытости нек-рых полос (явление предиссоциации).
Лит.: Хвольсон О., Курс физики, т. 2, Берлин, 1923: его же, Физика наших дней, изд. 4, M.—Л., 1932* Фриш С., Современные теории спектров, М.—Л., 1931* Kayser Н., Handb. d. Spektroskopie, В. 1—6, Lpz ’ 1900 — 12; loos G. u. Angerer ] gung d. Spektren, Handb. d. Experimentalphys Lpz., 1929; loos G., Ergebnisse u. Anwenuun&tn Spektroskopie, ibid., hrsg. v. W. Wien u. F. Harms, B. 22 Leipzig, 1929; Handbuch d. Physik, hrsg. v. H. Geiger u. K. Scheel, B. 21, B., 1929; В aly E., Spectroscopy, 3 ed v> i—o, L., 1924—27; Lecoq de Boisbaud-ran et Gram on t A., Analyse spectrale appliqu6e aux recherches de chimie minerale, P., 1923; Paschen F. u Gotze R., Seriengesetze d. Linienspektren, B., 1922; Hicks W., Treatise on the Analysis of Spectra, Cambridge, 1922; Hund F., Linienspektren u. periodisches System d. Elemente, 1927. С. Фриш.
Anre-B. 22