 > Техника, страница 82 > Стереохимия
> Техника, страница 82 > Стереохимия
Стереохимия
Стереохимия, отдел химии, задачей которого является изучение расположения атомов, составляющих молекулу, в пространстве и. динамику их взаимодействия и взаимовлияния. В соответствии с этой задачей С. в настоящее время представляет собой стройную систему знаний, охватывающую не только достижения химии, но и в очень большой мере использующую достижения физики и кристаллографии.
Потребность в стереохимия, представлениях появилась у химиков вместе с созданием атомистической теории. В самом начале 19 века вместе с созданием атомистической теории Дальтоном Волластон высказал ту мысль, что химия должна стремиться не только изучать качественный и количественный состав соединений, но также и пространственные формы, в которых атомы в соединениях сочетаются. Бесспорным доказательством того, что атомы, составляющие молекулу, расположены не в одной плоскости, а в пространстве, явились вещества, вращающие плоскость поляризации света, т. н. оптически деятельные вещества, в растворе, в жидком состоянии и в парах (смотрите Вращение плоскости поляризации и Спр. ТЭ, т. VIII, стр. 6, раздел V). Уже в 1831 г. Берцелиусупоминает оптическую деятельность левой винной кислоты в растворе. Давно известна также вращательная способность терпентинного масла в жидком состоянии и в парах. В 1848 г., то есть примерно за одиннадцать лет до создания теории строения углеродистых соединений Кекуле, Купером и Бутлеровым, Пастер открыл первый случай оптич. изомерии (смотрите) на примере винных к-т (смотрите также ниже). Несколько позднее он совершенно правильно объяснил пространственное строение правой и левой винных к-т и их одинаковую по величине, но противоположную по знаку вращательную способность тем, что их молекулы в смысле своего пространственного строения относятся друг к другу, как предмет к своему зеркальному изображению (смотрите Винные кислоты).Кроме открытия оптич. изомерии и ее правильного в общей форме объяснения Пастер дал методы получения оптически деятельных веществ из рацемических. Создание и развитие теории строения позволило конкретнее подойти к вопросу о пространственном расположении атомов, составляющих молекулу. Такое совершенно конкретное решение этого вопроса дали независимо друг от друга и почти одновременно в 1874 г. Вант-Гофф и Ле-Бель. Самый термин С. предложен В. Мейером.
Гипотеза Вант-Гоффа, быстро развившаяся в теорию тетраэдрич. строения углеродного атома или теорию асимметрического углерода (смотрите), легла в основу т. н. классич. С. Эта теория и до сего времени имеет большое актуальное значение в науке. Исследования структур углеродистых соединений рентгеноскопия, методом в наше время действительно подтверждают правильность основного положения классич. С. о том, что четыре валентности углеродного атома направлены к четырем вершинам тетраэдра, в центре которого находится углерод (смотрите Асимметрический углерод). Если четыре заместителя, связанных с центральным углеродом“ различны, получается т. н. асимметрия, углерод, и вся молекула становится асимметричной; при этом она делается способной вращать плоскость поляризации света. При наличии в молекуле одного асимметрического углерода получаются два оптически деятельных изомера—правый и левый,—обозначаемых буквой d и I. Правый и левый изомеры характеризуются полной одинаковостью своих физических и химических свойств. Они отличаются только вращением плоскости поляризации, энантио-морфизмом многогранников в случае кристаллизации, отношением к асимметрическим веществам и энзимам и своими физиологическими
*4
свойствами. При наличии нескольких асимметрических углеродов в молекуле число изомеров в самом общем случае вычисляется по формуле 2П, где п—число асимметрии, атомов углерода. Так, при наличии 4 асимметрических углеродов получается 16 изомеров. Пример—гексозы:
СН2ОН. СНОН · СНОН · СНОН · СНОН · СНО (звездочкой отмечены асимметрии, атомы). Для частного случая одинаковости асимметрии.углеродов число изомеров вычисляется по формулам: а) 2м-1—нечетное число асимметрии.углеродов; пример—триоксиглутаровые к-ты: СООН *
- СНОН · СНОН. СНОН. СООН—4 изомера и п _ J п б) 22 (22 + 1)—четное число асимметрии, уг леродов; пример—винныек-ты: СООН · СНОН·
СНОН. СООН—3 изомера. Изучение оптически деятельных веществ, методов их синтеза, их свойств и химии, превращений в связи с пространственным строением и составляет одно из основных направлений С. Оптич. активностью обладают весьма многие вещества растительного и животного происхождения—сахара, белки, терпены, ы и мн. др. вещества более простого состава (молочная к-та, аспарагин, винные к-ты, амиловый голь и др.). Т. о. вопросы пространственного строения молекул глубоко проникают в область биологии, химии и биологии. Примером блестящего применения теории асимметрии, углерода наг практике являются определение пространственного строения молекул сахаров и их синтез, сделанные гл. обр. Э. Фишером еще в 90-х гг. 19 века.
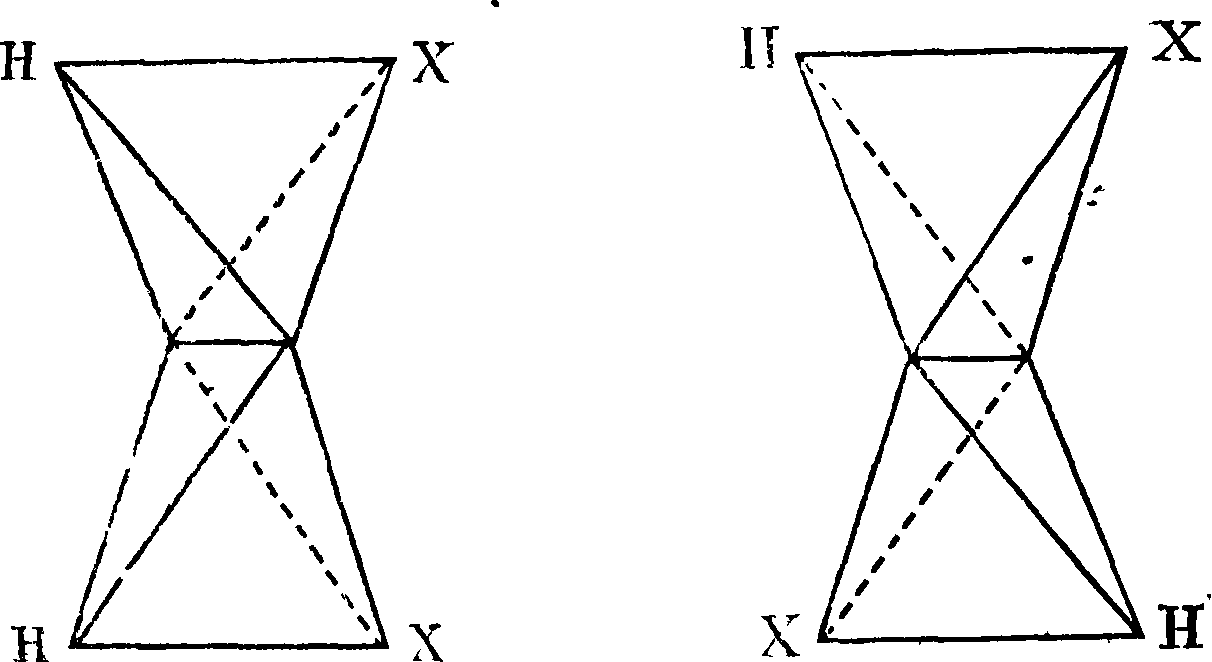
Из основного положения классич. С., что углеродный атом м. б. изображен тетраэдром в общем случае неправильным и в частном случае—при одинаковости четырех заместителей— правильным и что валентности его лежат попарно в двух взаимно перпендикулярных плоскостях, вытекает другое, также основное направление развития С.—именно учение о геометрии. изомерии, иначе называемой цис-транс-и з-о мер и ей. Фигура 1 и 2 показывают, что
Фигура 1. Фигура 2.
при соединении двух атомов углерода двойной связью возможны два изомера (фигура 1—цис-изомер, фигура 2—транс-изомер). В проекции будем иметь такое построение:
н—с—х н—с—х
I! II
н-с-х х-с-н цис-изомер транс-из©мер
В то время как физич. и химии, сцойства оптич. антиподов одинаковы, кроме перечисленных выше, геометрии, изомеры отличаются, правда, в большинстве случаев не очень резко, всеми своими физич., химии., а во многих известных случаях и физиологии, свойствами, что вполне понятно, учитывая различие внутримолекулярных расстояний у геометрии, изомеров между отдельными группами атомов или атомами, составляющими молекулу. Классич. пример—малеиновая (цис-соединение) и фумаровая (транссоединение) кислоты общей ф-лы СООН · СН : СН ·
• СООН. Теория геометрической изомерии этиленовых соединений построена Вислиценусом (1887 г.). В 1888 г. эта теория распространена Адольфом Байером на область полиметиленовых соединений. Классический пример—гекса-гидротерефталевые к-ты. Из их строения видно, что атомы углерода располагаются в одной плоскости (атомы углерода кольца опущены)
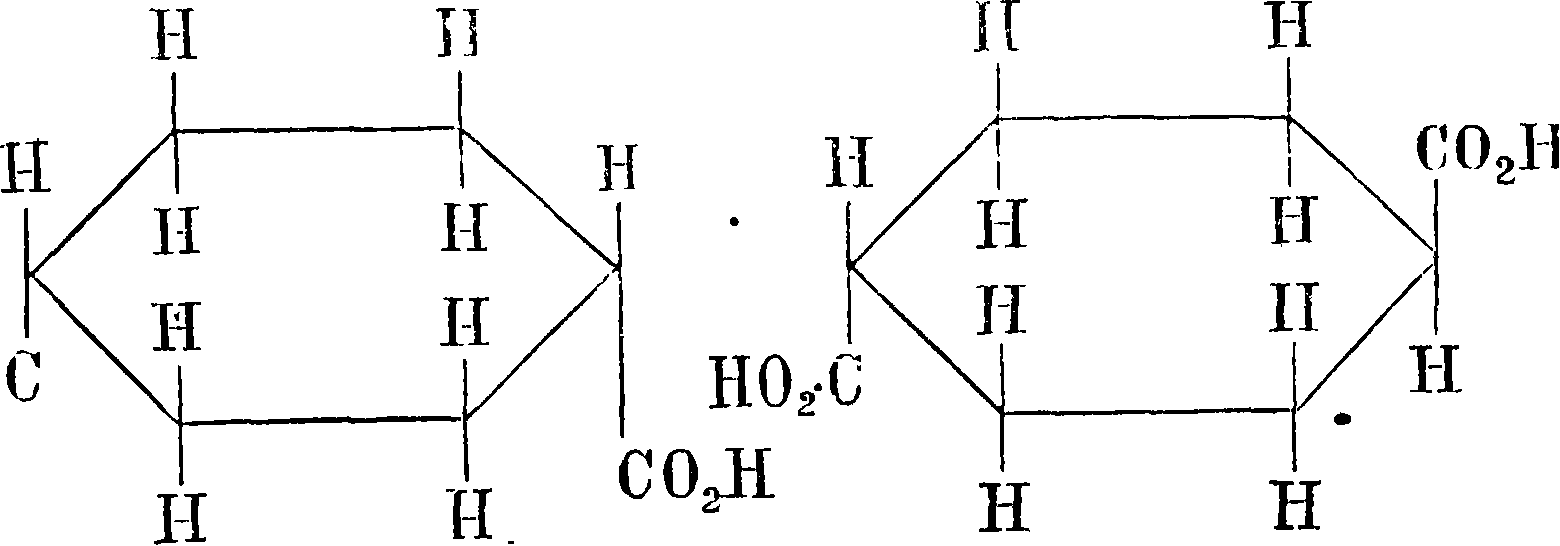
цис-изомер транс-изомер также видно, что все другие группы и атомы располагаются над или под плоскостью, в которой расположены центры углеродов, составляющих кольцо. Случаи геометрии, изомерии такого типа также очень распространены у углеродистых соединений как более простого строения, вроде только что рассмотренных, так и у более сложных соединений: терпенов и ов. Обычно в молекулах более сложного строения мы наблюдаем сочетание оптич. и геометрии, изомерии вместе. Аскан подробно изучил такое сочетание на примере камфорных кислот:
* /СООН НаС—СН
I * /С(СНз)2Н2С—С АС00Н АСН3
Здесь возможны (и известны) два геометрии.изомера, из которых каждый дает пару антиподов, то есть всего существуют четыре оптич. изомера. Выработаны методы определения строения геометрических изомеров. С. развила далее теорию строения молекул с несколькими двойными связями, вовсе без двойных связей, но с т. н. благоприятными положениями, с тройными связями, теорию разрыва двойной связи и перехода от геометрии, изомерии к оптич., теорию напряжения кольчатых систем в зависимости от величины отклонения валентности от их нормального положения в правильном тетраэдре с углом в 109°28, непосредственно примыкающую к ней теорию бициклич. систем.^ В се это вместе с основными положениями об оптич. и геометрии, изомерии и составляет предмет т. н. классической С. Сюда же близко примыкают и все те явления, которые составляют предмет т. н. С. без стереоизомерии, то есть все те явления, которые м. б. объяснены проявлением фактора пространственного влияния на протекание химии, процесса, но которые не связаны с явлением изомерии. Приведенными выше классическими примерами область пространственной изомерии по современным данным далеко не исчерпывается. Прежде всего ныне приобрело огромное значение выдвинутое еще Пастером в общей форме положение о том, что оптическая деятельность соединения зависит от асимметрического строения всей молекулы. Это же положение было намечено уже и Вант-Гоф-фом в его так называемом втором случае асимметрии, то есть асимметрии таких молекул, кото-
рые не имеют ни одного асимметрического углерода:
Зеркало а
Ь
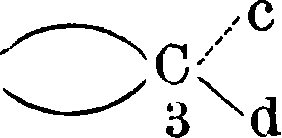
с.
d
/G ;С·
з v—^ 24
С
1
а
b
Такой тип молекулы—производного аллена— может иметь два оптич. изомера. Тонкими линиями на схеме обозначены те линии, которые лежат в плоскости бумаги, жирными—те, которые выдаются вперед, а пунктиром—те, которые уходят назад. Кольца располагаются взаимно перпендикулярно. Ныне мы можем привести ряд типичных примеров асимметрии и оптич. изомерии, полученной экспериментально, без асимметрии. углеродного атома: инозиты
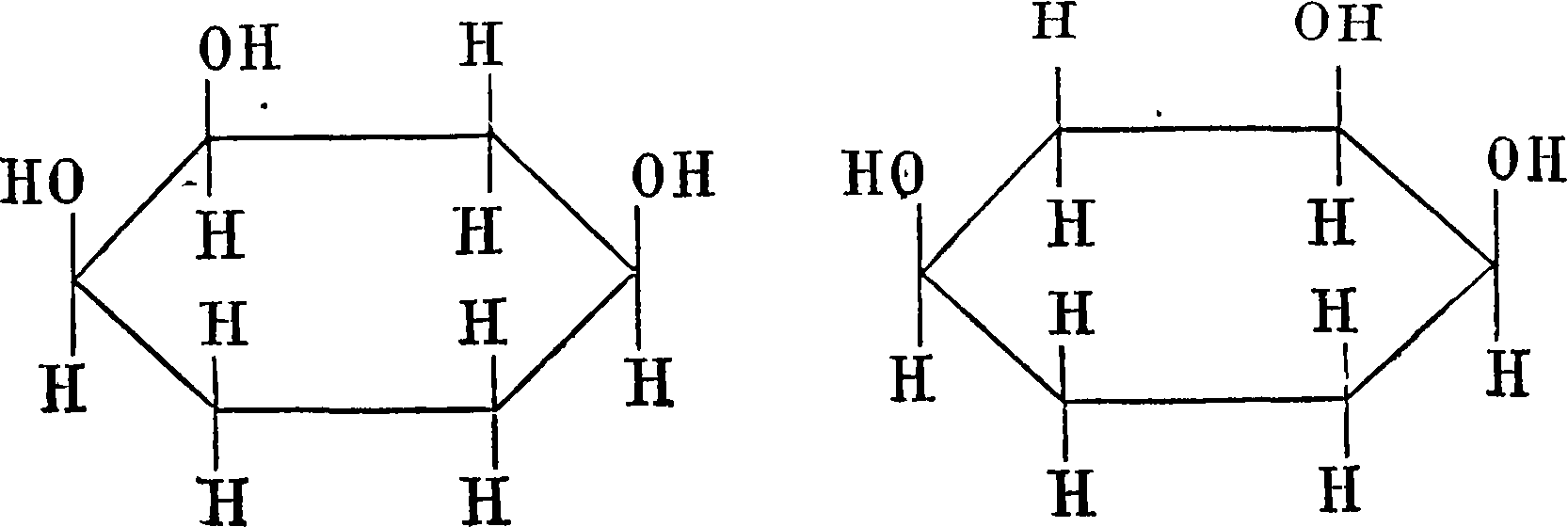
1-метилциклогексилиден-4-уксусная кислота
СНЗЧ уСКг-СКг^
b? ХСН2—СН. ХСООН
и ее производные, изученные Перкиным и Попом и др. начиная с 1907 г., спироцикланы общего типа:
/т с/а
--/Чь соединения типа динитродифеновых к-т:
N02 N02
ό—р
COOH COO]
(на схеме левое кольцо находится в плоскости бумаги, правое—перпендикулярно к ней и рассекается плоскостью бумаги пополам). Последний пример 6,6-динитродифеновой кислоты далее всех отошел от основных положений классич. С. Здесь оптич. изомерия возможна только вследствие взаимовлияния групп N02 и СООН, обусловливающих фиксированное положение в пространстве колец дифенила и препятствующих свободному вращению колец дифенила вокруг оси (простая связь между кольцами дифенила). Область подобных соединений и более сложного состава и строения изучена ныне очень тщательно и не только со стериче-ской, но и с динамич. точки зрения в связи с явлениями рацемизации. Оптич. изомерия без асимметрия, углеродного атома ныне представляет собою уже целую большую область С., которая несомненно найдет себе большие применения при изучении веществ, имеющих биологическое значение,—белков, ов, терпенов наиболее сложного строения, глюкозидов ит. д. Эта теория широко применяется и в области комплексных соединений (смотрите ниже). Стереохимия, представления широко охватили и соединения других элементов. В области органических соединений особенно развита С. азота. Давно доказана геометрическая изомерия у оксимов (альдоксимов и кетоксимов), диоксимов, гидразонов и диазосоединений. Тип изомерии (принимая во внимание азот, связанный двойной связью) в этих случаях близок к геометрия, изомерии этиленовых соединений: х—С—у х—С—у
N—z z—N
Оксиминокислоты при этом дают пример асимметрии молекулы без асимметрия, атома по типу, близкому к изомерам метилциклогекси-лиденуксусной к-ты:
но2с н н со2н
| с | С |
| сн2 сн2 | сн2 сн2 |
| сн2 сн2 | 1 1 сн2 сн2 |
| с | с |
| V | |
| N | N |
он но
Пространственное расположение валентностей пятивалентного азота подтверждается оптической деятельностью соединений типа: JN(CH3)· •(С3Н5)(С6Н5)(С7Н7) — йодистый метилаллилфе-нилбензиламмоний. В последнее время принимается, что даже три валентности азота, связанные простыми связями, лежат не в одной плоскости, что долгое время оспаривалось. Ныне доказано пространственное расположение валентностей еще для следующих элементов: Si, Sn, Р, As гл. обр. по типу: ач /С
/z
ь/ м
Be, В, Си, Zn гл. обр. по спирановому типу:
а /ь !><1 Ьх ха
Со, Сг, Fe, Rh, Ir, Pt, AI, Ru, Ni, Cu, As, отчасти Pb и Те гл. обр. по типу координационно построенных комплексных соединений (смотрите ниже). Кроме того в более сложных соединениях, например гетерополикислотах, можно предполагать стереоизомерию вольфрамовых, молибденовых и др. соединений. Ύ. о. в настоящее время стереоизомерия доказана примерно для 25% известных нам элементов.
Блестящее развитие стереохимия, представления получили в области комплексных соединений на основе координационной теории А. Вернера. Опираясь на данные химия, и ана-литико-химич. реакций, на данные электропроводности, на отношение к поляризованному свету, а в последнее время на избирательное свето-поглощение и рентгеноскопию, современная С. представляет себе пространственное строение комплексных соединений: так например известны два изомера комплекса СоС13 · 4NH3—один зеленый, другой фиолетовый (кроцео- и виолео-соли). Оба содержат кобальт в составе комплексного иона. Из трех атомов хлора у обоих комплексов можно без нагревания при осторожном ведении реакции осадить азотнокислым серебром только один атом хлора. Следовательно только один атом хлора в этих комплексах существует в растворе как свободный ион; два других атома, так же как и кобальт, входят в состав комплексного иона. Четыре молекулы аммиака также входят в состав комплексного иона. По данным электропроводности каждый из этих изомеров состоит из двух ионов. Отсюда оба изомера должны иметь строение [Со · 4NH3 · С12]С1, где все, что заключено в прямые скобки, составляет один положительно заряженный ион, а атом хлора, стоя-
щий за скобками, существует в виде отрицательного иона. Такое расположение и называется координацией атомов и атомных групп в комплексе, в его внутренней сфере (заключена в скобки). Координационное число—в данном случае 6—отвечает четырем молекулам аммиака и двум атомам хлора (суммα= 6), непосредственно связанным с центральным атомом. Изомерию зеленого и фиолетового соединений можно объяснить только различием пространственного строения положительного иона, в данном случае так называемым внутренней сферы комплекса. Для координационного числа 6, наиболее часто встречающегося у комплексов, Вернер предложил геометрии, фигуру в виде октаэдра, причем 4 атома аммиака и 2—хлора поместил на вершинах октаэдра, а кобальт—в его центре. При этом возможны только две формы расположения (фигура 3 и 4). Внутримолекулярные реак
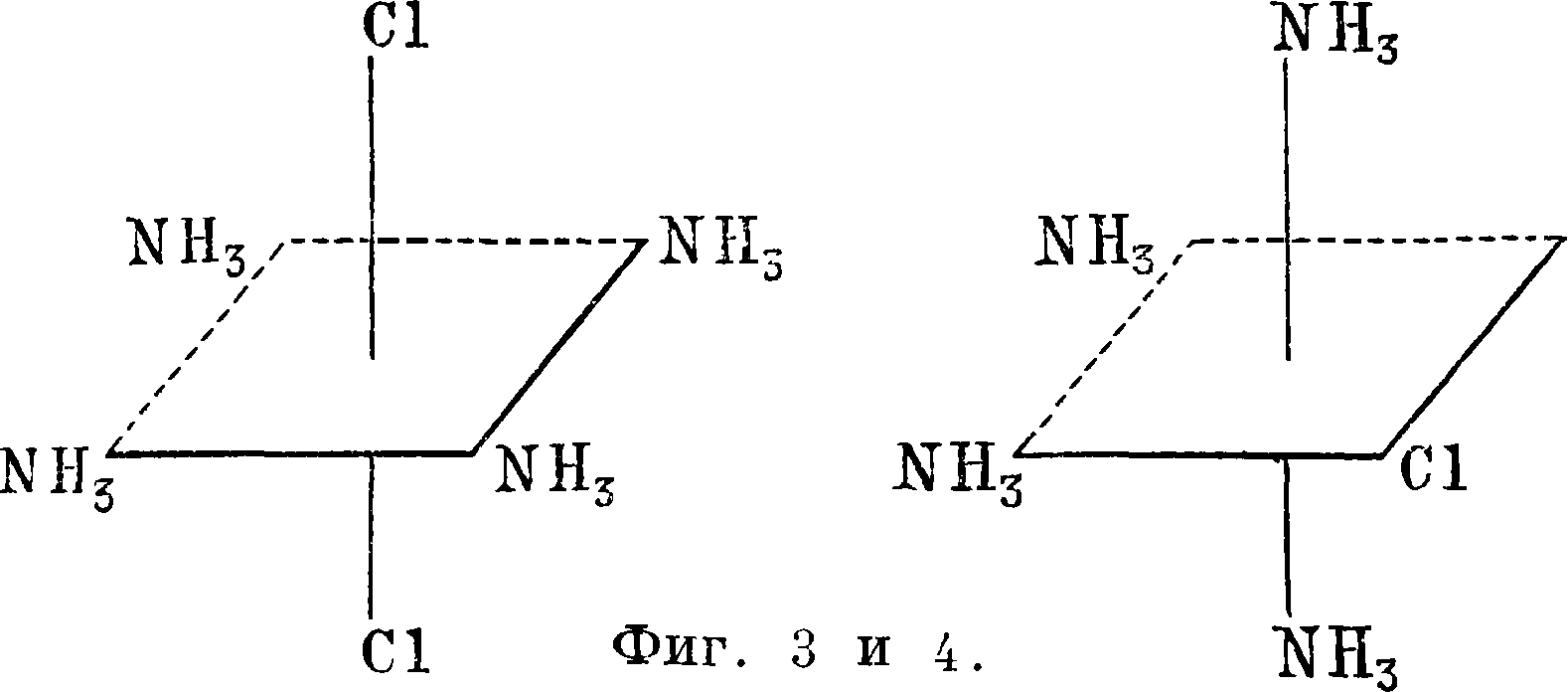
ции, отчасти аналогичные тем, к-рыми С. пользуется для доказательства цис-транс-изомерии у этиленовых и полиметиленовых соединений, заставляют принять для зеленого соединения фигура 6, для фиолетового—фигура 7 и назвать первое транс-изомером, т. к. в нем атомы хлора расположены по разные стороны плоскости, в которой расположены центр тяжести атома кобальта и молекул аммиака, а второе—цис-изо-мером. Ныне такое строение комплексов подтверждается и данными избирательного свето-поглощения и рентгеноскопическими данными. Подобных примеров стереоизомерии ныне у комплексов известно очень много. Все это составляет особую область С.—геометрия^ или цис-транс-изомерию комплексных соединений. Оптич. изомерия комплексных соединений, так же как и геометрия., составляет сейчас большую область С. Пример оптич. изомерии— «ен»-группа, занимающая два координационных места, например в молекуле этилендиамина NH2CH2-CH2NH2 (фигура 5: а—обычно Cl, Br, N02
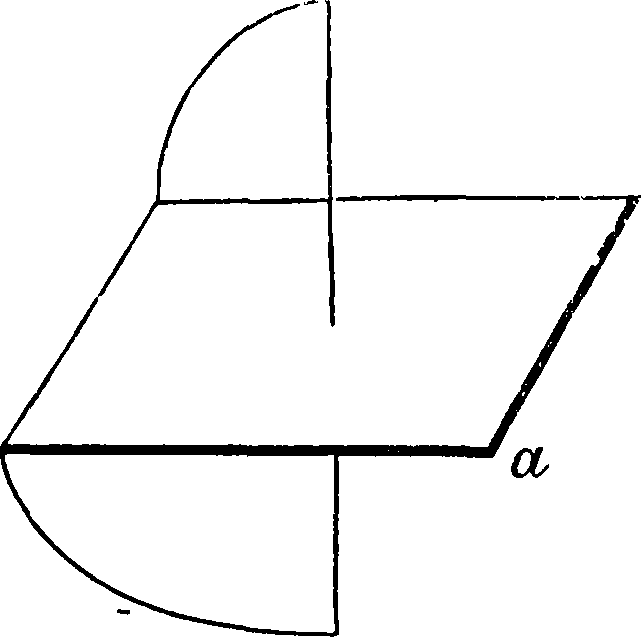
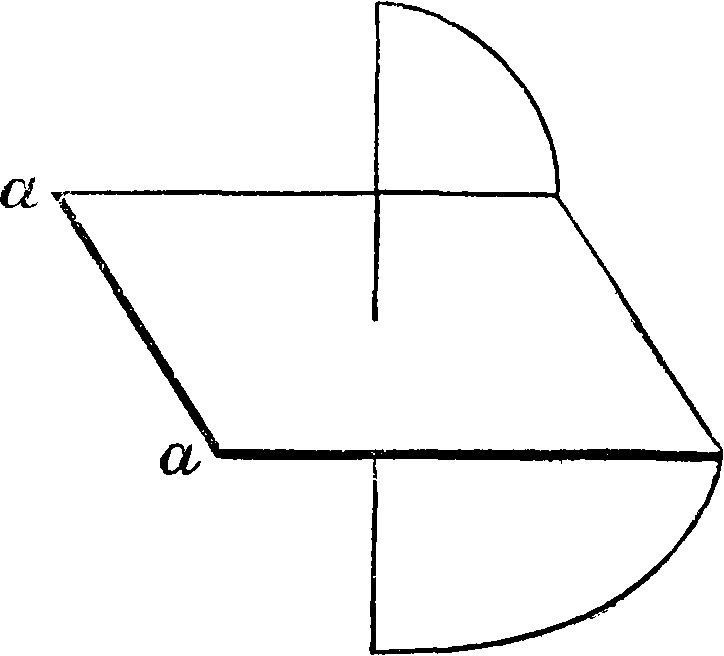
и др.). Здесь налицо оптич. изомерия без асимметрия. атома. Подобного рода типы изомерии, а также и нек-рые другие типы установлены ныне для комплексных соединений целого ряда элементов.
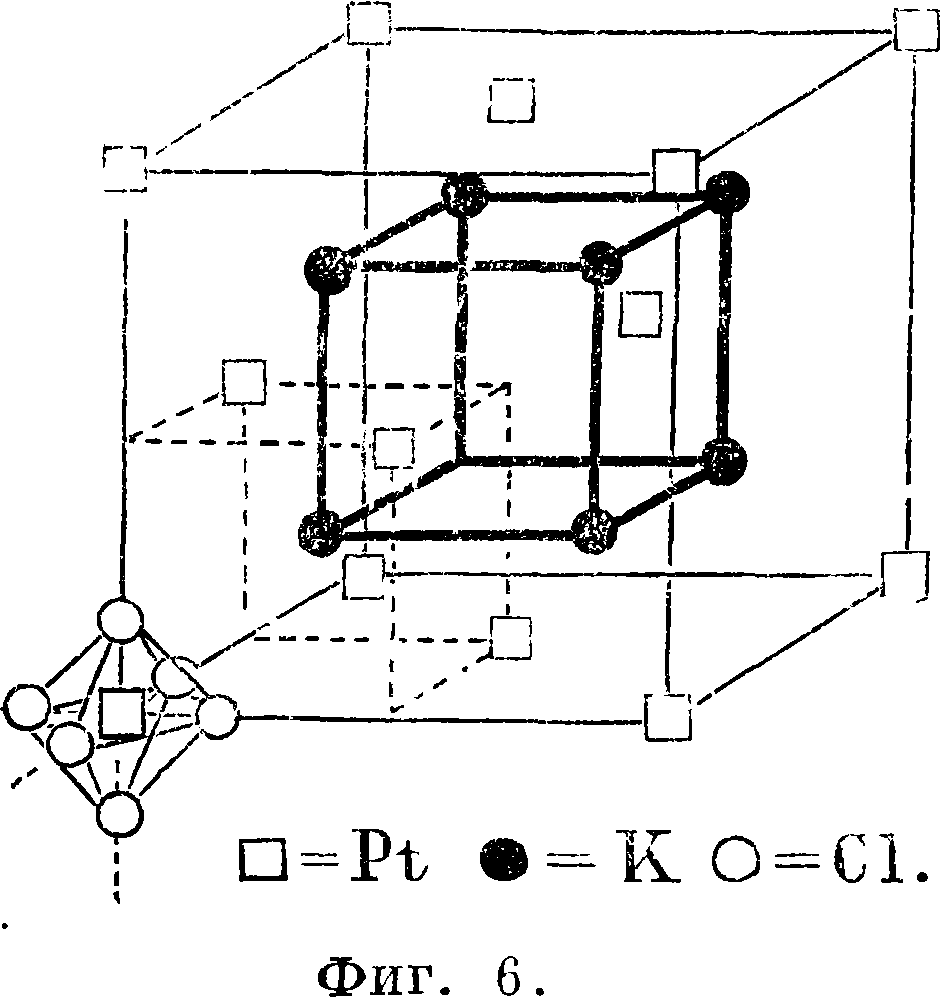
С. в последнее время получила весьма серьезные подтверждения правильности ее положений в рентгеноскопия, исследовании углеродистых и минеральных соединений: рентгеновская структура алмаза дает для атома углерода правильный тетраэдр; рентгеновская структу ра графита показывает, что атомы углерода образуют шестичленные кольца. Рентгеноскопия действительно доказала цепеобразное строение жирных к-т. Стереохимическое координационное строение комплексных соединений прекрасно доказано рентгеноскопически. Фигура 6 изображает рентгеновскую структуру комплексного соединения K2PtCl6.
В левом нижнем углу изображен комплексный ион [PtCl6], к-рый, как показывает рентгенограмма, имеет определенно октаэдрическое строение. Очень ценным в применении рентгеноскопии к изучению пространственного расположения атомов является то, что она позволила С. изучать кристаллич. состояние и вместе с тем дала методы определения расстояний между атомами. Рентгеноскопия позволила даже заглянуть в строение таких сложных структур, как клетчатка и каучук. Есть однако моменты, в которых рентгеноскопия, анализ не может дать на данном этапе определенного ответа о пространственном расположении атомов. Пример—строение пентаэритрита НОН2Сч /СН2ОН нон2с/9 ЧСН2ОН
и его производных. Частично подобные трудности при применении рентгеноскопии к изучению пространственного строения молекул происходят от того,что даже относительно простые молекулы часто не входят в кристалл с наивысшей симметрией, к-рую допускают их структурные ф-лы. Потребуется еще глубокая работа С., физики и кристаллографии, чтобы справиться с рядом трудных проблем на границе этих наук, где самое понятие химия, молекулы подвергается глубочайшей ревизии и пересматривается в различных направлениях вместе с пересмотром понятия химия, сродства.
> В процессе своего развития С. естественно выдвинула целый ряд динамических проблем первостепенной важности. Эти проблемы насквозь проникают все учение о пространственном расположении атомов. Молекула как динамическое целое не может быть рассматриваема вне движения, как неподвижная модель. Динамика в процессе образования стереоизомеров и во всем взаимовлиянии атомов друг на друга ярко выступает во всем развитии С., начиная с Ле-Беля с его динамич. представлениями об асимметрии и Пастера, к-рый открыл явление рацемизации и методы расщепления рацематов на оптически деятельные компоненты. Главнейшие из динамических проблем С.—это рацемизация и ауторацемизация, перегруппировки геометрия, изомеров (этиленовых, полиметиленовых и комплексных соединений), оптич. инверсия (т. н. Вальдена обращение, см.), изомеризация циклов, стерич. препятствия, асимметрия, синтез и др. Рацемизация состоит в том, что правый или левый изомер обыкновенно под влиянием нагревания, действия щелочей, к-т и других химия, и физич. агентов переходит в свой антипод; при этом оптич. деятельность становится равной нулю. При из-
вестных условиях можно бывает выделить ра-цемич. соединение, которое представляет собой непрочное молекулярное соединение правого и левого изомеров, в кристаллич. виде отличающееся во многих случаях иным содержанием кристаллизационной воды по сравнению с оптич. антиподами и обладающее иными физич. константами—уд. в и др. С точки зрения пространственной, для того чтобы оптич. изомер перешел в свой антипод, достаточно, чтобы два заместителя у асимметрия, углерода поменялись своими местами. Изучена и кинетика явлений рацемизации. При геометрич. перегруппировках также" происходит обмен местами заместителей, причем цис-изомер переходит в транс-изомер. Этот процесс также происходит обычно или под влиянием нагревания, или действия света, или действия различных химич. агентов. Так же, как и рацемизация, он идет часто в самом процессе синтеза. Геометрич. перегруппировки достигают различных пределов. Рацемизация может идти в ряде случаев, как например у хлор- и бромпропионовых эфиров, у бромянтарных эфиров, у многих комплексных соединений и прочие, сама собой—просто при стоянии. Тогда она называется ауторацемизацией. Сами собой могут происходить и геометрич. перегруппировки. Несмотря на большое количество (свыше 25) теорий, предложенных для объяснения вальденовского обращения, мы до сего дня не имеем надежного критерия для того, чтобы судить, в какой из реакций, в первой или второй, произошло изменение конфигурации в пространственно противо-полояшую. Вальденовское обращение изучено на многочисленных объектах и с различными агентами. Проблема пространственных перегруппировок в различных их видах является актуальнейшей проблемой современной С. Она является как бы частью обширнейшей проблемы химии—динамики внутримолекулярных реакций,— процессов изомеризации и процессов замещения. Молекула несомненно представляет собой динамич. целое, способное к различного рода внутримолекулярные перегруппировкам, определить направление которых и является интереснейшей задачей химии и с теоретич. и с практич. точки зрения для правильного направления синтеза нужных нам веществ. В С. мы всегда должны учитывать возможность перегруппировки и принять ее во внимание при определении строения. С динамич. точки зрения заслуживает особого вниманий и проблема асимметрии, синтеза. В природных условиях синтез протекает в большинстве случаев так, что в организме растения например непосредственно образуются правые или левые конфигурации веществ. Так образуются оптически деятельные белковые вещества, сахара и др. В условиях лаборатории обычно при синтезе правая и левая формы соединения образуются в равных количествах (смотрите Асимметрический углерод), и оптически деятельные формы мы получаем обычно путем расщепления рацемического соединения на оптич. деятельные компоненты. Однако за последнее время мы имеем целый ряд работ, до известной степени разрешающих эту интереснейшую проблему. Очень ценны в этом отношении последние, сделанные уже в тридцатых годах работы Куна и Брауна, а также Мит-челя, основанные на применении при синтезе кругового поляризованного света с длинами волн, отвечающими избирательной абсорбции синтезируемых продуктов.
С. выдвинула еще целый ряд проблем, также динамич. характера, как зависимость величины вращения от состава и строения молекул, от их насыщенности и ненасыщенности, от циклич. замыкания, от растворителя, от избирательного светопоглощения и прочие При этом поставлен вопрос о минимуме асимметрии, необходимом для создания в молекуле вращательной способности. Ныне эти проблемы на основе новейших представлений о природе химического сродства и образовании молекул приобретают особо интересное направление.
Подходя к изучению пространственного расположения атомов и динамики их взаимодействия самыми разнообразными методами, современная С. решает т. о. важнейшую теоретическую проблему естествознания. Вместе с тем она дает в руки химику методы синтеза, имеющие первостепенное практич. значение. Синтез сахаров и других углеводов, терпенов, ов для своего решения требует непременно стереохимии, подхода. Будущее синтеза—синтез белковых веществ—неразрывно связано со С. и ее методами исследования. Терапевтии. действие на наш организм ов, терпенов и камфоры, имеющее огромное значение в медицине, для полного понимания этих процессов несомненно потребует учета данных С. В медицине на С. основаны известные работы Эрлиха по вопросу о борьбе организма с ядами. С. сыграла большую роль в изучении процессов брожения и различных процессов, связанных с действием энзим. Являясь по существу глубоко теоретическим отделом химии, уже и теперь С. дала ряд ценных практических достижений. В дальнейшем развитии науки и техники ее практич. значение должно все более и более возрастать вместе с более глубоким внедрением теории в практику, вместе с более глубоким их взаимопроникновением.
Лит.: Ван т-Г о ф ф, Расположение атомов в пространстве, М., 1911,-Чугаев Л., О химическом строении комплексных соединений, СПБ, 1909; У с п е н с-. кий А., Теория асимметрии молекулы, «ЖРФХО», часть химич., т. 45, отд. 2, стр. 1, СПБ, 1913; Вальден П., Прошлое и настоящее стереохимии, Л., 1926; У с-п е н с к и и А., Вальденовское обращение, Л., 1926; "Труды Ин-та химич. реактивов»,вып. 13—Комплексные соединения^.—Л., 1933; Рихтер Ф., Последние успехи в области стереохимии, «Успехи химии», М., 1933; W е Γη е г A., Lehrbuch der Stereochemie, Jena, 1904; Pfeiffer P. in A. Werners Neuere Ansciiauungen auf dem Gebiete der anorganischen Chemie, Brschw., 1923; Wit tig G., Stereochemie, 1929 (готовится - русский перевод). А. Успзнский.