 > Техника, страница 83 > Сульфат
> Техника, страница 83 > Сульфат
Сульфат
Сульфат, технич. название безводного сульфата натрия Na2S04 (смотрите Натрия соединения). В природе С. встречается в виде минерала т е-нардита (о водной его форме—мирабилите Na2S04 · ЮН20—см. Глауберова соль) и в виде различных двойных солей. Естественные залежи С. пока разрабатываются мало, и его добывают почти исключительно разложением NaCl (серной к-той, бисульфатом или действием газов обжигательных колчеданных печей).
Производство С. 1. Способ Леблана. На грубоизмельченную каменную или грубозернистую выварочную соль действуют при нагревании гловерной серной к-той в 58—62° Be или камерной (не слабее 55° Be), если С. предназначается для приготовления хорошего стекла; обычно берут избыток серной кислоты (от 1 до й/зУо), т. к. часть ее улетучивается. Происходящая при этом реакция протекает в две фазы:.
I. NaCl -I- H2S04=NaHS04 + НС1.
II. NaCl + NaHS04=NaLS04 + HC1.
При низкой t° реакция протекает гл. обр. по ур-ию I,при· более высокой t° (красного каления) происходит полное разложение поваренной соли, а следовательно реакция протекает по ур-ию
II. Теоретически для получения С. на 100 ч. NaCl следует брать 83,81 ч. моногидрата серной кислоты или 107,44 ч. H2S04 60° Be, причем С. получается ок. 122 ч. В поваренной соли, идущей для приготовления С., определяют хлор, влажность, нерастворимый остаток и известь; примеси MgCl2 и СаС12 вызывают лишний расход серной к-ты; CaS04 вреден в том случае, если С. идет для приготовления серы, железо и глинозем вредны, если С. идет для приготовления стекла. Серную кислоту можно отчасти или полностью заменить бисульфатом натрия. Лучше всего Vio ч· (или еще меньше) NaHSO* предварительно смешать с поваренной солью и хорошо измельчить.
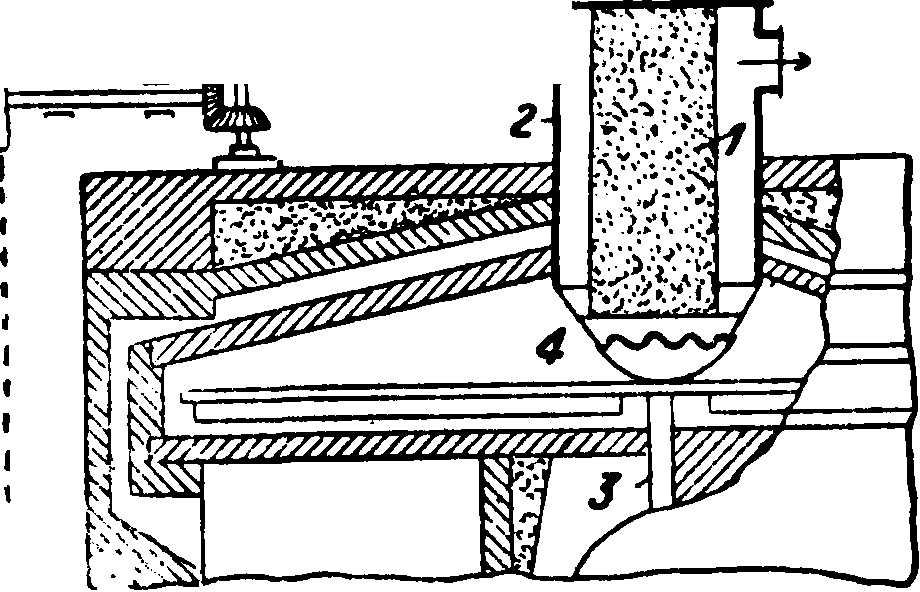
Для получения С. обычно пользуются сульфатными муфельными или специальными меха-нич. печами. Муфельная печь (фигура 1) состоит из двух частей, соединенных между собой каналом". Поваренную соль забрасывают через отверстие a, a серную к-ту. вливают сверху через особую вbронку в чугунную или толстостенную свинцовую чашу б. Кислотоупорный свод над чашей б снабжен для отвода газов трубой в из шамота. В чаше б происходит первая фаза реакции при более низкой ί°, причем здесь выделяется ок. 70% всей НС1, образующейся при получении С. Когда выделение НС1 в чаше слабеет, массу из чаши перегребают в муфель г иа шамотных кирпичей, равномерно распределяют железной кочергой по поду через рабочие-отверстия дг, д2 и нагревают постепенно до красного каления (ок. 700°) при помощи пламенных газов, идущих“из топки е и охватывающих муфель равномерно со всех сторон. Отходящие газы, раньше чем выйти в дымовую трубу, подогревают чашу б, а затем уже через жк з уходят наружу. Выделяющийся в муфеле НС1 отводится отдельно в конденсационную систему через трубу, сделанную из шамота или песчаника и отделенную от трубы в С. не сле-I дует доводите до плавления; каждые γ4 ч. его переворачивают гребками и разбивают образующиеся комья. С. считается готовым, когда он накален докрасна и не дымит при переворачивании. Готовый С. выгребают через отверстия dl9 д2 в находящиеся тут же железные ящики с крышкой. Одновременно в чашу забрасывают новую порцию поваренной соли. Охлажденный
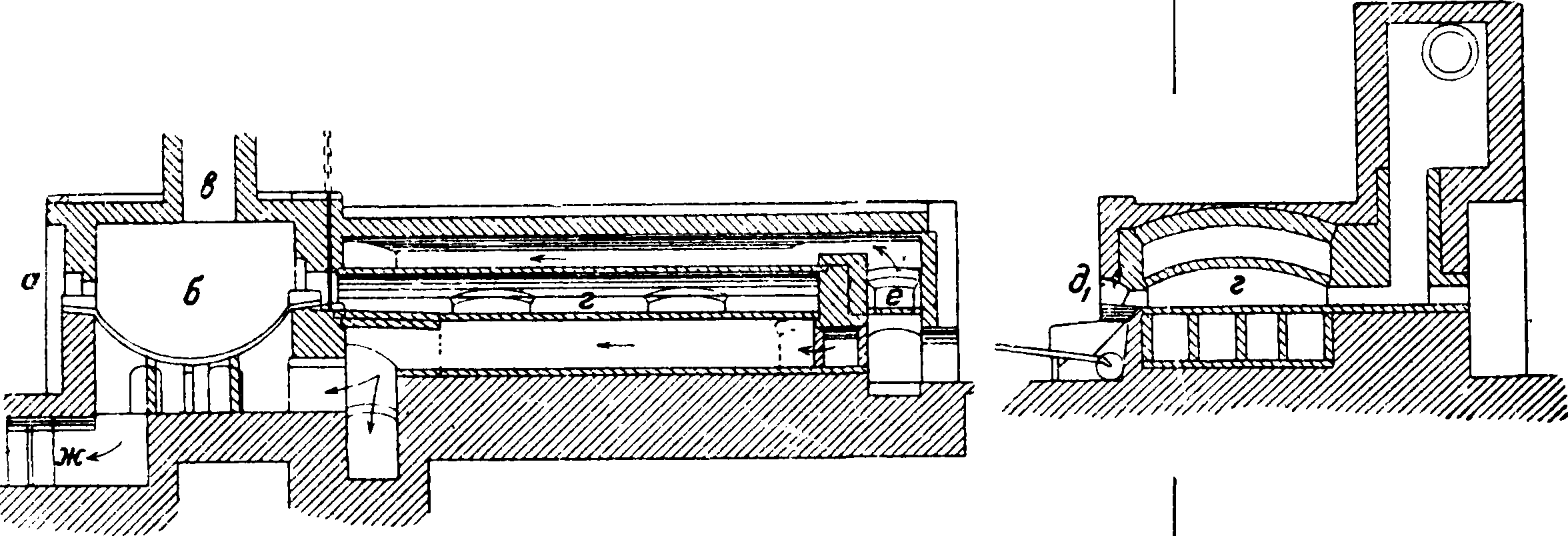
Фигура 1.
С. измельчают. Муфель делают до 10 метров длины, 3 метров ширины и 0,25 метров высоты; толщина его стенок 10 см. Чаши делают до 3 метров (и больше) в диам., 1/2 м глубиной и с 12—17-см толщиной стенок I1]. Муфельная печь в среднем перерабатывает в сутки до 12 загрузок по 500—600 килограмм каждая. Считается, что 1 м2 площади муфельной печи в 24 часа дает 300—400 килограмм С. при диам. чаши в 3 метров Расход каменного угля ок. 35% от веса полученного С. Недостаток муфельных печей—возможность проникания топочных газов в НС1, и наоборот. Для устранения этого в топочном пространстве муфеля держат избыточное давление, для чего топочное пространство располагают глубже муфеля. Повышенное дав
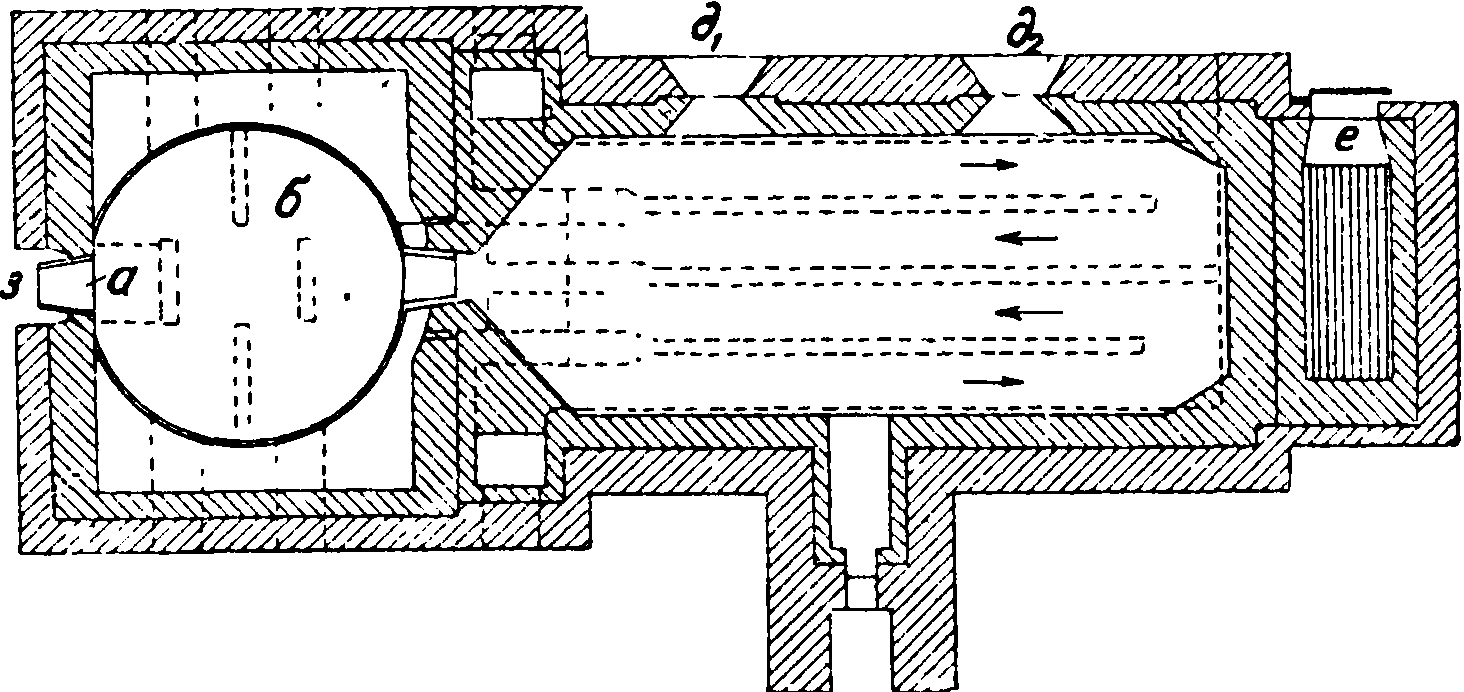
ление МОЖНО ч-гп-1 фиг· 2а. получить также введением воздуха, необходимого для сгорания, под нек-рым давлением; печи с повышенным давлением сокращают расход топлива. В последнее время муфельные печи строят с генераторной топкой, которые дают тот же эффект.
Применявшиеся раньше открытые пламенные печи в настоящее время почти совершенно оставлены (применяются еще в Англии), так как выделяющийся при реакции НС1 смешивается с пламенными газами и загрязняет кислоту, а, с другой стороны, сильно повышает температуру входящих в конденсационную установку газов.
При пламенных печах приходится применять слишком большую конденсационную установку, а в качестве топлива—нефть,кокс или очищенный генераторный газ. Производительность пламенных печей больше, чем в муфельных, приблизительно в I1/2 раза, и расход топлива меньше. Получаемый С. свободен от хлора.
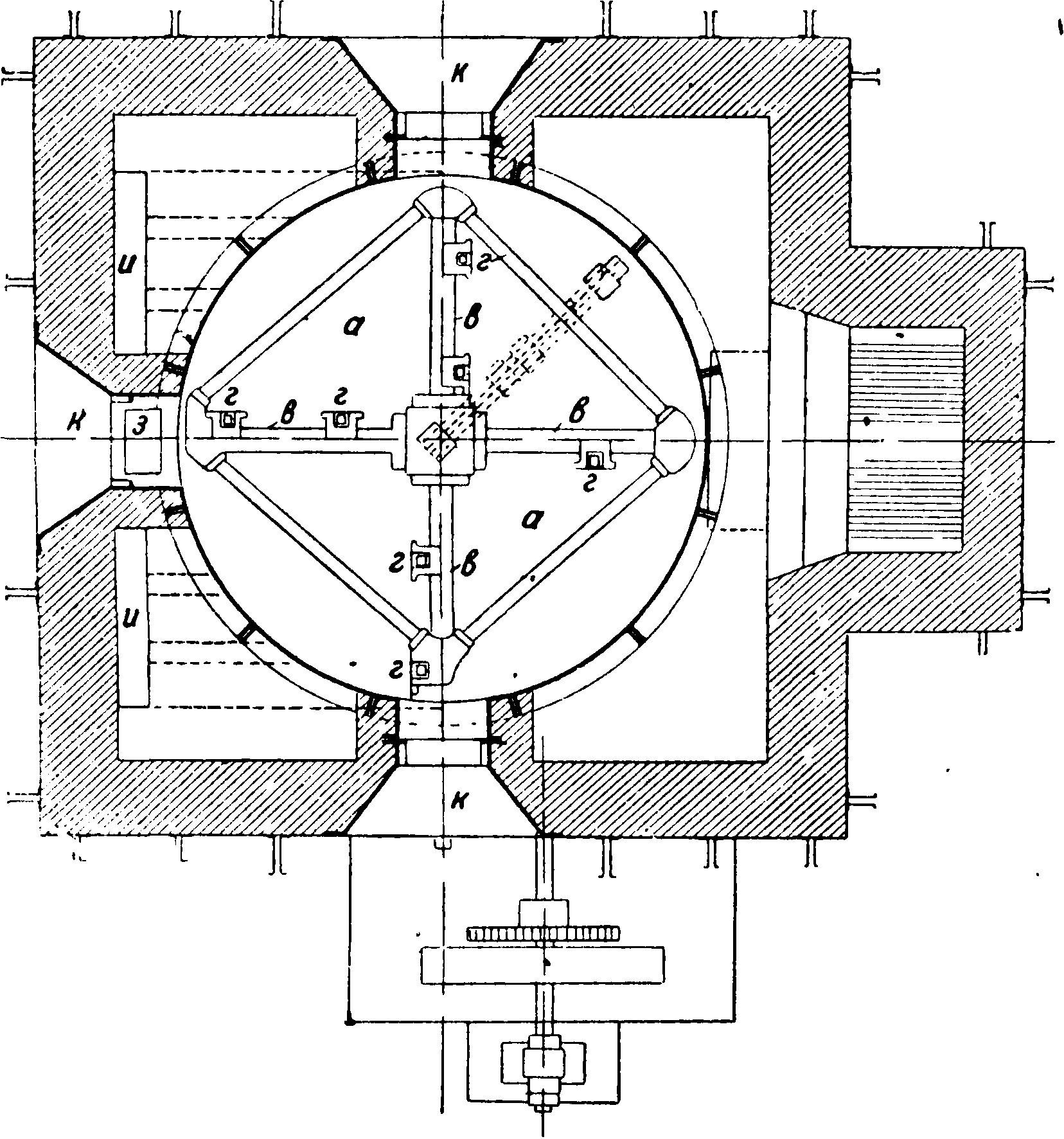
Механические сульфатные печи вошли в практику с 1896 г. На фигуре 2а и 26 показана механич. сульфатная печь Маннгеймского завода [2]. Печь эта состоит из чугунного муфеля а (диам. 5 м), внутри которого поставлена на вертикальной оси б мешалка в с кулаками г.Материал загружают через воронку ό, откуда он при посредстве шне- * ка подается в трубу вив муфель а. Выделяющийся при реакции НС1 отводится по трубе ж. Готовый С. при t° 450° выгружается по воронке з в поставленные тут же вагонетки. Весь муфель неподвижен, т. к. вделан в кирпичную кладку; топочные газы из топки и обогревают
~ муфель а до t°
ij ______ 700°. Чистка му-
П ^ g Г м и н * d
Фиг.
феля производится через отверстия к. Производительность печи (при диам. муфеля в 5 м) до 7—8 тонн С. в сутки. Расход топлива (каменного угля) 22+25% от веса получаемого1 С. Расход энергии 5 IP. Получаемый С. содержит около 1I2% NaCl и около 1% свободной к-ты. При работе на механич. сульфатных печах можно · пользоваться вместо серной кислоты исключительно бисульфатом (побочный продукт при производстве азотной к-ты). При этом реакция аналогична с имеющей место в обычных сульфатных печах на муфеле (вторая фаза).
Для переработки бисульфата его измельчают, хорошо перемешивают с поваренной солью, после чего загружают в муфель, нагретый до t°
700°. Содержание НС1в газах, образующихся при производстве С., очень изменчиво и колеблется в широких пределах. Так, в газах из муфеля содержится иногда только 2% НС1, в газах из чаши (в муфельных печах) ~ 22% НС1, в газах из механич. печи при переработке бисульфата—до 33—35%. В пламенных печах содержание НС1 бывает еще меньше.
На фиг“ 3 показана конструкция другой механич. сульфатной печи [з]. К-та поступает в печь через трубу 1, наполненную теплопроводным материалом, благодаря чему к-та, прёжде чем прийти в соприкосновение с перегретой солью, нагревается. К-та попадает в чашу (из фер-;
i
росилиция), вращающуюся при помощи вала. Соль вносится в резервуар через трубу 2. Однородная реакционная смесь течет из бассейна в середину печи. Горячий газообразный НС1, улетающий через трубу 2, служит для нагрева соли, которая идет из воронки и подается поршнем. С каждым ходом поршня вводится определенное количество соли в трубу; вал 3 при посредстве гребков 4 движет смесь к середине печи. Имеются сульфатные механические печи, работающие на 80% H^SO* и купоросном масле (печь Девальда[*]). Для получения С. и соляной кислоты имеются также цилиндрические вращающиеся печи с гребками [*»] (смотрите Соляная кислота).
2. Способ Мейера (Meyer) [6]. По исследованиям Мейера тесная смесь эквивалентных количеств тонко размолотой по--в— варенной соли и бисульфата уже при нагревании до 400° без всякой механич. обработки, в I короткий срок вы деляет весь НС1 в газообразном виде, причем получается С. высокого качества. Выделяющийся НС1 не содержит серной кислоты и по концентрации близок к 100%, т. к. к нему
Фигура ;
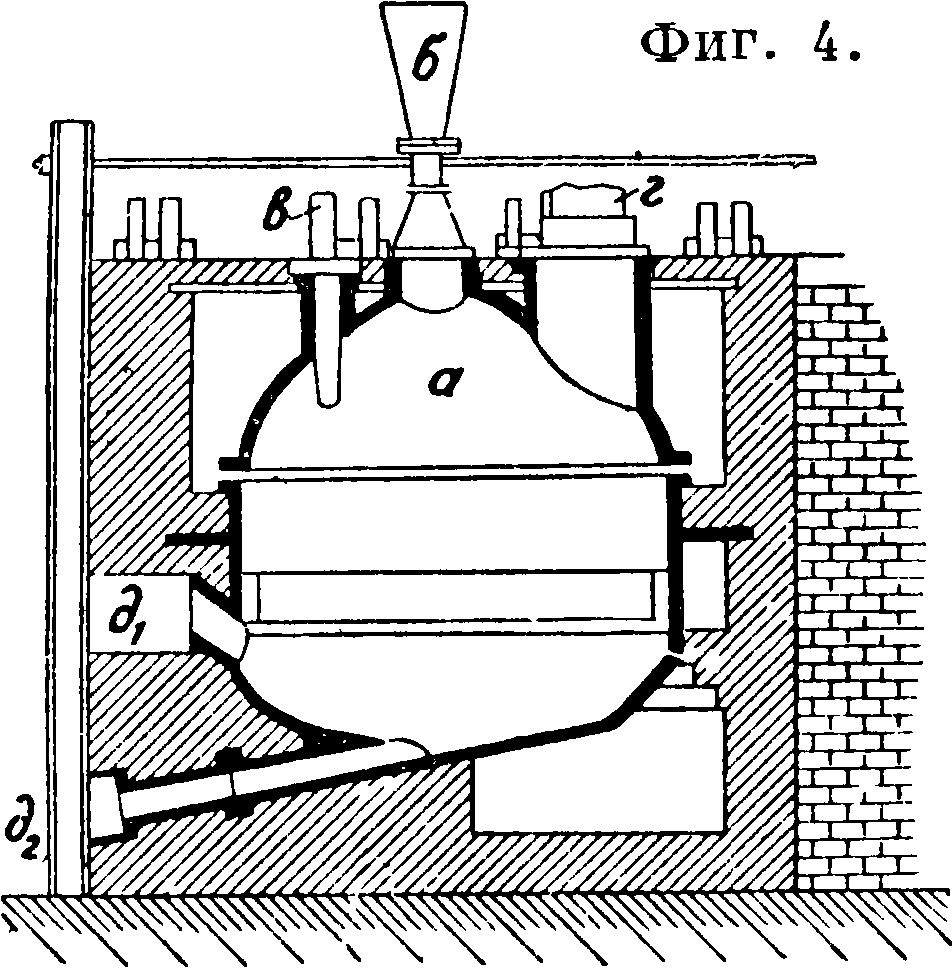
не примешивается воздух, что обычно имеет место при других способах получения С. При действии серной кислоты на поваренную соль реакция может проходить и без всякой механич. обработки при условии, что обе составные части вводятся в баню из расплавленного бисульфата при 300°. Первоначально полагали, что для этого процесса пригодна только 90%-ная серная к-та, но оказалось, что можно применять и более слабую к-ту (до 60° Вё), если реторту до уровня бисуль-фатного плава снабдить кислотоупорным материалом и нижнюю часть ее нагреть до необходимой темп-ры. Реакция лучше всего протекает на поверхности жидкого бисульфата, и тогда более легкие и еще сильно кислые слои медленно погружаются вниз. Отработанный бисульфат при помощи особого приспособления отводится равномерной струей и легко перерабатывается на С. Высота слоя бисульфата должен быть достаточной, т. к. иначе вместе с вытекающим бисульфатом может ухбдить и газ. Применяемые для этого реторты (фигура 4) состоят из замкнутого котла ale воронкой б для загрузки соли и трубой в для загрузки к-ты. Выделяющийся НС1 выходит через г, а готовый бисульфат через dv. Отдельный штуцер д2 служит для взятия пробы.
Нагревание лучше всего производить при помощи газа под давлением, который дает равномерную и легко регулируемую темп-ру. НС1 получается при этом 80—90%-ный, исключительной чистоты и совершенно сухой. Вместо NaCl можно применять КС1 [7]. Образующийся, легко застывающий и ломкий бисульфат калия немного гигроскопичен и легко размалывается; его непрерывно направляют на поверхность вращающегося барабана, где его получают в виде очень мелких чешуек с содержанием ок. 27% свободной кислоты [8]. Расход топлива около 20—25% количества разлагаемой соли.
По Фришеру темп-ру реакции между поваренной солью. и серной к-той можно понизить до 2(0° и даже менее, если на предварительно подогретую (до-200°) соль действовать горячей к-той; разложение NaCl в этом случае наступает почти мгновенно. Расход топлива при этом равен 12—15% от веса взятой соли. Образовавшийся бисульфат натрия, так же как и при способе Мейера, можно, прибавляя NaCl, переработать на С.
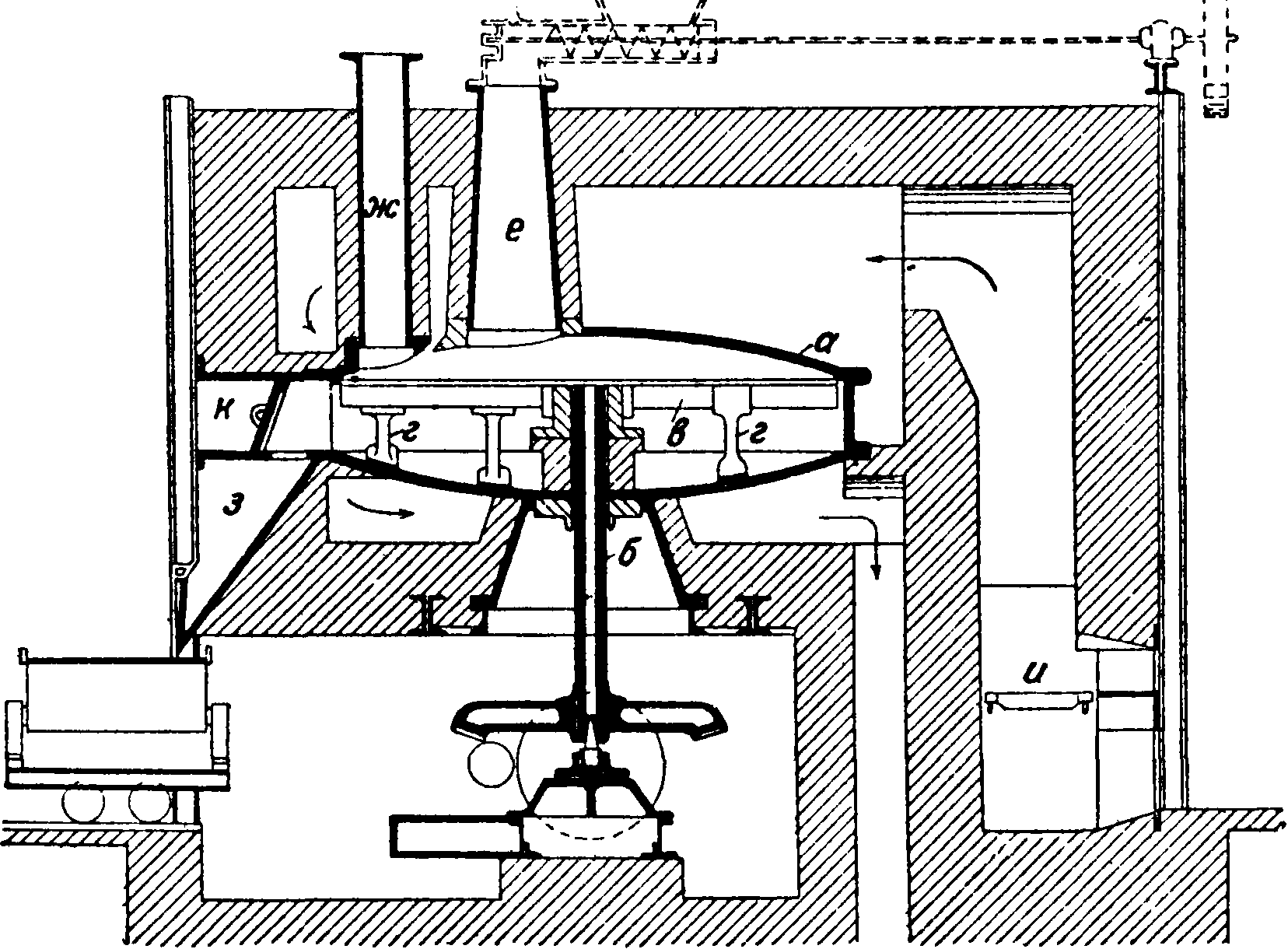
3. Способ Гаргривса (H^greaves) [9] дает возможность обходиться без готовой серной к-ты. На NaCl действуют сернистым газом обжигательных печей (с содержанием 6-Е8% S02), воздухом и парами воды; при t° 500° реакция протекает экзотермически по ур-ию 2NaCl + S02 + О + Н20=Na2S04 + 2НС1. Реакция ускоряется, если к NaCl прибавить ОД—1 % солей меди или железа [10]. В качестве исходного материала применяют серу, обманку и колчедан. На 100 килограмм С. требуется 200 килограмм водяного пара. Соль для увеличения ее пористости предварительно измельчают, увлажняют паром и затем в особом непрерывнодействующем аппарате ее высушивают и одновременно формуют в брикеты величиною 6x6x3 ель [“]. Брикеты загружают в особые печи из 10 больших чугунных цилиндров (высота 3,75 м, диам. 5,5 ж), соединенных в батарей (в два ряда) (фигура 5). Каждый цилиндр снабжен решеткой а и центрально расположенной термо
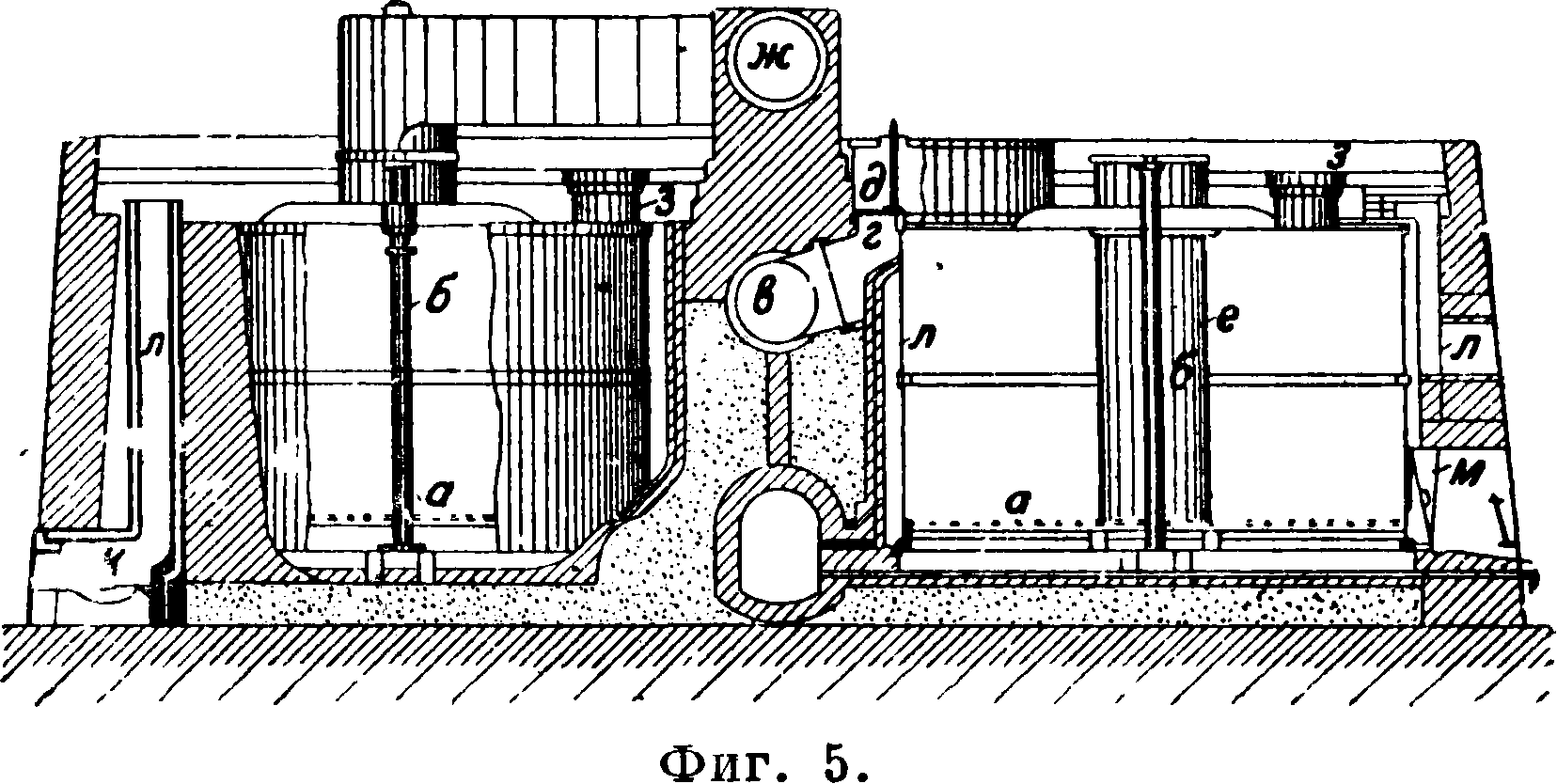
метрии. трубой б, в и г—отверстия для выхода газа, д—вентиль, е—труба для отвода газа, ж—труба для собирания газа, з—отверстия для загрузки, к—вспомогательная топка, л— дымоход, ж—отверстие для выгрузки. Каждый цилиндр вмещает ок. 100 ш соли, время ее переработки 17—20 дней. Смесь газов проходит последовательно через батарею, а затем истощенные уже газы (S02) перед выходом из батареи действуют на свежезагруженную поваренную соль. Газы из обжигательной печи обыкновенно пропускают сначала сверху вниз в цилиндр с почти уже готовым С. В работе находится 8 цилиндров; в двух—происходит загрузка и разгрузка. В конце батареи устанавливается вентилятор, к-рый высасывает газ, содержащий ок. 10% НС1 (по объёму). Один объём S02 дает 2 объёма НС1. При работе б. ч. не требуется внешнего нагревания, т. к. оптимальная t° (ок. 500°) создается за счет теплоты реакции. Неизбежные потери тепла вследствце излучения требуют хорошей изоляции аппаратуры. Если температура во время процесса спускается ниже 300°, то реакция прекращается. Если же темп-pa поднимается выше 610°, то соль может начать плавиться, и процесс прерывается. Батарея в 10 цилиндров дает в год 872 тыс. шС.с содержанием 96—97% Na2S04, ок. 0,8% NaCl, 0,08% Fen 0,3% свободной S03. При этом получается ок. 13 тыс. ш соляной кислоты 19—20° Вё. Расход горючего 12—15% от веса С. Эта установка особенно выгодна для производства больших количеств С. [12]. В последнее время в способ Гаргривса внесены некоторые улучшения. Так, рекомендуется к поваренной соли добавлять тонкоизмельченные горючие вещества (уголь, смолу, торф, опилки), благодаря чему лепешки получаются более пористыми. Клемм для ускорения реакции предлагает поднимать температуру выше 1°ПЛ, хлоридов, причем для предупреждения сплавления массы он прибавляет трудноплавкие вещества (глину, гипс, кизельгур и др.). Способ Гаргривса применяется гл. обр. в Англии, Франции и частью в Германии.
Можно еще указать на способы получения С., основанные на разложении NaCl сернокислыми солями. Так, нек-роё количество С. добывается в Стассфурте· растворением в воде кизерита (MgS04-H20) вместе с NaCl. При охлаждении полученного раствора до 0° выкристаллизовывается 10-водный сернокислый натрий, а в растворе остается MgCl2. Полученная этим путем соль не содержит железа.
Состав и свойства сульфата. Хороший С. представляет собо^о мелкозернистую однородную пористую массу белого цвета с желтоватым оттенком. Красный цвет, присущий иногда С., не- может служить признаком значительного содержания железа, а является часто следствием того, что масса была несколько перекалена, почему из соли железа образовалась окись железа; обыкновенно при этом происходит спекание массы в большие куски. Внутри кусков С. при хорошей работе не должно находиться зерен, неразмолотой поваренной соли; сероватые, ноздреватые куски попадаются только в плохо переработанных партиях. Лучший сорт С. должен содержать 96—97% Na2S04 и не более 0,5% NaCl при таком же или несколько большем проценте «свободной» серной к-ты. При значительном избытке (выше 1,5%) свободной кислоты получается С. зеленова-того цвета; кроме того он содержит до 0,1% Бе, немного A12(S04)3, CaS04, MgS04 (не всегда), нерастворимый остаток и воду.
Примерный состав С., вырабатываемого на одном из з-дов СССР в муфельных печах (в %):
Na2S04 96,28
NaCl0,21
A12(S04)30,89
Fe2(S04)3Μ3
CaS040,71
MgS04 0,19
Свободной H2S04, t. e. NaHS04, Fe2(S04)3и других веществ, перечисленных на S03 0,85
Нерастворимого остатка..0,52
Воды0,21
С., идущий для производства нек-рых сортов стекла (зеркальных и др. стекол), не должен содержать железа более 0,01—0,03%. Такой С. готовят в свинцовых чашах при помощи серной кислоты или очищают сульфат, полученный другим способом, кристаллизацией из воды с последующим прокаливанием. Для этого сульфат растворяют в теплой воде и, если нужно, нейтрализуют «свободную» кислоту известковым молоком, причем осаждается и окись железа. Раствор осветляют отстаиванием, и соль выкристаллизовывают. Полученные кристаллы обезвоживают прокаливанием. Способом прокаливания удается понизить содержание железа в сульфате до 0,006%.
Применение С. находит при изготовлении стекла, для приготовления соды (по способу Леблана), сернистого натрия, ультрамарина и сульфатной целлюлозы. Кроме того значительные количества сульфата перерабатывают (путем перекристаллизации из воды) на глауберову соль (смотрите).
При испытании С. обыкноЕенно ограничиваются определением свободной к-гы и неразложиышгося NaCl.
В СССР установлен следующий стандарт для С.: Na2S04— 9 3-^95%, H2S04+NaCl—не выше 3,0%, Fe203— не выше 0,4%, А1203—не выше 0,2%, влаги—не выше 2,0%, нерастворимого остатка—не выше 1,2% [13, 14].
Лит.: !) Дементьев К., Теплота и заводские печи„ Киев, 1911; 2) г. П. 325314; 3) Ан. П. 172010, «СИет. а. Ind. Review», Л., 1923, v. 42, 15, р. 308; 4) Лукьянов П., Курс химической технологии минеральных веществ, ч. 1, 3 изд., М.—Л., 1930; 3)Вульфсон 3. и П о к р ы ш е в с к и и И., «ЖХП», 1927, 1 1, т. krстр. 902; в) Г. П. 136998; 186398; ?) Г. II. 261411; 8) «The Chemical Trade Journal a. Chemical Engineer», L., 1924, p. 157; ®) Г. П. 1956, 17409; 10) N eumannB., Die Reak-tion heim Hargreaves Prozess, «Z. f. anorg. Ch.», Lpz., 1929, p. 1085; П) l u n g e Gr., Handb. d. Sodaindustrie u„ ihre Nebenzweige, B. 2, 3, Brnschw., 1909; 42) P i 1 i t zr«Ch.-Ztg», Cothen, 1919, p. 517; i») «ЖХП», 1925, t. 1, 12, стр. 84; i4) OCT 48.—Будников П., Химич. технология минеральных веществ, Иваново-Вознесенск, 1927; ФилософовП.иУыковская В., Глауберова соль, «НИ», т. 1, 1926; Минаев В., Химич. индустрия, ее особенности и значение для Сибири, «Вести, сиб. инж.», Томск, 1923, т.4,5; его же, Перспективы содовой индустрии в Сибири, там же, 1923. т. 4, 6; его же, Тус-кольская залежь мирабилита, как возможный центр содовой индустрии Кузнецко-Алтайской пром. области, там же, 1923, т. 5, 1; Пономарев И.,К вопросу о добыче природной соды в Сибири, «Жизнь Сибири», Новосибирск, 1922, 1; Философов И., Природная глауберова соль и ее значейие в содовом и стекольном производствах, «Труды комиссии сырья», П., 1917, вып. 4; О с т Г., Химическая технология, пер. с нем., Л., 1927, вып. 4; Ullm. Enz., В. 8, 2 Aufl.; Waeser В., Schwef e Isaure, Sulfat„ Salzsaure, Dresden, 1927. П. Будников.