 > Техника, страница 83 > Сурьма
> Техника, страница 83 > Сурьма
Сурьма
Сурьма, ан т и м о н и й, Sb, химия, элемент 5-й группы, аналог висмута, а и фосфора; ат. в 121,8; порядковый номер 51. С.—серо-белый блестящий металл, уд! в 6,67— 6,69, из жидкого состояния застывает в крис-таллич. виде (ромбоэдрич. форма), весьма хрупка при всех t° (растирается в порошок).
(при красном; калении) 630,5°; t°Kun. 1440°; теплоемкость 0,0509, линейный коэф. расширения (при 40°) 0Д152.1СГ^; электропроводность (при 0°) 2,56-1СГ4 мо смГ1, твердость по Мосу 3—3,5, по Бринелю 30 килограмм/мм2. Кроме обыкновенной С. известна ее весьма неустойчивая аллотропная форма (плотность 5,78), получаемая при длительном электролизе хлористой С. Выделившийся при электролизе металл при прикосновении к нему со ом и выделением тепла превращается в обыкновенную С. Обычно С. продается в виде металла «регулуса» (не менее 90% С. при минимальном содержании а). Очищенный регулус, отличающийся мелкокристаллич. строением, содержит С. не. менее 99,6%. С: продается также в виде сернистой С. с содержанием ок. 70% С. (сырая С.). Нек-рый спрос имеет окись С., получаемая при обработке бедных руд. При обыкновенной t° на воздухе металлич. С. не окисляется, при нагревании горит синевато-белым пламенем, образуя окись Sb203. С галоидами соединяется непосредственно с сильным тепловым эффектом, в соляной к-те медленно растворяется с выделением водорода, в царской водке и в азотной к-те растворяется легко. Главной первичной рудой С. является сурьмяный блеск Sb2S3 (стибнит, антимонит), встречающийся в игольчатых радиально лучистых, реже зернистых, агрегатах. Твердость 2, уд. в 4,5— 4,6. Сопровождающими минералами обычно являются различные сульфиды, сульфо-анти-мониты и самородные Au, Ag и Sb. Вмещающими жильными минералами являются кварц, реже барит и карбонаты. При неполном окислении сурьмяный блеск переходит вкермезит 2SbaS3. Sb203, при полном—в валентинит (ромбич. кристаллы) (сурьмяные цветы), сенармонтит Sb203 (куб. кристаллы) и с т и бнит (с тибиконит, сурьмяная охра) Sb203 · Sb205 · 2Н20. Кроме того С. входит в состав многочисленных сульфосолей, являющихся рудами других металлов, например пираргирит 3Ag2S · Sb2S3, тетраэдрит Cu2S·
• Sb2S3, буланжерит 5PbS · 2Sb2S3, миаргирит Ag2S · Sb2S3, бурнонит (2PbS. Cu2S) · Sb2S3>джемсонит 2PbS · Sb2S3 и много др.
Месторождения С. не приурочены к какому-либо определенному возрасту и встречаются в породах всех геологич. периодов (от докембрия до четвертичных); как правило сурьмяные жилы богаты лишь близ поверхности. Месторождения С. встречаются во многих странах всех частей света, но мощные эксплоатируемые месторождения С. сравнительно редки (Китай, Боливия, Мексика, Алжир, Франция, Италия,
Венгрия). В СССР известно значительное количество месторождений сурьмы; большинство из них находится на е в Душетском районе по Военно-ской дороге, Кутаисском районе, в ской и Балкарской областях и др. Месторождение, сурьмяной руды имеется также на Украине (Никитовка). Наиболее изученным и наиболее богатым месторождением сурьмяного блеска в СССР является Арамашев-ское месторождение Уральской области; кроме того известны месторождения С. на Урале, в Ср. Азии и в Бурято-Монгольской республике.
Промсть до сих пор почти не пользуется методами обогащения сурьмяных руд, применяя гл. обр. для получения С. из руд прямые металлургии. методы, в результате которых получают или сернистую С., или окись С., или метал-лич. С. Большее количество С. получается из сурьмяного блеска. С. получается гл. обр. сухим путем; мокрый и электрометаллургии, способы до настоящего времени распространения не получили. Выплавку сернистойС. во Франции, Богемии и Венгрии ведут в тиглях, обогреваемых голым пламенем. Глиняные тигли емкостью 5—25 килограмм руды имеют в дне отверстия, через которые вытекает расплавленный сульфид (сурьмяный блеск плавится, не разлагаясь) в подставленные горшки, зарытые для медленного охлаждения в песок (чтобы получить дучший блеск металла); этот способ прост, но не экономичен (большой расход горючего). Более совершенной является выплавка в спе^ циальных печах (фигура 1). В четыре трубко
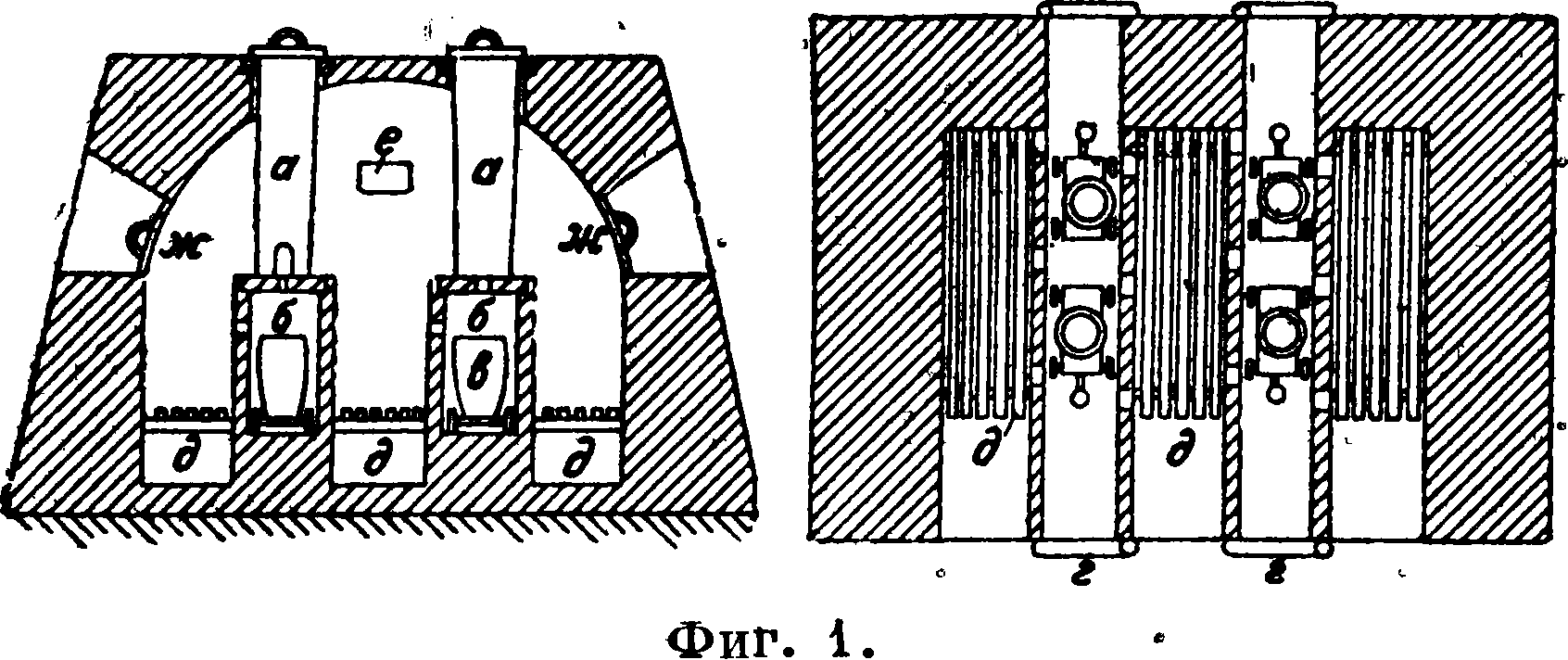
образных тигля а высотой 1 м, диам. 25 сантиметров загружают руду по 250 к?. Внизу тиглей имеются отверстия б для выпуска сернистой С. в вагонет-ки-горщки в, помещенные в каналы, закрываемые крыщками г. Топливо сжигается на решетках d; дымовые газы, обогрев „тигли, выходят через каналы е. Отверстия ж служат для осмотра печи. Одна загрузка выплавляется за 3 ч., расход топлива 64% от веса руды. Выплавку сернистой С. производят также в пламенных печах (типа свинцовоплавильных).
Металлическую С. из сурьмяного блеска получают путем комбинированного окислительно-восстановительного обжига и путем осадительной плавки с железными стружками (по реакцид Sb2S34-3Fe=2Sb+3FeS), совершаемой в тиглях (употребительны тигли из графита), а также в отражательных печах. Окислительно-восстановительный обжиг ведут двумя основными способами: 1) сернистую С. Sb2S3при ограниченном доступе воздуха или при прибавлении водяного пара (при этом сера руды связывается в виде H2S) переводят в испаряющуюся окись С., собираемую в конденсационных камерах, и 2) давая избыток кислорода“ превращают Sb2S3 при t° не выше 350° (процесс ведется в пламенных печах) в нелетучую Sb204, которая получается с примесями Sb2S3, сульфатов других металлов и некоторыми другими. Частично улетучивающийся при этом способе обжига продукт улавливается в специальных конденсационных камерах. В промышленности наиболее распространен первый из указанных способов и ведется в шахтных и муфельных печах. В наиболее распространенной шахтной печи Хереншмидта (фигура 2) размельченная руда в кусках 1—4 сантиметров закладывается вместе с горючим (кокс, древесный уголь) в верхней части а, под которой образован наклонными колосниками б. Обжиговые газы при помощи вентилятора просасываются через трубу г в конденсационные камеры d (длина каждой 1 м), связанные между собой ребристыми трубами е. Для окончательной очистки газ проходит через башню ж, имеющую коксовую насадку з, орошаемую
Фигура 2.
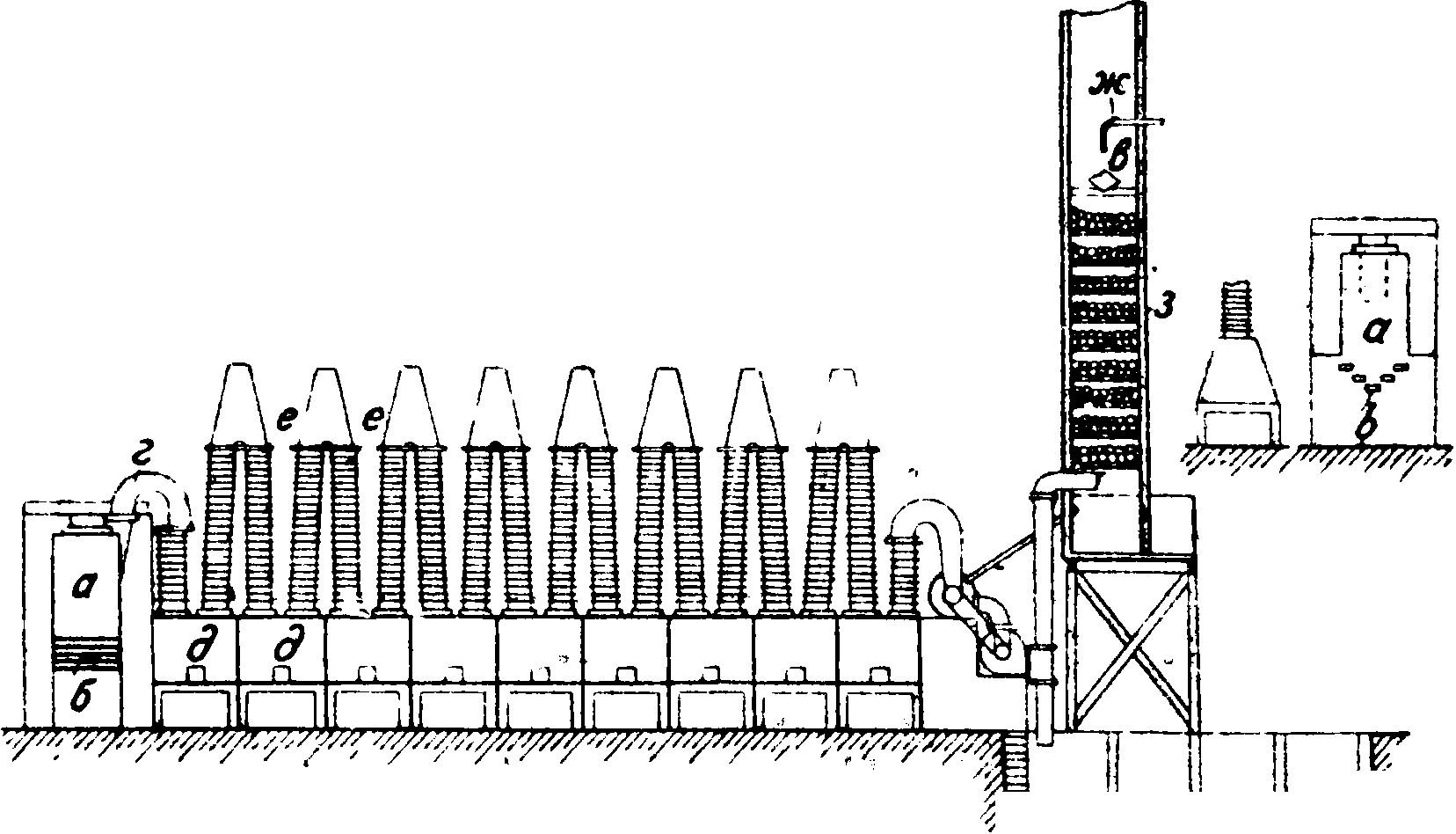
при помощи разбрызгивателя в водой. Печи делаются из огнеупорного кирпича, конденсационные камеры—из чугунных плит, коксовая башня—деревянная. Выход G, из руды ок. 90% (при 10—15%-ной руде). Описанная печь перерабатывает в сутки 6 ш руды с затратой топлива (кокс) 5—6%. Процесс ведется при t° ок. 400°. Для обработки сырой С. также применяют в последнее время вращающиеся печи.
Восстановление окиси С. до металдич. С. производят в шахтных, пламенных и муфельных печах. Восстановление в шахтных печах дает выходы лучше, чем в пламенных йечах, но представляет технич. трудности в защите образующегося металла от окислительного действия дутья. В шахтных печах обычно обрабатывают более низкосортные материалы. Восстановление в пламенных печах технически просто, но связано с потерей металла 12—30%, почему применяется лишь при обработке бога-. тых С. материалов. Так же и при восстановлении в тиглях обрабатывают богатые С. материалы. Независимо от аппаратуры, на которой производится восстановление, для защиты испаряющейся при нагревании с углем Sb203, возможности лучшей рафинации „и для большей подвижности шлаков к шихте, идущей в плавку, прибавляют различные плавни (соду, глаубе-I рову соль и т. д.). Восстановление ведут при j t° красного каления. Полученная указанным i способом С. для получения чистого продукта ! обычно подвергается рафинированию, которое производится в тиглях или пламенных печах; последний способ дешевле и производительнее, но связан с большими потерями С. По английскому способу рафинирование в тиглях производится одновременно с изготовлением сырой С. В пламенную печь загружают 500—700 Кг cbipofi С. (с 92% Sb); после расплавления ее ( прибавляют 3—7 % соды или сульфат с углем.
! Образующиеся шлаки через три часа снимают, j затем прибавляют на 100 килограмм металла 3 килограмма Sb2S3,
{ 15 килограмм Sb204 и 4,5 килограмм поташа. Продолжи -I тельность рафинирования 8 час. Потери С. при рафинировании достигают 20-НЮ %. Получен-j ный продукт содержит 98—99% Sb. Для ра-: финирования применяется также хлорирующий I обжиг с NaCl, MgCl2.,
При получении С. мокрым способом по Гаргривсу (Hargreaves) мелко размолотую РУДУ обрабатывают горячей соляной кислотой, раствор нейтрализуют известью и высаживают С. цинком или железом. Осадок промывают соляной к-той и водой и переплавляют в тиглях. Эдвардс обрабатывает сурьмяные руды 7 %-ным холодным раствором сернистого кальция; по Хереншмидту применяется раствор сернистого натрия. Борхерс при действии щелочей получает раствор антимонитов, к-рый подвергают электролизу и получают металлич. С. Коерр и К0 обрабатывает сурьмяные руды раствором хлористого железа: 6FeCl3 + Sb2S3=6FeCl2+ + 2SbCl3 + S3. Раствор SbCl3 при электролизе выделяет металлич. С.
С. применяется в различных отраслях промышленности в виде чистого металла и гл.обр. в виде сплавов, а также в виде различных солей. Чистая металлич. С. в форме мелкого порошка идет для придания предметам из папье-маше вида полированной стали и для бронзирования металлич. и гипсовых вещей. Наиболее распространенные сплавы олова, свинца, меди и С., баббиты, содержат последнюю в количестве 64-18%. Главное применение сплавы С. с РЬ и Zn имеют в качестве «типографского металла» для типографских шрифтов (4-4-26% Sb). Британский или «белый» металл, представляющий сплав Sb и Sn с небольшими добавками Си, Bi, Zn, РЬ, идет для изготовления посуды. Особо важное значение имеют сплавы Sb и Sn (твердый или сурьмянистый свинец), применяемые для изготовления кислотоупорных клапанов и для шрапнельных пуль. О сплавах С. см. Спр. ТЭ, т. II.
В мировой пром-сти наблюдается непрерывный рост потребления С., Особенно сильно возрастающий в военное время. Мировая добыча сурьмяных руд (в цифрах металла, содержащегося в руде)в 1926 г. достигла 31 344 ш.Процент участия отдельных стран в мировой добыче С. (1923—25 гг.) характеризуется следующими цифрами: Китай—74%, Боливия—4,5%, Франция—4%, Мексика—4%, Алжир—3%, Италия—2%, Австралия—1%, прочие—7,5%. Цены на С. подвергаются резким колебаниям в зависимости от условий рынка, в особенности в военное время. Нормальная стоимость 1 ш сурьмы (Лондон) до войны 305 р., в военное время она поднималась до 1 038 р. т, установившись в 1926 году 610 р. за 1 ш. Промышленной добычи С. ни в довоенной России ни в СССР не производилось, и вся потребность покрывалась ввозом из-за границы.
Лит.: Федоровский Н.М., Опыт прикладной минералогии, Л., 1924; Обзор минеральных ресурсов СССР, вып. 46, Сурьма, Изд. Геолог. К-та, Л., 1928; Болдырев А.К., Курс описательной минералогии, вып. 1, Л., 1926; Богданович К. И., Рудные месторождения, т. 2, СПБ, 1913; Естественные произьодитель-ные силы России, т. 4, Полезные ископаемые, Л., 1917; В e 1 1 a n g e г E., Le Tilon Greorges des Mines de la Lucet-te, «Ann. des Mines», P., 1921, t. 12; Launay L., Traits de M6tallog6nie, Grltes пппёгаих et m6tallif6res, P., 1913: Chun g-J u - W a n g, Antimony, L., 1909; Ullm. Enz. der technischen Chemie, B.l, 2 Aufl., 1928; Borchers, Zinn, Wismut, Antimon, H. a/S., 1924. M. Менковский.
С. соединения. С. образует соединения трехвалентного и пятивалентного типа. В природе встречаются соединения преимущественно трехвалентной С., наиболее устойчивые. Соединения пятивалентной сурьмы образуются при действии сильных окислителей на соединения трехвалентной сурьмы.
Соединения трехвалентной С. Трехокись С. Sb2Og встречается в природе в двух кристал -
лич. модификациях: сенармонт и т“ и в а-лентинит; образуется при окислительном обжиге сурьмяного блеска, сжигании металлич. С. на воздухе, при воздействии на нее водяного пара при t° красного каления или при прокаливании преимущественно гидроокисью. При обычной t° Sb203—белый порошок (кристаллы правильной системы), желтеющий при нагревании и превращающийся при этом в ромбическую модификацию; при t° красного каления плавится и возгоняется; при продолжительном нагревании на воздухе превращается в четырех-окись С. Sb204 (вероятно соединение трех-окиси и пятиокиси: Sb203 + Sb205 *-► 2Sb204). При прокаливании с углем, цианистым калием или же в токе окиси углерода или водорода Sb203 восстанавливается до Sb; Sb203 является исходным продуктом для получения ряда соединений С. Применяется в качестве забелителя или глушителя при эмалировании. Предложено также применение ее в качестве белой краски. Гидроокись С. Sb(OH)3 осаждается разбавленной серной к-той из растворов рвотного камня (смотрите ниже). Sb203 и Sb(OH)3 являют^ ся амфотерными соединениями; они образуют солеобразные соединения с сильными к-тами и с сильными основаниями; растворяются поэтому в разбавленной азотной и серной к-тах и в тех щелочах, с к-рыми образуют растворимые соли. Соединения Sb203 со щелочами, антимониты, производятся от неизвестной в свободном виде метасурьмянистой кислоты HSb02; ее натриевые соли, например средний сурьмя нистокислый натрий NaSb02* •ЗН20 и соответствующая кислая соль.Ка8Ь02· •2HSb02, очень трудно растворимы в воде. При растворении металлич. С. или Sb203 в горячей конц. серной к-те образуется сульфат С., кристаллизующийся в виде гидрата 2Sb2(S04)3-•5Н20. А зотнокислаяС. Sb(N03)3 образуется при растворении С. или Sb203 в холодной конц. азотной к-те. Известны также комплексные соли С. с щелочными солями минеральных и органических кислот, как сурьма-калий сульфат KSb(S04)2, сурьма-калий-оксалат K3Sb(C204)3 · 4Н20 и др. В присутствии избытка воды последние расщепляются гидролитически, причем образуются основные соли, в которых группа SbO, антимонил, играет роль основания. Важнейшая из этих солей— виннокислый антимонил-калий KC4H406-Sb0-• Н20, так называемым рвотный камень, кристаллизуется в выветривающихся на воздухе ромбических призмах, растворяющихся в 14 ч. воды; раствор имеет специфич. металлич. вкус и побуждает к рвоте; на последнем свойстве основано применение его в медицине; в настоящее время его применяют также в текстильном деле в качестве протравы (при основных красителях). Готовится путем кипячения раствора винного камня с трехокисью С. Треххлористая С. SbCl3, сурьмяное масло, или, получается при кипячении трехсернистой С. (природной или искусственной) с соляной к-той; бесцветная кристаллич. масса с t°nJl, 73,4°, 219°. SbCl3 легко растворяется в небольшом количестве воды (а также в сероуглероде, ацетоне и в эфире); при разбавлении водного раствора образуется вследствие гидролиза сначала хлорокись SbOCl, применявшаяся в медицине под названием а л ь г а р о-това порошка, а потом Sb203; SbCl3 растворяется также в растворах хлористых щелочей с образованием комплексных солей типа
Me3SbCl6. Эти соли применяются, как и чистая SbCl3, для воронения стали и для окраски латуни, алюминия, цинка и олова в темные цвета, причем они покрывают металлы защищающим от коррозии тонким слоем металлич. С. Двойные соли применяются также в текстильном деле в качестве протравы взамен более дорогого рвотного камня. Трехфтористая С. SbF3получается из Sb203 и плавиковой к-ты; растворяется в воде с кислой реакцией, но не дает осадков основных солей; применяется, равно как и ее двойные соли, с щелочными флюори-дами (фторидами) и другими солями минеральных к-т [SbFj.NaF; 4SbF3-NH4F; SbF3-NaCl; SbF3-(NH4)2S04] в текстильном деле в качестве протравы, а также при электролитич. получении металлич. С. Трехсернистая С. Sb2S3 в природе встречается в виде сурьмяного блеска; осаждается сероводородом из кислых растворов солей трехвалентной С. в виде аморфного оранжевого осадка, темнеющего при сушке и превращающегося при нагревании в черную кристаллич. модификацию, идентичную с природным сурьмяным блеском. Sb2S3 растворяется в щелочах и щелочных сульфидах. При этом образуются хорошо кристаллизующиеся соли тиокислот, а также поликислоты H2Sb4S7. При последующем кипячении с серой эти соли превращаются в тиоантимонаты (смотрите ниже). Путем кипячения сурьмяного блеска с серой и едким натром получают хорошо кристаллизующуюся т. н. сольШлиппе Na3SbS4*9H20. CepooKHCbC.Sb2S20 красного цвета, встречается в природе; искусственно готовится путем нагревания раствора SbCl3 в растворе тиосульфата (гипосульфита) натрия. Применяется в живописи под названием минеральной киновари. Сурьмянистыйводород SbH3 получается при воздействии водорода in statu nascendi на соли С., а лучше всего при растворении сплава С. и цинка в соляной к-те, содержащей винную к-ту; бесцветный ядовитый газ, вызывающий при вдыхании тошноту, головные боли; t°nJlч —88°, t°Kun, —17°. Является сильно экзотермич. соединением, медленно разлагающимся уже при обычных t°, а ообразно—под влиянием электрич. искры. Под влиянием воздуха окисляется с образованием темной модификации элементарной С.
Соединения пятивалентной С. Пятиокись С. Sb205 желтоватого цвета, обладает более ясно выраженными кислыми свойствами, чем Sb203. Получается при многократном упаривании металлич. С. с азотной к-той; уже при 440° распадается на кислород и четырехокись (смотрите выше). В воде растворяется незначительно с кислой реакцией. При плавлении Sb205 со щелочами получаются кислые пироантимо-н а т ы, как напримерхорошо растворимая калийная соль, кристаллизующаяся в виде моногидрата K2H2Sb207 · Н20, применяющаяся в анализе в качестве реактива на натрий; метаан-тимонат натрия NaSb03 применяется под разными названиями, например лей-конин в качестве опацификатора (глушителя) в производстве молочного стекла и эмалей. Для тех же целей предложено пользоваться щелочноземельными солями сурьмяной к-ты. Основной антимонат свинца применяется в качестве керамической краски (живопись по фарфору) под названием неаполитанской желтой. Пятихлористая С. SbCl5 получается при сжигании металлич. С. в хлоре или же при воздействии последнего на SbCl3;
бесцветная жидкость уд. в 2,35, t°Kun. (при 14 миллиметров давления) 68°, t°nAt —6°, распадающаяся легко на С12 и SbCl3. Пользуясь свойством SbCl5 легко отщеплять хлор (образующаяся при этом SbCl3 легко его присоединяет обратно), ее применяют в качестве переносчика хлора при хлорировании разнообразных органич. соединений, например этилена, ацетилена, метана и др. Кроме того используется свойство SbCl5образовывать хорошо кристаллизующиеся аддитивные соединения с органич. соединениями, особенно производными бензола. С небольшими количествами холодной воды SbCl5 образует гидраты, как SbCl5-H20 или SbCl5*4H20; с большим количеством воды гидролизуется, образуя пиросурьмяную к-ту H4Sb207. С неорганич. хлоридами образует комплексные соли типа MeSbCl6. Пятифтористая С. SbF5 кипит при 150°; растворяется с шипением в воде. С щелочными фторидами образует комплексные соли типа MeSbF6. Пятисернистая С. Sb2S5 получается при осаждении сероводородом из кислых растворов соединений пятивалентной С. в виде аморфного оранжево-красного осадка, отличающегося от SbaS3растворимостью в аммиаке при нагревании. При нагревании в сухом виде до 220°, а под водой до 100° или Же под действием солнечных лучей распадается на Sb2Ss и свободную серу. При растворении Sb2S5 в сернистых или едких щелочах образуются соли тиоортосурь-м я н о и к-т ы H3SbS4, из которых важнейшая сольШлиппе; из нее путем обработки разбавленной серной к-той или (во избежание выделения сероводорода) раствором тритиона-та технически готовят Sb2S5:
2Na3SbS4-f3NaaS306=Sb2S5-f6Na2S208.
Sb?S6 применяется в резиновом производстве как ускоритель вулканизации и наполнитель, окрашивающий каучук в красный цвет; в смеси с бертолетовой солью, так же как Sb2S3, применяется (как вещество, выделяющее при горении много тепла) в спичечном производстве и пиротехнике. Многочисленные торговые марки Sb2S6 отличаются между собою количеством содержащейся в них свободной серы и связанной с этим окраской, колеблющейся от яркокрасной до оранжевой.
Многочисленные органические соединения С. применяются в медицине.
Лит.: Любавин Н., Техническая химия, т. 4, ч. 2, М., 1906; Abegg R.u.Auerbach Н., Handb. d. anorg. Chemie, В. 3, Abt. 3, Lpz., 1907; Melior J., A Comprehensive Treatise on Inorganic a. Theoretical Chemistry, v. 9, L., 1929; DammerO. u. Peters F., Chemische Technologie der Neuzeit, 2 Aufl., B. 3, Stg., 1927; Ullm. Enz., 2 Aufl., В. 1, 1928; Christiansen W., Organic Derivates of Antimony, New York, 1924. E. Кронман.