 > Техника, страница 83 > Суспензии
> Техника, страница 83 > Суспензии
Суспензии
Суспензии, дисперсные системы с твердой дисперсной фазой. Обычно С. называют системы, образуемые твердым телом, измельченным в жидкой среде, например воде (гидросуспензии), в бензоле (бензосуспензии) и т. д. Дымы являются С. с газовой дисперсионной средой (а э р о с у с п е н з и и). С. по методу получения и по физико-химич. структуре делятся на 1) дисперсионные и 2) конденсационные, или кристаллизационные. С. первой группы получаются при всех процессах измельчения твердых тел, являясь продуктом технич. процессов помола, дробления, шлифования, сверления и др.Форма частиц таких С. носит случайный характер. С. же второй группы возникают обычно из растворов при кристаллизации, часто в результате химич. реакций с образованием малорастворимых веществ (BaS04, AgCl) при характерных реакциях, применяемых в химия, анализе. Между частицами таких С. и тем же веществом, растворенным в окружающей их дисперсионной среде, устанавливается подвижное равновесие; условия скорости кристаллизации на гранях кристаллич. частиц С., граничащих с окружающей средой—раствором, определяют форму (габитус) частиц. Эти условия в свою очередь определяются законом Гиббса-П.Кюри-Вуль-фа, согласно к-рому
V=2 σΛ· min>
Ψ—свободная поверхностная энергия (смотрите) частицы-кристаллика должна стремиться к минимуму при достижении равновесия. При этом (в эрг /см2)—удельная свободная энергия гравии г (ее «поверхностное натяжение»), а £,·— площадь данной грани. Сумма распространена на все грани г частицы.
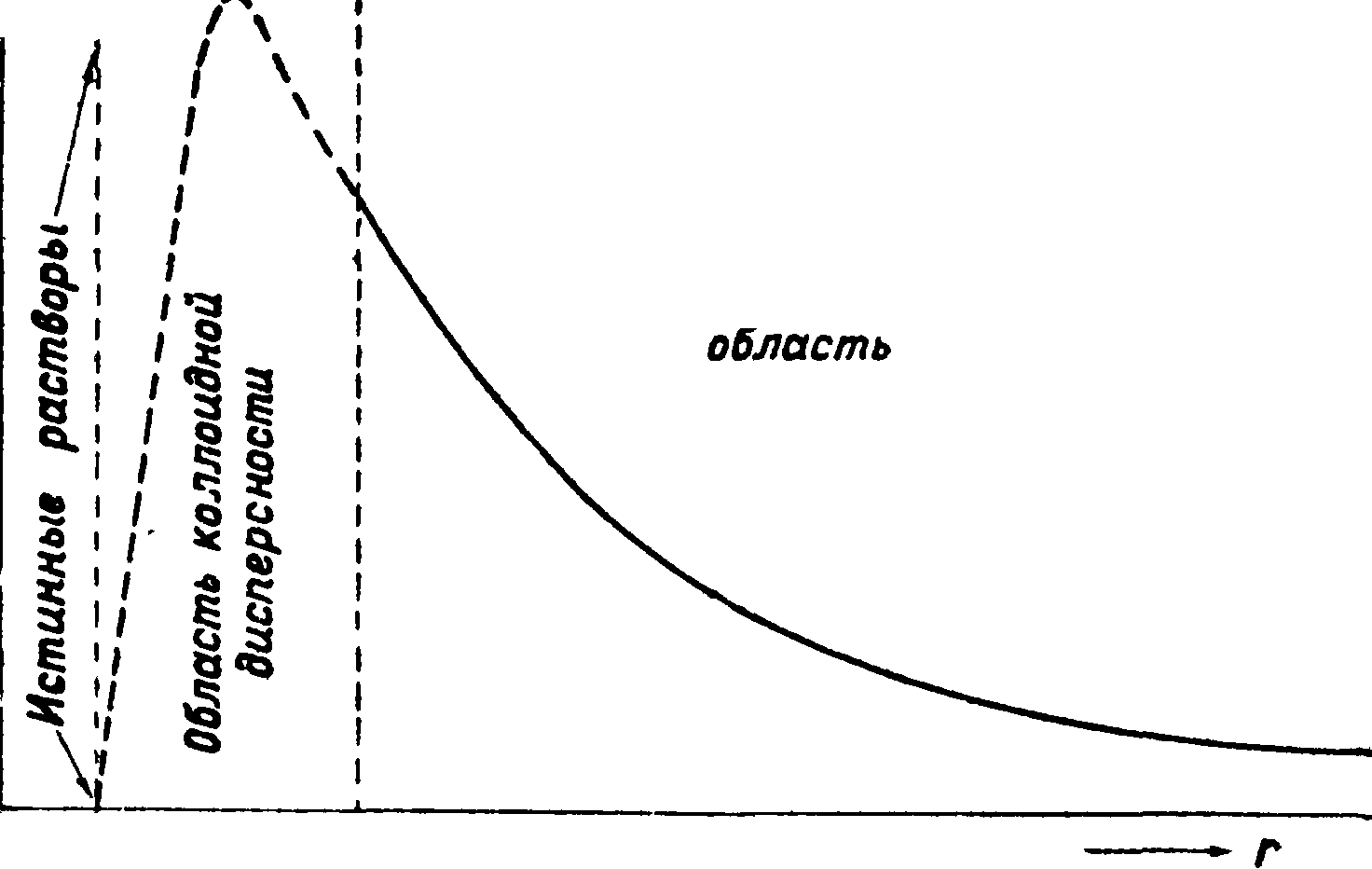
При уменьшении диаметра (2г) частиц С. степеньдисперсности,т. е« удельная поверхность дисперсной фазы, объём которой Vl9
возрастает: γ*=г3 (смотрите фигуру). Параллельно с этим растет роль поверхностных явлений в С. по сравнению с объёмными (смотрите Поверхностное натяжение, Капиллярные явления), так как число молекул, Грубо-дисперсная образующих
гтт (0,001-0,0001μ)
1к поверхностные слои на границе 1,2 (частица— среда), пш увеличивается по сравнению с числом «объёмных» молекул дисперсной фазы nv и
£>12 __ 3 ^ Tig
Vx~ г - п
При достаточной степени дисперсности С. все их свойства определяются в основном природой их внутренней поверхности раздела (частица-среда). Однако при дальнейшем уменьшении радиуса частиц (при г < 0,1 μ в области от 0,1 до 0,01 μ) сама природа поверхностного слоя начинает изменяться; удельная поверхностная энергия <т12 и другие молекулярно-стати-стич. величины, характеризующие некомпен-сированность молекулярных сил в пограничном слое, начинают резко изменяться. Поверхность раздела изменяется при этом качественно, и мы переходим в область коллоидной дисперсности (С. постепенно превращается в коллоидный раствор с рядом специфически новых свойств, см. фигуру). Дальнейшее уменьшение г, приближающегося к нижнему физич. пределу—молекулярным разделам (rwt-n),n само понятие о поверхности раздела в обычном ста-тистич. представлении теряет смысл. Это схематически и представлено на фигуре, где г отложен Цо оси абсцисс, а величина поверхности раздела &12или лучше всей поверхностной энергии дисперсной системы <t12*S12 по оси ординат. В коллоидной области развитие поверхностных явлений (нанр. поверхностной энергии) достигает наибольшего значения перед тем, как вовсе исчезнуть при переходе к истинным растворам, то есть к однофазной, гомогенной системе, тогда как до этого система была гетерогенной, двухфазной. Сказанным определяется особая роль коллоидного состояния как предельно-промежуточного, качественно отличного от соседних областей. Поэтому нельзя говорить о непрерывном повышении степени дисперсности при переходе от С. к истинным (молекулярно-или ионно-дисперсным) растворам, не указывая, что речь идет о качественно совершенно различных системах. Граничная коллоидная область есть область максимального развития гетерогенности С. перед полным исчезновением одной из фаз (появлением гомогенности).
С. могут быть разделены также на м о н о-дисперсные, состоящие из частиц практически одинаковых размеров, и на п о л и дисперсные, содержащие частицы различного радиуса, причем полная картина распределения суспензированной массы по радиусам частиц (по фракциям от г до г +Аг) характеризуется особой функцией распределения. Нахождение этой ф-ии и решение всех задач, связанных с определением степени дисперсности в С., образуют специальную область физико-химии дисперсных систем—д и с п е р-сионный анализ и в частности седимен-тометрич. анализ (смотрите Седиментометрия).
Большое значение среди других методов исследования С. имеют непосредственное микроскопии. изучение размеров и формы частиц, легко применимое в области обычной дисперсности С. при ν>1μ, и исследование электрич. поверхностных свойств С., поверхностного заряда их частиц (смотрите Катафорез, Электрофорез, Электроосмос), Наиболее характерным свойством С. является ихкоагулируемость, то есть способность их частиц слипаться, образуя хлопья под действием молекулярных сил (поверхностной энергии), или самопроизвольна (автокоагуляция) [V] или при добавлении электролитов (э лектрокоагуляция). Последнее связано с разряжением (уменьшением одноименного заряда) частиц при адсорбции (смотрите) ими ионов обратного знака. Однака при значительной адсорбции ионов она может вызвать повышение заряда частиц, ведущее к уменьшению их слинаемости (стабилиза-ц и и) и к расслоению хлопьев (коагулята) на отдельные, наиболее мелкие первичные частицы. Добавление к С. поверхностно-активных веществ, молекулы или мицеллы которых адсорбируются на границе частица—среда с образованием достаточно механически прочной адсорбционной пленки, тоже вызывает стабилизацию С. К таким поверхностно-активным веществам (ста билизаторам) относятся з а щ и τη ы е к о л л о и д ы, увеличивающие концентрацию электролита, потребную для коагуляции С. Образование молекулярных адсорбционных слоев поверхностно-активных веществ на границе частица—среда влияет на автокоагуляцию С., изменяя диэлектрич. свойства пограничного слоя и тем самым изменяя условия адсорбции в нем ионов. Это действие особенно резко проявляется в С. с неполярной (нанр. углеводородной) дисперсионной средой—резкое повышение диэлектрич. постоянной и следовательно заряда частиц вызывает резкую стабилизацию С. С1,2]. В водных же С. те же адсорбирующиеся вещества вызывают обратный эффект, т. н. сенсибилизацию, вследствие некоторого понижения диэлектрической постоянной пограничного слоя. ’
Лит.:1) Ребиндер Л., Адсорбция, поверхностные явдения и свойства адсорбционных слоев (в книге Наумова В., Химия коллоидов, гл. 9, 3 изд., Л., 1932); 2) Ребиндер П., Исследования по физико-химии технических суспензий (Сборник экспериментальных работ), М.—Л., 1933.—Д уманский А., Дисперсность и коллоидное состояние вещества, Харшв—Кшв, 1932; Песков Н., Физико-химич. основы коллоидной науки, М.—Л., 1932; Ребиндер П. и Серб-Серо и-н а Н., «Журнал физ. химии», 1930, т. 2, вып. 6; Вен-стрем Е., там же, т. 2, вып. 3, 6; Freundl ich Η., «Kapillarchemie», 4 Aufl., В. 1—2, Lpz., 1930—31; RehbinderP., WenstrOm E. u. Lagutkina L., «Ztschr. f. phys. Chemie», Lpz., 1930, B. 146 A, p. 63; Rehb inder P. u. WenstrSm E., «Koll.-Ztschr.», Lpz., 1930, B. 53, p. 151 (1930). П. Ребиндзр.