 > Техника, страница 85 > Термический анализ
> Техника, страница 85 > Термический анализ
Термический анализ
Термический анализ, один из важнейших методов количественного изучения зависимости температур плавления равновесных систем от их состава. Он представляет один из наиболее разработанных в теоретическом отношении методов «Физико-химического анализа» и находит широкое применение в экспериментальной практике при исследованиях простых и сложных естественных и искусственных веществ, например металлич. сплавов, естественных и искусственных силикатов и др.
1. Система из одного компонента. Если кристаллы какого-либо вещества постепенно нагревать и довести до полного расплавления, а затем это явление изобразить на диаграмме «температура—время», то получится не плавная кривая, рисующая переход кристаллов из твердого состояния в жидкое—расплавленное, а с соответствующей остановкой
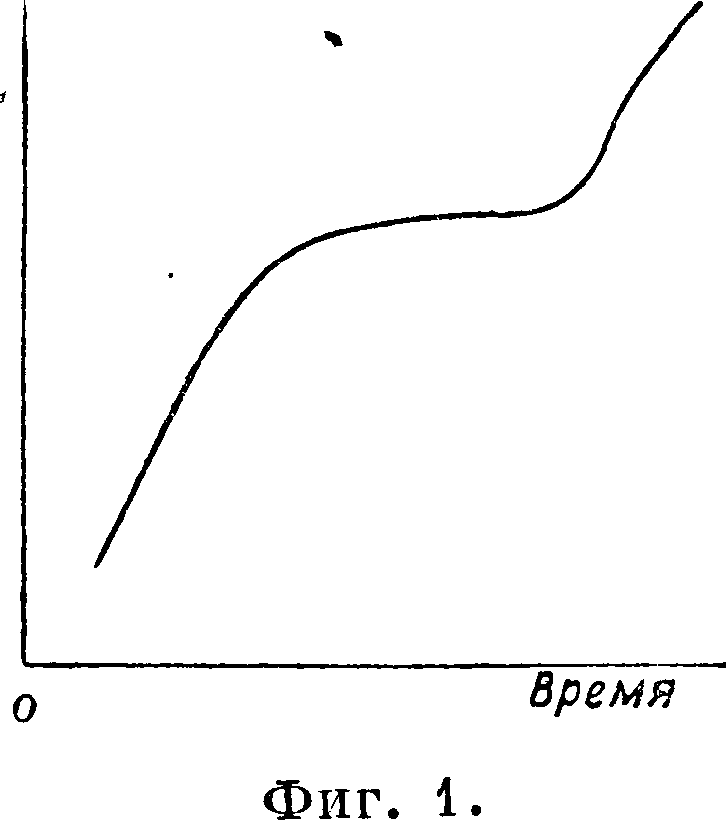
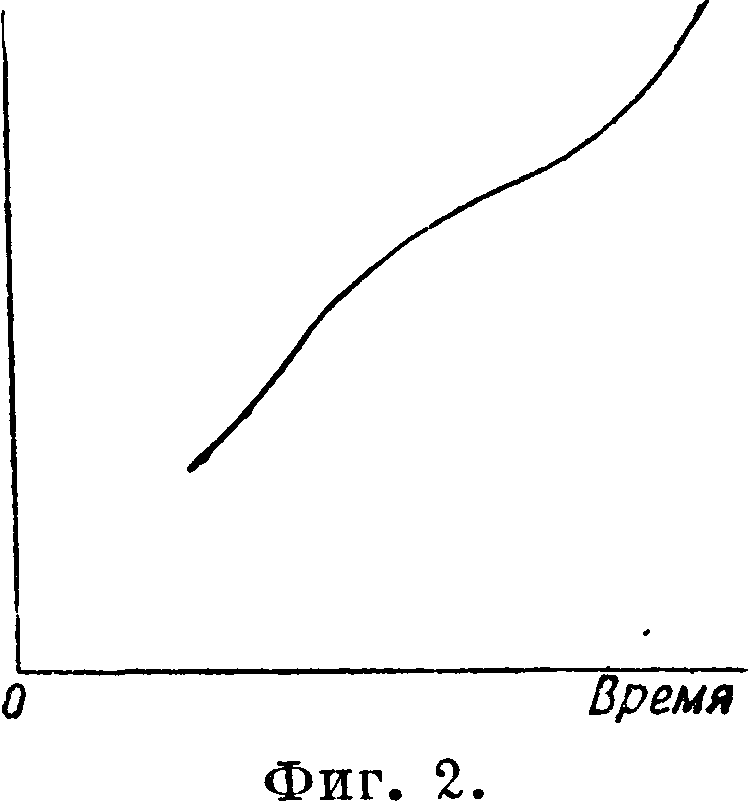
в повышении t° (фигура 1). Обратно, при охлаждении отвердевание расплавленного кристаллического вещества не всегда идет по той же кривой из-за явлений переохлаждения, когда ниже t°nAm оно остается еще жидким, что и наблюдается среди нек-рых силикатов и других веществ. В результате такое расплавленное кристаллическое вещество резко изменяет свои свойства (в величине вязкости или внутреннего трения) и, оставаясь при понижении t° хотя и жидким, но малоподвижным, наконец застывает не в кристаллическом, авт.н. стекловидно м состоянии. И вещество, прошедшее через это состояние, при новом нагревании уже не даст кривой с остановками, соответствующими переходу из твердого состояния в жидкое, а будет изменяться по плавной кривой, т. к. станет постепенно размягчаться, уменьшая внутреннее трение, пока не превратится в жидкую массу, то есть в состояние со значительно уменьшенным внутренним трением (фигура 2). При охлаждении такого расплавленного вещества оно или вернется в свое вновь полученное стеклообразное состояние или же получит кристаллизацию. При охлаждении остальных расплавленных кристаллич. веществ (металлы, их сплавы, нек-рые силикаты и другие вещества) происходит возвращение их в кристаллич. состояние. При этом самая способность к кристаллизации будет обусловлена образованием определенного числа кристаллич. ядер в единице объёма в течение единицы времени, а также и скоростью кристаллизации. Оба эти фактора растут по мере увеличения охлаждения и, достигнув максимума, падают до нуля. Вещества при одном и том же химич. составе могут иметь в твердом состоянии различные модификации, различающиеся физич. свойствами и реакционной способностью, то есть будут полиморфными (см .Полиморфизм). Когда одна модификация после нагревания пре-
вращается в другую, существующую и при охлаждении, то такое явление называется м о-нотропией. Когда же обе модификации существуют при одной Г, но при повышении t° может существовать только одна, а при понижении—только другая, то подобным веществам дают название энантиотропных.
2. Системы из двух компонентов. Для изучения системы двух веществ наносят на плоскостную координатную систему «состав—свойство» по оси абсцисс химии, состав исследуемых веществ, а по оси ординат t°nJlm их и t° других превращений и получают в результате кривые, характеризующие зависимость этих t° от состава системы, то есть кривую плавкости двух веществ. Расплавленная и подвергнутая затем охлаждению система из двух веществ даст при охлаждении ряд соответствующих остановок в момент кристаллизации и других превращений. Темп-ры плавления, кристаллизации и превращений измеряют или не-> посредственно при помощи термоэлектрических пирометров (смотрите Пирометрия), соединенных с градуированными милливольтметрами, или же автоматически записывают на светочувствительной бумаге лучом •света, отраженным зеркальцем очень чувствительного гальванометра типа д’Арсонваля. Гальванометр тогда соединяется с термопарой, один конец которой в фарфоровом или стеклянном футляре погружается в сплав, а другой конец помещается в
-среду с постоянной t°.
, Из термоэлектрич. пирометров наиболее известен пирометр Ле-Шате-лье, а из автоматиче-
Фигура 3.
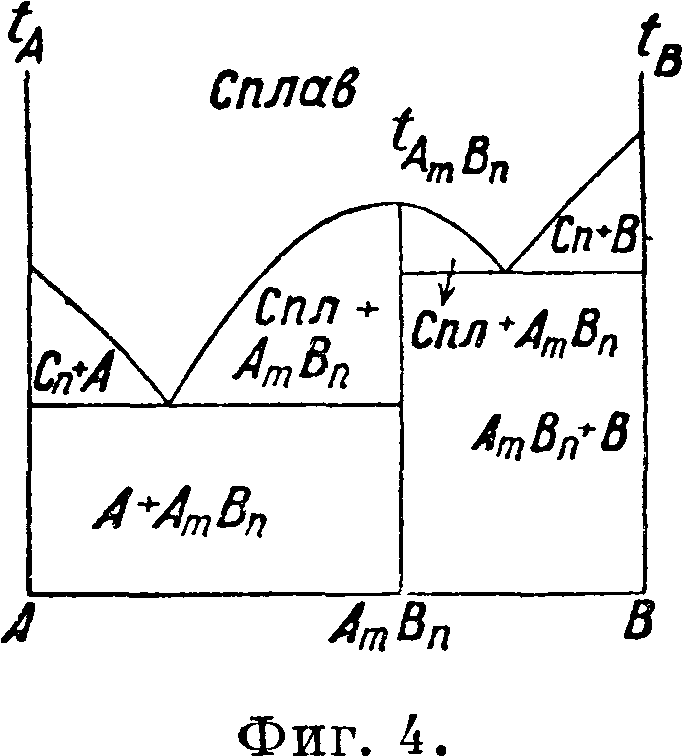
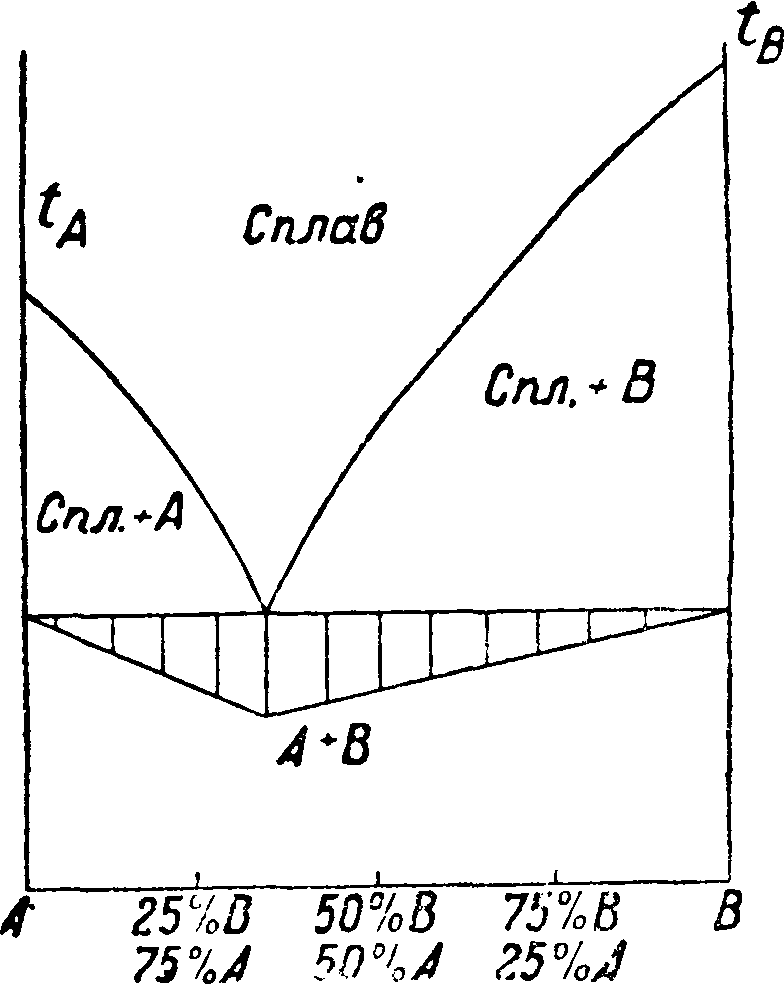
ски записывающих—саморегистрирующий пирометр академика Курнакова. Из систем двух веществ различают три главнейших типа, а) Эвтектическая смесь двух веществ. Фигура 3 изображает такую диаграмму «состав—свойство», когда одно вещество по мере прибавления к нему другого вещества образует смеси с все понижающейся t°nΛ>, которая достигает наибольшего понижения в одной точке, соответствующей наиболее легкоплавкой смеси из определенной пропорции двух данных веществ и называемой эвтектической смесью или просто эвтектикой. При дальнейшем увеличении в смеси второго вещества t°nJlt начинает повышаться. Прямая, проведенная через эвтектич. точку параллельно оси абсцисс, обозначает цолное превращение жидкого сплава в механич. смесь кристаллов двух исходных твердых веществ. Если отложить на перпендикулярах к этой эвтектич. прямой отрезки, пропорциональные продолжительности остановок в момент затвердевания, отмечаемых пирометром, а затем концы этих отрезков соединить, то получится фигура, близкая к тр-ку, носящая название треугольника Таммана, играющего существенную роль при точном определении состава эвтектики, б) Определенное химическое соединение двух веществ. На фигуре 4 и 5 представлены термин, диаграммы состояния
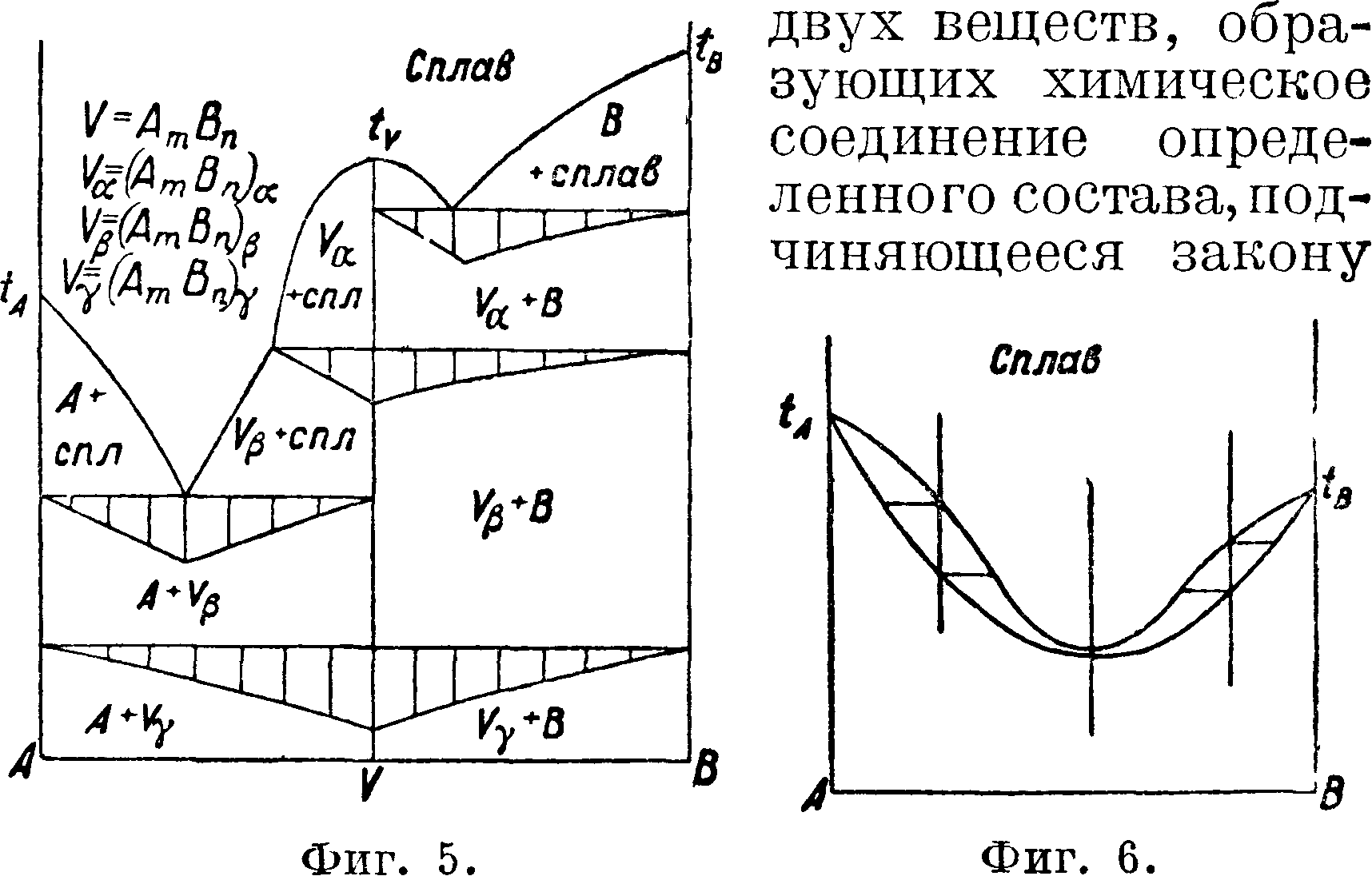
кр#атных пропорций Дальтона. Это определенное химич. соединение отвечает максимуму на кривой плавкости. На тех же фигурах кривые плавкости имеют еще по две эвтектич. остановки, отвечающие смесям одного вещества с полученными химич. соединениями и другим веществом. Фигура 5 отмечает кроме того полиморфные превращения в твердом состоянии. Для точного определения состава эвтектик и указанных превращений в твердом состоянии ниже эвтектических прямых и прямых превращений в твердом состоянии строятся тр-ки Таммана, что и показано на фигуре 5. в) Т в е р д ы и раствор или смешанные кристаллы двух веществ. Твердые криста шич. вещества, подобно жидкостям (смотрите Спр. ТЭ, T.VII, стр. 185—23€>), способны давать при застывании расплавленных веществ однородные смеси в различных пропорциях, т. н. твердые растворы (смотрите Растворы твердые) или смешанные кристаллы. На фигуре 6, 7, 8 изображены характерные термин, диаграммы состояния двух веществ, дающих непрерывный ряд смешанных кристаллов или твердых растворов обоих веществ, имеющих £°-ный минимум (фигура 6), Г-ный максимум (фигура 7) t°nJl, лежащие между темп-рами плавления обоих веществ (фигура 8). Все три изображенных случая твердых растворов имеют верхнюю кривую,
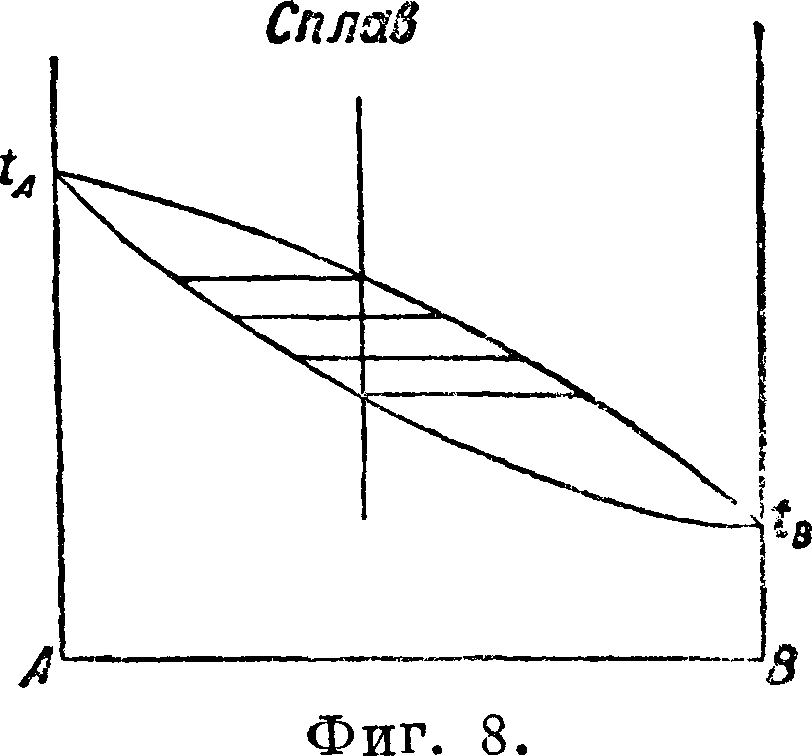
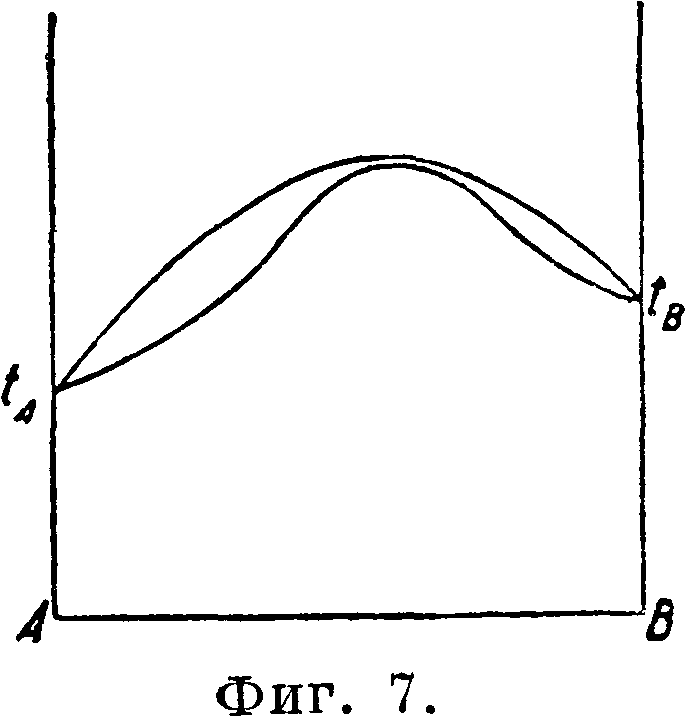
представляющую начало выделения из сплава твердых кристаллов, и нижнюю кривую, являющуюся границей перехода всего сплава в твердое кристаллич. состояние. Помимо указанных наиболее характерных трех случаев Т. а. устанавливает более сложные случаи образования твердых растворов двумя веществами (смотрите Растворы твердые).
3. Система трех веществ. Термин, диаграмма состояния трех веществ изображается не на плоскости, а в виде пространственной фигуры, в основании которой помещают равно сторонний тр-к. В вершинах такого тр-ка располагают исследуемые вещества, и в результате каждая из сторон этого тр-ка (фигура 9) представит одну из систем двух веществ. Точки внутри тр-ка являются соединениями из трех веществ, причем состав веществ определяется длиной прямых а, b, с проведенных из данной точки параллельно трем сторонам тр-ка. Сумма этих прямых равна длине стороны тр-ка, принимаемой за 100. Из точек тр-ка, представляющих данный состав веществ, восстанавливают перпендикуляры, на которых откладывают t°nJltих. Вершины этих перпендикуляров соединяют сплошной поверхностью, которая и представит
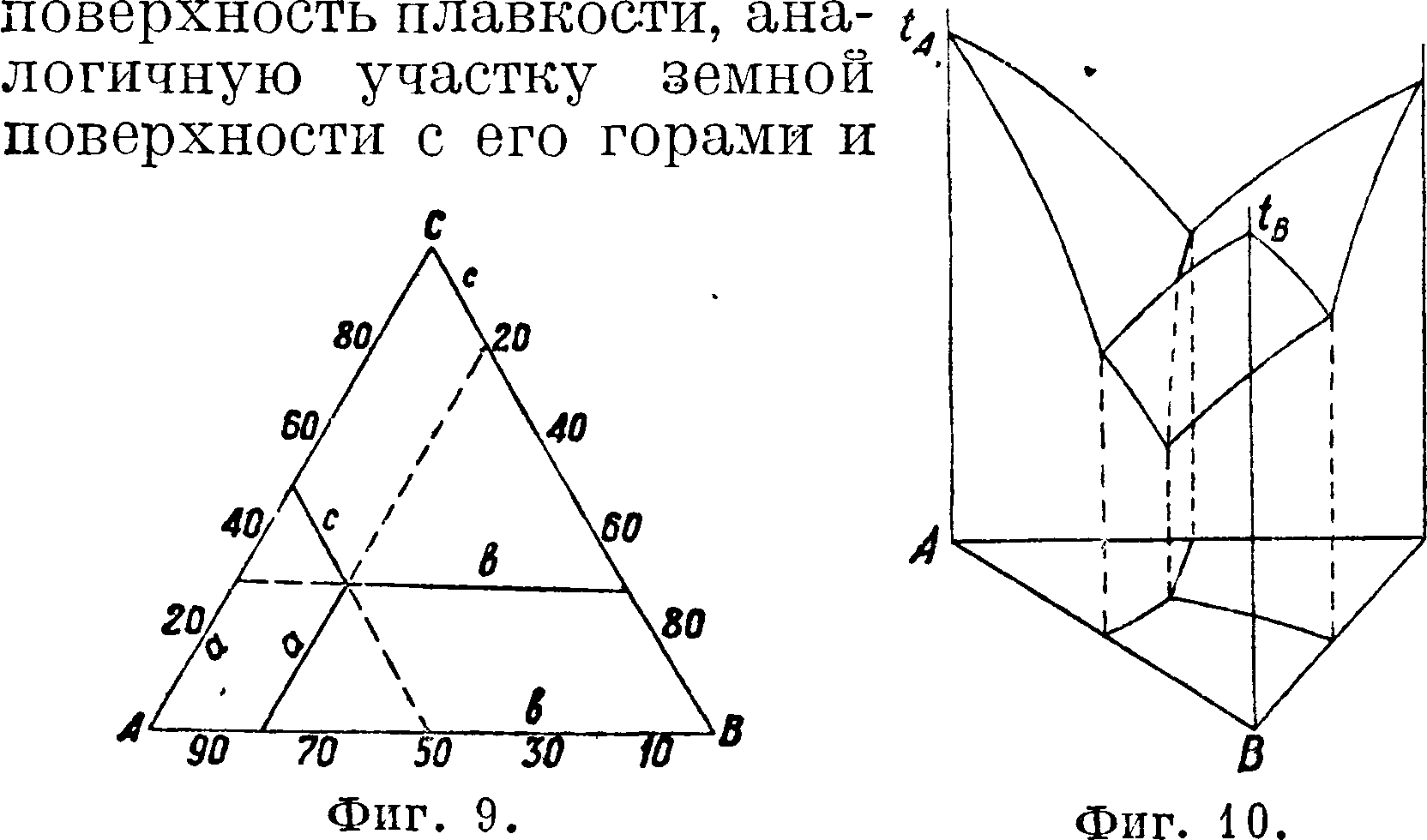
долинами; при этом вершины этих гор соответствуют t°nJl определенных химических соединений, а наинизшие точки при пересечении поверхностей и линий—температуры эвтектических смесей (фигура 10).
4. Система четырех и более веществ. -Изображение термич. диаграммы состояний четырех веществ еще не получило общепризнанного решения в виду большой трудности и сложности в выполнении. Сказанное еще в большей степени должен быть отнесено к системе веществ более четырех.
Лит.: Курнаков Н., Введение в физико-химич. анализ, 2 изд., Л., 1928; его же, Растворы и сплавы, в книге Менделеева Д., Основы химии, т. 1, 9 изд., М. — Л., 1927; Тамман Г., Металлография, пер. с нем., М.—Л., 1931; «Известия Ин-та физико-химич. анализа», Л., «Ж»; E i t e 1 W., Physikalische Chemie d. Silikate, Lpz., 1929; DoelterC.u. LeitmeierH., Handbuch d. Mineralchemie, 5 Aufl., В. 1—4, Dresden— Lpz., 1912—30; T a m m a η n Agregatzustande, 2 Aufl.,
Lpz., 1923. В. Тарарин.