 > Техника, страница 85 > Терпены
> Техника, страница 85 > Терпены
Терпены
Терпены —обширный класс непредельных углеводородов общей ф-лы С10НГ1, широко распространенных в природе, гл. обр. в эфирных маслах (смотрите), в которых Т. являются часто главно! составной частью. Таково наир, терпентинное масло, или скипидар, и др. Обычно одновременно с Т. в эфирных маслах присутствуют производные Т. (ы, альдегиды, кетоны), обусловливающие характерный запах и практическую ценность эфирных масел. Некоторые производные Т. приобрели самостоятельное значение в различных отраслях пром-сти и в медицине, наир, гераниол (смотрите), ментол (смотрите), тмфэра (смотрите) и др. Большая часть Т. и их производных представляет легкоподвижные бесцветные жид кости с характерным запахом, с сильным светопреломлением и в большин стве своем оптически активные, под действием света и воздуха, сравнительно быстро, осмо-ляются. Т. разделяются на следующие группы.
1) Т. с открытой цепью углеродных атомов (алифатические Т.). Важнейшими представителями этой немногочисленной группы являются углеводороды с 3 двойными связями—мирцен и оцимен, легко полимеризующиеся в каучукообразные продукты и переходящие в циклич. Т. и дитерпены. Мирцен (1) — жидкость с 1°кчп. 167 —172° и уд. в при 15° 0,8013-1-0,8023. Мирцен найден в масле из листьев Pimenta acris, в масле хмеля, вербены(Lippia citriodora) и др. При перегонке под обычным давлением легко осмоляется; образуется при дегидратации линалоола (смотрите) и переходит в линалоол при гидратации. Восстановление мирцена натрием в овом растворе приводит к дигидромирцену С10Нц. При окислении перманганатом мирцен дает янтарную к-ту. О ц и м е н — изомер мирцена (2) с t°Kun. 73—74° при 21 миллиметров и уд. В: D15 0,801, встречается в масле Ocymum basilicam, О. gratissimum и др. Натрием в овом растворе м. б. восстановлен, как и мирцен, в дигидро-мирцен. При нагревании оцимен превращается в изомерный аллоцимен.
2) Моноциклические Т. представлены в эфирных маслах большим числом изомерных углеводородов, дающих при гидрировании ti-гексагидроцимол (п-ментан, 3), производными которого они являются, и т. о. находятся в генетич. связи с n-цимолом, в к-рый переходят например при дегидрировании с серой; производные м- (4) и о-ментана в природе не найдены, нек-рые из них получены синтетически. Переход от ментана к Т. ф-лы С10Н16 теоретически м. б. осуществлен отнятием от ментана 4 атомов водорода, попарно от соседних углеродов, в результате чего получаются разные мо-ноциклические Т. Положение двойных связей в циклических Т. обозначают греч. буквой Δ с стоящими справа вверху цифрами (показателями), обозначающими углеродный атом, к-рый связан с соседним, следующим по счету, двойной связью. Если двойная связь является семициклической, то есть находится между циклом и боковой связью, то цифру, обозначающую положение углерода в боковой цепи, заключают в скобки. На этом основании построена рациональная номенклатура Т. как производных менгана, но большинство Т. имеет установившиеся исторически собственные наименования. Важнейшими представителями моноциклич. Т. являются: лимонен, Δ1’8 - ментадиен (5),
бесцветная жидкость с запахом лимона, Цип. 175—177° и удельным весом D15 0,850. Правый с£-изомер встречается в лимонном, померанцевом и многих др. маслах, левый I-изомер—в хвойных маслах. Концентрированная серная к-та переводит лимонен в ti-цимол; еще легче такой переход осуществляется путем дегидро-генизационного катализа. Лимонен восстанавливается водородом в присутствии платиновой черни в карвоментен
/СН,.СН2ч
НзС-С >СН.СН(СНзЬ
^СН* СЯ0
а последний в ментан. Раствором перманганата лимонен окисляется в 4-атомный —:л и-м о н е н-э р и т р и т с 1пЛт 191,5—192°. С сухим хлористым водородом лимонен образует моногидрохлорид, обработкой которого например уксуснокислым натрием получают опти-
чески активный α-τ ерпинеол (30); в присутствии влаги получаются дигидрохлориды (цис- и транс-). Лимонен связан простыми взаимными переходами с терпинеол ом, терпином (33) и карвоном (37). Характерным для лимонена является тетрабромид с 104—105°.
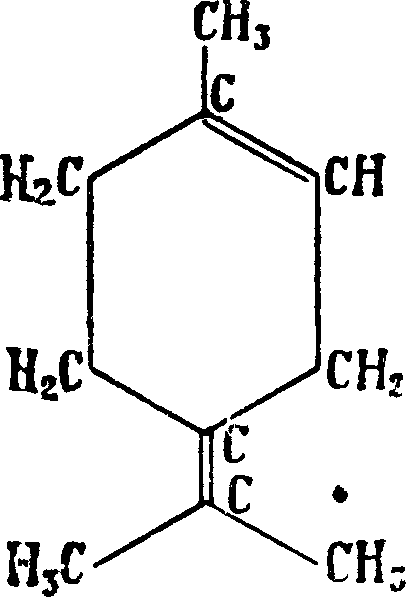
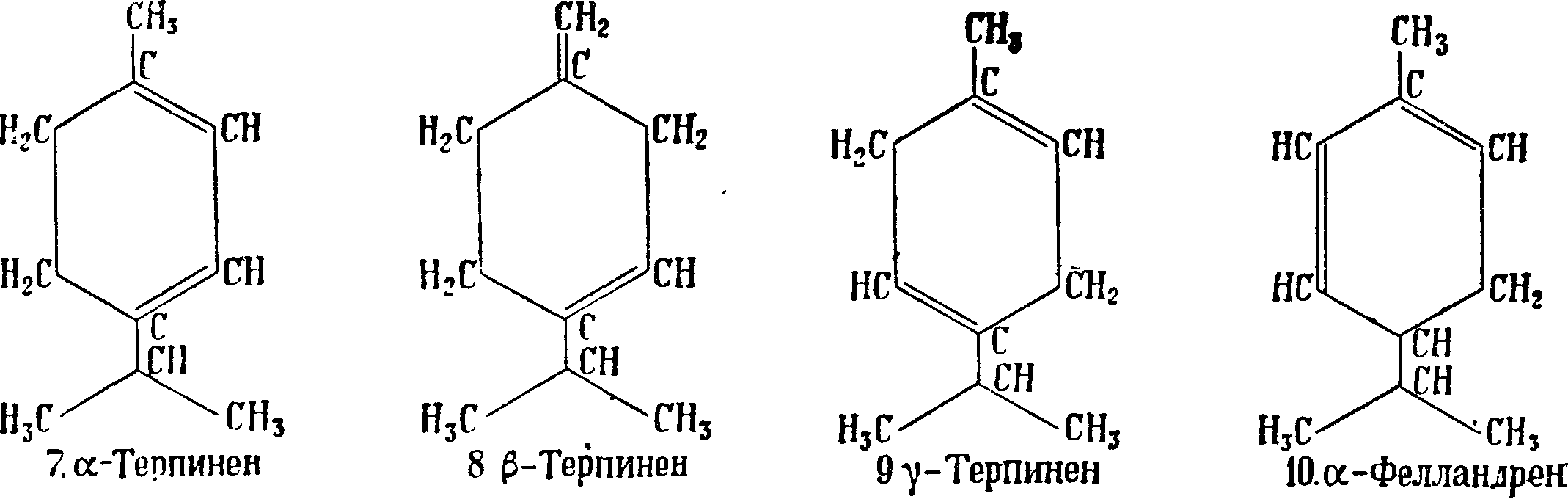
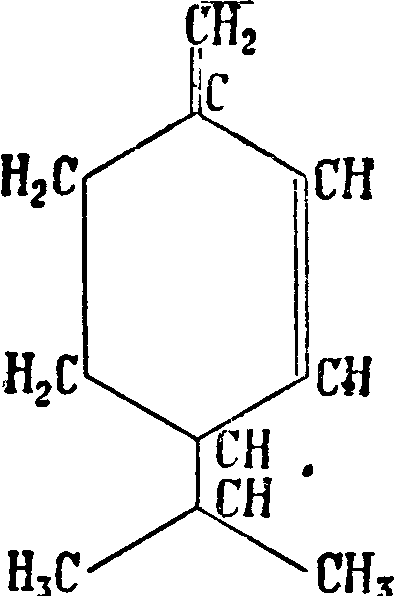
Д и п е н т е н—недеятельная модификация лимонена—может быть получен в результате смешивания равных частей правого и левого лимонена, а также путем его рацемизации. Имеет то же строение, что и лимонен; в особенности много дипентёна содержится в отработанном скипидаре после производства терпи-неола. Изомеризация многих Т.—лимонена, пинена, фелландрена и т. д.—приводит к дипен-тену, который получается также полимеризацией рзопрена. Для дипентена характерны тетрабромид с 125 —126° и гидрохлорид с („л 50°. Терпинолен Δ1>4(8) - ментадиен (6) c’fom. 183—185° и уд. в D20 0,855. Получается как побочный продукт при производстве терпинеола. Характеризуется тетрабромидом с i°u> 116° и дибромидом с Ьпл. 69—70°. α-терпинен Аьз-ментадиен (7) с t°Kun; 172—175° и уд. в D 9 0,8353. В природе встречается в кориандровом, майорановом и др. маслах. Получается наряду с другими изомерами при действии к-т на различные Т. (пинен, дипентен, фелландрен и т. д.) и их кислородные соединения (линалоол, терпинеол, терпингид-рат). В противоположность пинену, камфену, лимонену, терпинолену и др. терпинен разрушается полностью хромовой смесью на холоду; этим путем его можно удалить из смеси с другими соединениями; при хранении осмоляется. Характерен для терпинена дихлоргидрохлорид с (°пл. 51°. Наряду с α-терпиненом во многих эфирных маслах встречаются изомерные ему Т. β- и γ-τ ерпинены Δ3>1(7)- и Δ ^-ментадиен (8 и 9), α-фелландрен А^-ментадиен (10) с t°KUn. 173—175°, уд. в D35 0,8425—0,8565 и β-φ елландрен Л2’1(7)-ментадиен (11), с (кип. 57° (при 11 миллиметров), уд. в D15 0,848—0,852; встречаются в эфирных маслах (укропном, эвкалиптовом и других). При окислении дают различные продукты: α-фелландрен дает а-окси-/Гизопрспилглутаровую кислоту, ^-фелландрен дает а-окси-/?-изопропиладипиновую к-ту. Фелландрен очень неустойчив против солнечного света и высоких темп-p, перегоняется только при большом разряжении в вакууме. Силь-в е с т р е н (12) с tKUn. 175—177° и уд. в.Б20 0,848; в природе не найден, повидимому образуется лишь в результате изомеризационных превращений других Т. (карена) под влиянием повышенной темп-ры; устойчив по отношению к разным реагентам; недеятельная форма сильвест-рена называется карвестреном. Длясиль-вестрена характерен дигидрохлорид с ί„Λ. 72°.
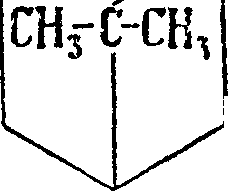
3) Бициклические Т. Важнейшими би-циклическими системами предельного характера являются системы карана, пинана и камфана (13, 14 и 15), представляющие комбинированные системы наружного шестичленного и внутреннего 3-, 4- или 5-членного кольца; получаются они синтетически ката-литич. разложением гидразона соответствующего кетона: каран из гидразона карона, пинан из гидразона пинокамфона и камфан из гидр-азоиа камфоры по общему ур-ию
Cl0H16N : NH2=C10H184-N2
или гидрированием соответствующего терпена. Важнейшими представителями бйцикличес.шх
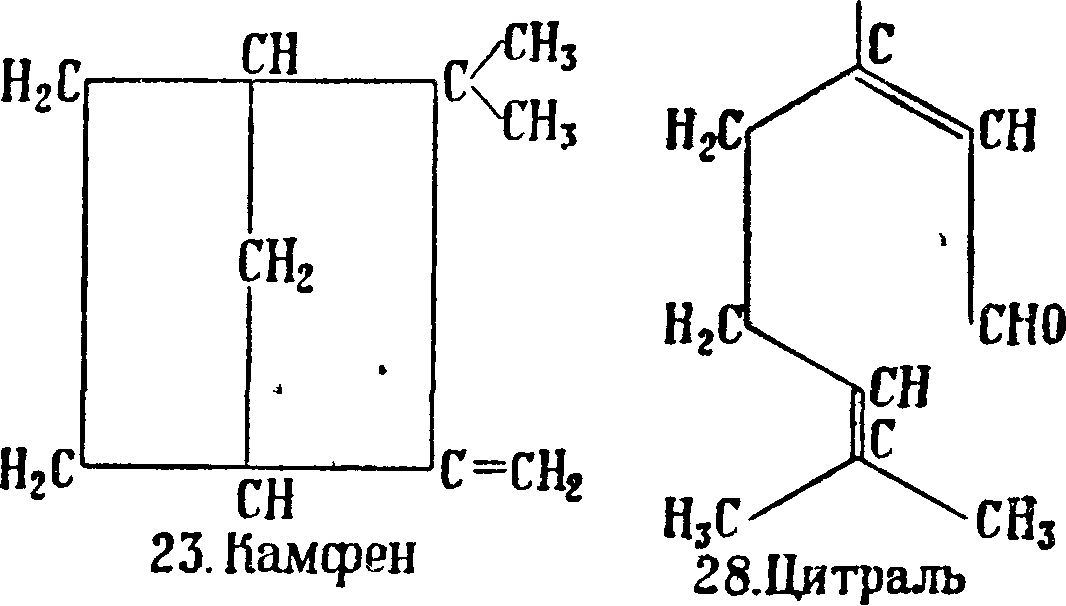
Т. являются: Л3-карен (16) с Щип. 168—169° при 705 миллиметров и уд. в 0,8586, встречается в русском и немецком скипидарах, иногда со-ввместно со своим изомером Δ-кареном (17)· с (кип. 165,5—167° при 707 миллиметров и уд. в Df( 0,8552. Под влиянием различных реагентов оба карена легко изомеризуются в сильвестрен и кар-вестрен или дипентен, что долгое время препятствовало их изучению, а-п и н е н (18) с Пип. 154—156° и уд. в Щ° 0,8580—0,878, содержится гл. обр. в маслах хвойных растений, составляет главную часть скипидара (смотрите), а у нек-рых—почти единственную. Известны правый d-, левый I- и недеятельный Ш-пинены; пинен легко превращается в производные других систем; особенно важны реакции присоединения к пинену хлористого водорода, причем образуется при одновременной изомеризации борнилхлорид (19), и гидратация пинена разбавленными минеральными кислотами, причем образуется терпинеол, терпингидрат и др. соединения. Химич. свойства пинена изучены весьма подробно; он применяется в производстве терпинеола и синтетич. камфоры (смотрите)ув медицине и лакокрасочном производстве. β-π инен (н опине н) (20) — ближайший изомер α-пинена, отличающийся от последнего“ положением двойной связи, с t^un. 163—164° и уд. в D15 0,8650; часто встречается вместе с а-пиненом. β-пинен с ббльшим успехом, чем а-пинен, применим для синтеза камфоры и производства терпинеола, т. к. соответствующие реакции протекают быстрее и с большими выходами; кроме того /Гпинен труднее превращается в моноциклич. Т. Под влиянием крепких минеральных к-т к пинену присоединяется вода, и происходит изомеризация с образованием борнеола (смотрите). Гидратация /Гпинена разбавленной серной и ледяной уксусной к-тами приводит к терпину (зЗ). Борнилен (21), единственный Т., являющийся производным системы камфана, не встречающийся в природе; получается борнилен отщеплением хлористого-водорода от борнилхлорида или воды от борнеола (22); tiun. 146° при 740 миллиметров, (°пл. 113°. К а м ф е н (23) встречается главным образом в масле различных хвойных, получается из борнилхлорида при отнятии хлористого водорода, из изоборнеола при отнятии воды; (пЛ. 49°, (кип. 160°. Переход от борнилхлорида или изоборнеола к камфену сопровождается внутримолекулярной перегруппировкой.
4) Производные алифатических терпенов. Важнейшими представителями их являются: цитронеллол С10Н20О, природный продукт, состоит из двух изомеров (24 и 25); жидкость с запахом розы, встречается вг эфирных маслах герани, розы, цитронеллы; tmin. 225—226° и уд., в В % 0,862. Окисление приводит к различным продуктам в зависимости от применяемых условий и окислителей, например хромовая смесь дает гл. обр. цитронел-лаль с примесью изопулегона, цитронелловой кислоты и др.; перманганат—трехатомный, ацетон и β-метил адипиновую к-ту. Технически получается из цитронеллаля восстановлением амальгамой алюминия или выделением из соответствующих масел (смотрите Душистые вещества). Цитронеллаль С10Н38О в виде смеси двух изомеров (26 и 27) встречается в маслах цитронеллы,1 некоторых эвкалиптов, мелиссы и др.; tSun. 203 — 20b° и уд. вес D15 0,8552. Под влиянием к-т легко изомеризу-ется в аависимости от формы в изопулегол или
2
и
Н2С
>.сн сн сн. сн3
Jc
п СI
I
HC
1с *
нгС^ ^СНз 1 Мирдея. 2-Оцкмгн
Н2С
СНз
JCH
Сй2
Vй
81сн
H,Ctf j>CH,
З.п-Ментан
Н2С
НгС
СН2
Πϊ-CIis
ч. Jch2
Чй ΙξΗ
н3Ч ^сн3
4.м-Ментан сн,
1с
HjCfXCH
Н2С
СН2
н3с^ ^сн2
5 Лимонен
6. Терпин олен
SC
Н,С
СН2
сн-с
ΙΙ.β-Фелландрен 12.Сильвестрен
СН2 til.
ΓΗ,
СН
Н2С
Н2С
СН3Г-СН3
СН:
СН
сн
13 Каран н,с н,с сн,
г
CHfC-CHj
сн,
I
сн
19. Борнилхлорид
СН3
СН
Н,С
Н2С>
СН
СН3-С-СН3
СН*
сн
14. Пинан
СН,
СНП Н2СГ ^>сн НгГ
СИ,
СИ
20. β-Пинеи
Н2СХ CHfC-Щ
СН2
НгС
СН,
сн
15.Камсран
СН3
С
Н,С
Н,С
CHj-C-CH,
сн сн сн
21.Борнилен
ГН,
1с нс н2с
СНз-С-СН,
,сн
16. Δ-Карен н2с
И2С
CH3-C-CH5
сн2
сн
22.Борнеол
СН,
LC
Н2С Н£
CH3-C-CH3
СН
17 Д4-Карен
НС
Η,Γ>
сн,-с-сн,
сн сн. сн
18 ссПинен СНа снон
| гн3 | си3 | сн3 | сн3 | |
| 1сн | j™ | JcH | ]сн | СНз |
Н2С
н2с
СНг НгГ
СН2
СН20Н НЧХ αιОН
’ ХСН? χρ
JC #
HjC^ ^CH, Н3С^ ^СНз Лимонрнная форма Терпинолениая форма 24 и 25 Цитронеллол
Н2С
Н2С
СН2 н2с сно Н2С
сн2
сн2
сно н2с^ ^сн3 Н3С ^сн3Лимоненная форма Тррпиноленная форма 26 и 27. Ци гронеллаль
Н2С
Н2С
СН
Н3С^ ^СН329. Гераниол
СН,
.С
ЯгС
СН2ОН НгС
СН
СН2
QOH)
Н,с^ ^СН330. а-Терпииеол сн,
Jc-OH
Н2Г
н2с сн2
СНз с-он
Н2С
к >СНг Н2С
Λ
Н3×^гн2 Н3С
31 β-Терпинеол
сн2
сн2
СН3
32.у-Тергошеол
СН3
le-он
Н2С
Н2С
сн.
1шн)
Н3С^ ^СН333. Терпин
СН3
СН
Н2С
Н2С
Н3с сн2
со
СНз
34 ПуЛегон
СНз
СН
Н2С
Чг
„А
35. Ментол
СН3
1сн игс си2
снон Н2С^ сн3
X
Н3С^ ^ ЗбЛулегол
СНг
СНОН
СН3
СН3
!с
йс!
Н,с1 Лнг
it11
Н3×^сн, 37 Карпок
ПоГ
ГН2
Н*СЧ.
СИ Зб.ФеНАОН
./ГН,
чСНз
1£Н
Н5С^ сн, 39 ТУйон
Н2С
Н об
СН2
СН2
Н,С^ ^ ГН3
40 Щшеол
СН,
JL
Н2СГ" ХСН
h2cL Jco ^-сн,
41.Ниперитон
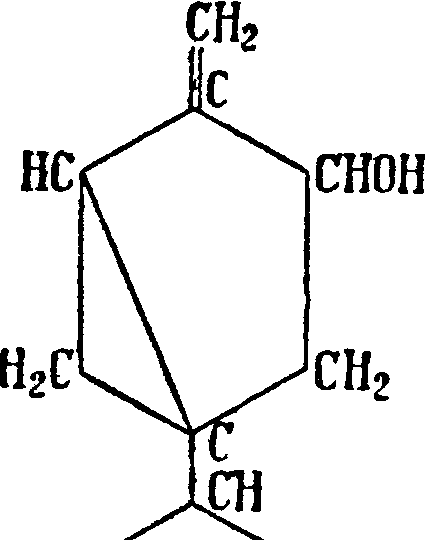
Н3С^ ^СН342.Сабинол эдентон. Ц и т р а л ь С10Н16О (28)—жидкость с лимонным запахом, встречается в лимонном, лемонграсовом, змееголовниковом и др. маслах; Пип. 228—229° и уд. в D15 0,831—0,895. Под влиянием минеральных к-т легко переходит в димол, окисью серебра окисляется в гераниевую к-ту, водородом в присутствии платиновой черни восстанавливается в цитронеллол, амальгамой натрия в уксусной к-те восстанавливается в гераниол (29) и изомер последнего—н е р о л, в соответствии с наличием обеих изомерных форм. Цитраль находит непосредственное применение в парфюмерном деле и в особенности в производстве ионона (смотрите). Гераниол (смотрите) (29) — жидкость с запахом розы с Пип. 120—122° при 17 миллиметров давления, уд. в 0,8829, встречается в гераниевом, цитронелло-вом, пальмарозовом маслах, при окислении дает альдегид—цитраль, образует с безводным хлористым кальцием кристаллич. соединение, к-рое водой разлагается с обратным выделением гераниола. Стереоизомер гераниола—н е р о л— также обладает запахом розы; Пип. 125° при 25 миллиметров давления, уд. в 0,8813, встречается в пе-тигреновом, неролиевом, розовом и др. маслах. Πς свойствам очень близок к гераниолу, отличаясь от последнего большей легкостью изомеризации в терпинеол и легкостью дегидратации. Не образует кристаллич. хлоркальциево-го соединения. Изомерный этим двум ам линалоол (смотрите)—жидкость с запахом, напоминающим ландыш, tiurit 197—198°, уд. в 0,869, встречается в правовращающей форме—в кориандровом масле, в левовращающей—в масле линалоэ; эфиры линалоол а и жирных к-т составляют наиболее ценную составную часть лавандового, бергамотного и др. масел. При окислении линалоола хромовой смесыо вследствие предварительной перегруппировки получается цитраль. Эти ы и их эфиры имеют первостепенное значение в мыловаренно-парфюмерной промышленности.
5) Производные моноцикл и ч. Т. Терпинеол СГ)Н180, продажный терпинеол—смесь изомеров α-, β- и γ- (30, 31 и 32); α-терпинеол с Игт. 217—219°, t^. 35°, уд. в В“ 0,935—0,940; ^-терпинеол с Пип. 209—210°, 33°, уд. в 0,819; у-терпинеол с Ил. 69—70°. Терпинеол встречается в некоторых скипидарах, особенно экстракционных, и в маслах: померанцевом, камфорном, лимонном, гераниевом и др. Технически получается из скипидара гидратацией последнего разбавленными минеральными к-тами (серной, азотной) с последующим отщеплением воды от“ образующегося при этом терпингидрата. Под действием минеральных к-т и водоотнимающих реагентов терпинеол переходит в смесь циклич. Т. или гидратируется, переходя в терпин. Технич. терпинеол—бесцветная жидкость с запахом сирени, находит большое применение в парфюмерном и мыловаренном производствах. Терпин С10Н2 02 (33) известен в двух сте-реоизомерных модификациях: цис- и трансформе. Первая дает с 1 мол. кристаллизационной воды терпингидрат с Ил. 116—117°. Т е р-пингидрат получается непосредственно из скипидара действием разведенных минеральных к-т, при нагревании дает безводный цис-терпин с 101—105°, при окислении дает т e р е би-
нов у ю к-ту. Транс-терпин—кристаллич. вещество с ПЛт 156—158°, Пип. 263—265°, гидрата не образует. Получается гл. обр. при омылении дигидрохлорида, дипентена и терпинена.
Ц и н е о л (40) — жидкость с холодящим камфорным запахом, Пип. 176—177°, уд. в 0,928—0,930, представляет главную и характерную составную часть большинства эвкалиптовых масел, но найден и в ряде других эфирных масел (кайепутовом, розмариновом, лавровом, спиковом и др.). Образуется при дегидратации терпингидрата и поэтому является побочным продуктом при производстве терпинеола. Дает с резорцином и многими фенолами двойные соединения. П у л е г о н С10Н16О (34) встречается во многих маслах, наир, пулеги-евом, зизифоровом и др., Пип. 224° при 750 мЖ и уд. в D20 0,9373: При каталитическом восстановлении, присоединяя четыре водорода, дает весьма ценный продукт—ментол (смотрите) (35). Восстановление металлич. натрием в овом растворе приводит к у—и у л е г о-л у (36) с Пип. 209—210°, образующемуся из цитронеллаля (лимоненной формы) при действии уксусного ангидрида. Изомерный пуле-гону пиперитон (41) с t£un. 235—237°, уд. в П1э 0,9375 встречается в эвкалиптовых маслах в виде оптически активных форм, восстановлением переводится в ментол и изоментол и используется для этой цели в промышленности. Для получения синтетич. ментола используется также встречающийся в мятном масле наряду с этим ом м е н т о н—жидкость с мятным запахом, с Пип. 207—208°, уд. в 0,8960. Ментон может встречаться в двух стереоизомерных формах. К а р в о н CioHi.O (37) — бесцветная жидкость, пахнущая тмином, с Пип. 225—231° и уд. в D15 0,9645-У 0,9652°. Найден во многих маслах (тминном, укропном, кудряво-мятном и др.). Для установления генетич. связи между Т. и их производными чрезвычайно важной является связь между карвоном и лимоненом. Эта связь была установлена на основе следующих превращений: лимонен (5) при действии нитрозилхло-рида даег лимонен-нитрозохлорид; отщеплением элементов хлористого водорода от нит-розохлорида получается изонитрозосоединение (оксим), из которого осторожным гидролизом с отщеплением гидроксил амина был получен карвон (ф-ла 37):
С1ЭН1в -* C10H16.NOC1 С10Н14 : NOH -> С10Н14b.
6) Производные бициклических Т. Борнео л, по запаху напоминающий камфору, с Ил. 203—208°, Нип. 213°, очень легко возгоняется, встречается в хвойных маслах в левовращающей форме, б. ч. .в виде эфиров. Правовращающий борнеол найден в розмариновом и др. маслах. Борнеол наряду с его стереоизомером — изоборнеолом — получается при гидратации пинена и камфена, при окислении они дают камфору (смотрите) с тем же знаком вращения, что и pi сходный борнеол. С а б и н о л (42) —жидкость с слабым характерным запахом, с tKUn. 209°, уд. в 0,9518, встречается в масле козацкого можжевельника (Juniperus sabina); при восстановлении переходит в туй-иловый. Фенхон С^Н^О (38) с Пип. 192—195° находится в фенхелевом, туйевом и других маслах. При восстановлении фенхона получается фенхиловый СА HlsO с НЛт45°. Т у и о н (танацетон) Сх Н^О (39) — бесцветная жидкость с 1КЧПт 200 — 201° и удельны i весом D20 0,913 встречается в полынном, туйевом и некоторых других маслах. При восстановлении металличезк ш натрием образуется туйиловый СиН180.
Кроме Т. состава С10Н13 и их производных, важнейшие из которых перечислены выше, в природе довольно широко распространены также значительно более сложные соединения того же типа. Наиболее распространенными в природных продуктах являются сескви тер-, пены, или полуторные Т. Ci5H24; далее следуют дитерпены С2оН32 и политерпены (C10Hi6)m· Важнейшими представителями сес-квитерпенов являются кадинен, кариофиллен, сантален, пачулей, цедрен и многие другие. Из кислородных сесквитерпенов, встречающихся в эфирных маслах, наибольшее значение имеют ы с открытой углеродной цепью— фарнезол C15H2S0, неролидол С15Н260, соответствующие по строению терпеновым ам: гераниолу и линалоолу; из бициклич. се-сквитерпеновых ов санталол ы—смесь изомерных ов состава С15Н23ОН, ц е д р о л и многие др. Строение громадного большинства сесквитерпеновых углеводородов и их производных до настоящего времени остается пока недостаточно изученным.
Промышленное значение Т. имеют довольно ограниченное в противоположность их кислородным производным, которые находят широкое применение в качестве изолированных душистых веществ (смотрите). Т. редко находят непосредственное применение в пром-сти и являются по преимуществу исходным сырьем или полупродуктом дальнейшего синтеза; однако некоторые из них применяются в медицине в качестве растворителей, пластификаторов и флотационных реагентов.
Пине н—основной исходный продукт для получения терпингидрата, терпинеола и камфоры; применяется также для приготовления всякого рода скипидарных мазей и непосредственно в медицине как наружное и антисептическое средство, а также во многих случаях как растворитель (смотрите Скипидар). К а м ф е н является промежуточным продуктом при получении синтетич. камфоры из пинена. Лимонен и дипентен находят применение при производстве искусственного лимонного масла, а отчасти в производстве терпинеола. Т е р-пингидрат имеет гл. обр. значение как полупродукт при производстве терпинеола; широко применяется также в медицине при лечении заболеваний дыхательных путей. Терпинео л—дешевое душистое вещество, находит широкое применение в парфюмерно-мыловаренном производстве как непосредственно, так и в виде эфиров, употребляется также при изготовлении нек-рых лаков. Ц и т р а л ь, являясь типичным душистым веществом с запахом лимона, находит непосредственное применение в парфюмерии, но основное его применение при синтезе ионона (смотрите). Цитронеллаль (помимо непосредственного применения эфирных масел, содержащих этот альдегид) применяется для получения одного из наиболее важных синтетич. душистых веществ—гидроксицитронел-лаля. Ментон, пиперитон, пулегон являются исходным сырьем для получения синтетич. ментола.
Сырьем для получения Т. и их производных являются почти исключительно эфирные масла (смотрите); только отдельные Т. получаются в качестве побочного продукта при производстве древесной целлюлозы. Переработка эфирных масел для выделения Т. или их производных производится как физико-химич., так и химич. методами. Для выделения Т. чаще всего применяется фракционированная разгонка при обычном давлении или в вакууме. Для очистки Т. применяется перегонка с едкими щелочами, известью и тому подобное. Для разделения близкокипя-щих Т. предложены способы, основанные на различной скорости диффузии через эбонитовую перегородку (например а- и β-пинена) или на различной растворимости в винном е невысокой концентрации. Кислородные производные Т. выделяются различными способами в зависимости от характера функциональной группы. Для выделения ов применяется
Т. Э. m. XXIII.
получение труднолетучих с водяным паром (бензойных, янтарных) или высококипящих эфиров (борных); для первичных и вторичных ов большое значение имеет получение кислых фталевых эфиров. Кроме этих общих методов имеются также специальные для отдельных ов, например получение хлоркальциево-го соединения гераниола. Для альдегидов и кетонов главными методами кроме фракционированной разгонки масла является получение кристаллич. или растворимых бисульфитных и сульфитных соединений, разлагаемых при помощи щелочей или к-т. В отдельных случаях, например для выделения ментола, камфоры, применяется вымораживание их из эфирного масла. В большинстве случаев выделение Т. и их производных объединяется с дальнейшей их переработкой в синтетич. душистые вещества и составляет т. о. первую стадию этого производства. О производстве в СССР см. Душистые вещества и Эфирные масла.
Лит.: Симонсен И., Терпены, пер. с англ.,М.—Л., 1933; W а 1 1 а с h О., Terpene u. Campher, 2 Auflage, Lpz., 1914; A s с h а η О., Naphtenverbindungen, Terpene und Campherarten, B., 1929; BakerJ., Natural Terpenes, London, 1930; Si mons en J., The Terpenes, Cambridge, 1931. См. также Эфирные масла и Душистые вещества. А. Шаврыгин.