 > Техника, страница 86 > Тонометрия
> Техника, страница 86 > Тонометрия
Тонометрия
Тонометрия наука об измерении давления пара растворов, гл. обр. по сравнению с давлением пара чистого растворителя. В Т. измеряют диференциальными методами понижение давления пара раствора р по сравнению с давлением р0 чистого растворителя р0 —р, вызванное нелетучим растворенным веществом.
Относительное понижение давления пара в достаточно разведенных (слабых) растворах не зависит вовсе от природы растворителя и растворенного вещества, а лишь от относительного их содержания, то есть от относительного числа грам-молекул растворенного вещества п и растворителя щ в растворе (закон Рауля). Вант-Гоффом было показано, что этот основной закон Т. выводится непосредственно из наличия осмотич. давления раствора р (смотрите Осмотическое давление, Осмос). Действительно представим себе простейший осмометр (смотрите Осмотическое давление) в замкнутом пространстве (фигура: 1—пар растворителя, 2—раствор, 3— растворитель). Осмотич. давление Рв нем уравновешивается гидростатич. давлением избыточного (поднятого) столба жидкости: Р=h-D^g; в газообразной фазе на уровне растворителя в чашке давление пара р=р0, а над мениском раствора в трубке р, очевидно равное давлению пара раствора, определится по барометрич. формуле:
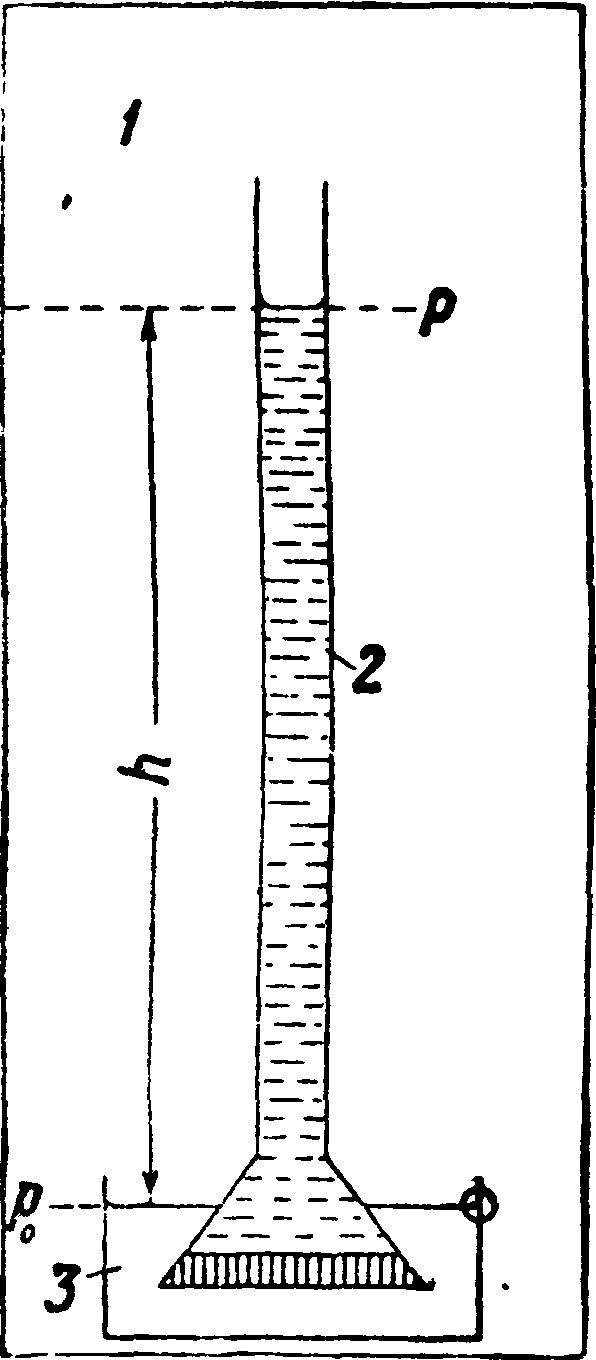
Ро
V
М09 тонн _ Ро-Р RT П Ро
(1)
т. к. при малых разностях р0—р, =
но h=уг——, а Р=RT · ~ по закону Вант-Гоф-фа-Клапейрона. Отсюда Ро~р-=т. к.-~~=п0
Ро “о здесь М0—мол. в растворителя, D±—его плотность (практически равная плотности слабого раствора), Vx—объём раствора. С понижением давления пара тесно связаны: 1) повышение t°uun. ATS раствора под постоянным атмосферным“ давлением по сравнению с чистым растворителем и 2) понижение t°njlt раствора (депрессия) ΔΤ0. Посредством ур-ия (1) обе эти величины связываются с осмотич. давлением, и в этом большое научное значение основной тоно-
метрич. величины Ро~р-=— и закона Рауля. Термодинамически легко показать, что и
Qs Ро кгр __ктб Ар где Ts, Т0—t°Kun. и раствора под атмосфер ным давлением, a Qs, Q0—соответствующие скрытые теплоты для 1 моля чистого растворителя. Так как измерения давления пара часто сравнительно громоздки, их предпочитают обычно заменять (для вычисления любого иа осмотич. свойств раствора) либо измерениями повышения t°Kunнепосредственно связанными с понижением давления пара (эта область физико-химической методики называется эбуллиоскопией), либо измерениями депрессии точки замерзания (см.Криоскопия). Однако по указаниям некоторых исследователей диферен-циальные измерения тонометрич. коэфициента
Ро — Р и ~~~ =* ~ настолько просто осуще ствимы и достаточно точны, что могут служить как для определения всех других осмотич. свойств растворов, так и для вычисления среднего мол. в или степени диссоциации (ассоциации) растворенного вещества в растворе. Из условия ~=учитывая, что п=~ и Щ=щ,
находим:
Ар
Ро
jL_
м т т0
•М0,
здесь М0—мол. в растворителя, известная величина, a m и т0—навески (весовые количества) растворенного вещества и растворителя в г;
m m*
ΐη0 = ϊόο’ Где ^-навеска растворенного вещества в 100 г растворителя. Отсюда легко найти М=~ В случае диссоциации или ас социации в растворе надо ввести коэф. г (смотрите Криоскопия) и Ар1р0=г-п/п0.
Лит.: Raoult, «CR», 1882, Т. 94, р. 1517, Т. 95, р. 108, 1030, 1885, Т. 101, р. 1056; «Ztschr. f. phys. Che-mie», Lpz., 1888, B. 2, p. 488, 1892, B. 9, p. 343, 1896, B. 20, p. 601; Jellinek K., Lehrbuch d. phys. Chemie, 2 Aufl., В. 1, Stg., 1928; Arndt К., Handb. d. phy-sikalisch-chemischen Technik f. Forscher u. Techniker, 2 Aufl., Stg., 1923. П. Ребиндер.